一种粘质沙雷氏菌定量检测的方法与流程
本发明涉及一种人员生物防护装备防护性能评价指示菌的检测,具体涉及建立一种准确的粘质沙雷氏菌定量检测方法。本发明还涉及建立一种粘质沙雷氏菌定量检测的不确定度评定方法。
背景技术:
:
生物安全柜、生物防护服、生物防护口罩、医用外科口罩是常见的生物防护装备,为了保障操作人员的安全,需要对这些装备的微生物防护性能进行评价。粘质沙雷氏菌(Serratia marcescens)因其培养周期短、雾化和冲击耐受性好、易消毒处理等优点,被公认为生物防护评价的指示菌。因此,该菌定量检测结果的准确性对上述生物防护装备防护性能评价的准确性起直接影响作用。
然而,目前对于粘质沙雷氏菌定量检测方法的研究还很少,因此非常有必要建立一种准确可靠的粘质沙雷氏菌定量检测方法和不确定度评定方法。
技术实现要素:
:
本发明的第一目的是提供一种重复性和准确性好的粘质沙雷氏菌定量检测方法。
本发明的第二目的是提供一种粘质沙雷氏菌定量检测的不确定度评定方法。
建立粘质沙雷氏菌定量检测方法,要解决的主要技术问题有两个:
一是采用何种计算公式,使定量结果最为准确;
二是待测样品的粘质沙雷氏菌细菌培养方法,特别是细菌平板计数中的上样体积,对于粘质沙雷氏菌在营养琼脂平板上的均匀分布和最终平板计数结果的准确性很关键。
本发明经过反复实验,给出了解决两个问题的方案:一种粘质沙雷氏菌定量检测方法,其特征是:采用营养琼脂平板涂布法培养后选取粘质沙雷氏菌菌落,计数典型菌落数,并记录稀释因子,按公式①计算,得到粘质沙雷氏菌活菌浓度的结果:
式中,
C为粘质沙雷氏菌活菌浓度,CFU/mL;
N为平板上粘质沙雷氏菌典型菌落的总数,CFU;
d为稀释因子,无量纲;
v为平板上粘质沙雷氏菌匀液的接种体积,mL。
用于计数的平板,选择有典型特征的粘质沙雷氏菌菌落,且菌落数在15CFU~150CFU之间的平板,计数该稀释度平板上的典型菌落数;菌落计数以菌落形成单位(colony-forming units,CFU)表示,定量检测结果C以活菌浓度(CFU/mL)表示。
所述有典型特征的粘质沙雷氏菌菌落特征是:凸起,中心不透明,边缘不规则,产生红色色素。
在上述方法中,用于平板计数的待测粘质沙雷氏菌的培养方法,特征是:
1)将待测粘质沙雷氏菌菌株样品中加入无菌的磷酸盐缓冲液作为稀释液进行复水溶解,然后再进行10倍系列稀释,得到不同稀释度的样品匀液;
实际检测生物安全柜和生物防护服等时,样品为直接取样的采集液。
2)选取上述1~5个稀释度的样品匀液接种于营养琼脂平板上,每个稀释度的样品匀液在平板的上样体积是0.05~1mL;优选的上样体积是0.2mL;
(3)将平板置于培养箱中进行培养。
所述进行10倍系列稀释是第一步制成1:10的稀释液S1,再用S1制成1:10的稀释液S2…,可根据需要多次稀释,得到不同稀释度的稀释液S2、S3、S4、…Sn
所述接种于营养琼脂平板上,是涂布整个平板,但不触及平板边缘。因粘质沙雷氏菌如不涂布均匀会出现粘连成片的情况,影响计数结果的准确性,甚至无法计数。
所述涂布时,平板表面的样品液体应全部吸收,每个稀释度至少重复3次。
所述培养的方法是,涂布后将平板静置10min,倒置于培养箱,30℃±1℃培养12~24h。优选培养时间是15h。
所述营养琼脂平板的制备方法如下:先将营养琼脂培养基各成分煮沸使其溶解,调节pH7.2±0.2,然后于121℃高压灭菌15min。
将高压灭菌后的液态营养琼脂摇匀倾注于平板上。若不立即使用,应储存在4℃冰箱中,且不超过48h。
优选的营养琼脂培养基组成为:牛肉膏3.0g,蛋白胨5.0g,酵母粉3.0g,蔗糖10.0g,琼脂粉15.0g,蒸馏水1000mL。
在本发明的一个实例中,营养琼脂平板的制备是按如下方式具体操作:
(1)配制营养琼脂培养基,煮沸溶解营养琼脂培养基各成分,调节pH 7.2±0.2,121℃高压灭菌15min。使用前加热溶化琼脂,摇匀后倾注平板。使用前在4℃冰箱储存不超过48h。
(2)将待测粘质沙雷氏菌(Serratia marcescens)标准菌株(ATCC,菌株编号8039)的冻干样品从-20℃冰箱取出后,在室温下放置5min,用移液器加入2mL无菌的磷酸盐缓冲液作为稀释液进行复水溶解,充分混匀后制备成S0样品匀液。再用1mL移液器吸取S0样品匀液1mL,沿管壁缓慢注于盛有9mL稀释液的无菌试管中,振摇试管或换用1支1mL无菌吸头反复吹打使其混合均匀,制成1:10稀释的S1样品匀液。再用稀释液对充分溶解后的样品S1在经灭菌后的试管中进行10倍系列稀释,分别为S2、S3、S4、…Sn,每递增稀释一次,换用一次1mL无菌吸头,混匀要充分。
(3)选择三个适宜稀释度的样品匀液,每个稀释度分别吸取0.2mL样品匀液接种于营养琼脂平板上,然后用无菌L棒涂布整个平板,注意不要触及平板边缘。因粘质沙雷氏菌如不涂布均匀会出现粘连成片的情况,涂布时平板表面的样品液体应全部吸收,每个稀释度至少重复3次。
(4)涂布后,将平板静置10min后,将平板倒置于培养箱,30℃±1℃培养,12~24h。
通过实施例中重复性验证和复现性验证实验证明上述方法具有良好的重复性和准确性。
根据上述本发明建立的粘质沙雷氏菌定量检测的方法,本发明还提供了一种粘质沙雷氏菌定量检测的不确定度评定方法,步骤如下:
(1)A类不确定度分量uA是通过定量检测方法的标准偏差、检测次数及所要求的置信水平按统计方法计算出的不确定度。
采用营养琼脂平板涂布法对粘质沙雷氏菌样品重复检测n次。对检测数据采用格拉布斯准则进行离群值检验和正态性分析后,采用公式②计算A类不确定度uA,采用公式③计算A类相对标准不确定度urel(A)。
式中,uA为A类标准不确定度;为平均值的标准偏差;为平均值;Xi为每次检测数据;n为检测次数。
式中,urel(A)为A类相对标准不确定度;uA为A类标准不确定度;为平均值。
(2)通过对本发明所述的一种粘质沙雷氏菌定量检测的方法的所述步骤(5)中的公式①的各参数以及对定量检测过程的分析,B类相对标准不确定度主要来源包括:
a)移液器带来的相对标准不确定度urel(v)可通过查询移液器校准证书获得;
b)样品稀释因子带来的相对标准不确定度urel(d)按照公式④计算得到:
式中,urel(d)为样品稀释因子的相对标准不确定度;k为稀释倍数;a为菌液体积(1mL);b为稀释液体积(9mL);ub为稀释液体积的标准不确定度;urel(a)为菌液体积的相对标准不确定度。
按照公式⑤合成B类相对标准不确定度urel(B):
(3)考虑到A类和B类两部分标准不确定度相互独立,用公式⑥计算合成相对标准不确定度urel(char):
式中,urel(char)为合成相对标准不确定度,urel(A)为A类相对标准不确定度,urel(B)为B类相对标准不确定度。
(4)用公式⑦计算定量检测方法的相对扩展不确定度:
Urel=kurel(char) ⑦
式中,Urel为相对扩展不确定度,urel(char)为合成相对标准不确定度,k为扩展因子。
重复次数越多,所得计算结果越准确,但检测成本和时间越长,通常应重复3~10次。
经实验证实本方法不仅可以定量检测粘质沙雷氏菌的活菌浓度,还可以给出定量检测的不确定度。在本发明的实例中,所得到的粘质沙雷氏菌定量检测结果和不确定度评定结果是经过9次重复实验后所获得的(见实施例1)。
本发明具有以下创新点:
1、建立了待测样品的粘质沙雷氏菌营养琼脂平板涂布法,通过对平板计数方法中上样体积的优化,找到了最适于粘质沙雷氏菌在营养琼脂平板上均匀分布的上样体积,保证了最终平板计数结果的准确性;
2、找到了适用于粘质沙雷氏菌定量检测结果的计算公式,使定量结果准确;
3、通过对本发明中建立的定量检测方法和检测结果计算公式中各参数进行分析,提供了一种粘质沙雷氏菌定量检测的不确定度评定方法。
本发明具有以下有益效果:
1、灵敏度高
因本方法采用对样品的系列稀释进行的平板计数,该方法决定了其灵敏度可检测到1个CFU。
2、特异性强
1)具有粘质沙雷氏菌典型特征
用本发明方法培养的粘质沙雷氏菌的菌落,具有“凸起,中心不透明,边缘不规则,产生红色色素”的粘质沙雷氏菌典型特征(见图1)。
2)经16S rRNA测序证明
从平板上随机挑取10个菌落,提取基因组DNA,针对其16S rRNA进行测序,其鉴定结果均为粘质沙雷氏菌(见实施例)。
3、重复性好
每天重复测试粘质沙雷氏菌样品9次,连续测试5天,组内组间差异无显著性(见实施例)。
4、复现性好
选择8家实验室采用粘质沙雷氏菌定量检测方法—营养琼脂平板涂布法进行方法的协同验证实验,每家实验室收测试5瓶粘质沙雷氏菌冻干样品,组内组间差异无显著性(见实施例)。
附图说明
图1是实施例中营养琼脂平板上培养生长的粘质沙雷氏菌典型菌落形态;
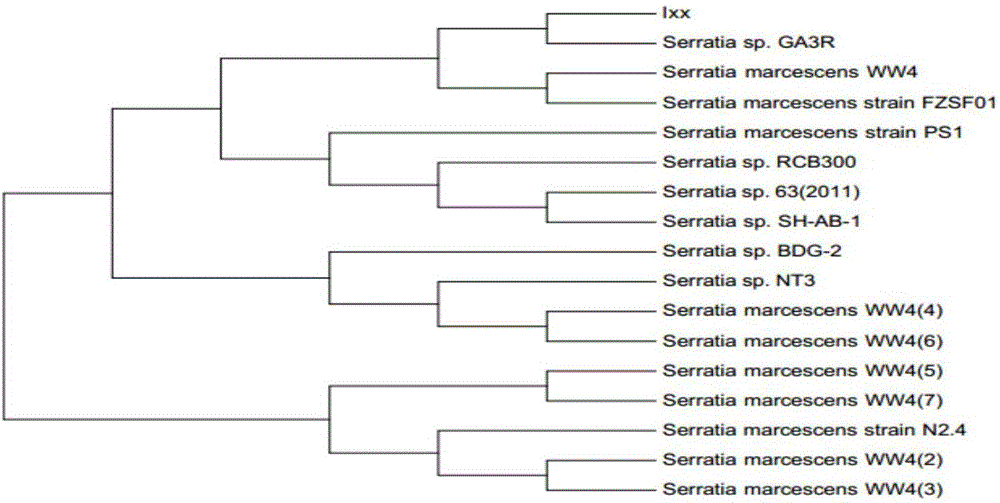
图2是实施例中粘质沙雷菌16S rRNA基因序列的系统发育进化树。
具体实施方式
粘质沙雷氏菌冻干样品的定量检测
一、材料与方法
1.粘质沙雷氏菌(Serratia marcescens)标准菌株的编号为ATCC8039;待测样品为粘质沙雷氏菌冻干样品的活菌浓度范围为(0.87~1.27)×1010CFU/ml(中国计量科学研究院研制);按照营养琼脂培养基(牛肉膏3.0g,蛋白胨5.0g,酵母粉3.0g,蔗糖10.0g,琼脂粉15.0g,蒸馏水1000mL)的组成配制培养基,煮沸溶解,调节pH 7.2±0.2,121℃高压灭菌15min。使用前加热溶化琼脂,摇匀后倾注平板。
2.将待测的冻干样品从-20℃冰箱取出后,在室温下放置5min,用移液器加入2mL无菌的磷酸盐缓冲液作为稀释液进行复水溶解,充分混匀后制备成S0样品匀液。再用1mL移液器吸取S0样品匀液1mL,沿管壁缓慢注于盛有9mL稀释液的无菌试管中,振摇试管或换用1支1mL无菌吸头反复吹打使其混合均匀,制成1:10稀释的S1样品匀液。再用稀释液对充分溶解后的样品S1在经灭菌后的试管中进行10倍系列稀释,直到稀释至1:1010,分别为S2、S3、S4、…S10,每递增稀释一次,换用一次1mL无菌吸头,混匀要充分。
3.样品接种与培养:根据给出的粘质沙雷氏菌活菌浓度范围进行估算,选择S7、S8、S9三个稀释度的样品匀液,每个稀释度分别吸取0.2mL样品匀液接种于营养琼脂平板,然后用无菌L棒涂布整个平板。涂布后,将平板静置10min后,将平板倒置于培养箱,30℃±1℃培养,12~24h。
4.样品结果计算:将培养后的平板放置在生物安全柜中观察,选择有典型的粘质沙雷氏菌菌落且菌落数在15CFU~150CFU之间的S8平板(稀释因子为1:10-8)计数,根据公式计算①结果得到粘质沙雷氏菌样品的活菌浓度。
5.粘质沙雷氏菌特异性验证:从平板上随机挑取10个典型的粘质沙雷氏菌菌落分别进行特异性验证。采用细菌基因组提取试剂盒,提取和纯化得到粘质沙雷氏菌基因组DNA,参照GenBank中粘质沙雷氏菌标准菌株基因序列设计和合成16S rRNA全长基因的引物(见表1)。采用表1中的引物配制PCR扩增体系,按照程序:95℃变性10min;30个循环扩增(95℃ 60s,55℃ 30s,72℃ 90s);72℃延伸10min。从而获得16S rRNA的PCR扩增产物,将PCR扩增产物进行测序,并登陆NCBI(http://www.ncbi.nlm.nih.gov/blast),将所得序列与数据库已知序列进行比对分析。
表1粘质沙雷氏菌16S rRNA扩增引物序列
6.重复性验证
重复性验证时,每天重复测试粘质沙雷氏菌样品9次,连续测试5天,共得到45个测定结果,同时用无菌磷酸盐缓冲液做空白对照,培养后观察平板上菌落生长情况并进行计数,按照公式①计算实验结果。相对标准偏差RSD采用公式⑧计算。
式中,RSD为营养琼脂平板涂布法重复性相对标准偏差;为总平均值;D为实验天数;n为每日重复次数;xdi为第d天i次重复结果;为第d天所有重复结果的均值。
7.复现性验证
选择8家实验室采用粘质沙雷氏菌营养琼脂平板涂布法进行方法的协同验证实验。每家实验室发5瓶粘质沙雷氏菌冻干样品进行测试,通过公式计算结果,每瓶样品重复3次,取平均值作为该瓶样品的实验结果。收到各家实验结果后,先对各家实验室数据采用格拉布斯准则进行离群值检验,再用科克伦(Cochran)法检查各组数据之间是否等精度,采用公式⑨计算室间相对标准偏差RSDR。
式中,RSDr为室内相对标准偏差;为总平均值;m为实验室个数;n为样品个数;xij为第i个实验室j个样品的结果;为第i个实验室所有样品检测结果的均值。
8.不确定度评定
采用养琼脂平板涂布法对粘质沙雷氏菌样品重复检测9次。对检测数据采用格拉布斯准则进行离群值检验和正态性分析后,按照公式②-⑦计算不确定度。
二、实验结果
1.粘质沙雷氏菌特异性验证
从平板上随机挑取10个典型的粘质沙雷氏菌,分别采用细菌基因组提取试剂盒,提取和纯化得到粘质沙雷氏菌基因组DNA,采用表1中的引物配制PCR扩增体系,按照程序:95℃变性10min;30个循环扩增(95℃ 60s,55℃ 30s,72℃ 90s);72℃延伸10min。从而获得16S rRNA的PCR扩增产物,将PCR扩增产物进行测序,并登陆NCBI(http://www.ncbi.nlm.nih.gov/blast),将所得序列与数据库已知序列进行比对,并使用MEGA 3.1软件构建各菌株的系统发育树(图2),鉴定的结果表明,待测菌株均为粘质沙雷氏菌。
2.营养琼脂平板涂布法重复性验证
采用建立的营养琼脂平板涂布法,重复测试粘质沙雷氏菌样品9次,连续测定5天,共得到45个测定结果,同时用无菌磷酸盐缓冲液做空白对照,统计实验结果。按照公式⑧计算结果,由表2可知,该方法的室内重复性相对标准偏差为8.93%,达到了微生物定量检测方法<30%的要求,说明粘质沙雷氏菌营养琼脂平板涂布法具有很好的重复性,能够对粘质沙雷氏菌进行准确的定量检测。
表2营养琼脂平板涂布法重复性验证结果(D=5,n=9)
a为第d天所有重复结果的均值
上述结果证明粘质沙雷氏菌营养琼脂平板涂布法具有很好的重复性,能够对粘质沙雷氏菌进行准确的定量检测。
3.营养琼脂平板涂布法复现性验证
将参与复现性验证研究的8家实验室数据,分别采用格拉布斯准则进行离群值检验,再将各实验室检测结果的平均值视为一组新的数据,进行正态分布分析,再对各家实验室检测结果的平均值采用格拉布斯准则进行离群值检验,经过检验并没有发现离群值。
按照公式⑨计算结果见表3,该方法的室间相对标准偏差即复现性相对标准偏差RSDR为15.89%,可以达到微生物定量检测方法精度<30%的要求。
表3营养琼脂平板涂布法复现性验证结果(m=8,n=5)
上述结果证明粘质沙雷氏菌营养琼脂平板涂布法具有很好的复现性,能够对粘质沙雷氏菌进行准确的定量检测。
4.粘质沙雷氏菌的定量检测结果
采用营养琼脂平板涂布法对粘质沙雷氏菌样品重复测量9次。将培养后的平板放置在生物安全柜中观察,选择有典型的粘质沙雷氏菌菌落且菌落数在15CFU~150CFU之间的S8平板(稀释因子为10-8)计数,根据平板上的菌落数按照公式①计算粘质沙雷氏菌样品的活菌浓度(见表4)。对定量检测数据采用格拉布斯准则进行离群值检验和正态性分析后,取算数平均值作为粘质沙雷氏菌定量检测的结果(见表4)。
例:S8平板(稀释因子为10-8)的计数结果为21CFU,其计算结果(如下)为1.05×1010CFU/mL
表4粘质沙雷氏菌样品的定量检测结果
5.粘质沙雷氏菌的定量检测不确定度评定
粘质沙雷氏菌定量检测结果的不确定度主要由A类不确定度和B类不确定度组成。
5.1A类相对标准不确定度urel(A)
A类不确定度分量uA是通过检测方法的标准偏差、检测次数及所要求的置信水平按统计方法计算出的不确定度。采用营养琼脂平板涂布法对粘质沙雷氏菌样品重复检测9次。根据表4中的定量检测数据,采用公式②计算A类不确定度uA为0.022×1010CFU/mL,用公式③计算A类相对标准不确定度为1.99%。
5.2B类相对标准不确定度urel(B)
B类相对标准不确定度主要来源包括:a)移液器带来的相对标准不确定度urel(v),查询证书得1%(k=2),urel(v)=1%/2=0.5%;b)样品稀释因子带来的相对标准不确定度urel(d)。样品稀释是由1mL菌液加入9mL无菌磷酸盐缓冲液进行稀释,因此设菌液体积为a,稀释液体积为b,1mL移液器的的相对标准不确定度查证书Urel(a)为1%(k=2),urel(a)=1%/2=0.5%;9mL移液器的的相对标准不确定度查证书Urel(b)为1%(k=2),urel(b)=1%/2=0.5%,ub=urel(b)*b=0.5%*9mL=0.045mL,稀释液体积的标准不确定度实际检测经过是经过8次稀释,稀释倍数k为8。按照公式④计算得到为urel(d)为1.79%。
式中,urel(d)为样品稀释因子的相对标准不确定度;k为稀释倍数;a为菌液体积(1mL);b为稀释液体积(9mL);ub为稀释液体积的标准不确定度;urel(a)为菌液体积的相对标准不确定度。
按照公式⑤合成B类相对标准不确定度为0.060。
5.3合成不确定度uchar和相对扩展不确定度U
考虑到两部分标准不确定度相互独立,用公式⑥计算合成相对标准不确定度urel(char),用公式⑥计算相对扩展不确定度Urel,结果见表5。
Urel=kurel(char)=2×2.7%=5.4%
表5粘质沙雷氏定量检测不确定度评定结果
上述结果证明不确定度评定方法适用于粘质沙雷氏菌的定量检测。
- 还没有人留言评论。精彩留言会获得点赞!