一种小肽及其应用的制作方法
本发明涉及生物技术领域,具体涉及一种小肽及其应用。
背景技术:
糖尿病是一组以慢性血糖水平增高为特征的代谢疾病群。高血糖引起的葡萄糖自动氧化、蛋白质糖基化作用的增强及脂代谢异常是糖尿病患者体内自由基,特别是活性氧(ROS)增加的主要原因,同时也导致一些抗氧化酶的活性明显降低,从而使糖尿病患者体内处于一定程度的氧化应激状态。氧化应激不仅参与了糖尿病的发生、发展以及恶化的全部过程,而且还参与了糖尿病并发症的重要病理改变--多种器官的动脉粥样硬化(AS)。血管壁的重要构成成分是血管平滑肌细胞(VSMCs),位于血管中层及内膜。在动脉粥样硬化等血管病变中,血管平滑肌细胞的异常增殖是血管壁增厚的主要原因。增生的VSMCs还可以导致冠状动脉内膜的病变,进而发生动脉粥样硬化。在AS的发生和发展过程中,VSMCs的增殖和凋亡的平衡程度也会随病变的进展发生相应改变。AS的病变初期,血管壁细胞数量增多、内膜增厚、管腔变窄除了与VSMCs过度增殖有关,还与调亡率下降导致细胞累积、数量增多密切相关。平滑肌细胞的调亡不足也是内膜损伤后动脉粥样硬化早期进展的重要原因。现有技术中缺乏药物、功能食品能够调节高糖诱导的VSMCs异常增殖、调节高糖环境下平滑肌细胞的凋亡使其趋于正常状态,以缓解糖尿病并发症,延缓或阻止AS的发展。
技术实现要素:
本发明的主要目的是提供一种能够调节高糖诱导的VSMCs异常增殖、高糖环境下平滑肌细胞的凋亡、且具有抗氧化活性的小肽。
本发明再一目的是提供所述小肽的应用。
本发明的目的采用如下技术方案实现。
一种小肽,其氨基酸序列如SEQ ID NO:1所示。申请人设计了多个小肽序列,由生工生物工程(上海)股份有限公司提供各小肽。通过大量的筛选工作,发现氨基酸序列为AREGEM(SEQ ID NO:1)的小肽(以下简称本发明小肽),不仅具有较好的抗氧化性,而且能够调节高糖诱导的VSMCs异常增殖、调节高糖环境下平滑肌细胞的凋亡,最终使其趋于正常状态。
本发明还提供所述小肽在制备缓解糖尿病并发症的功能食品、抗动脉粥样硬化形成的功能食品、抗氧化功能产品、清除自由基产品、抑制脂质过氧化产品中的应用。
本发明还提供含有所述小肽、用于缓解糖尿病并发症的功能食品。
本发明还提供含有所述小肽、用于抗动脉粥样硬化形成的功能食品。
本发明还提供含有所述小肽的抗氧化功能产品。
本发明还提供含有所述小肽的清除自由基产品。
本发明还提供含有所述小肽的抑制脂质过氧化产品。
有益效果:
本发明小肽,不仅具有较强的抗氧化能力,而且能够调节高糖诱导的VSMCs异常增殖、调节高糖环境下平滑肌细胞的凋亡,最终使其趋于正常状态,因此,能够缓解糖尿病并发症,延缓或阻止AS的发展。本发明还提供该小肽在制备缓解糖尿病其他并发症的功能食品、抗动脉粥样硬化形成的功能食品、抗氧化功能产品、清除自由基产品、抑制脂质过氧化产品等方面的应用。
附图说明
图1(a)不同浓度的本发明小肽对高糖诱导的VSMCs增殖的影响,其中G表示高糖组,G+7.5/15/30/45/60表示加入不同浓度本发明小肽的实验组,数字表示加入小肽的最终浓度;(b)不同浓度的本发明小肽对正常糖孵育的VSMCs存活率的影响,横坐标为本发明小肽的最终浓度。##:与正常组相比有高度差异(p<0.01);*:与高糖组相比有显著差异(p<0.05);**:与高糖组相比有高度差异(p<0.01),下同。
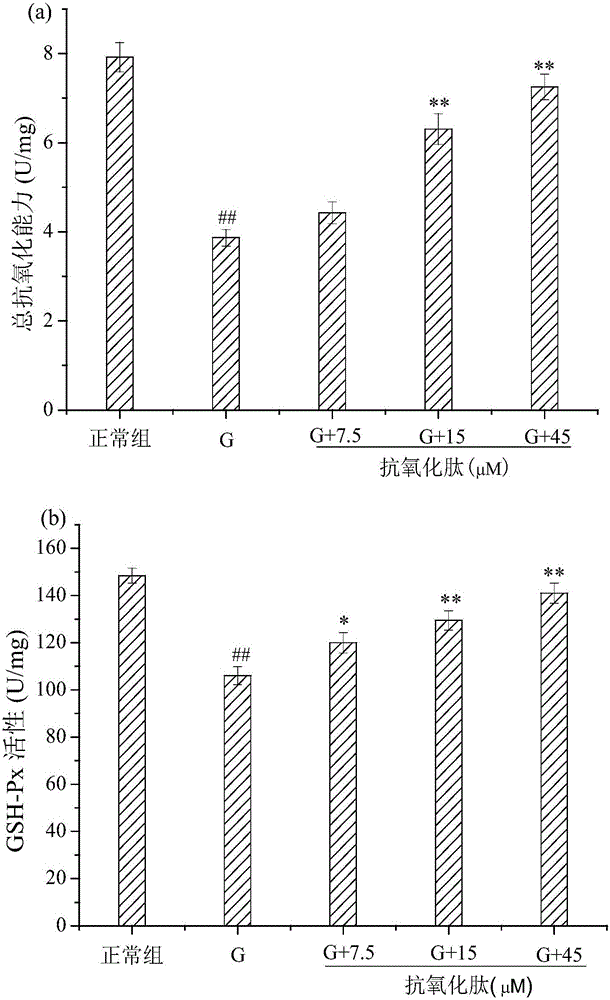
图2不同浓度的本发明小肽对VSMCs中T-AOC(图2(a)))、GSH-Px(图2(b))、SOD(图2(c))、MDA(图2(d))水平的影响,其中G表示高糖组,G+7.5/15/45表示加入不同浓度本发明小肽的实验组,数字表示加入的本发明小肽的终浓度。
图3(a)不同浓度的本发明小肽对高糖诱导的VSMCs内ROS的影响,其中G表示高糖组,G+7.5/15/30/45表示加入不同浓度本发明小肽的实验组,数字表示加入小肽的最终浓度;(b)不同浓度的本发明小肽对正常糖孵育的VSMCs内ROS的影响,横坐标为本发明小肽的最终浓度。
图4本发明小肽对细胞凋亡的影响,图4(a)表示正常组,图4(b)表示高糖组;图4(c)表示加入了终浓度为15μM本发明小肽的实验组;图4(d)表示加入了终浓度为45μM本发明小肽的实验组;图4(e)统计学分析各实验组细胞的凋亡率,其中G表示高糖组,G+15/45表示加入不同浓度本发明小肽的实验组,数字表示加入本发明小肽的最终浓度。
具体实施方式
1材料:ABTS、荧光素钠盐FL、AAPH、Trolox、噻唑蓝(MTT)、荧光探针DCFH-DA、二甲基亚砜(DMSO)、45%葡萄糖购自美国Sigma公司;血管平滑肌细胞(VSMCs)购自北京市疾控中心;胎牛血清(FBS)、低糖DMEM培养基(含糖量为1g/L)、Penicillin-Streptomycin(100×)、Trypsin EDTA(0.05%)、Hank平衡盐溶液(HBSS)购自美国Gibco公司;总抗氧化能力(T-AOC)试剂盒、超氧化物酶(SOD)试剂盒、谷胱甘肽过氧化物酶(GSH-Px)试剂盒、丙二醛(MDA)试剂盒、微量蛋白含量测定(BCA法)试剂盒购自南京建成生物工程研究所;Annexin V-FITC细胞凋亡检测试剂盒、RIPA细胞裂解液购自碧云天生物试剂公司。
2主要仪器与设备:Spectra Max M2e多功能酶标仪,美国Bio Tek公司;MSC-Advantage-1.2生物安全柜,HERA-cell CO2培养箱,美国Thermo Fisher公司;WH-2微型漩涡混合仪,上海沪西分析仪器厂有限公司;JY92-Ⅱ超声波细胞粉碎仪,宁波新艺超声设备有限公司;THZ-C恒温培养振荡器,太仓市实验设备厂;H1850R高速冷冻离心机,湖南湘仪实验室仪器开发有限公司;流式细胞仪Accuri C6,美国BD公司。
实施例1本发明小肽的抗氧化性
本实施例考察本发明小肽的抗氧化性。
1.氧自由基吸收能力(ORAC)测定
吸取20μL待测样品溶液(反应体系中的最终浓度为50μM)和80μL荧光素钠溶液(反应体系中荧光素钠的最终浓度为175nM)于黑色96微孔板的各孔中,混匀,在37℃孵育15min后。用多道移液器向微孔板的各孔中加入100μL AAPH(偶氮二异丁脒盐酸盐,反应体系中AAPH最终浓度为24mM)启动反应。然后将微孔板放置于酶标仪中,振荡混匀后于37℃、485nm激发波长、538nm发射波长下进行测定。每2min测定一次荧光强度,每次读数前振板2s,测定时间设置在荧光值衰减至基线后,设定时间为100min。
以浓度分别为0、6.25、12.5、25、50、100μM的Trolox(水溶性维生素E)制作标准曲线。标准品Trolox和待测样品(最终浓度为50μM)均用75mM的磷酸盐缓冲液(pH 7.4)溶解和稀释。每个实验组设置6个平行,并用磷酸盐缓冲液代替样品作为对照组。ORAC值一般以Trolox当量(Trolox equivalent,TE)来表示,单位为μM TE/μM Peptides。结果发现,本发明小肽(如SEQ ID NO:1所示)的ORAC值为2.13±0.07μM TE/μM Peptides。
2.ABTS+·自由基清除活性测定
用蒸馏水配制过硫化钾溶液(储备液中过硫化钾的终浓度为2.45mM),然后用该溶液与ABTS(2,2-联氮-二(3-乙基-苯并噻唑-6-磺酸)二铵盐)水溶液混合,配制得到ABTS+·储备液(ABTS+·浓度为7mM)。在室温条件下避光静置24h后,用0.1M的磷酸盐缓冲液(PBS,pH 7.4)将ABTS+·储备液稀释一定的倍数,使其在734nm下的吸光度值在0.7±0.02,得到ABTS+·工作液。实验组:用移液器吸取190μL的ABTS+·工作液至96孔板各孔中,然后每孔加入10μL的样品溶液,混合均匀后在25℃的环境下避光反应20min,反应完成后测定反应体系在734nm下的吸光值。对照组:以0.1M的磷酸盐缓冲液(PBS,pH 7.4)替代样品溶液。ABTS+·自由基的清除率=[(A0-A)/A0]×100%,其中,A0表示对照组的吸光值;A表示实验组的吸光值。
表1不同浓度本发明小肽清除ABTS+·自由基能力(X±S,n=3)%
注:表1中的X表示平均数,S表示标准偏差。
从表1可以看出,本发明小肽随着浓度的增加,其清除ABTS+·自由基能力逐渐增强,在浓度为5、7.5、10、12.5、15mM时,其清除率分别为11.70±3.45%、25.90±4.27%、36.05±3.26%、55.65±5.12%、73.10±4.68%。
实施例2本发明小肽对高糖诱导的VSMCs异常增殖的保护作用
采用本发明小肽进行如下实验。
1.噻唑蓝(MTT)法检测细胞增殖
取对数生长期的VSMCs,用含2%FBS的低糖DMEM培养基将细胞悬液调至5×104个/mL,接种于96孔板中,每孔100μL(空白对照组加入100μL含2%FBS的低糖DMEM培养基),细胞数目为5×103个/孔,置于37℃、5%CO2培养箱中培养48h后,吸去培养液,每孔加入100μL低糖DMEM培养基。空白对照组不加任何物质,其他孔随机分为三大组:正常组不添加任何物质;高糖组(G)加入适量的45%的葡萄糖溶液,使葡萄糖最终浓度为25mM;实验组加入最终浓度为25mM的葡萄糖和不同浓度的本发明小肽,每组设6个平行。继续培养24h后,每孔加入10μL、5mg/mL的MTT溶液(PBS溶液配制,过0.22μm无菌膜除菌),培养4h;弃上清液加入100μL异丙醇溶解液,37℃恒温振荡器中避光反应15min后,在酶标仪于波长570nm处测定吸光值(A)。细胞增殖率=[(As-A0)/(An-A0)]×100%,其中,As为实验组吸光值,An为正常组吸光值,A0为空白对照组吸光值。采用X±S(X表示平均数,S表示标准偏差)形式表示各数据。
图1(a)为不同浓度的本发明小肽对高糖诱导的VSMCs增殖的影响。以正常组作为对照组,高糖环境条件下能明显促进VSMCs的增殖,细胞数量高出对照组的42.58±3.78%(p<0.01)。经过不同浓度的本发明小肽(7.5、15、30、45和60μM)孵育24h后,细胞增殖率分别下降至138.93±5.14%、132.64±4.76%、122.55±5.91%、104.41±4.36%和103.95±5.29%。当本发明小肽的浓度为45、60μM时,VSMCs的增殖率几乎达到了和正常组一致的水平。实验结果表明,一定浓度的本发明小肽可以保护细胞,有效抑制高糖引起的VSMCs增殖过快。
为了弄清本发明小肽对VSMCs的生长是否具有影响,检测了在正常糖孵育条件下(即本实施例标题1中第一段中的正常组)加入不同浓度本发明小肽对VSMCs存活率的影响,结果如图1(b)所示。从该图可以看出,在7.5、15、30、45和60μM的浓度条件下,本发明小肽对正常糖孵育的VSMCs的生长无任何不良影响,说明7.5-60μM的本发明小肽对细胞没有任何毒性(p>0.05),对VSMCs既无促进生长作用,也无抑制生长作用。
2.细胞总抗氧化能力(T-AOC)、抗氧化酶活(谷胱甘肽过氧化物酶GSH-Px和超氧化物歧化酶SOD)和丙二醛(MDA)的检测
取对数生长期的VSMCs,用0.05%EDTA-胰蛋白酶溶液消化后,用含10%FBS的低糖DMEM培养基将细胞悬液调至1×105个/mL,接种于24孔板,每孔500μL,使细胞数目为5×104/孔,待细胞完全贴壁后,换用不含血清的低糖DMEM培养基培养24h,使细胞同步于G0期。随机分为三大组:正常组不添加任何物质;高糖组(G)加入适量的45%的葡萄糖溶液,使葡萄糖的最终浓度为25mM;实验组加入最终浓度为25mM的葡萄糖和不同浓度的本发明小肽,每组设6个平行。继续孵育48h。然后除去上清液,各孔加入200μL细胞裂解液,冰上裂解细胞15min后,用细胞刮将细胞及裂解液刮下来,转移到离心管中,然后在冰水浴条件下超声波破碎(功率300W,3~5s/次,间隔10s,重复3次),吸取各组细胞匀浆液,按试剂盒(总抗氧化能力(T-AOC)试剂盒、超氧化物酶(SOD)试剂盒、谷胱甘肽过氧化物酶(GSH-Px)试剂盒、丙二醛(MDA)试剂盒均购自南京建成生物工程研究所)说明书测定各实验组细胞裂解液的T-AOC、SOD和GSH-Px活性和MDA含量,采用X±S(X表示平均数,S表示标准偏差)形式表示各数据。
图2(a)为不同浓度的本发明小肽对VSMCs中T-AOC含量的影响。总抗氧化能力(T-AOC)包括酶与非酶在内的全部抗氧化物,是一个能够全面反映抗氧化能力的指标。经过25mM的葡萄糖处理后,VSMCs中的T-AOC与正常组相比有显著的降低(p<0.01)。低浓度的本发明小肽具有一定的提高T-AOC的作用,但效果不明显(p>0.05)。与高糖组相比,加入浓度为15μM和45μM的本发明小肽后,VSMCs中的T-AOC分别提高到了6.31±0.34U/mg和7.25±0.39U/mg(p<0.01)。表明本发明小肽可以通过提高细胞抗氧化能力来保护细胞。
由图2(b)和2(c)可知,正常组VSMCs中的GSH-Px和SOD活性均在较高的水平,经过25mM的葡萄糖处理48h后,高糖组(G)细胞中的GSH-Px和SOD活性显著降低(p<0.01))。同高糖组相比,各实验组细胞中GSH-Px和SOD的活性随着本发明小肽浓度的升高,酶活性均有不同程度的提高。各不同浓度的本发明小肽组(7.5、15和45μM)谷胱甘肽过氧化物酶的活力分别为119.96±4.30U/mg、129.47±4.09U/mg、141.04±4.23U/mg;超氧化物歧化酶的活力分别为127.87±5.16U/mg、142.29±4.88U/mg、159.79±5.54U/mg。统计分析结果表明,15μM和45μM本发明小肽实验组的GSH-Px和SOD酶活较高糖组的酶活性均有极显著性提高(p<0.01)。
丙二醛(MDA),作为氧自由基攻击生物膜中的多不饱和脂肪酸引发的脂质过氧化反应的最终产物,其含量的变化可以间接的反映细胞的受损程度。由图2(d)可知。高糖组的MDA含量与正常组相比显著升高(p<0.01)),说明高糖环境使质膜脂质过氧化而积累大量产物MDA。当加入不同浓度的本发明小肽(7.5、15、和45μM)孵育48h后,各组细胞内MDA的含量分别下降至1.40±0.05、1.17±0.04和0.87±0.04nmol/mg。统计分析结果表明,不同浓度的(7.5、15和45μM) 本发明小肽对细胞中的MDA含量具有极显著的清除作用(p<0.01)。细胞内MDA含量的变化,表明本发明小肽在一定程度上抑制了细胞内的脂质过氧化作用,增强了细胞的抗氧化防御系统。
3.VSMCs内活性氧(ROS)含量的检测
取对数生长期的VSMCs,用0.05%EDTA-胰蛋白酶溶液消化后,用含10%FBS的低糖DMEM培养基将细胞悬液调至1×105个/mL,接种于24孔板,每孔500μL,使细胞数目为5×104/孔,置于37℃、5%CO2培养箱中培养48h后,吸去培养液,换用不含血清的低糖DMEM培养基。16h后,随机分为三大组:正常组不添加任何物质;高糖组(G)加入适量的45%的葡萄糖溶液,使葡萄糖最终浓度为25mM;实验组加入最终浓度为25mM的葡萄糖和不同浓度的本发明小肽,每组设3个平行。继续培养8h后,吸弃孔内液体,用HBSS(Hank平衡盐溶液)溶液清洗2遍之后,每孔加入300μL浓度为10μM的荧光探针DCFH-DA(2',7'-二氯荧光黄双乙酸盐)溶液,放入CO2培养箱中培养1h后;在酶标仪中于激发波长485nm,发射波长530nm处测定荧光值。采用X±S(X表示平均数,S表示标准偏差)形式表示各数据。
实验结果如图3(a)所示。以正常组细胞内ROS的含量为100%,将其作为对照组,高糖组细胞内的ROS含量显著高于正常组(p<0.01),其细胞内的ROS含量达到了118.32±2.85%。经过不同浓度的本发明小肽(7.5、15、30和45μM)处理后,各组细胞内的ROS水平分别下降至105.24±3.32%、98.28±4.63%、96.39±3.59%和96.96±4.23%。实验结果表明:通过在高糖中加入不同浓度的本发明小肽后,与高糖组相比,可以显著降低细胞内ROS的水平。说明本发明小肽能有效抑制高糖引起的VSMCs内ROS水平增高,抑制氧化应激的发生。
为了探究本发明小肽本身对VSMCs内ROS含量的影响,我们检测了在正常糖孵育条件下(本实施例标题3中第一段的正常组)加入不同浓度本发明小肽后VSMCs内ROS的含量。从图3(b)可以看出,加入不同浓度本发明小肽的实验组和正常组细胞内的ROS含量无显著性差异(p>0.05),证明一定浓度的本发明小肽对正常糖孵育的VSMCs内ROS的含量没有任何影响。实验结果表明本发明小肽本身对实验结果无干扰作用。同时证明,本发明小肽对高糖诱导的VSMCs的保护作用是通过抑制氧化应激实现的。
本发明小肽不仅可以显著提高高糖孵育的VSMCs中总抗氧化能力(T-AOC)、谷胱甘肽过氧化物酶(GSH-Px)和超氧化物歧化酶(SOD)的活性,降低脂质过氧化产物丙二醛(MDA)的含量,有效抑制高糖引起的VSMCs内活性氧(ROS)水平增高,抑制氧化应激的发生,而且能够抑制高糖诱导的血管平滑肌细胞增殖。
实施例3本发明小肽对高糖孵育的VSMCs凋亡的影响
采用本发明小肽进行如下实验。
Annexin V-FITC/PI双染法检测细胞凋亡率:各组细胞的凋亡率采用Annexin V-FITC细胞凋亡检测试剂盒(碧云天生物试剂公司),即Annexin V-FITC/PI双染法。取对数生长期的VSMCs,用0.05%EDTA-胰蛋白酶溶液消化后,用含10%FBS的低糖DMEM培养基将细胞悬液调至5×104个/mL,接种于6孔板,每孔2mL,使细胞数目为1×105个/孔,置于37℃、5%CO2的培养箱中培养48h后,吸去培养液,换用不含血清的低糖DMEM培养基,并随机分为三大组:正常组不添加任何物质;高糖组(G)加入适量的45%的葡萄糖溶液,使葡萄糖的最终浓度为25mM;实验组加入最终浓度为25mM的葡萄糖和不同浓度的本发明小肽,每组设3个平行。继续培养48h后,将细胞培养液吸出至离心管中,用PBS缓冲液洗涤细胞一次,除去上清液后,用0.05%EDTA-胰蛋白酶溶液消化收集细胞,吸除胰蛋白酶溶液后加入收集的细胞培养液,稍混匀,转移到离心管中,将细胞悬液在4℃、以800g离心5min后弃上清,收集细胞,然后用PBS缓冲液轻轻重悬细胞,在4℃、以800g离心5min,除去上清液,加入195μL Annexin V-FITC结合液轻轻重悬细胞,然后加入5μL Annexin V-FITC和10μL碘化丙啶染色液,轻轻混匀,在室温下避光孵育20min。随后置于冰浴中,随即进行流式细胞仪检测细胞,获得的数据用Annexin V-FITC荧光强度(FLl-A通道)为X轴,PI为荧光强度(FL2-A通道)为Y轴的散点图分析细胞凋亡情况。
图4为本发明小肽对细胞凋亡的影响。各组细胞绝大部分出现在Annexin-/PI -双阴性区域,说明细胞处于正常状态。与正常组细胞相比,高糖组Annexin+/PI -细胞和Annexin+/PI+细胞比例下降,说明高糖环境抑制平滑肌细胞的凋亡。加入不同浓度的本发明小肽处理后,Annexin+/PI-细胞和Annexin+/PI+细胞的比例逐渐上升。实验结果表明:本发明小肽可以减弱这种抑制作用。进一步分析各组细胞的凋亡率(采用X±S形式表示各数据,X表示平均数,S表示标准偏差)。加入25mM的葡萄糖处理后,细胞凋亡率由正常组的21.30±1.41%降低到高糖组的14.20±0.88%(p<0.01),加入本发明小肽(15(M和45(M)孵育48h后,细胞凋亡率分别上升至17.60±0.85%(p<0.05)、20.80±1.13%(p<0.01)。实验结果表明:高糖环境抑制平滑肌细胞的凋亡,本发明小肽可以减弱这种抑制作用。
综上所述,本发明小肽具有良好的抗氧化活性,能够调节高糖诱导的VSMCs异常增殖使其趋向于正常状态,能够调节高糖环境下平滑肌细胞的凋亡趋于正常状态,因此,本发明小肽可以应用于制备缓解糖尿病并发症的功能食品、抗动脉粥样硬化形成的功能食品、抗氧化功能产品、清除自由基产品和抑制脂质过氧化产品中。
SEQUENCE LISTING
<110> 南京财经大学
<120> 一种小肽及其应用
<130> 20161206
<160> 1
<170> PatentIn version 3.3
<210> 1
<211> 6
<212> PRT
<213> artificial
<220>
<223> 小肽
<400> 1
Ala Arg Glu Gly Glu Met
1 5
- 还没有人留言评论。精彩留言会获得点赞!