一种快速检测鉴定菊花叶枯线虫的LAMP引物组及其检测方法与流程
本发明属于植物病害分子检测
技术领域:
,具体地,涉及一种快速检测鉴定菊花叶枯线虫的LAMP引物组及其检测方法。
背景技术:
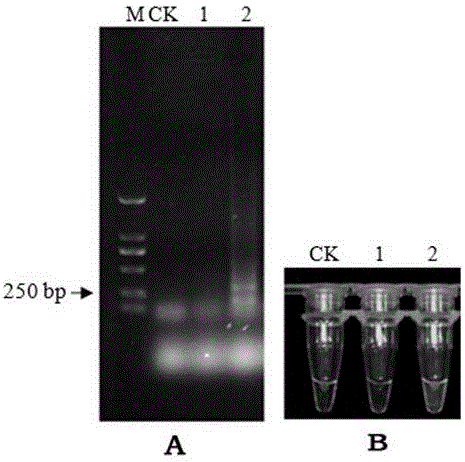
:菊花叶枯线虫(Aphelenchoidesritzemabosi(Schwartz,1911)Steiner&Buhrer,1932)又称菊花滑刃线虫或腋芽滑刃线虫,是一种寄生在植物地上部并引起危害的一种植物病原线虫,与水稻干尖线虫(A.besseyi)和草莓滑刃线虫(A.fragariae)一起统称为叶线虫(foliarnematode)。菊花叶枯线虫的寄主范围广泛,能寄生两百多种植物包括观赏植物、蔬菜、小果类植物和其它野生植物,最典型的寄主便是菊花(Dendranthemamorifolium)。菊花叶枯线虫危害寄主植物会导致其降低或失去经济价值,严重会导致植株枯死。在一些国家,菊花叶枯线虫病是菊花上的重要病害。当菊花叶枯线虫侵染菊花时取食菊花植株的芽和生长点,导致菊花的生长和发育缓慢,同时造成叶片的扭曲和畸形。该线虫危害草莓会造成其产量下降65%。菊花叶枯线虫主要分布在温带地区,在亚洲、欧洲、北美洲和南美洲都有发现。在我国,菊花叶枯线虫仅在个别地区发生。菊花起源于我国,是我国栽培历史最悠久、最普遍的传统名花,我国菊花的销售量居世界首位,是我国花卉产业创汇最多的品种之一。为有效防止菊花叶枯线虫从国外传入和在国内传播扩散,我国于2007年将其列入中华人民共和国进境植物检疫性有害生物名录,2013年列入全国林业危险性有害生物名单。菊花叶枯线虫的鉴定主要是依靠形态学鉴定,主要根据雌虫的体长、侧线数、后阴子宫囊长、尾部形态和雄虫的交合刺长等特征。这些特征需要用高倍显微镜才可以观察到,并且卵和幼虫均不适用于用形态学方法鉴定。此外,菊花叶枯线虫所在的滑刃属(Aphelenchoides)种类繁多,虫体均非常细小,长度通常只有0.20~1.3mm,根据形态学特征鉴定大量相似的滑刃属线虫的种类非常困难,且传统的形态学检测鉴定需要几天时间,并且需要多条雌虫,因此研究和使用分子生物学方法快速准确的检测鉴定菊花叶枯线虫是非常有必要的。崔汝强的专利申请200910037299.7根据菊花叶枯线虫的rDNA-ITS序列,设计了菊花叶枯线虫的特异性引物,利用PCR技术对菊花叶枯线虫进行分子鉴定,该方法虽然具有准确、灵敏的优点,但是仍然存在着一定的限制:(1)其所述的具有检测单条线虫DNA的灵敏度只能是针对纯的菊花叶枯线虫DNA,而且检测灵敏性很差(针对纯的菊花叶枯线虫DNA灵敏度为能够检测到一条线虫DNA),而对于多种线虫混合样品甚至是植物组织等实物样品,比如在检疫工作中、当样本中菊花叶枯线虫含量较低时,无法实现检测目的;(2)需要用精密而昂贵的PCR仪,检测过程复杂、时间较长(需要数小时),结果必须通过琼脂糖凝胶电泳检测才可以判定,不能满足口岸和调运检疫以及田间监测的需求。技术实现要素:本发明所要解决的技术问题是克服现有技术中菊花叶枯线虫检测成本高,检测范围窄,技术复杂,时间较长的缺陷和不足,为菊花叶枯线虫的快速检测鉴定和早期诊断提供一种新的、准确、灵敏、稳定和结果判定直观的LAMP检测方法,本发明方法操作简便、实用性强,为口岸和调运检疫以及产地监测中的菊花叶枯线虫的快速检测鉴定提供了有效的手段。本发明的目的是提供一种快速检测鉴定菊花叶枯线虫的LAMP引物组。本发明的另一目的是提供利用上述LAMP引物组快速检测菊花叶枯线虫的LAMP检测方法。本发明的上述目的是通过以下技术方案给予实现的。一种用于快速检测菊花叶枯线虫的LAMP引物组,所述引物组包括一对外引物F3/B3,一对内引物FIP/BIP和一条环引物LF;其序列分别依次如SEQIDNO.1~SEQIDNO.5所示。具体为外引物F3:SEQIDNO.1,外引物B3:SEQIDNO.2;内引物FIP:SEQIDNO.3,内引物BIP:SEQIDNO.4;环引物LF:SEQIDNO.5。本发明设计的菊花叶枯线虫LAMP引物组中的一对外引物和一对内引物可对菊花叶枯线虫18S核糖体RNA序列中的6个不同区域进行识别扩增,若6个区域中的任何区域与引物不匹配都不能进行核酸扩增,因此相对于PCR引物只对靶序列的两个个不同区域进行识别扩增而言,菊花叶枯线虫LAMP检测的特异性大大提高,假阳性的概率则随之大大降低,因此检测的准确性大大提高。同时设计的一条环形引物,可以提高扩增速度,减少反应时间。同时,所述LAMP引物组在检测和/或鉴定菊花叶枯线虫中的应用亦在本发明保护范围内。优选地,是在检测混有不同种类的线虫样品中或/和植物组织样品中的菊花叶枯线虫中的应用。一种快速检测菊花叶枯线虫的LAMP检测方法,所述方法包括如下步骤:S1.以待测样品DNA为模板,利用上述LAMP引物组进行LAMP扩增;S2.根据扩增结果判断待测样品中是否含有菊花叶枯线虫。优选地,步骤S1所述待测样品DNA的提取方法为:用ddH2O清洗线虫,挑取单条线虫放入反应容器(如PCR管),内含8μLddH2O和1μL10×PCRBuffer(Mg2+free),液氮中放置1~2min(优选1min),80~90℃(优选85℃)加热1~3min(优选2min),向反应容器(如PCR管)中加入1μL1mg/mL蛋白酶K,50~60℃(优选56℃)加热10~20min(优选15min),90~95℃(优选95℃)加热10~15min(优选10min),得到DNA提取液。优选地,步骤S1所述LAMP扩增的体系为:10×ThermopolBuffer2.5μL;25×F3/B31μL;25×FIP/BIP1μL;25×LF1μL;10mmol/LdNTPs6μL;100mmol/LMgSO41.5μL;8U/μlBstDNA聚合酶2.0warmstart1μL;模板DNA1μL;甜菜碱4μL;ddH2O补至25μL。优选地,步骤S1所述LAMP扩增的反应条件为55~65℃温育55~60min,75~85℃保温6~10min。更优选地,步骤S1所述LAMP扩增的反应条件为65℃温育60min,80℃保温10min。优选地,步骤S2所述根据扩增结果判断待测样品中是否含有菊花叶枯线虫的具体方法为:利用电泳法或荧光染料法对LAMP扩增进行检测,根据检测结果判断待测样品中是否含有菊花叶枯线虫。具体是:所述电泳法为:将待测样品LAMP扩增产物进行电泳观察(使用1%琼脂糖凝胶在5~10V/cm电压下电泳25min检测LAMP扩增产物),若扩增产物呈明显的梯状条带,则为阳性,表示待测样品中含有菊花叶枯线虫;若扩增产物未出现条带,则为阴性,表示待测样品中不含有菊花叶枯线虫。所述荧光染料法为:将荧光染料加入待测样品LAMP扩增产物中,混匀,若呈现绿色荧光,则为阳性,表示待测样品中含有菊花叶枯线虫;若呈现橙色,则为阴性,表示待测样品中不含有菊花叶枯线虫。更优选地,所述荧光染料为终浓度为0.05mmol/L钙黄绿素和0.6mmol/L锰离子的混合液。更优选地,所述荧光染料与待测样品LAMP扩增产物以1:6体积比混匀。本发明将设计的菊花叶枯线虫的LAMP检测方法对菊花叶枯线虫的不同发育期(卵、幼虫、雌虫和雄虫)以及形态和生物学特性相对近似的2个目6个属7种其他植物线虫进行了测试验证,保证了该方法的检测结果具有充分的稳定性和可信度。本发明建立的菊花叶枯线虫LAMP检测方法所用检测时间仅需1小时,并且检测灵敏度达到1/100单条虫DNA。而传统的形态学检测鉴定需要几天时间,并且需要多条雌虫;且已报道的菊花叶枯线虫PCR检测方法则需要数小时,也只检测了一条线虫DNA。因此本发明的检测速度更快、灵敏度更高。另外,上述LAMP检测方法在检测和/或鉴定菊花叶枯线虫中的应用亦在本发明保护范围内。该方法不仅可以检测菊花叶枯线虫的雌虫和雄虫成虫,对于卵、幼虫等发育期的菊花叶枯线虫也同样具有很好的检测效果。因此,优选地,上述LAMP检测方法在检测和/或鉴定菊花叶枯线虫的卵或幼虫中的应用亦在本发明保护范围内。优选地,是在检测混有不同种类的线虫样品中或/和植物组织样品中的菊花叶枯线虫中的应用。此外,所述LAMP引物组在制备检测和/或鉴定菊花叶枯线虫试剂盒中的应用亦在本发明保护范围内。因此,本发明还提供一种快速检测菊花叶枯线虫的试剂盒,所述试剂盒中包含有上述LAMP引物组。优选地,所述试剂盒中还包含有线虫DNA提取试剂以及检测试剂。更优选地,所述DNA提取试剂包含10×PCRBuffer(Mg2+free),ddH2O和蛋白酶K。更优选地,所述检测试剂包含有10×ThermopolBuffer,10mmol/LdNTPs,100mmol/LMgSO4,8U/μlBstDNA聚合酶2.0warmstart,甜菜碱、ddH2O和荧光染料。再优选地,所述荧光染料为钙黄绿素或SYBRGreenI。作为一种可选择的实施方式,所述快速检测菊花叶枯线虫的试剂盒的使用方法具体如下:(1)提取待测样品的DNA:用ddH2O清洗线虫,挑取单条线虫放入200μLPCR管中(含8μLddH2O和1μL10×PCRBuffer(Mg2+free)),液氮中放置1min,85℃加热2min,向PCR管中加入1μL1mg/mL蛋白酶K,56℃加热15min,95℃加热10min,得到DNA提取液。(2)LAMP扩增反应:将提取得到的DNA按总体系为25μL建立扩增反应体系:10×ThermopolBuffer2.5μL;25×F3/B31μL;25×FIP/BIP1μL;25×LF1μL;10mmol/LdNTPs6μL;100mmol/LMgSO41.5μL;8U/μlBstDNA聚合酶2.0warmstart1μL;模板DNA1μL;甜菜碱4μL;ddH2O补至25μL;反应条件为:65℃温育60min,80℃保温10min。(3)向反应后的LAMP扩增产物中加入荧光染料,匀混,若呈现绿色荧光,则为阳性,表示待测样品中含有菊花叶枯线虫;若呈现橙色,则为阴性,表示待测样品中不含有菊花叶枯线虫;或者将反应后的LAMP扩增产物进行电泳检测,若扩增产物呈明显的梯状条带,则为阳性,表示待测样品中含有菊花叶枯线虫;若扩增产物未出现条带,则为阴性,表示待测样品中不含有菊花叶枯线虫。本发明所述试剂盒可用来检测或/鉴定不同发育期及形态(卵、幼虫、雌虫和雄虫)的菊花叶枯线虫或/和混有不同种类的线虫样品中或/和植物组织样品中的菊花叶枯线虫。本发明与现有技术相比,具有以下有益效果:(1)特异性强、准确性高:本发明设计的菊花叶枯线虫LAMP引物中的1对外引物和1对内引物对菊花叶枯线虫18S核糖体RNA序列中的6个不同区域进行识别扩增,若6个区域中的任何区域与引物不匹配都不能进行核酸扩增,因此相对于PCR引物只对靶序列的2个不同区域进行识别扩增而言,菊花叶枯线虫LAMP检测的特异性大大提高,假阳性的概率则随之大大降低,因此检测的准确性大大提高。(2)检测结果的稳定性强、可信度高:本发明设计的菊花叶枯线虫LAMP引物对菊花叶枯线虫的不同发育期(卵、幼虫、雌虫和雄虫)以及形态和生物学特性相对近似的2个目6个属7种其他植物线虫进行了测试验证,保证了该方法的检测结果具有充分的稳定性和可信度。(3)检测速度快、效率高、灵敏度高:本发明建立的菊花叶枯线虫LAMP检测方法所用检测时间仅需1小时,并且检测灵敏度达到1/100单条虫DNA。(4)检测效率高、操作简单:本发明建立的菊花叶枯线虫LAMP检测方法不仅可以检测雌虫,而且可以检测卵、幼虫和雄虫,克服了传统的形态学方法只能检测鉴定雌虫的缺陷;本方法可以检测混有不同种类的线虫样品中和植物组织样品中的菊花叶枯线虫,省去了传统形态学鉴定和已有PCR检测方法所要求的样品分离步骤,从而节省了大量时间和工作量;本发明建立的LAMP荧光染料检测方法,只需恒温水浴锅或有稳定热源的设备就能进行,基于琼脂糖凝胶电泳法和荧光染料直观目测法,用肉眼观察颜色变化就可判定结果,省去了昂贵的仪器设备和繁琐的操作过程。因此本发明的检测效率大大提高,操作非常简单、易行。(5)本发明建立的对菊花叶枯线虫进行LAMP检测的引物和方法,实用性强,应用性广,可以广泛应用于口岸和调运检疫以及田间监测中对菊花叶枯线虫的检测,为菊花叶枯线虫的进出境检疫和调运检疫以及田间病害早期诊断和监测提供了准确、快速和易行的方法,对提高菊花叶枯线虫的检出率和防控效果具有重要意义。附图说明图1为本发明所述菊花叶枯线虫LAMP引物组特异性电泳检测结果;其中M为Maker2000,1为空白对照,2和3为水稻干尖线虫,4和5为菊花叶枯线虫。图2为本发明菊花叶枯线虫LAMP方法特异性检测结果;其中A为菊花叶枯线虫LAMP扩增产物电泳检测结果,B为菊花叶枯线虫LAMP扩增产物荧光染料反应结果;M为Maker2000,CK为空白对照,1为菊花叶枯线虫,2为松材线虫,3为水稻潜根线虫,4为南方根结线虫,5为香蕉穿孔线虫,6为滑刃属线虫未定种1,7为滑刃属线虫未定种2。图3为本发明菊花叶枯线虫LAMP引物稳定性测试结果;其中A为菊花叶枯线虫LAMP电泳检测结果,B为菊花叶枯线虫荧光染料反应结果;M为Maker2000,CK为空白对照,1~6分别为不同条件下培养的菊花叶枯线虫种群,1和2为1号培养群体,3和4为2号培养群体,5和6为3号培养群体。图4为本发明菊花叶枯线虫不同发育期单一个体DNA的LAMP反应结果;其中A和C为菊花叶枯线虫LAMP扩增产物电泳检测结果,B和D为菊花叶枯线虫LAMP扩增产物荧光染料反应结果;A和B中:M为Maker2000,CK为空白对照,1为水稻干尖线虫,2~4为菊花叶枯线虫单条雄虫,5~7为菊花叶枯线虫单条雌虫;C和D中:M为Maker2000,CK为空白对照,1~3为菊花叶枯线虫单个卵,4~6为菊花叶枯线虫单条幼虫。图5为本发明菊花叶枯线虫LAMP扩增检测灵敏度结果;其中A为扩增产物电泳检测结果,B为扩增产物荧光染料反应结果;M为Maker2000,CK为空白对照,1为菊花叶枯线虫未稀释单条虫DNA,2-6分别为10-1倍、10-2倍、10-3倍、10-4倍和10-5倍单条虫DNA。图6为本发明菊花叶枯线虫和对照线虫混合样品LAMP扩增检测结果;其中A为扩增产物电泳检测结果,B为扩增产物荧光染料反应结果;M为Maker2000,CK为空白对照,1为水稻干尖线虫、松材线虫、水稻潜根线虫、南方根结线虫、香蕉穿孔线虫和滑刃属线虫未定种的混合样品,2为菊花叶枯线虫、水稻干尖线虫和松材线虫的混合样品,3为菊花叶枯线虫、水稻潜根线虫和南方根结线虫的混合样品,4为菊花叶枯线虫、香蕉穿孔线虫和滑刃属线虫未定种的混合样品,5为菊花叶枯线虫、水稻干尖线虫、松材线虫和水稻潜根线虫的混合样品,6为菊花叶枯线虫、南方根结线虫、香蕉穿孔线虫和滑刃属线虫未定种的混合样品,7为菊花叶枯线虫、松材线虫、水稻潜根线虫、南方根结线虫和香蕉穿孔线虫的混合样品。图7为本发明菊花叶枯线虫和菊花叶组织混合样品LAMP扩增检测结果;其中A为扩增产物电泳检测结果,B为扩增产物荧光染料反应结果;M为Maker2000,CK为空白对照,1为不含菊花叶枯线虫的菊花叶组织,2为菊花叶枯线虫和菊花叶组织混合样品。具体实施方式下面结合说明书附图和具体实施例对本发明作出进一步地详细阐述,所述实施例只用于解释本发明,并非用于限定本发明的范围。下述实施例中所使用的试验方法如无特殊说明,均为常规方法;所使用的材料、试剂等,如无特殊说明,为可从商业途径得到的试剂和材料。实施例1菊花叶枯线虫LAMP引物设计及检测1.LAMP引物设计从NCBI上下载菊花叶枯线虫18S核糖体RNA基因序列(GenBank登陆号:EU186067.1)。通过序列比对,并下载多条相似的其他线虫18S核糖体RNA基因序列,通过多重比对寻找18S序列片段中的特异序列片段,设计获得多组用于菊花叶枯线虫检测的LAMP引物组,均包括一对外引物,一对内引物和一条环引物。经过初步的检测验证(方法如下),最终筛选得到一组最优的LAMP引物组,其序列如下:外引物对:F3(SEQIDNO.1所示):5’-TGTTGAACCGTTCGGGGT-3’B3(SEQIDNO.2所示):5’-TGTTTCAGCCGACAAAACCA-3’内引物对:FIP(SEQIDNO.3所示):5’-AGGACGCAAGTCGAACGGCCGAAAGGGCGTCACTCG-3’BIP(SEQIDNO.4所示):5’-GTGCTCAAGGCGTGTCTTAGGAGCCGCAACCTTGTTCCA-3’环引物:LF(SEQIDNO.5所示):5’-GCGCAAACACGCAAAATACC-3’2.LAMP引物检测验证(1)单条线虫DNA提取将来自云南的1个菊花叶枯线虫种群YN-1作为测试靶标线虫,以与菊花叶枯线虫最近似的水稻干尖线虫作为对照线虫。分别提取菊花叶枯线虫和水稻干尖线虫种群的单条线虫DNA,提取方法参照王江岭等(2011),具体步骤如下:用ddH2O清洗线虫,挑取单条线虫放入200μLPCR管中(含8μLddH2O和1μL10×PCRBuffer(Mg2+free)),液氮中放置1min,85℃加热2min,向PCR管中加入1μL1mg/mL蛋白酶K,56℃加热15min,95℃加热10min,得到DNA提取液可直接进行LAMP扩增或-20℃保存待用。(2)LAMP扩增反应利用设计好的LAMP引物组,以上述提取的单条线虫DNA为模板,按以下反应体系进行LAMP扩增反应。LAMP反应体系:10×ThermopolBuffer2.5μLF3/B3(25×)1μLFIP/BIP(25×)1μLLF(25×)1μLdNTPs(10mmol/L)6μLMgSO4(100mmol/L)1.5μLBstDNA聚合酶2.0warmstart(8U/μl)1μL模板DNA1μL甜菜碱4μLddH2O补足25μL注:引物25倍混合液包括40μMFIP、40μMBIP、5μMF3、5μMB3和10μMLF。LAMP反应条件为:65℃温育60min,80℃保温10min。(3)检测结果使用1%琼脂糖凝胶在5~10V/cm电压下电泳25min检测LAMP扩增产物,结果如图1所示,菊花叶枯线虫种群的DNA样品出现了明显的梯状条带,而水稻干尖线虫的DNA样品和空白对照皆未出现条带。因此,确认所设计的引物可以作为菊花叶枯线虫的LAMP特异引物。实施例2菊花叶枯线虫LAMP引物特异性和稳定性检测1.样品制备以本实验室保存的菊花叶枯线虫作为测试靶标线虫,以本实验室保存的香蕉穿孔线虫、松材线虫、水稻潜根线虫、南方根结线虫以及本实验室分离的滑刃属线虫作为对照线虫,测试菊花叶枯线虫LAMP引物的特异性。用本实验室保存的不同条件下培养的菊花叶枯线虫种群以及单条雌成虫、单条雄成虫、单条幼虫和单个卵进行菊花叶枯线虫LAMP特异引物稳定性测试。单条虫DNA模板的提取,以及LAMP扩增反应体系和反应条件同实施例1,用电泳法和荧光染料法检测结果,具体操作如下:(1)电泳检测法:检测方法与实施例1相同。(2)荧光染料检测法:使用的荧光染料为钙黄绿素。将钙黄绿素溶液(1mM/L)和MnCl2溶液(1mM/L)以体积比1∶12的比例混合配制成荧光染料溶液,其中钙黄绿素终浓度为0.05mmol/L,锰离子终浓度为0.6mmol/L。反应前将4μL荧光染料溶液加在离心管盖的内侧,LAMP反应结束后,摇动离心管将盖上的染料混入扩增产物,若显现绿色荧光则为阳性,若显现橙色(与反应前颜色相同)则为阴性。2.检测结果(1)将供试线虫的DNA用菊花叶枯线虫LAMP引物扩增后的产物分别经电泳法和荧光染料法检测,结果如图2所示:只有菊花叶枯线虫的DNA样品电泳检测结果出现特异条带(图2A),且加入荧光染料后颜色变为绿色荧光(图2B),而6种对照线虫DNA样品未出现特异条带,加入荧光染料后也并未变色。因此本发明设计的菊花叶枯线虫LAMP引物具有很好的特异性。(2)采用菊花叶枯线虫特异LAMP引物对不同条件下培养的菊花叶枯线虫种群的DNA进行LAMP扩增后的产物分别经电泳法和荧光染料法检测,结果如图3所示:6个不同条件下培养的菊花叶枯线虫种群的DNA样品电泳检测结果皆出现了阶梯状条带(图3A),荧光染料结果(图3B)与电泳图一致,不同条件下培养的菊花叶枯线虫种群的DNA样品均变为绿色荧光,这表明,所述LAMP检测引物及方法在种内表现出了很好的稳定性。(3)采用菊花叶枯线虫特异LAMP引物对菊花叶枯线虫单条(个)雌虫、雄虫、幼虫和卵的DNA进行LAMP扩增后的产物分别经电泳法和荧光染料法检测,结果如图4所示:4种菊花叶枯线虫样品均分别出现梯状电泳条带(图4A,4C)和荧光绿色(图4B,4D),空白和阴性对照均未出现特异条带和荧光绿色。这表明,本发明的菊花叶枯线虫LAMP引物和反应体系适用于检测菊花叶枯线虫不同发育时期的单条线虫或单个卵。实施例3菊花叶枯线虫LAMP引物灵敏度检测1.样品制备及检测方法采用实施例1的方法提取菊花叶枯线虫的单条虫DNA,将DNA浓度按100、10-1、10-2、10-3、10-4和10-5梯度进行稀释后作为模板,,以实施例1的LAMP引物组,按照实施例1的反应体系和反应条件进行LAMP扩增,每个处理进行三次重复。分别用上述电泳法和荧光染料法检测LAMP扩增产物。2.检测结果以梯度稀释的菊花叶枯线虫单条虫的DNA为模版进行LAMP扩增反应,反应后的产物分别进行电泳和荧光染料检测,结果如图5所示:菊花叶枯线虫的单条虫DNA模版稀释100倍后仍然可以扩增出清晰的电泳条带(图5A),加入荧光染料后则显现绿色荧光(图5B)。因此,本发明的菊花叶枯线虫LAMP方法的灵敏度为单条虫DNA的10-2倍。实际上,菊花叶枯线虫的单条虫DNA模版稀释1000倍后,仍然可看到较明显的扩增条带和绿色荧光,可以说本发明的菊花叶枯线虫LAMP方法的灵敏度为单条虫DNA的10-3倍。考虑到对实验结果的严谨性,我们下结论为:本发明的菊花叶枯线虫LAMP方法的灵敏度为单条虫DNA的10-2倍。实施例4多种线虫混合样品和植物组织中的菊花叶枯线虫LAMP检测1.样品制备(1)菊花叶枯线虫和对照线虫混合样品制备将菊花叶枯线虫和不同种类的对照线虫按以下方式混合(每种线虫一条虫)后作为检测对象:菊花叶枯线虫、水稻干尖线虫和松材线虫;菊花叶枯线虫、水稻潜根线虫和南方根结线虫;菊花叶枯线虫、香蕉穿孔线虫和滑刃属线虫未定种;菊花叶枯线虫、水稻干尖线虫、松材线虫和水稻潜根线虫;菊花叶枯线虫、南方根结线虫、香蕉穿孔线虫和滑刃属线虫未定种;菊花叶枯线虫、松材线虫、水稻潜根线虫、南方根结线虫和香蕉穿孔线虫。阴性对照为:水稻干尖线虫、松材线虫、水稻潜根线虫、南方根结线虫、香蕉穿孔线虫和滑刃属线虫未定种。(2)菊花叶枯线虫和植物组织(菊花叶组织)混合样品制备将30条菊花叶枯线虫和20mg菊花叶组织混合作为检测对象,阴性对照为不包含菊花叶枯线虫的20mg菊花叶组织。2.DNA提取和LAMP扩增菊花叶枯线虫和对照线虫混合样品DNA采用实施例1的方法提取。菊花叶枯线虫与菊花叶组织混合样品DNA提取采用OmegaHPPlantDNAKit试剂盒方法,具体操作方法如下:(1)称取20mg菊花组织叶片,用剪刀剪碎,在体视显微镜下挑取30条菊花叶枯线虫,一起放入离心管中,液氮速冻,用研磨棒研磨约2min;(2)离心管中加入500μLBufferCPL,加入10μLβ-巯基乙醇,涡旋混匀后65℃水浴15min,水浴期间颠倒混匀两次;(3)加入500μL氯仿和异丙醇混合液(24∶1),涡旋混匀,10000rpm室温离心10min;(4)取上清液300μL于新的1.5mL离心管中,加入10μLRnase酶;(5)加入150μLBufferCXD和300μL无水乙醇,混匀得到一均匀的混合液;(6)将DNA样品纯化柱置于2mL收集管中,将混合液转移到纯化柱,10000rpm离心1min;(7)弃滤液和收集管,将纯化柱放入新的收集管中,加650μLSPWWashBuffer,10000rpm离心1min;(8)倒弃滤液,加入650μLSPWWashBuffer,10000rpm离心1min;(9)倒弃滤液,10000rpm空柱离心2min,甩干柱子中残留的液体;(10)把纯化柱置于新的1.5mL离心管中,加30uL预热至55℃的无菌水至柱子的膜中央,静置2min。10000rpm离心1min。将菊花叶枯线虫混合线虫样品和菊花叶枯线虫混合植物样品按照实施例1的反应体系和反应条件进行LAMP扩增反应。3.检测结果分别用上文所述电泳法及荧光染料法对各样品DNA的LAMP扩增产物进行检测,结果如图6和图7所示:含有菊花叶枯线虫的混合线虫样品和菊花叶组织样品均出现明显的特异条带(图6A和7A),扩增产物的颜色均变为绿色荧光(图6B和7B)。因此本发明设计的菊花叶枯线虫LAMP检测方法可以直接从多种线虫混合样品和菊花叶组织样品中检测鉴定出菊花叶枯线虫,且灵敏性很好,操作简便、实用性强,在菊花叶枯线虫的检测鉴定方面具有很好的应用前景,尤其适用于基层实验和检疫工作。SEQUENCELISTING<110>华南农业大学<120>一种快速检测鉴定菊花叶枯线虫的LAMP引物组及其检测方法<130>2016<160>5<170>PatentInversion3.3<210>1<211>18<212>DNA<213>F3<400>1tgttgaaccgttcggggt18<210>2<211>20<212>DNA<213>B3<400>2tgtttcagccgacaaaacca20<210>3<211>36<212>DNA<213>FIP<400>3aggacgcaagtcgaacggccgaaagggcgtcactcg36<210>4<211>39<212>DNA<213>BIP<400>4gtgctcaaggcgtgtcttaggagccgcaaccttgttcca39<210>5<211>20<212>DNA<213>LF<400>5gcgcaaacacgcaaaatacc20当前第1页1 2 3
相关技术
网友询问留言
已有0条留言
- 还没有人留言评论。精彩留言会获得点赞!
1