一种用于单通道双靶点核酸检测的实时荧光PCR检测方法与流程
本发明涉及生物检测技术领域,特别涉及一种用于单通道双靶点核酸检测的实时荧光PCR检测方法。
背景技术:
伴随着基因分子诊断技术的迅猛发展,PCR、RT-PCR、Real-Time PCR、LAMP等新技术正以其高特异性、敏感性和时效性慢慢地在取代传统的病原体分离培养和生化鉴定等敏感性低、费时费力的检测方法。同时由于临床诊断技术的不断提高,其对检测技术的敏感性要求也越来越高,这里就包括检测敏感性AS(analytical sensitivity)和临床敏感性CS(clinical sensitivity)。例如呼吸道感染、腹泻病原体感染、脑炎脑膜炎病原体感染等疾病常常是由多个混合病原体感染引起,如果仅仅检测一个指标,临床敏感性及其临床的指导意义也会大大降低。
目前为了提高检测敏感性多采用荧光定量PCR技术,荧光定量PCR技术是在普通PCR的基础上在PCR反应体系中加入荧光基团,在靶序列扩增过程中,随着PCR反应产物不断累积,荧光信号强度也等比例增加,并逐渐累积形成一条扩增曲线,通过荧光扩增曲线实时监测整个PCR进程,最后通过标准曲线对未知模板进行定性及定量分析的方法。
如今体外诊断行业依靠单重荧光定量PCR技术作为分子诊断工具已有二十多年,单重PCR检测具有检测通量低、检测成本高、检测时间长等缺点。
技术实现要素:
本发明的发明目的在于提供一种用于单通道双靶点核酸检测的实时荧光PCR检测方法,以解决单重PCR检测通量低、检测成本高、检测时间长的问题。
本发明示出一种用于单通道双靶点核酸检测的实时荧光PCR检测方法,包括:
PCR体系中引入了与核酸模板互补的探针和特异性引物,设定PCR扩增程序,进行PCR扩增循环,所述PCR扩增循环的过程中,每个循环均在延伸步骤中进行实时的荧光信号强度采集,并通过对实时的荧光信号强度变化对目标靶序列一进行定性分析;所述探针的5’端标记荧光报告基团,所述探针的3’端标记猝灭基团;所述特异性引物标记引物猝灭基团和引物荧光报告基团;
所述PCR扩增循环结束后,通过采集的荧光信号强度变化绘制熔解曲线对检测的目标靶序列二进行定性分析。
进一步,所述通过实时的荧光信号强度变化对检测的目标靶序列一进行定性分析的步骤包括:
通过酶水解所述探针产生荧光强度变化对检测的目标靶序列一进行定性分析。
进一步,所述通过采集的荧光信号强度变化绘制熔解曲线对检测的目标靶序列二进行定性分析的步骤包括:
采集所述特异性引物的扩增产物的荧光信号强度变化绘制熔解曲线对检测的目标靶序列二进行定性分析。
进一步,所述特异性引物的5’端修饰标记引物猝灭基团,所述特异性引物中间位置标记引物荧光报告基团。
进一步,所述引物猝灭基团与所述引物荧光报告基团之间的间距为15-25nt。
进一步,所述探针的Tm值高于所述特异性引物的Tm值5℃-10℃。
进一步,所述PCR扩增程序包括;
预变性和酶激活温度为95℃,时间为1min;
逆转录温度为60℃,时间为30min;
cDNA预变性温度为95℃,时间为1min;
变性温度为95℃,时间为15s;
退火温度为60℃,时间为30s;
延伸及荧光采集的温度为72℃,时间为30s;
熔解曲线分析的温度为55℃-95℃。
进一步,所述特异性引物包括:目标靶序列一特异性引物和目标靶序列二特异性荧光引物;
所述目标靶序列一特异性引物的核酸序列为:SEQ ID NO:1AAGAACACAGATCTCGAGGCTCTC和SEQ ID NO:2GTCTCCATTTCCATTTAGGGCATTC;
所述目标靶序列二特异性引物的核酸序列为:SEQ ID NO:4[BHQ1]-TTCAAATATCAGACAAAAACAAAACCAA[T(FAM)]CC和SEQ ID NO:5TGTCTATTTTGTTGCTTTAATAATCGAG。
进一步,所述探针的核酸序列为:SEQ ID NO:3CTGCAGTCCTCGCTCACTGGGCAC
根据本发明的实施例示出一种用于单通道双靶点核酸检测的实时荧光PCR检测方法,包括:PCR体系中引入了与核酸模板互补的探针和特异性引物,设定PCR扩增程序,进行PCR扩增循环,所述PCR扩增循环的过程中,每个循环均在延伸步骤中进行实时的荧光信号强度采集,并通过对实时的荧光信号强度变化对目标靶序列一进行定性分析;所述探针的5’端标记荧光报告基团,所述探针的3’端标记猝灭基团;所述特异性引物标记引物猝灭基团和引物荧光报告基团;所述PCR扩增循环结束后,通过采集的荧光信号强度变化绘制熔解曲线对检测的目标靶序列二进行定性分析。本发明是基于酶水解探针产生荧光信号及特异性引物扩增后,产物杂交产生荧光信号两种技术原理,针对单色荧光通道中目标靶序列一核酸的检测采用酶水解探针的方式,目标靶序列二的核酸的检测使用采用熔解曲线的方式,进而实现在单色荧光通道中同时进行两个靶点的检测和分析,本发明解决了传统PCR检测方法无法用一支反应管里有限数量的检测通道提高靶点检测通量的问题,极大的提升了单管PCR反应检测的通量,为科研及临床复杂的混合病原体感染检测及多基因遗传的检测提供了强大的技术支持。
附图说明
为了更清楚地说明本发明实施例或现有技术中的技术方案,下面将对实施例中所需要使用的附图作简单地介绍,显而易见地,下面描述中的附图仅仅是本发明的一些实施例,对于本领域普通技术人员来讲,在不付出创造性劳动的前提下,还可以根据这些附图获得其他的附图。
图1为根据一优选实施例示出的一种用于单通道双靶点核酸检测的实时荧光PCR检测方法的流程图;
图2为引物荧光基团和猝灭基团之间的标记位置做了不同间距的处理测得荧光强度图;
图3为检测模板中只有甲型流感InfA时的熔解曲线;
图4检测模板中只有甲型流感InfA时的扩增曲线;
图5为检测模板中只有甲型流感InfB时的熔解曲线;
图6检测模板中只有甲型流感InfB时的扩增曲线;
图7为检测模板中既有InfA也有InfB时的熔解曲线;
图8为检测模板中既有InfA也有InfB时的扩增曲线。
具体实施方式
下面将结合本发明实施例中的附图,对本发明实施例中的技术方案进行清楚、完整的描述,显然,所描述的实施例仅仅是本发明一部分实施例,而不是全部的实施例。基于本发明中的实施例,本领域普通技术人员在没有做出创造性劳动前提下所获得的所有其他实施例,都属于本发明保护的范围。
本发明实施例示出一种用于单通道双靶点核酸检测的实时荧光PCR检测方法,如图1所示,所述方法包括:
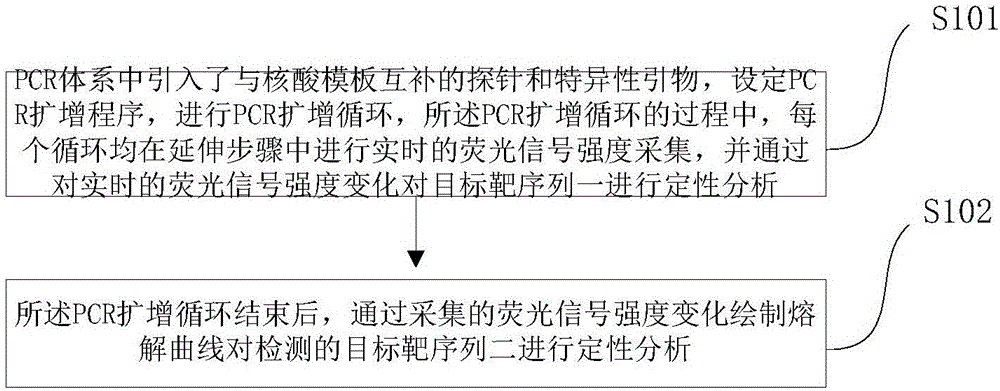
S101,PCR体系中引入了与核酸模板互补的探针和特异性引物,设定PCR扩增程序,进行PCR扩增循环,所述PCR扩增循环的过程中,每个循环均在延伸步骤中进行实时的荧光信号强度采集,并通过对实时的荧光信号强度变化对目标靶序列一进行定性分析;
其中,所述探针的5’端标记荧光报告基团,所述探针的3’端标记猝灭基团;所述特异性引物标记引物猝灭基团和引物荧光报告基团;
S102,所述PCR扩增循环结束后,通过采集的荧光信号强度变化绘制熔解曲线对检测的目标靶序列二进行定性分析。
进一步,所述特异性引物的5’端修饰标记引物猝灭基团,所述特异性引物中间位置标记引物荧光报告基团。
进一步,所述通过对实时的荧光信号强度变化对检测的目标靶序列一进行定性分析的步骤包括:
通过酶水解所述探针产生荧光强度变化对检测的目标靶序列一进行定性分析。
进一步,所述引物猝灭基团于所述引物荧光报告基团之间的间距为15-25nt。
在特异性引物设计中对引物荧光基团和猝灭基团之间的标记位置做了不同间距的处理,结果如图2,其中1为引物荧光基团和猝灭基团之间间距大于25nt,2为引物荧光基团和猝灭基团之间间距为15-25nt,3为引物荧光基团和猝灭基团之间间距小于15nt。
其中以这两个基团标记位置相距15-25nt为最佳实验效果,当间距大于25nt或者小于15nt实验结果均不理想,其中以小于15nt效果最不好,分析可以发现当寡聚核苷酸长度太短时,其标记的荧光基团和猝灭基团在单链和杂合双链时荧光产生效率均不高,这应该是由荧光基团的荧光一直被猝灭基团所猝灭所导致。
本发明中所提供的方法为一种在单色荧光通道中进行双靶点检测的多重荧光PCR技术,更具体地说为一种实时荧光PCR扩增结合终点熔解曲线分析的多重PCR检测技术,PCR体系中荧光的产生方式为酶水解探针产生荧光和特异性引物杂交产生荧光,两种发生方式相结合。
本发明中提到的熔解曲线法实现方式为,在靶点的特异性引物的5’端标记引物猝灭基团,在特异性引物中间位置标记报告基团,引物猝灭基团和引物荧光报告基团之间的间距最后优选为15-25nt,随着PCR不断的扩增,PCR体系内将会积累大量带有荧光的扩增靶序列片段,PCR扩增结束后,进行熔解曲线法分析,当温度低于扩增产物设计的Tm值时,带荧光的扩增产物在体系中为相互杂交的DNA双链状态,此时由于荧光报告基团和猝灭基团的物理位置较远,故而荧光报告基团产生的荧光不能被猝灭基团猝灭,体系可以检测到荧光信号;当温度高于扩增产物设计的Tm值时,带荧光的扩增产物在体系中以DNA单链的形式存在,这时由于寡聚核苷酸的分子柔性,导致荧光报告基团与猝灭基团的物理位置较近,进而荧光报告基团发出的荧光被猝灭基团所猝灭,体系检测不到荧光信号。
靶核苷酸序列特异性引物和探针的设计:
本发明中靶核酸序列特异性引物和探针设计,除了要考虑保证序列的保守性和特异性外,还需对选择为熔解曲线法的靶点的引物作特殊修饰处理,即在特异性引物的5’端修饰标记猝灭基团,同时在特异性引物的中间修饰标记荧光报告基团,其中猝灭基团和荧光报告基团的间距优选为15-25nt。
PCR反应体系的配比:
多重反应体系中,靶点Real time PCR反应体系组成至少含有如下组份:PCR buffer、DNA聚合酶、dNTPs、引物、探针以及催化DNA聚合酶所需要的金属阳离子。
本发明的优选方案为:
SEQ ID NO:1AAGAACACAGATCTCGAGGCTCTC;
SEQ ID NO:2GTCTCCATTTCCATTTAGGGCATTC;
SEQ ID NO:3CTGCAGTCCTCGCTCACTGGGCAC;
其中荧光报告基团与猝灭基团标记的位置为:[荧光报告基团]-CTGCAGTCCTCGC[T-猝灭基团]CACTGGGCAC-[猝灭基团];
SEQ ID NO:4[BHQ1]-TTCAAATATCAGACAAAAACAAAACCAA[T(FAM)]CC;
SEQ ID NO:5TGTCTATTTTGTTGCTTTAATAATCGAG;
本发明实施例示出的一种用于单通道双靶点核酸检测的实时荧光PCR检测方法,根据靶核酸序列的保守性,选取保守性较好的区域,进行扩增的特异性引物和探针的设计,其中探针的Tm设计要高于特异性引物5-10℃,同时在探针的5’端标记荧光报告基团,在探针的3’端标记猝灭基团。在扩增开始时,探针与模板结合,随后,DAN聚合酶的5’端→3’端外切酶活性将探针酶切降解,使报告荧光报告基团和猝灭基团分离,从而荧光定量PCR扩增仪可接收到荧光信号。随着反应的进行,扩增产物不断累积,荧光信号强度也等比例增加。每经过一个循环,收集一个荧光强度信号,通过荧光强度变化监测产物量的变化,得到一条荧光扩增曲线图。荧光扩增曲线可以分成三个阶段:荧光背景信号阶段、荧光信号指数扩增阶段和平台期。在荧光背景信号阶段,产生荧光的水平不能与背景明显地区别,指数期时,产物量的对数值与起始模板量之间存在线性关系,在平台期,扩增产物已不再呈指数级的增加,因此可以在反应处于指数期的某一点上来检测产物的量,并且由此来推断模板最初的含量。
进一步,所述PCR扩增程序为:
预变性和酶激活温度为95℃,时间为1min;
逆转录温度为60℃,时间为30min;
cDNA预变性温度为95℃,时间为1min;
变性温度为95℃,时间为15s;
退火温度为60℃,时间为30s;
延伸及荧光采集的温度为72℃,时间为30s;
熔解曲线分析的温度为55℃-95℃。
进一步,所述在扩增结束后绘制熔解曲线的步骤包括:
扩增结束后每上升0.5℃采集一次荧光信号,绘制熔解曲线。
本发明的检测方法为Real time RT-PCR,将RNA逆转录和DNA扩增结合起来,同时在PCR扩增结束后进行溶解曲线分析。Real time RT-PCR反应过程为:
1)cDNA合成;
2)cDNA预变性,时间和长度取决于靶核苷酸长度及碱基组成,预变性的温度一般为90℃-105℃,时间一般为1-10min,预变性的目的为使双链核苷酸序列彻底分离为单链;
3)变性,温度一般为90℃-105℃,时间一般为10s-30s;
4)退火,使各引物退火检测核酸的靶序列上。退火的温度通常为40℃-60℃,退火的时间可以是10s-60s;
5)延伸,引物与模板结合,开始合成新的双链DNA,延伸温度一般为40℃-80℃,延伸时间可以是10s-5min。本发明实施例的优选方案为:
结果分析:
当该检测通道只有72℃的扩增曲线,且在溶解曲线分析时无熔解曲线峰时,该通道检测结果为只检测到设计为探针的目标靶序列一;
当该检测通道没有72℃的扩增曲线,但在溶解曲线分析时有熔解曲线峰时,该通道检测结果为只检测到设计为熔解曲线检测的目标靶序列二;
当该检测通道既有72℃的扩增曲线,且在溶解曲线分析时有熔解曲线峰,则该通道检测结果为既检测到设计为探针的目标靶序列一,又检测到设计为熔解曲线的目标靶序列二;
当该检测通道既没有72℃的扩增曲线,且在溶解曲线分析时也没有熔解曲线峰时,该通道检测结果为既没有检测到设计为探针的目标靶序列一,又没有检测到设计为熔解曲线的目标靶序列二;
为证明该发明方法的可行性,进行了以呼吸道检测为载体的研究:
其中1为甲型流感InfA;2为甲型流感InfB;3为甲型流感InfA和甲型流感InfB
其中在FAM通道中设计为探针检测目标靶序列一为:甲型流感InfA,设计为熔解曲线分析目标靶序列二为InfB。测试结果为:
(1)当检测模板中只有甲型流感InfA时,结果如图3和图4所示,检测中只有扩增曲线而没有熔解曲线峰;
(2)当检测模板中只含有InfB时,结果如图5和图6所示,检测中没有扩增曲线而只有熔解曲线峰;
(3)当检测模板中既有InfA也有InfB时,结果如图7和图8所示,检测中既有扩增曲线也有熔解曲线峰;
可见,本发明是基于DNA聚合酶水解探针产生荧光信号及特异性引物扩增产物杂交产生荧光信号的两种技术原理,针对单色荧光通道中一个目标靶序列一的检测采用探针,目标靶序列二的检测使用采用熔解曲线的方式,进而实现在单色的荧光通道中同时进行两个靶点检测和分析。
由以上技术方案可知,本发明的实施例示出一种用于单通道双靶点核酸检测的实时荧光PCR检测方法,包括:PCR体系中引入了与核酸模板互补的探针和特异性引物,设定PCR扩增程序,进行PCR扩增循环,所述PCR扩增循环的过程中,每个循环均在延伸步骤中进行实时的荧光信号强度采集,并通过对实时的荧光信号强度变化对目标靶序列一进行定性分析;所述探针的5’端标记荧光报告基团,所述探针的3’端标记猝灭基团;所述特异性引物标记引物猝灭基团和引物荧光报告基团;所述PCR扩增循环结束后,通过采集的荧光信号强度变化绘制熔解曲线对检测的目标靶序列二进行定性分析。本发明是基于酶水解探针产生荧光信号及特异性引物扩增后,产物杂交产生荧光信号两种技术原理,针对单色荧光通道中目标靶序列一核酸的检测采用酶水解探针的方式,目标靶序列二的核酸的检测使用采用熔解曲线的方式,进而实现在单色荧光通道中同时进行两个靶点的检测和分析,本发明解决了传统PCR检测方法无法用一支反应管里有限数量的检测通道提高靶点检测通量的问题,极大的提升了单管PCR反应检测的通量,为科研及临床的复杂的混合病原体感染检测及多基因遗传的检测提供了强大的技术支持。
本领域技术人员在考虑说明书及实践这里公开的发明后,将容易想到本发明的其它实施方案。本申请旨在涵盖本发明的任何变型、用途或者适应性变化,这些变型、用途或者适应性变化遵循本发明的一般性原理并包括本发明未公开的本技术领域中的公知常识或惯用技术手段。说明书和实施例仅被视为示例性的,本发明的真正范围和精神由下面的权利要求指出。
应当理解的是,本发明并不局限于上面已经描述并在附图中示出的精确结构,并且可以在不脱离其范围进行各种修改和改变。本发明的范围仅由所附的权利要求来限制。
SEQUENCE LISTING
<110> 湖南圣湘生物科技有限公司
<120> 一种用于单通道双靶点核酸检测的实时荧光PCR检测方法
<130> 11
<160> 5
<170> PatentIn version 3.5
<210> 1
<211> 24
<212> DNA
<213> Influenza virus type A
<400> 1
aagaacacag atctcgaggc tctc 24
<210> 2
<211> 25
<212> DNA
<213> Influenza virus type A
<400> 2
gtctccattt ccatttaggg cattc 25
<210> 3
<211> 24
<212> DNA
<213> Influenza virus type A
<400> 3
ctgcagtcct cgctcactgg gcac 24
<210> 4
<211> 31
<212> DNA
<213> Influenza virus type B
<400> 4
ttcaaatatc agacaaaaac aaaaccaatc c 31
<210> 5
<211> 28
<212> DNA
<213> Influenza virus type B
<400> 5
tgtctatttt gttgctttaa taatcgag 28
- 还没有人留言评论。精彩留言会获得点赞!