复合聚乙烯亚胺修饰氧化石墨烯复合材料及其制备方法和应用与流程
本发明涉及生物医学及纳米材料
技术领域:
,尤其涉及一种复合聚乙烯亚胺修饰氧化石墨烯复合材料及其制备方法和应用。
背景技术:
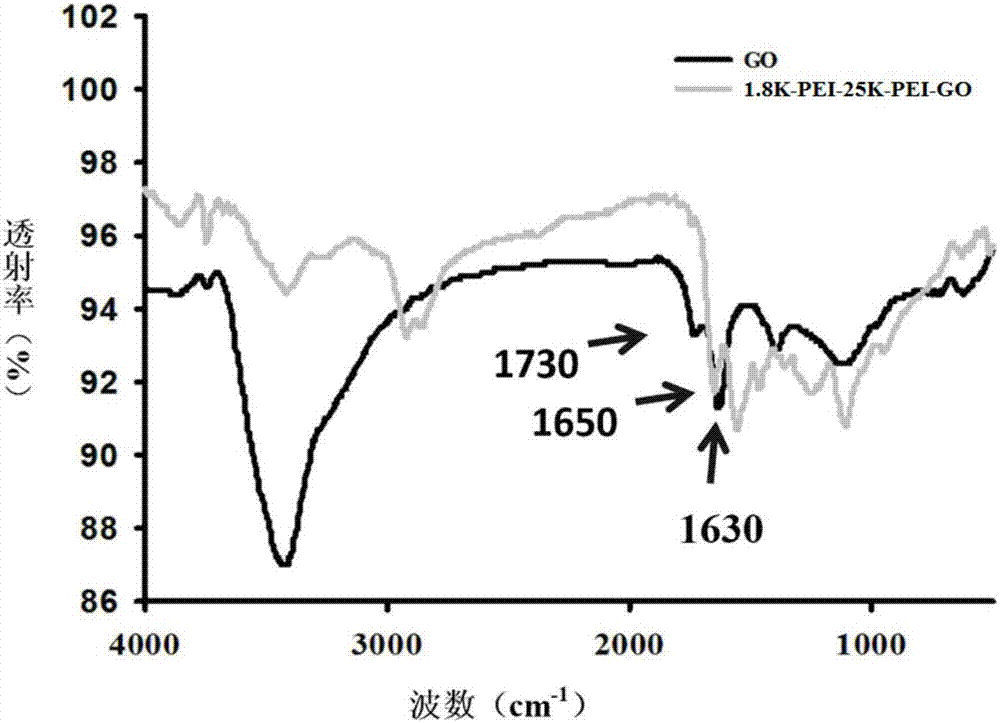
:随着功能基因组时代的来临,构建各种功能基因突变体成为实验室研究和产业界必不可少的技术和措施。同时在生物医药领域,将功能基因导入含有基因缺失/突变的病灶细胞并在表达,从而改变细胞的遗传属性,取得更好的治疗效果。成功的基因转染和基因治疗离不开有效的复合材料。继续发展安全有效且低毒性的基因复合材料是基因转染技术研究中急需解决的问题。目前基因转染试剂一般可分为两类:病毒复合材料和非病毒复合材料。病毒复合材料具有高的转染效率,但由于免疫原性的存在,导致机体产生排斥,使得基因输送安全性不高。传统的非病毒复合材料有脂质体、聚合物以及金纳米颗粒等,但存在转染效率较低,细胞毒性高,缺乏靶向性等缺陷。在化疗药物领域也存在类似的问题,像多柔比星类脂溶性药物在口服和注射给药过程中容易流失,在到达病灶细胞之前已经代谢,造成药物利用低,对正常组织细胞具有较强的毒副作用。因此,寻求构建高效而又安全的转染试剂和药物复合材料,使目的基因在细胞中有效表达和药物在组织细胞中的高效运输,是当前生物医药领域关注的热点和重点。技术实现要素:本发明要解决的技术问题是克服现有技术的不足,提供一种转染效率高、毒性低的复合聚乙烯亚胺修饰氧化石墨烯复合材料及其制备方法,可应用于基因转染和药物运载,具有高效、快捷、安全等优势。为解决上述技术问题,提供了一种复合聚乙烯亚胺修饰氧化石墨烯复合材料,包括氧化石墨烯、低分子聚乙烯亚胺、高分子聚乙烯亚胺和交联剂,所述低分子聚乙烯亚胺和高分子聚乙烯亚胺通过交联剂修饰于所述氧化石墨烯表面;所述高分子聚乙烯亚胺为相对分子质量≥20000的聚乙烯亚胺,所述低分子聚乙烯亚胺为相对分子量小于5000的聚乙烯亚胺。上述的复合聚乙烯亚胺修饰氧化石墨烯复合材料,优选的,所述高分子聚乙烯亚胺为相对分子质量为20000~25000的聚乙烯亚胺,所述低分子聚乙烯亚胺为相对分子量为1500~3000的聚乙烯亚胺。上述的复合聚乙烯亚胺修饰氧化石墨烯复合材料,优选的,所述高分子聚乙烯亚胺、低分子聚乙烯亚胺与所述氧化石墨烯的质量比为5~10∶5~10∶1。上述的复合聚乙烯亚胺修饰氧化石墨烯复合材料,优选的,所述交联剂为1-乙基-3-3-二甲基氨基丙基、n-羟基琥珀酰亚胺酯和三乙醇胺中的一种或多种。作为一个总的技术构思,本发明还提供了一种上述的复合聚乙烯亚胺修饰氧化石墨烯复合材料的制备方法,包括以下步骤:s1、将氧化石墨烯分散在水中,加入交联剂得到混悬液;将高分子聚乙烯亚胺和低分子聚乙烯亚胺混合加入交联剂得到混合溶液;s2、将所述混合溶液逐滴滴入混悬液中搅拌使充分接触;s3、用透析袋透析得到复合聚乙烯亚胺修饰氧化石墨烯复合材料。上述的制备方法,优选的,所述氧化石墨烯中加入的交联剂为1-乙基-3-3-二甲基氨基丙基(edc)和n-羟基琥珀酰亚胺酯(nhs);所述高分子聚乙烯亚胺和所述低分子聚乙烯亚胺的混合物中加入的交联剂为三乙醇胺(tea)。edc和nhs是为了使氧化石墨烯的羧基与聚乙烯亚胺的氨基更好地发生反应,生成酰胺键。tea是为了更好地溶解聚乙烯亚胺。上述的制备方法,优选的,所述步骤s2中所述搅拌的温度为室温,搅拌的时间为24h;所述步骤s3中,所述透析袋为100kda的透析袋,所述透析的条件为:在室温下以去离子水渗透3d。本发明中的室温为25℃。作为一个总的技术构思,本发明还提供了一种上述的复合聚乙烯亚胺修饰氧化石墨烯复合材料或上述的制备方法制备得到的复合聚乙烯亚胺修饰氧化石墨烯复合材料在微生物或动植物细胞基因转染中的应用。优选的,微生物细胞为大肠杆菌、酵母菌或放线菌,动物细胞为实验室培养的稳定细胞系或原代培养细胞,植物细胞为建立的细胞系或植物愈伤组织。作为一个总的技术构思,本发明还提供了一种上述的复合聚乙烯亚胺修饰氧化石墨烯复合材料或上述的制备方法制备得到的复合聚乙烯亚胺修饰氧化石墨烯复合材料在药物运载中的应用。优选的,所述药物为抗肿瘤药物。上述的应用,优选的,所述药物为芳香族药物。由于氧化石墨烯表面的独特碳原子结构可以与芳香性物质的苯环或杂环发生π-π堆垛作用,因此这种复合材料还可以负载其他芳香性药物,如阿霉素、紫杉醇、白藜芦醇、吲哚美辛、伊立替康等。与现有技术相比,本发明的优点在于:(1)本发明提供了一种复合聚乙烯亚胺修饰氧化石墨烯复合材料,包括氧化石墨烯、低分子聚乙烯亚胺和高分子聚乙烯亚胺。其中氧化石墨烯是一种新型二维碳纳米材料,具备良好的生物相容性、高比表面积、易修饰性,已被开始应用于药物传递。氧化石墨烯通过π-π堆垛作用,可将芳香族药物如多柔比星高效负载于表面。而在氧化石墨烯表面修饰复合聚乙烯亚胺可以促进复合材料高效进入细胞。聚乙烯亚胺是一种正电性的聚合物,被认为是转染的黄金复合材料。支化聚乙烯亚胺中含有大量氨基,有利于自身的质子化效应,促进内涵体逃逸,提高转染效率。高分子的聚乙烯亚胺虽然具有较高转染效率,但毒性较大,低分子聚乙烯亚胺虽然细胞毒性较小,但转染效率也较低。本发明充分发挥两者的优良特性,利用两者混合型溶液对氧化石墨烯表面进行修饰,得到了转染效果高于低分子量聚乙烯亚胺,而细胞毒性低于高分子量聚乙烯亚胺的新型聚乙烯亚胺-氧化石墨烯纳米复合物。(2)本发明提供了一种复合聚乙烯亚胺修饰氧化石墨烯复合材料的制备方法,在氧化石墨烯与混合的聚乙烯亚胺反应中,交联剂edc和nhs是为了使氧化石墨烯的羧基与聚乙烯亚胺的氨基更好地发生反应,生成酰胺键。聚乙烯亚胺混合溶液中加入的tea是为了更好地溶解聚乙烯亚胺。透析的作用是为了除去多余的聚乙烯亚胺,获得复合聚乙烯亚胺修饰氧化石墨烯。(3)本发明提供了一种复合聚乙烯亚胺修饰氧化石墨烯复合材料在基因转染和药物转载中的应用,当其应用于基因转染,在人肝癌细胞smmc-7721中转染效率达80%以上,在浓度为18μg/ml时,细胞存活率保持在85%以上,且整个转染过程可在含血清条件下进行。将应用于药物复合材料实验,负载抗肿瘤药物多柔比星,负载率达到25%,肿瘤细胞识别率达85%以上。具有安全、快捷、有效等优势。附图说明为使本发明实施例的目的、技术方案和优点更加清楚,下面将结合本发明实施例中的附图,对本发明实施例中的技术方案进行清楚、完整的描述。图1为实施例1中的复合聚乙烯亚胺修饰氧化石墨烯复合材料的原子力显微镜图。图2为实施例1中的复合聚乙烯亚胺修饰氧化石墨烯复合材料的红外图。图3为实施例2中的复合聚乙烯亚胺修饰氧化石墨烯复合材料的转染效率荧光图。图4为实施例2中的复合聚乙烯亚胺修饰氧化石墨烯复合材料与其他转染试剂转染效率对比图。图5为实施例3中的复合聚乙烯亚胺修饰氧化石墨烯复合材料对dox在不同ph下的释放曲线。图6为实施例3中的复合聚乙烯亚胺修饰氧化石墨烯复合材料装载dox的体外细胞摄入荧光图。图7为实施例3中的复合聚乙烯亚胺修饰氧化石墨烯复合材料与其他材料装载dox的细胞毒性分析。具体实施方式以下结合说明书附图和具体优选的实施例对本发明作进一步描述,但并不因此而限制本发明的保护范围。实施例以下实施例中所采用的材料和仪器均为市售。实施例1:一种本发明的复合聚乙烯亚胺修饰氧化石墨烯复合材料(1.8k-pei-25k-pei-go),包括氧化石墨烯、低分子聚乙烯亚胺、高分子聚乙烯亚胺和交联剂,低分子聚乙烯亚胺和高分子聚乙烯亚胺通过交联剂修饰于氧化石墨烯表面;高分子聚乙烯亚胺的相对分子量为25000,低分子聚乙烯亚胺的相对分子量为1800。高分子聚乙烯亚胺、低分子聚乙烯亚胺和氧化石墨烯的质量比为5∶5∶1。一种本实施例的复合聚乙烯亚胺修饰氧化石墨烯复合材料的制备方法,包括以下步骤:(1)取1mg氧化石墨烯于去离子水中,超声分散30min;使氧化石墨烯完全分散于水体中得到氧化石墨烯分散液。(2)在氧化石墨烯分散液中加入54.3mg的1-乙基-3-3-二甲基氨基丙基(edc)与50.6mg的n-羟基琥珀酰亚胺酯(nhs),混合得到混悬液。(3)将5mg的高分子聚乙烯亚胺和5mg的低分子聚乙烯亚胺按照质量比为1∶1进行混合,然后加入100μl的三乙醇胺(tea)得到混合溶液。(4)将步骤(3)的混合溶液逐滴滴加到步骤(2)的混悬液中,超声30min混合后,室温搅拌24h,最后装入100kda的渗透袋在25℃下透析3天,得到复合聚乙烯亚胺修饰氧化石墨烯复合材料。对实施例1的复合聚乙烯亚胺修饰氧化石墨烯复合材料进行原子力显微镜(afm)分析,参见图1:复合聚乙烯亚胺修饰氧化石墨烯复合材料高度为2~4nm,尺寸为20nm~80nm。对实施例1的复合聚乙烯亚胺修饰氧化石墨烯复合材料进行红外分析,参见图2:聚乙烯亚胺有效地结合在氧化石墨烯上。对比例1一种高分子聚乙烯亚胺修饰氧化石墨烯复合材料(25k-pei-go),与实施例1的区别在于步骤(3)为:将10mg的高分子聚乙烯亚胺加入100μl的三乙醇胺(tea)中得到混合溶液。对比例2一种低分子聚乙烯亚胺修饰氧化石墨烯复合材料(1.8k-pei-go),与实施例1的区别在于步骤(3)为:将10mg的低分子聚乙烯亚胺加入100μl的三乙醇胺(tea)中得到混合溶液。实施例2一种实施例1的复合聚乙烯亚胺修饰氧化石墨烯复合材料在基因转染中的应用。将肝癌细胞smmc-7721以每孔104的密度接种于6孔板中,并培养24小时以待smmc-7721细胞贴壁。接着,将原有的培养基小心吸弃,然后往各孔中加入0.1ml含10%fbs的dmem培养基。分别将1.8k-pei-25k-pei-go(实施例1)、25k-pei-go(对比例1)、1.8k-pei-go(对比例2)以及氧化石墨烯(go)与绿色荧光蛋白表达质粒按照质量比为10∶1混合,加入dmem培养基混合30分钟得到复合物1、2、3、4。分别取上述复合物1~4于孔中,在37℃培养箱中继续孵育4h之后,再将原有培养基小心吸弃,加入新鲜的dmem培养基,继续在细胞培养箱中孵育。在48h后用荧光倒置相差显微镜下观察绿色荧光蛋白的表达量。孵育24h并未达到最佳转染效果,48h已经达到最佳的转染效果,而72h死亡细胞比24h和48h较多。图3为实施例2中的1.8k-pei-25k-pei-go的转染效率荧光图。左图为转染荧光图,在488nm的光激发下,细胞发出绿色荧光,代表绿色荧光蛋白在细胞中成功表达。右图代表明亮视野图,即细胞在光镜下的图。分别在24h、48h和72h后,将各孔中的培养基吸弃干净,加入pbs清洗两次,用细胞裂解液(细胞裂解液包括tri-hcl、nacl、pmsf、edta)裂解细胞并使用荧光素酶活性检测试剂盒(购买自生工生物工程股份有限公司)来检测裂解液中的荧光素酶活性。裂解液中的蛋白含量则通过bca蛋白检测试剂盒(购买自生工生物工程股份有限公司)来检测。荧光素酶活性用相对荧光单位/毫克蛋白(rlu/mg)来表示,从而测定转染效率。测定结果参见表1。表1:各组转染效率对比图4为复合聚乙烯亚胺修饰氧化石墨烯复合材料组、高分子聚乙烯亚胺组、低分子聚乙烯亚胺组和氧化石墨烯组转染效率对比图。从表1和图4的结果可知:复合聚乙烯亚胺修饰氧化石墨烯复合材料的转染效率明显优于低分子聚乙烯亚胺组和氧化石墨烯组,甚至比高分子聚乙烯亚胺组更高。实施例3一种实施例1的复合聚乙烯亚胺修饰氧化石墨烯复合材料在药物转载中的应用。实验组:将100μm的阿霉素与0.2mg/ml的实施例1的1.8k-pei-25k-pei-go加入ph=7.4的磷酸缓冲溶液中,于黑暗处室温搅拌24小时得到混合物。将混合物以12000rpm离心5min,并用去离子水洗涤,重复离心操作,直到上清液变为无色。最后沉淀物即为负载阿霉素的复合聚乙烯亚胺修饰氧化石墨烯复合材料(1.8k-pei-25k-pei-go-dox),冷冻干燥备用。对照1组:将对比例1的25k-pei-go代替1.8k-pei-25k-pei-go进行同样操作得到负载有阿霉素的高分子聚乙烯亚胺(25k-pei-go-dox)。对照2组:将对比例2的1.8k-pei-go代替1.8k-pei-25k-pei-go进行同样操作,负载有阿霉素的第分子聚乙烯亚胺(1.8k-pei-go-dox)对照3组:将氧化石墨烯(go)代替1.8k-pei-25k-pei-go进行同样操作得到负载有阿霉素的氧化石墨烯(go-dox)。药物装载效率测定:由朗伯-比尔定律可知,物质的吸光度与浓度成正比。将dox配制成浓度分别为0.025mg/ml、0.05mg/ml、0.1mg/ml、0.2mg/ml、0.4mg/ml的溶液,在480nm处测定上述不同浓度dox溶液的吸光度值。根据浓度与吸光度值获得线性方程。将上述1.8k-pei-25k-pei-go-dox于去离子水中透析,通过最终测定透析液中多余的dox在480nm处吸光度值,再根据之前所得线性方程,可得其浓度。因此确定了没有装载的dox质量,反推负载在载体上的dox质量。计算得到药物装载效率(dle)与包封效率(ee)。装载效率(drugloadingefficiency),dle=(w起始药物-w未装载药物)/w载体。包封率(entrapmentefficiency),ee=(w起始药物-w未装载药物)/w起始药物。w起始药物为加入反应体系的药物质量,w未装载药物为透析之后在透析液中的药物质量,w载体为复合型聚乙烯亚胺修饰氧化石墨烯复合材料。计算得到药物装载效率(dle)与包封效率(ee)分别为29.35%和52.87%。体外药物的释放测定:药物释放通过透析法分析,具体步骤为:将1.8k-pei-25k-pei-go-dox分为两份,分别溶于模拟癌细胞微环境的ph=5.3(2ml)与生理环境ph=7.4的pbs(2ml)中,置于100kda透析袋中,于50ml的pbs中渗透,并在37℃下低速搅拌。在不同的时间间隔下(2、4、6、8、10、12和24hr),取透析袋外pbs(2ml),测量其在480nm的uv吸光度值,同时补加等量的pbs溶液。释放入pbs中dox的浓度通过dox的标准浓度曲线得到,这种方法同样适用于go-dox(以go作为对照)。所有的实验重复三次,累积计算dox的释放量。参见图5:1.8k-pei-25k-pei-go载药后对药物具有明显缓释效果,在ph=5时,24h药物释放率为30%,远高于ph=7.4的24%,说明该载药适合在偏酸环境释放。体外细胞摄取实验:将肝癌细胞smmc-7721以每孔104个细胞(以细胞计数板计数)的密度接种于含2ml培养基(含10%胎牛血清的deme培养基,dmem是一种含各种氨基酸和葡萄糖的培养基)的6孔培养板培养。将含dox浓度分别为0.5μg/ml、1μg/ml、2μg/ml、5μg/ml的dox、go-dox、1.8k-pei-25k-pei-go-dox加入各孔,于37℃培养箱中分别孵育0.5、1、2,4hr后舍弃培养液,用ph=7.4的pbs清洗细胞2次,荧光显微镜下收集荧光图像。其中dox浓度为的5μg/ml的1.8k-pei-25k-pei-go-dox在2hr的荧光成像结果最好,成像结果参见图6,左图为阿霉素在荧光视野下发出红色荧光,说明阿霉素从载体上有效释放出来,由于阿霉素与载体结合会导致其荧光淬灭或微弱,此处印证前面体外模拟肿瘤弱酸性下,药物的释放。右图代表明亮视野图,即细胞在光镜下的图。从图6中可知:载药组80%细胞呈现明显红色荧光,说明药物已成功进入细胞。载药效果分析:将smmc-7721肝癌细胞以6000个细胞每孔的密度接种于96孔板中,培养24hr以待细胞贴壁且长至对数生长期。随后小心吸弃原有培养基,分别向各孔中加入120μl含1.8k-pei-25k-pei-go-dox的dmem培养基(其中1.8k-pei-25k-pei-go-dox的质量体积浓度分别为2μg/ml、6μg/ml、10μg/ml、14μg/ml、18μg/ml)、含1.8k-pei-25k-pei-go的dmem培养基(其中1.8k-pei-25k-pei-go的质量体积浓度分别为2μg/ml、6μg/ml、10μg/ml、14μg/ml、18μg/ml)、含1.8k-pei-go-dox的dmem培养基(其中1.8k-pei-go-dox的质量体积浓度分别为2μg/ml、6μg/ml、10μg/ml、14μg/ml、18μg/ml)、含go-dox的dmem培养基(其中go-dox的质量体积浓度分别为2μg/ml、6μg/ml、10μg/ml、14μg/ml、18μg/ml)。孵育24hr后小心吸取原有培养基,在各孔中加入100μl含10μlmtt溶液的dmem培养基,继续孵育4hr。随后向每孔加入150μl的dmso,孵育5min,取出置于摇床上低速摇匀10min。最后,通过使用酶标仪来检测各孔在570nm处的吸光度值来计算细胞活性。检测结果参见图7。图7表明:1.8k-pei-25k-pei-go组细胞活性保持在85%以上,未呈现明显细胞毒性。而1.8k-pei-25k-pei-go-dox组对细胞出现明显抑制效果,其抑制效果明显优于1.8k-pei-go-dox和go-dox组。随着go-dox浓度的升高毒性有所增加。这是由于go-dox通过胞吞作用进入细胞,在肿瘤弱酸环境导致药物释放。而1.8k-pei-25k-pei-go-dox和1.8k-pei-go-dox通过静电作用和胞吞作用进入细胞,在肿瘤弱酸环境和内涵体逃逸作用下导致药物释放。因此,由图6和图7可知,1.8k-pei-25k-pei-go能很好进入细胞以及促使药物释放,且细胞毒性小,而1.8k-pei-25k-pei-go-dox细胞毒性强。在1.8k-pei-25k-pei-go-dox浓度为18μg/ml时,细胞活性已经低于60%。同时考察18μg/ml的1.8k-pei-25k-pei-go-dox、18μg/ml的go-dox的药物装载率和细胞存活率,考察结果参见表2。表2:考察药物装载率和细胞存活率dox(%)go-dox(%)1.8k-pei-25k-pei-go-dox(%)药物装载率(%)15.55±3.0229.35±4.41细胞存活率(%)65.59±3.6267.54±5.6555.62%±7.38从表2中可知:1.8k-pei-25k-pei-go-dox组的药物装载率和细胞存活率均优于go-dox组。以上所述,仅是本发明的较佳实施例而已,并非对本发明作任何形式上的限制。虽然本发明已以较佳实施例揭示如上,然而并非用以限定本发明。任何熟悉本领域的技术人员,在不脱离本发明的精神实质和技术方案的情况下,都可利用上述揭示的方法和技术内容对本发明技术方案做出许多可能的变动和修饰,或修改为等同变化的等效实施例。因此,凡是未脱离本发明技术方案的内容,依据本发明的技术实质对以上实施例所做的任何简单修改、等同替换、等效变化及修饰,均仍属于本发明技术方案保护的范围内。当前第1页12
相关技术
网友询问留言
已有0条留言
- 还没有人留言评论。精彩留言会获得点赞!
1