一种提高大肠杆菌电转化阳性重组子获取效率的方法与流程
本发明属于生物工程技术领域,涉及一种微生物电转化的方法,具体涉及一种提高大肠杆菌电转化阳性重组子获取效率的方法。
背景技术:
电转化技术应用于生物领域用于得到有一定功能的工程菌,是一种非常实用的技术。但是,转化过程中存在转化过程繁琐,重组效率不高等问题,重组子筛选也存在筛选结果不准确的问题。影响重组率的因素众多,同源臂长度、阿拉伯糖诱导浓度及时间、复苏时间、温度、转化电压等都会影响其转化效率,而其中最主要的影响因素为同源臂长度、电转化电压及阿拉伯糖诱导浓度。在用常规方法进行重组子筛选过程中也会出现将假阳性重组子误认为阳性的后果。
技术实现要素:
鉴于现有技术存在的问题,本发明的目的在于提供一种提高大肠杆菌电转化阳性重组子获取效率的方法,从而解决现有的大肠杆菌电转化效率低、筛选不准确的问题。
为解决上述问题,本发明采用以下技术方案来实现:
一种提高大肠杆菌电转化阳性重组子获取效率的方法,采用的步骤包括,
(1)含卡那霉素抗性基因的外源线性靶DNA片段的构建;
(2)大肠杆菌电转化感受态细胞的制备;
(3)外源线性靶基因DNA片段与大肠杆菌电转化感受态细胞基因整合;
(4)筛选大肠杆菌阳性重组子;
所述筛选大肠杆菌阳性重组子的鉴定引物包括正向引物和反向引物,
正向引物为:
purn-F:5′-CCCAGGAACACGCTATTTATCC-3′
ppx-R:5′-CATCTACCACACGGGCTATGAC-3′
反向引物为:
p-F:5′-TCTGCGTTACTGCCTTGATGAT-3′
p-R:5′-TAATCAATATTGCGCGTCATCC-3′。
所述步骤(1)构建时,用于扩增外源线性靶DNA片段的引物基因序列包括SEQ ID No.1所示上游引物F-Kan和SEQ ID No.2所示下游引物R-Kan。
5’-ATGGGTCAGGAAAAGCTATACATCGAAAAAGAGCTCAGTTGGTTATCGTTGCGATTGTGTAGGCTGGAG-3’
5’-TTATTCAGGTTGTTCGAGTGATTTGATGTAGTCGTAAATCGCCAACTGCGTAACGGCTGACATGGGAATTAG-3’
所述步骤(2)大肠杆菌电转化感受态细胞的制备方法,包括以下步骤:
挑取大肠杆菌单菌落接种于液体培养基中过夜培养;
移接菌液于预热的含氨苄霉素LB培养基中培养,待OD600=0.2~0.25时,加入L-阿拉伯糖,所述L-阿拉伯糖摩尔浓度为10-20mmol/L,待OD600=0.5~0.6后转移菌液于预冷的离心管冰浴、离心,弃上清液,用冰冷无菌水重悬沉淀;
沉淀后再次离心,弃上清液,冻存,即得到大肠杆菌感受态细胞。
优选的,所述L-阿拉伯糖摩尔浓度为15mmol/L。
所述大肠杆菌为E.coli/pKD46。
所述步骤(3)包括以下步骤:
将外源线性靶基因DNA片段与大肠杆菌感受态细胞悬液混合后,预冷条件下进行脉冲电击,脉冲电击结束后,室温下加入SOC液体培养基得到电转液,筛选获得含外源线性靶基因的大肠杆菌的阳性转化子;
所述脉冲电击条件为:电脉冲为25uF,电阻为200Ω,电压为1.6-1.8kV。
优选的,所述脉冲电击电压为1.8kV。
本发明的有益效果是:
(1)本发明根据待敲除目标基因序列两端的互补序列设计的短臂同源序列范围,使外源DNA片段更易与细菌染色体发生交换并重组。
(2)本发明提出的重组电转化电压,提高电转化效率。
(3)本发明提出的诱导重组子生长的阿拉伯糖浓度范围,在此合适范围内更易得到大量阳性重组子。
(4)本发明设计正反向鉴定引物,对阳性重组子进行进一步鉴定,提高鉴定准确性。
附图说明
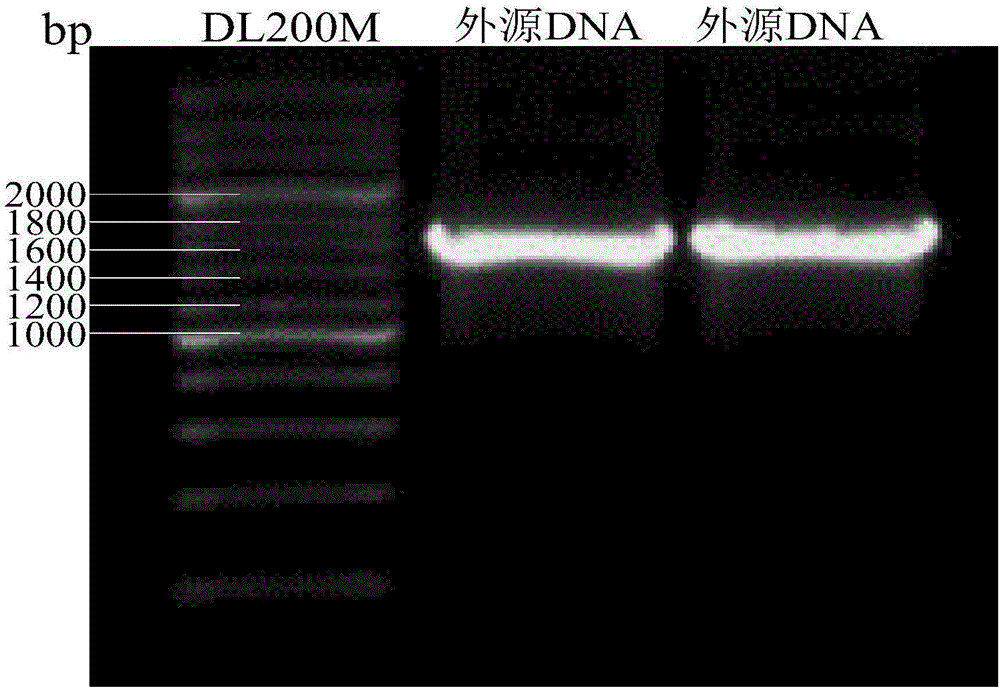
图1是外源目的DNA的PCR扩增谱图;
图2是重组菌株正向PCR验证谱图;
图3是野生型菌株和重组菌株反向PCR验证结果。
具体实施方式
下面结合附图和具体实施方式对本发明进行详细说明,不能认定本发明的具体实施只局限于这些说明。对于本发明所属技术领域的普通技术人员来说,在不脱离本发明构思的前提下,还可以做出若干简单推演或替换,都应当视为属于本发明的保护范围。
实施例1
本实施例提供一种提高大肠杆菌电转化阳性重组子获取效率的方法,包括大肠杆菌感受态细胞的制备方法及含卡那霉素抗性基因的外源线性靶基因DNA片段的获取方法,本发明设计了50bp的同源臂序列,构建含卡那霉素抗性基因的外源DNA片段。其次:以大肠杆菌ATCC25922为受体菌,制备感受态大肠杆菌E.coli/PKD46,其中,阿拉伯糖浓度为15mmol/L,最后将外源DNA片段导入大肠杆菌,其中电转化电压为1.8kV。
具体步骤如下(以敲除大肠杆菌ppk基因中,将外源基因DNA片段重组入大肠杆菌为例):
1、含卡那霉素抗性基因的外源线性靶DNA片段的构建
对待敲除目标基因序列进行分析设计出用于扩增外源靶基因DNA片段的引物,其5′端为50bp待敲除目标基因ppk两侧的延伸短臂同源序列,3′端为20bp的用于扩增两侧带有FRT标记的卡那霉素抗性基因。以pKD4质粒为模板,常规PCR方法扩增靶基因片段,产物片段长度约1600bp,胶回收后用于电转化。
上游同源臂引物F-Kan(划线部分为同源臂,是从起始密码子开始的50bp的序列):
5’-ATGGGTCAGGAAAAGCTATACATCGAAAAAGAGCTCAGTTGGTTATCGTTGCGATTGTGTAGGCTGGAG-3’
下游同源臂引物R-Kan(划线部分为同源臂,是从终止密码子向左的50bp的序列):
5’-TTATTCAGGTTGTTCGAGTGATTTGATGTAGTCGTAAATCGCCAACTGCGTAACGGCTGACATGGGAATTAG-3’
以pKD4质粒为模板扩增靶基因DNA片段的反应体系和条件见表1。
PCR扩增条件:94℃预变性1min;94℃变性30s,55℃退火30s,72℃延伸2min,反应进行30个循环;72℃再延伸10min;4℃保温至∞。
扩增完成后,1%的琼脂糖凝胶电泳检测PCR产物。
表1 PCR反应体系
2、大肠杆菌(E.coli/pKD46)电转化感受态细胞的制备
具体操作如下:
(a)从新鲜琼脂板挑取大肠杆菌(E.coli/pKD46)单菌落接种于5mlLB液体培养基中30℃,170rpm过夜培养16小时;
(b)按1:50移接菌液于50ml预热的含氨苄霉素(60ug/ml)LB培养基中,30℃,220rpm培养,每隔30min测定其OD600值,待OD600=0.2~0.25时,加入L-阿拉伯糖,使之终浓度分别为5mmol/L、、15mmol/L、30mmol/L、50mmol/L诱导培养约1h,使其OD600=0.5~0.6;
(c)当OD600=0.5~0.6时,转移20ml菌液于50ml预冷的离心管后,迅速将离心管冰浴30min,不时缓慢摇匀以保证内容物充分冷却,为下一步准备;
(d)4℃,4300rpm离心15min,以回收细胞,弃上清,用40ml冰冷无菌水重悬沉淀;
(e)4℃,4300rpm离心20min,以回收细胞,弃上清,用25ml冰冷10%除菌甘油重悬沉淀两次;
(f)加入1ml冰冷的10%除菌甘油重悬后,分装于1.5ml灭的Eppendorf离心管中,每管100ul;
(h)冻存于-70℃冰箱中。使用前室温下待融解后将管转移至冰上。
3、外源线性靶基因DNA片段整合到大肠杆菌野生菌基因组
具体操作如下:
(a)以8~10ul的体积向每个含有E.coli/pKD46感受态细胞的离心管中加入约100ng构建好的外源线性靶基因DNA片段,置于冰上3~5min;
(b)调节电转化仪,使电脉冲为25uF,电阻为200Ω、电压分别为1.8kv、2.0kv、2.3kv;
(c)将感受态细胞与外源线性靶基因DNA片段的混合物加至预冷的电转化杯中,轻击液体以确保感受态细胞与外源线性打靶DNA悬液位于电转化杯底部。擦干电转化杯外侧的冷凝水和雾气,将其放进电转化仪上;
(d)进行脉冲电击;
(e)脉冲结束后,尽可能快的取出电转化杯。室温下加入1mlSOC液体培养基,,吹打后,吸取1ml电转液于1.5ml灭菌Eppendorf离心管中;
(f)30℃,170rpm振荡培养2.5h后,6000rpm离心5min,弃800ul上清后,剩余菌液200ul涂布于含有卡那霉素(25ug/ml)的营养琼脂平板上正置3h后,再倒置培养12h。
实验发现,当分别采用电转化电压为1.8,2.0,2.3kV时,L-阿拉伯糖诱导摩尔浓度5,15,30,50mmol/L,只有在电转化电压为1.8kV和L-阿拉伯糖诱导摩尔浓度为15mmol/L条件下,得到了重组子,而其余条件下并未有重组子长出。
实施例2
本实施例对实施例1的结果进行筛选验证
1、重组菌的筛选
(a)待上述含有卡那霉素(25ug/ml)的营养琼脂平板上长出菌落后,挑取单菌落接种至50mlLB培养基中。30℃,170rpm培养5h后,将温度升高到42℃,170rpm继续培养10h;
(b)采用划线分离的方式,取菌液一环,分别接种至含有卡那霉素(25ug/ml)和含有氨苄霉素(60ug/ml)的营养琼脂平板上,30℃过夜培养;
(c)筛选与菌种保藏挑取能够在含有卡那霉素的平板上生长而在氨苄霉素的平板上不生长的菌落,接种至含有卡那霉素的LB培养基中,37℃过夜培养16h后,接种至营养琼脂斜面培养基30℃后4℃保藏备用。
2、阳性重组子的分子鉴定
设计鉴定引物对含卡那霉素抗性重组子进行PCR扩增,通过扩增产物的大小判断野生菌基因组上的ppk基因是否被替换成功。
A.正向引物鉴定
1)引物设计
根据GenBank提供的大肠杆菌基因组序列信息,运用Primer Premier5.0和Oligo6.0设计出所需的PCR引物,序列如下:
purn-F:5′-CCCAGGAACACGCTATTTATCC-3′
ppx-R:5′-CATCTACCACACGGGCTATGAC-3′
2)扩增体系及条件
正向引物鉴定靶基因替换大肠杆菌野生菌ppk基因PCR扩增反应,采用25ul反应体系,具体反应体系和条件见表2。
表2 PCR反应体系
PCR扩增条件:95℃预变性5min;95℃变性30s,53℃退火45s,72℃延伸1.5min,反应进行30个循环;72℃再延伸10min;4℃保温至∞。
扩增完成后,1%的琼脂糖凝胶电泳检测PCR产物。胶回收后克隆测序。
B.反向引物鉴定
1)引物设计
根据GenBank提供的大肠杆菌基因组序列信息运用Primer Premier5.0和Oligo6.0设计出所需的PCR引物,序列如下:
p-F:5′-TCTGCGTTACTGCCTTGATGAT-3′
p-R:5′-TAATCAATATTGCGCGTCATCC-3′
2)扩增体系及条件
反向引物鉴定靶基因替换大肠杆菌野生菌ppk基因时的PCR扩增反应,采用25ul反应体系,具体反应体系和条件见表3。
表3 PCR反应体系
PCR扩增条件:95℃预变性5min;95℃变性30s,49.5℃退火45s,72℃延伸1.5min,反应进行30个循环;72℃再延伸10min;4℃保温至∞。
扩增完成后,1%的琼脂糖凝胶电泳检测PCR产物,胶回收后克隆测序。
测序结果表明,采用正向鉴定引物purn-F/ppx-R,重组菌株E.coli/ppk-Kan+的扩增条带约2000bp,与预期结果相符。采用反向鉴定引物p-F/p-R,野生型菌株扩增条带大小约为1200bp,与预期结果相符,重组菌未扩增出任何条带,经测序验证及BLAST比对后,表明大肠杆菌重组菌E.coli/ppk-Kan+重组成功,外源DNA已整合入大肠杆菌基因组中。
核苷酸或氨基酸序列表
<110> 西安建筑科技大学
<120> 一种提高大肠杆菌电转化阳性重组子获取效率的方法
<160>
<210> 1
<211> 22
<212> 正向引物purn-F
<213>
<220>
<400> 1
CCCAGGAACACGCTATTTATCC
<210> 2
<211> 22
<212> 正向引物ppx-R
<213>
<220>
<400> 2
CATCTACCACACGGGCTATGAC
<210> 3
<211> 22
<212> 反向引物p-F
<213>
<220>
<400>3
TCTGCGTTACTGCCTTGATGAT
<210> 4
<211> 22
<212> 反向引物p-R
<213>
<220>
<400> 4
TAATCAATATTGCGCGTCATCC
<210> 5
<211> 69
<212> SEQ ID No.5
<213>
<220>
<400> 5
ATGGGTCAGGAAAAGCTATACATCGAAAAAGAGCTCAGTTGGTTATCGTTGCGATTGTGTAGGCTGGAG
<210> 6
<211> 71
<212> SEQ ID No.6
<213>
<220>
<400> 6
TTATTCAGGTTGTTCGAGTGATTTGATGTAGTCGTAAATCGCCAACTGCGTAACGGCTGACATGGGAATTAG
<210> 7
<211> 2067
<212> 待敲除目标基因序列
<213>
<220>
<400> 7
ATGGGTCAGGAAAAGCTATACATCGAAAAAGAGCTCAGTTGGTTATCGTTCAATGAACGCGTGCTTCAGGAAGCGGCGGACAAATCTAACCCGCTGATTGAAAGGATGCGTTTCCTGGGGATCTATTCCAATAACCTTGATGAGTTCTATAAAGTCCGCTTCGCTGAACTGAAGCGACGCATCATTATTAGCGAAGAACAAGGCTCCAACTCTCATTCCCGCCATTTACTGGGCAAAATTCAGTCCCGGGTGCTGAAAGCCGATCAGGAATTCGACGGCCTCTACAACGAGTTGTTGCTGGAGATGGCGCGCAACCAGATCTTCCTGATTAATGAACGCCAGCTCTCCGTCAATCAACAAAACTGGCTGCGTCATTATTTTAAGCAGTATCTGCGTCAGCACATTACGCCGATTTTAATCAATCCTGACACTGATTTAGTGCAGTTCCTGAAAGATGATTACACCTATCTGGCGGTGGAAATTATCCGTGGCGATACCATCCGTTACGCGCTGCTGGAGATCCCATCAGATAAAGTGCCGCGCTTTGTGAATTTACCGCCAGAAGCGCCGCGTCGACGCAAGCCGATGATTCTTCTGGATAACATTCTGCGTTACTGCCTTGATGATATTTTCAAAGGCTTCTTTGATTATGACGCGCTGAATGCCTATTCAATGAAGATGACCCGCGATGCCGAATACGATTTAGTGCATGAGATGGAAGCCAGCCTGATGGAGTTGATGTCTTCCAGTCTCAAGCAGCGTTTAACTGCTGAGCCGGTGCGTTTTGTTTATCAGCGCGATATGCCCAATGCGCTGGTTGAAGTGTTACGCGAAAAACTGACTATTTCCCGCTACGACTCCATCGTCCCTGGTGGTCGTTATCATAATTTTAAAGACTTTATTAATTTCCCCAATGTCGGCAAAGCCAATCTGGTGAACAAACCACTGCCGCGTTTACGCCACATTTGGTTTGATAAAGCCCAGTTCCGCAATGGTTTTGATGCTATTCGCGAACGCGATGTGTTGCTCTATTATCCTTATCATACCTTTGAGCATGTACTGGAACTGCTGCGTCAGGCTTCGTTCGACCCGAGCGTACTGGCGATTAAAATTAACATTTACCGCGTGGCGAAAGATTCACGCATCATCGACTCGATGATCCACGCCGCACACAACGGTAAGAAAGTCACCGTGGTGGTTGAGTTACAGGCGCGTTTCGACGAAGAAGCCAACATTCACTGGGCGAAGCGCCTGACCGAAGCAGGCGTGCACGTTATCTTCTCTGCGCCGGGGCTGAAAATTCACGCCAAACTGTTCCTGATTTCACGTAAAGAAAACGGTGAAGTGGTGCGTTACGCACACATCGGGACCGGGAACTTTAACGAAAAAACCGCGCGTCTTTATACTGACTATTCGTTGCTGACCGCCGATGCGCGCATAACCAACGAAGTACGGCGGGTGTTCAACTTTATTGAAAACCCATACCGTCCGGTGACATTTGATTATTTAATGGTGTCGCCGCAAAACTCCCGCCGCCTGTTGTATGAAATGGTGGACCGCGAAATCGCCAACGCGCAGCAAGGGCTGCCCAGCGGTATCACCCTGAAGCTAAATAACCTTGTCGATAAAGGCCTGGTTGATCGTCTGTATGCGGCCTCCAGCTCCGGCGTACCGGTTAATCTGCTGGTTCGCGGCATGTGTTCGCTGATCCCCAATCTGGAAGGCATTAGCGACAACATTCGTGCCATCAGTATTGTTGACCGTTACCTTGAACATGACCGGGTTTATATTTTTGAAAATGGCGGCGATAAAAAGGTCTACCTTTCTTCCGCCGACTGGATGACGCGCAATATTGATTATCGTATTGAAGTGGCGACGCCGCTGCTCGATCCGCGCCTGAAGCAGCGGGTGCTGGACATCATCGACATATTATTCAGCGATACAGTCAAAGCACGTTATATCGATAAAGAACTCAGTAATCGCTACGTTCCCCGCGGCAATCGCCGCAAAGTACGGGCGCAGTTGGCGATTTACGACTACATCAAATCACTCGAACAATCTGAATAA
- 还没有人留言评论。精彩留言会获得点赞!