轮状病毒野毒株的VP7基因的串联中和抗体表位肽及融合蛋白的制作方法
本发明属于生物医药领域,具体来说是G1+G9轮状病毒VP7中和抗体表位肽及融合蛋白。
背景技术:
抗原表位又称抗原决定簇,是指抗原分子表面具有特殊结构和免疫活性的氨基酸基团,具有刺激机体产生抗体或致敏淋巴细胞并能够被其识别的一个免疫活性区。病毒抗原表位是指病毒上能与抗体特异性结合的糖蛋白和核蛋白复合体结构,具有保守的氨基酸序列。将抗原表位基因重组到原核载体上,然后进行原核表达,获得融合蛋白,再根据它与特异性抗体结合的特点,经 Western blot、 ELISA等方法分析表达抗原蛋白的抗原性是构建重组表位疫苗的常用思路。
轮状病毒(Rotavirus,RV)是引起5岁以下婴幼儿严重腹泻的重要病原体之一。轮状病毒属于呼肠孤病毒属,是一种无包膜的二十面体形状病毒。基因组不连续,由11个节段(Segment)的双链RNA组成,编码6种结构蛋白(VP1-4, 6, 7)和6种非结构蛋白(NSP1-6)。其中VP7基因含有轮状病毒重要的中和抗原表位和主要的交叉中和表位,能够中和不同基因型的轮状病毒,是研究轮状病毒表位疫苗的主要基因。
通过研究轮状病毒野毒株的VP7基因的串联中和抗体表位肽及融合蛋白,为轮状病毒基因工程疫苗的研究提供前期研究基础。
技术实现要素:
本发明的目的在于找到轮状病毒野毒株的VP7基因的串联中和抗体表位肽及融合蛋白。
本发明是轮状病毒野毒株的VP7基因的串联中和抗体表位肽及融合蛋白,其特征在于,所述抗原表位肽源自G1型和G9型轮状病毒 VP7基因的多个中和抗原表位;
并且所述抗原表位肽的长度为75个氨基酸序列,构建到pThioHisA-NP载体(HBV核心抗原表位载体)的优势表位中,可成功表达出融合蛋白。
所述的抗原表位肽,其特征在于抗原表位肽选自下组:
(1)SEQ ID NO.的氨基酸序列:
RV-X1氨基酸序列
EASNQISDGEWKDGGGGSMKYDQNLELDMGGGGSTTNVDSFETVAENEKGGGGSKINLTTTTGGGGSHKLDVTTN;
RV-X1DNA序列
GGATCCGAGGCGAGCAACCAGATCAGCGACGGTGAATGGAAGGATGGTGGCGGTGGCAGCATGAAATACGACCAAAACCTGGAGCTGGATATGGGTGGCGGTGGCAGCACCACCAACGTGGACAGCTTCGAAACCGTTGCGGAGAACGAAAAGGGTGGCGGTGGCAGCAAAATTAACCTGACCACCACCACCGGTGGCGGTGGCAGCCACAAGCTGGATGTGACCACCAACGAATTC;
(2)将 (1) 中所示氨基酸序列经过优化而形成的,且与载体蛋白融合表达后能够被轮状病毒抗体识别。
融合蛋白,其特征在于,所述融合蛋白是如权利要求 1 所述的抗原表位肽与载体蛋白NP(HBV核心抗原表位载体)融合所形成的。
本研究通过生物信息学方法分析了我们自主分离的人轮状病毒野毒株ZTR-68株(G1)和ZTR-18(G9))的VP7基因的分子序列及结构,选取了G1的aa 88-100,aa 142-152,aa 209-223和aa 235-242四个中和表位及G9的aa 235-242一个中和抗原表位,以连接肽GGGGS相连,通过基因工程手段将串联的抗原表位构建到科室保存的pThioHisA-NP载体的优势表位中。构建的重组表达质粒HBcAg-X1,转化至E.coli BL 21,IPTG 诱导表达,形成VLPs结构,从而将抗原表位高效呈递于VLPs表面,表达出的表位蛋白能够被轮状病毒抗体识别,实验结果为轮状病毒基因工程疫苗的研究提供前期研究基础。
附图说明
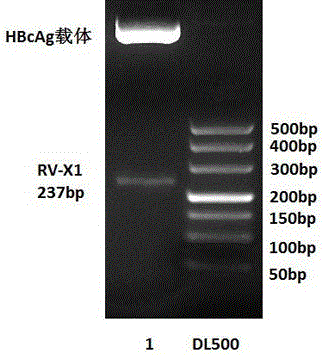
图1 PCR结果,M:DL500 DNA Marker;1:X1片段
图2 BamHI和EcoRI双酶切鉴定结果M:DL500 DNA Marker;1:X1片段;
图3图3 SDS-PAGE检测RV-X1的表达;
图4 Western blot检测RV-X1。
具体实施方式
结合1、2、3、4所示,获得轮状病毒野毒株的VP7基因的串联中和抗体表位肽及融合蛋白的方法如下:
1、质粒、菌及毒种
用于构建的HBcAg质粒由北京协和医学院医学生物学研究所分子免疫室构建,由分子生物室保存。E.coil DH5α和BL21感受态细胞由分子生物室制备和保存,用于质粒转化及外源蛋白的表达。VP7序列来源的G1型轮状病毒ZTR-68株由发明人自主分离并提交保藏于中国微生物菌种保藏管理委员会(保藏号:CGMCC5265),G9型轮状病毒ZTR-18株由由发明人自主分离并提交保藏于中国微生物菌种保藏管理委员会普通微生物中心(CGMCC)提交保藏,编号:11288。
、抗体及主要试剂
Western blot 所用的山羊抗轮状病毒抗体由分子生物室自己制备并保存,HRP-Rabbit anti Goat IgG抗体购自KPL。质粒和胶回收试剂盒购自OMEGA公司,T4DNA 连接酶、限制性内切酶BamHI和EcoRI均购自Thermo公司、DL500购自TaKaRa公司。氯化钠、胰蛋白胨、酵母提取物等购自OXOID公司、氨苄青霉素购自Amresco公司、异丙基-β-D—硫代半乳糖苷(IPTG)购自上海生工生物工程股份有限公司。
G1型轮状病毒(ZTR-68株)和G9型(ZTR-18株)中和表位基因的合成及优化
经过抗原表位预测,选取A组G1型野毒株-68株VP7 蛋白的AA 88~100(EASNQISDGEWKD),AA 142~152 (MKYDQNLELDM),AA209-223( TTNVDSFETVAENEK);AA235-242 (KINLTTTT)序列和G9型野毒株-18株的VP7蛋白的AA235~242(HKLDVTTN),用连接肽GGGGS将上述5个片段连接成一个连续的阅读框,人工合成并优化编码蛋白的DNA序列,并在DNA 序列两端加上BamHI和EcoRI和酶切位点,DNA合成由金斯瑞生物科技有限公司完成,新基因命名为RV-X1。
4、G1型轮状病毒(ZTR-68株)和G9型(ZTR-18株)中和表位基因的构建
根据GenBank中VP7基因序列设计引物,序列如下:RV-VP7-F:5′- AATGGATCCGAGGCGAGCAACCA -3′(下划线部分为BamHI酶切位点);RV-VP7-R:5′-ATAGAATTCGTTGGTGGTCACATCCAG -3′(下划线部分为EcoRI酶切位点),扩增片段大小为237bp。引物由上海捷瑞生物工程有限公司合成。
以合成的质粒为模板进行PCR扩增。PCR反应体系为50ul,含dNTPs 10ul,5×PCR缓冲液 10ul,上游引物 1.3ul,下游引物 1.3ul,DNA聚合酶 2.5ul,模板 2.5ul,其余体积用无菌水补足。PCR反应条件为98℃ 1min,98℃ 10s,72℃ 30s,72℃ 15s,72℃ 10min。 PCR产物进行2.0%琼脂糖凝胶电泳分析。胶回收大小为237bp的片段如图1。
G1型轮状病毒(ZTR-68株)和G9型(ZTR-18株)中和表位基因的鉴定
将X1基因片段和用于作为连接载体的HBcAg质粒用相同的内切酶BamHI和EcoRI进行双酶切,分别将酶切后的X1目的片段和HBcAg载体进行胶回收。切出相同得到黏性末端后,用T4连接酶将X1和HBcAg按10:1的浓度,22℃连接10min。将连接产物全部转化DH5α感受态,于37℃培养14h,用含有氨苄青霉素的LB琼脂板进行筛选含有HBcAg-X1的阳性克隆,抽提质粒后得到表达载体HBcAg-X1,用BamHI和EcoRI做酶切鉴定并测序验证。用BamHI和EcoRI双酶切HBcAg-X1,通过质量分数为2.0%的琼脂糖凝胶电泳后显示,该质粒被双酶切切成2条带,目的基因片段大小为237bp,酶切结果表明X1基因片段已经成功插入到HBcAg载体中。
G1型轮状病毒(ZTR-68株)和G9型(ZTR-18株)中和表位蛋白的表达及鉴定
分别挑取HBcAg-X1和HBcAg空载体表达菌的新鲜单菌落接种于5 ml 含氨苄青霉素(终浓度50μg/L) LB 液体培养基中,200 r/min,37℃振荡培养,当细菌浓度生长至吸光度A600为0.6~0.8 时,加入终浓度1.0 mmol/L IPTG 诱导,同时设未诱导对照,继续在37℃培养3 h,离心收集菌体。用PBS重悬菌体,经10%SDS-PAGE分析。轮状病毒嵌合型重组表位蛋白在大肠杆菌中获得了成功表达,如图3所示,经过western blot检测,表达的蛋白能够被轮状病毒抗体识别如图4所示。
轮状病毒(Rotavirus,RV)是引起5岁以下婴幼儿严重腹泻的重要病原体之一。流行病学调查结果表明,在轮状病毒流行季节不是所有型别都能暴发流行,人类最为易感的RV基因型主要有:G1P[8],G2P[4],G3P[8],G4P[8]和G9P[8],而在中国,轮状病毒的流行情况和世界范围内的流行情况大致相似,主要流行的基因型是G1P[8]和G3P[8],而其他基因型如G2,和G4也占有相当大的比例。除了以上提到的几种基因型,G9和G12两种基因型的轮状病毒在最近几年的流行趋势也开始呈增长态势。而至于P基因型,只有P[8]和P[4]两种P基因型呈现出较大的流行趋势。
根据已经上市疫苗的治疗情况说明,无论单价还是多价疫苗,都是轮状病毒疫苗研发的重要策略,对抗轮状病毒引起的腹泻病症时都表现出卓越的有效性和安全性,这也使得轮状病毒疫苗的研发策略备受争议。争论的焦点主要在于,是仅有制成疫苗的轮状病毒株能产生交叉保护效果,还是除了疫苗株之外的其他轮状病毒株也普遍都能产生交叉保护效果如果产生交叉保护效果是轮状病毒的普遍特性,有没有必要研发多价轮状病毒疫苗无论研制何种形式的疫苗,研究疾病的流行病学动态和病原体特征都是非常重要的。前期流行病学研究表明,在不同地区和不同时间造成RV流行病毒株基因型是不同的,例如最初流行主要毒株型为G1型,随后出现G3和G2等病毒株的流行,最近在中国多个地区的流行病学资料提示,G9型已经逐渐成为主要流行型。虽然有关RV病毒的研究表明,不同型之间有交叉识别和一定水平的交叉保护作用,但不同型的交叉保护能力存在显著性差异。
通过文献查询和结构预测可知,轮状病毒的交叉中和表位基因位于病毒的VP7基因中,主要有四个突变区域:aa 88-100, aa 142-152, aa 209-223, aa 235-242。其中aa 235-242是在G9型轮状病毒中新发现的一个交叉中和表位,结合前期实验室的研究基础,该表位可能是导致G1型轮状病毒免疫后获得血清抗体中和G9型轮状病毒效果差的原因。因此,从中和抗体识别角度分析,研究G1+G9型表位轮状病毒疫苗具有重要的意义。研究可以为未来轮状病毒多价疫苗的发展提供实验基础。
EASNQISDGEWKDGGGGSMKYDQNLELDMGGGGSTTNVDSFETVAENEKGGGGSKINLTTTTGGGGSHKLDVTTN;
GGATCCGAGGCGAGCAACCAGATCAGCGACGGTGAATGGAAGGATGGTGGCGGTGGCAGCATGAAATACGACCAAAACCTGGAGCTGGATATGGGTGGCGGTGGCAGCACCACCAACGTGGACAGCTTCGAAACCGTTGCGGAGAACGAAAAGGGTGGCGGTGGCAGCAAAATTAACCTGACCACCACCACCGGTGGCGGTGGCAGCCACAAGCTGGATGTGACCACCAACGAATTC;
- 还没有人留言评论。精彩留言会获得点赞!