一种金属有机框架材料的制备方法及其应用与流程
本发明属于无机和材料化学科学领域,特别涉及一种金属有机框架材料的制备方法及其应用。
背景技术:
在过去的几十年里,燃料燃烧所释放的二氧化碳(CO2)已经成为造成温室效应的主要气体,引起了严重的环境问题。
CO2捕获和封存技术是减少对大气碳排放的一种非常重要的技术,引起世界上许多科学家的关注。然而,由于被工业上广泛使用的胺吸收法具有胺毒性大、腐蚀性强和易挥发等缺点,研发更有效地封装CO2的材料已经成为研究热点,例如沸石材料、多孔有机化合物和金属有机框架材料(Metal-Organic Frameworks,MOFs)。金属有机框架材料具有结构规整、孔有序、孔结构可以通过有机配体修饰进行调控和功能化的特点,是一种极具潜力的CO2吸附材料。化学家通过产生裸露的金属中心以及引入极性基团(如胺基、羟基、卤素等)等方法来提高金属有机框架材料对CO2的吸附量和吸附选择性。这些金属有机框架材料大部分是使用单纯羧酸配体来构筑的,通常会出现结构不稳定的情况,因而限制了它们的应用。就与过渡金属离子形成配位键的强度而言,四氮唑配体比羧酸配体更具优势,所形成的金属有机框架材料更加稳定,也更能满足实际的应用条件。
在我国的能源结构中,过于依赖煤炭、天然气等化石燃料,捕获分离CO2对于碳减排具有重要的意义。本专利使用含有氮唑和羧酸双功能配位基团的配体,开发了一种稳定性好并且能有效地选择吸附CO2的金属有机框架材料。
技术实现要素:
发明目的:本发明针对上述现有技术存在的问题做出改进,即本发明的第一个目的在于公开了一种金属有机框架材料的制备方法。本发明的第二个目的在于公开了一种金属有机框架材料的应用。
技术方案:一种金属有机框架材料的制备方法,包括以下步骤:
1)将0.029质量份的六水合硝酸钴和0.01~0.02质量份的5-(4-(5-四唑基)苯基)间苯二甲酸加入N,N-二甲基甲酰胺和水的混合溶剂中搅拌均匀后得到混合液,其中:
混合溶剂包括3.5~4.5质量份的N,N-二甲基甲酰胺和2.5~3.5质量份的水;
2)将步骤1)得到的混合液置于密闭的高压反应釜中,加热到100~110℃并保温60~80小时,然后以每分钟0.1~0.2℃的速度冷却到室温得到反应产物;
3)过滤步骤2)得到的反应产物,得到红色块状晶体;
4)将步骤3)得到的红色块状晶体用甲醇交换60~80小时,然后在220℃下真空加热5~7小时,即得到金属有机框架材料。
进一步地,步骤3)得到的红色块状晶体的化学式为{[Co2(tzpa)(OH)(H2O)2]·DMF}n,式中:
tzpa为5-(4-(5-四唑基)苯基)间苯二甲酸的负三价阴离子配体,其结构式为:
DMF为N,N-二甲基甲酰胺。
进一步地,步骤4)得到的金属有机框架材料的化学式为[Co2(tzpa)(OH)]n,式中:
tzpa为5-(4-(5-四唑基)苯基)间苯二甲酸的负三价阴离子配体,其结构式为:
更进一步地,步骤4)中的金属有机框架材料的兰格缪尔比表面积为532m2/g。
一种上述金属有机框架材料的应用,用于CO和CO2混合气体中对CO2的选择性吸附分离。
有益效果:本发明公开的一种金属有机框架材料的制备方法及其应用具有以下有益效果:
1、制备工艺简单;
2、可操作性强;
3、反应条件温和;
4、安全系数高;
5、原料便宜,生成成本低;
6、使用了5-(4-(5-四唑基)苯基)间苯二甲酸配体,增强了金属有机框架材料的稳定性;
7、直接加热除去材料中Co2+离子上的配位水分子后,形成裸露的金属中心,并且与未参与配位的羧基氧原子和氢氧根成为有效的CO2结合位点,从而提高了材料在298~313K温度下对CO2较高的吸附量以及CO2/CO吸附选择性。
附图说明
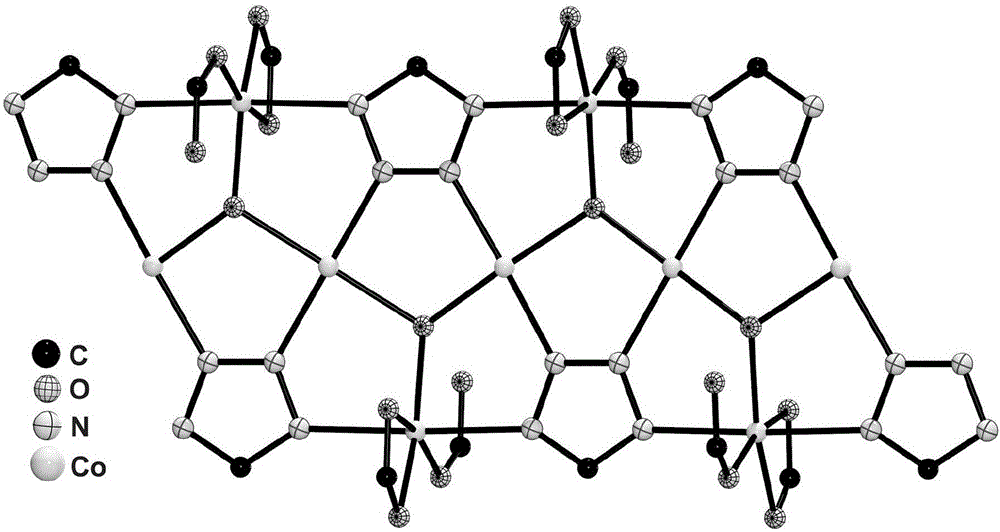
图1为红色块状晶体中的Co2+离子的配位环境图;用于生成对称原子的对称代码:
#1-x,-y,1-z;
#2-0.5+x,0.5-y,-0.5+z;
#3-0.5+x,-0.5-y,-0.5+z;
#4x,-y,-0.5+z;
#5-x,y,0.5-z;
图2为红色块状晶体沿c轴方向的一维金属-氢氧根-四氮唑带状构筑单元的结构示意图;
图3为红色块状晶体沿c轴方向的三维堆积示意图;
图4为金属有机框架材料的初始合成样品和活化后样品的热失重曲线图;
图5为金属有机框架材料的初始合成样品以及活化后样品的粉末X-射线衍射图;
图6为金属有机框架材料在不同低温温度下的CO2、H2和CO吸附等温线示意图;
图7为金属有机框架材料在298K和313K的CO2和CO吸附等温线示意图;
图8为金属有机框架材料对CO2-CO混合气体在298K下的CO2/CO选择性曲线示意图;
图9为金属有机框架材料对CO2-CO混合气体在313K下的CO2/CO选择性曲线。
具体实施方式:
下面对本发明的具体实施方式详细说明。
具体实施例1
一种金属有机框架材料的制备方法,包括以下步骤:
1)将0.029质量份的六水合硝酸钴和0.0155质量份的5-(4-(5-四唑基)苯基)间苯二甲酸加入N,N-二甲基甲酰胺和水的混合溶剂中搅拌均匀后得到混合液,其中:
混合溶剂包括3.78质量份的N,N-二甲基甲酰胺和3质量份的水;
2)将步骤1)得到的混合液置于密闭的高压反应釜中,加热到105℃并保温72小时,然后以每分钟0.1℃的速度冷却到室温得到反应产物;
3)过滤步骤2)得到的反应产物,得到红色块状晶体(即金属有机框架的初始合成样品),
4)将步骤3)得到的红色块状晶体用甲醇交换60小时,然后在220℃下真空加热6小时,即得到金属有机框架材料(即活化后的合成样品)。
进一步地,步骤3)得到的红色块状晶体的化学式为{[Co2(tzpa)(OH)(H2O)2]·DMF}n,式中:
tzpa为5-(4-(5-四唑基)苯基)间苯二甲酸的负三价阴离子配体,其结构式为:
DMF为N,N-二甲基甲酰胺。
进一步地,步骤4)得到的金属有机框架材料的化学式为[Co2(tzpa)(OH)]n,式中:
tzpa为5-(4-(5-四唑基)苯基)间苯二甲酸的负三价阴离子配体,其结构式为:
此外步骤4)得到的金属有机框架材料中含有由三个Co2+离子组成的三角形三核簇[Co3(μ3-OH)(N4C)3],并且相邻的三角形三核簇通过边共享延伸成一维金属-氢氧根-四氮唑带状构筑单元,然后所形成的带状构筑单元通过tzpa的配位延伸,形成一个三维框架。
更进一步地,步骤4)中的金属有机框架材料的兰格缪尔比表面积为532m2/g。
一种上述金属有机框架材料的应用,用于CO和CO2混合气体中对CO2的选择性吸附分离。
结构描述:
对步骤3)得到的红色块状晶体进行结构表征和解析,确定其晶胞和空间结构,该晶体属单斜晶系C2/c空间群,其不对称单元含有三个Co2+离子、一个tzpa配体、一个氢氧根和两个配位水。
如图1所示,三个Co2+离子都采用六配位八面体配位构型:Co1原子具有N2O4配位环境,其中两个氮原子分别来自于两个tzpa配体的四氮唑基团、四个氧原子分别来自于两个羧基和一个氢氧根;与Co1相似,Co2和Co3原子也具有N2O4配位环境,其中两个氮原子也分别来自于两个tzpa配体的四氮唑基团、然而不同的是四个氧原子分别来自于一个羧基和两个配位水分子。Co1、Co2和Co3原子通过一个氢氧根和三个四氮唑环连接形成三核簇[Co3(μ3-OH)(ttaz)3]。在三核簇中,一个氢氧根连接三个Co2+离子形成等腰三角形(两个Co2+离子之间的距离分别为3.52,3.52和),如图1所示。沿c轴,相邻的三核簇通过边共享,相互连接形成少见报道的一维金属-氢氧根-四氮唑带状构筑单元,如图2所示。相邻的带通过tzpa配体连接形成三维框架结构。有趣的是,该三维框架沿c轴方向存在着尺寸约为的一维矩形孔道,孔隙率为37.3%,如图3所示。很重要的一点是,所形成孔道的表面由未参与配位的羧基氧原子、裸露的金属中心以及氢氧根所占据,它们都能对CO2分子产生较强的吸附作用力,从而提高框架材料对CO2分子的吸附选择性。
吸附测试
如图4所示,通过比金属较框架材料活化前后(初始合成样品是步骤3)得到的红色晶体,活化后的合成样品指的是步骤4)得出的样品)的热重曲线,可以发现活化后的材料不含有配位水以及溶剂分子DMF,并且能够稳定到大约210℃。同时金属有机框架材料暴露在空气、水以及大部分常见的有机溶剂中都比较稳定。
如图5所示的粉末X-射线衍射图表明活化后的框架材料发生了轻微无定形,但其主体框架结构并未发生变化,孔道仍然存在。
该金属有机框架材料的孔性通过气体吸附实验进行了验证。气体吸附数据是通过美国麦克公司ASAP 2020M比表面积测定仪收集。如附图6所示,在低温下,金属有机框架材料对N2(77K)、CO2(195K)和CO(195K)均表现出可逆的I型吸附等温线,属于典型的微孔吸附,对应的100kPa压力下的吸附量分别为43.7cm3(STP)g-1、45.3cm3(STP)g-1和154.0cm3(STP)g-1,证实了活化后框架材料的孔道仍然存在。对195K温度下的CO2吸附等温曲线进行拟合,得到兰格缪尔比表面积为532m2g-1。与低温下不同的是,在室温298K下,金属有机框架材料对CO的吸附量很小,在100kPa压力下的吸附量为7.8cm3(STP)g-1,然而对CO2的吸附量达到63.8cm3(STP)g-1,如附图7所示。
另外,在313K温度和100kPa压力下,金属有机框架材料对CO2的吸附量为55.8cm3(STP)g-1,而对CO的吸附量只有5.43cm3(STP)g-1。由此可以发现,金属有机框架材料具有较高的CO2/CO的选择性。通过理想吸附溶液理论计算,在298K和313K温度下,对于CO2体积含量分别为50%和10%的CO2-CO混合气体,在0.1~100kPa压力范围内,金属有机框架材料的CO2/CO吸附比例分别介于31.8~74.6和16.9~39.8之间,如附图8和9所示。金属有机框架材料之所以对CO2有较好的吸附选择性能主要是由于其孔表面含有裸露的金属中心、未参与配位的羧基氧原子以及氢氧根等,它们作为吸附位点对CO2分子产生强的作用力。另外,框架材料具有大小合适的孔尺寸,由于CO2的动力学直径比CO的动力学直径小因此CO2分子更容易被吸附进入框架材料孔道中。较高的吸附选择性使得该框架材料能够应用于工业废气中CO和CO2的分离捕获。
具体实施例2
一种金属有机框架材料的制备方法,包括以下步骤:
1)将0.029质量份的六水合硝酸钴和0.01质量份的5-(4-(5-四唑基)苯基)间苯二甲酸加入N,N-二甲基甲酰胺和水的混合溶剂中搅拌均匀后得到混合液,其中:
混合溶剂包括3.5质量份的N,N-二甲基甲酰胺和2.5质量份的水;
2)将步骤1)得到的混合液置于密闭的高压反应釜中,加热到100℃并保温80小时,然后以每分钟0.15℃的速度冷却到室温得到反应产物;
3)过滤步骤2)得到的反应产物,得到红色块状晶体,
4)将步骤3)得到的红色块状晶体,用甲醇交换,70小时,然后在220℃下真空加热5小时,即得到金属有机框架材料。
进一步地,步骤3)得到的红色块状晶体的化学式为{[Co2(tzpa)(OH)(H2O)2]·DMF}n,式中:
tzpa为5-(4-(5-四唑基)苯基)间苯二甲酸的负三价阴离子配体,其结构式为:
DMF为N,N-二甲基甲酰胺。
进一步地,步骤4)得到的金属有机框架材料的化学式为[Co2(tzpa)(OH)]n,式中:
tzpa为5-(4-(5-四唑基)苯基)间苯二甲酸的负三价阴离子配体,其结构式为:
更进一步地,步骤4)中的金属有机框架材料的兰格缪尔比表面积为532m2/g。
一种上述金属有机框架材料的应用,用于CO和CO2混合气体中对CO2的选择性吸附分离。
具体实施例3
一种金属有机框架材料的制备方法,包括以下步骤:
1)将0.029质量份的六水合硝酸钴和0.02质量份的5-(4-(5-四唑基)苯基)间苯二甲酸加入N,N-二甲基甲酰胺和水的混合溶剂中搅拌均匀后得到混合液,其中:
混合溶剂包括4.5质量份的N,N-二甲基甲酰胺和3.5质量份的水;
2)将步骤1)得到的混合液置于密闭的高压反应釜中,加热到110℃并保温65小时,然后以每分钟0.2℃的速度冷却到室温得到反应产物;
3)过滤步骤2)得到的反应产物,得到红色块状晶体,
4)将步骤3)得到的红色块状晶体用甲醇交换80小时,然后在220℃下真空加热7小时,即得到金属有机框架材料。
进一步地,步骤3)得到的红色块状晶体的化学式为{[Co2(tzpa)(OH)(H2O)2]·DMF}n,式中:
tzpa为5-(4-(5-四唑基)苯基)间苯二甲酸的负三价阴离子配体,其结构式为:
DMF为N,N-二甲基甲酰胺。
进一步地,步骤4)得到的金属有机框架材料的化学式为[Co2(tzpa)(OH)]n,式中:
tzpa为5-(4-(5-四唑基)苯基)间苯二甲酸的负三价阴离子配体,其结构式为:
更进一步地,步骤4)中的金属有机框架材料的兰格缪尔比表面积为532m2/g。
一种上述金属有机框架材料的应用,用于CO和CO2混合气体中对CO2的选择性吸附分离。
上面对本发明的实施方式做了详细说明。但是本发明并不限于上述实施方式,在所属技术领域普通技术人员所具备的知识范围内,还可以在不脱离本发明宗旨的前提下做出各种变化。
- 还没有人留言评论。精彩留言会获得点赞!