一种利用流式细胞术快速分选高山被孢霉原生质体融合子的方法与流程
技术领域:
:本发明涉及的是微生物筛选方法,特别是一种利用流式细胞术快速分选高山被孢霉原生质体融合子的方法。
背景技术:
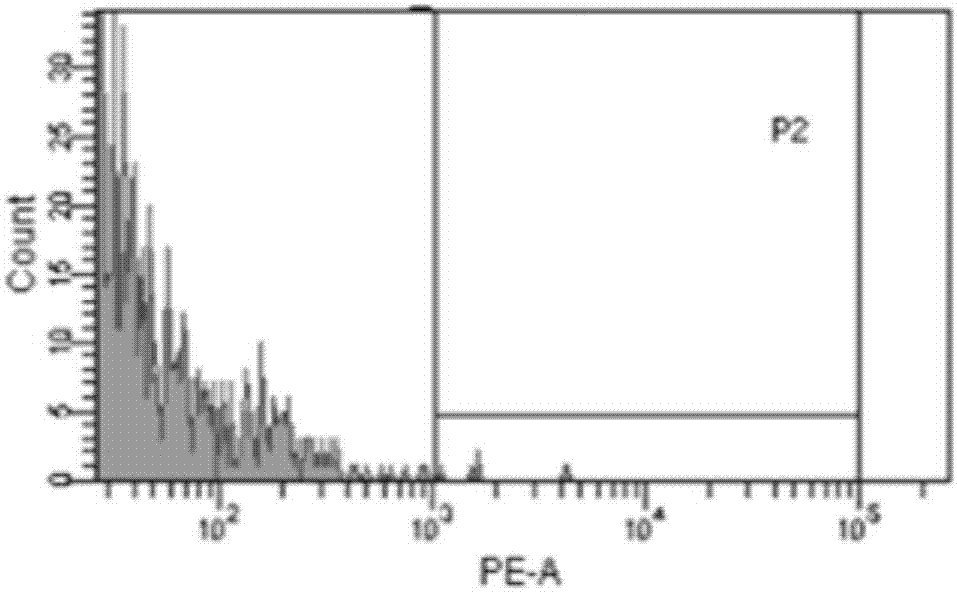
::花生四烯酸是一种ω-6多不饱和脂肪酸,英文缩写为ara(arachidonicacid),又名aa。其在人体内发挥多重作用,是多种循环二十烷酸衍生物的前体,如前列腺素、前列腺环素、血栓烷素和白细胞三烯等,其又具有酯化胆固醇、抑制血小板聚集、降低血液黏度、调节白细胞功能、提高免疫力和促进婴幼儿大脑发育等功能。作为一种高效新型的营养强化剂,aa应用广泛,需求逐年增加,国内外花生四烯酸产业继续呈现规模化扩大的趋势。工业上主要通过微生物发酵来获取aa,高山被孢霉菌种因其油脂含量丰富、aa含量高和油脂组成合理而被普遍应用于aa的发酵生产。发酵过程中,菌种选育是提高花生四烯酸产量的首要关键因素之一。传统的物理化学诱变、自然杂交等育种技术存在工作量大,突变方向不定等弊端,近些年利用原生质体融合技术选育微生物菌种逐渐成为研究热点。相比其他育种技术,原生质体融合技术具有独特的优点:突破了种间、属间以及科间的不亲和障碍,实现了远源杂交。尽管遗传信息量大,但并不需要了解双亲详细的遗传背景,操作简单,可定向选育具备双亲优良性状的融合子。融合子的筛选是原生质体融合技术中的一个关键步骤,目前应用较多的利用营养缺陷或者抗性标记筛选融合子方法对菌株自身特性有一定要求,而且工作量较大,还易影响菌株本身的正常代谢及生理特性。本研究采用了流式细胞术筛选真菌原生质体融合子,分别采用不同荧光染料细胞膜红色荧光探针dil和细胞膜绿色荧光探针dio标记双亲原生质体,融合后利用流式细胞仪分选带两种荧光信号的融合子,检测速度快、分选纯度高,为融合子的筛选提供了一种有效手段。技术实现要素:本发明的目的是以高山被孢霉为研究对象,提出一种利用流式细胞术快速分选原生质体融合子的方法。利用流式细胞术分选高山被孢霉或其他菌体原生质体融合子,为融合子的筛选提供了一种有效手段。本发明的目的通过如下的技术方案来实现:(1)高山被孢霉两亲本a、b菌株原生质体的制备分别将pda斜面上生长5-7天的不同性状的高山被孢霉两亲本菌丝刮下,用无菌水洗涤离心2次,再以浓度0.5-1.0mol/lnacl溶液洗涤1次并离心,取1mg离心获得的湿菌体加入5ml混合酶解液,轻摇使离心后的菌丝体和酶解液充分混合,再置于28-32℃、转速70-150r/min的恒温摇床中,酶解4h,酶解液用四层高级擦镜纸过滤除去菌丝体碎片,于4℃,5000r/min离心10min,沉淀用0.5-1.0mol/lnacl溶液洗涤2次后离心获得原生质体。所述混合酶解液中各酶的浓度分别为蜗牛酶10-20mg/ml、纤维素酶5-10mg/ml、溶菌酶0.2-0.8mg/ml、几丁质酶0.2-0.5mg/ml。最佳混合酶解液为蜗牛酶15mg/ml、纤维素酶6mg/ml、溶菌酶0.5mg/ml、几丁质酶0.2mg/ml。(2)分别使用不同颜色荧光染料对两亲本菌株原生质体进行荧光染色及融合处理将得到的两亲本原生质体分别悬浮于5mlpbs中,并分别加入lμl的dil(细胞膜红色荧光探针)和lμldio(细胞膜绿色荧光探针)荧光染色剂,35-40℃避光温育20-60min。离心去除染色剂,并用pbs缓冲液洗涤2次后悬浮。取等量荧光染色的两亲本原生质体悬液在离心管内混合进行融合,于4℃,5000r/min离心10min,弃上清留沉淀,向沉淀中加入5ml35%peg6000,轻轻摇匀,于30℃静置60min,离心后沉淀用0.5-1.0mol/lnacl洗涤2次并悬浮,获得融合悬浮液;所述避光温育时,最佳温度37℃,最佳时间30min。(3)利用流式细胞仪分选融合子选择已染色融合子悬浮液的1个细胞群,调节确定合适的放大电压,以另外的未染色的融合原生质体作为对照,选定红色荧光信号强的区域p2,再选定同时绿色荧光信号也强的区域p3,分选出同时带两种荧光信号的融合子,即为融合成功的融合子,并将其收集于装有3ml1mol/l山梨醇溶液的收集管中。(4)融合子再生将融合成功的融合子涂布再生平板进行两级再生,培养条件为28℃倒置培养2-5d,培养基为再生培养基,待长出菌丝后转接到pda固体培养基茄瓶中进行再培养,待孢子大量萌发,刮取孢子制备孢子悬液,然后取5-10%孢子悬液接种于pda液体培养基的三角瓶中,在25-30℃,湿度30-60%、摇床转速为180-250rmp的条件下培养2-4d,再将种子液按5-10%的接种量接入含有pda液体培养基的三角瓶中,同样条件培养8-14d,检测aa产量。本发明所用的培养基及缓冲液:1.pda固体培养基:马铃薯20%,葡萄糖2%,琼脂2%,kh2po40.05%,mgso40.025%,ph自然;2.pda液体培养基:马铃薯20%,葡萄糖2%,kh2po40.05%,mgso40.025%,ph自然;3.再生培养基:以1mol/l山梨醇配制的pda培养基;4.pbs:nah2po4·h2o2.14g、na2hpo42.26g溶于100ml水中,ph6.5,取上述配制好液体10ml,加入4.68gnacl后加水定容到100ml即得到pbs;5.荧光染色剂配制:分别取1mgdio和dil加入10mldmso获得。本发明的优点是:1.利用流式细胞术分选原生质体融合子,检测速度快、分选纯度高,大大减少了融合子筛选的工作量。2.目前,尚未发现该方法应用于高山被孢霉原生质体融合子的筛选,为融合子筛选提供了一种新的有效手段。3、经过本发明筛选的原生质体融合子再生后,明显地提高了高山被孢霉aa产量。附图说明:图1为流式细胞分选图谱,p1为分选范围细胞区域图2为流式细胞分选图谱,p2为红色荧光信号强的原生质体图3为流式细胞分选图谱,p3为p2中绿色荧光信号强的原生质体图4为流式细胞分选出融合子的再生情况,其中a为融合子再生3天形态,其中b为融合子再生5天形态具体实施方式:本发明所用菌株均由高山被孢霉mortierellaalpinacfcc88447(购于中国林业微生物菌种保藏管理中心)紫外诱变后分离纯化获得,菌种以甘油管保存于-80℃冰箱内,每6个月转存一次。实施例1(1)两亲本菌株a和b的原生质体的制备将pda斜面上生长5-7天的菌丝刮下,用无菌水洗涤离心2次,再以浓度0.5-1.0mol/lnacl溶液洗涤1次并离心,取1mg离心获得的湿菌体加入5ml混合酶解液,轻摇使离心后的菌丝体和酶解液充分混合,再置于28-32℃,转速70-150r/min的恒温摇床中,酶解4h,酶解液用四层高级擦镜纸过滤除去菌丝体碎片,于4℃,5000r/min离心10min,沉淀用0.5-1.0mol/lnacl溶液洗涤2次后离心获得原生质体;(2)两亲本菌株原生质体荧光染色后融合处理将得到的两亲本原生质体分别悬浮于5mlpbs中,并分别加入lμl的dil(细胞膜红色荧光探针)和lμldio(细胞膜绿色荧光探针)荧光染色剂,40℃避光温育20min,离心去除染色剂,并用pbs缓冲液洗涤2次后悬浮。取等量荧光染色的两亲本原生质体悬液在离心管内混合,于4℃,5000r/min离心10min,弃上清留沉淀,向沉淀中加入5ml35%peg6000,轻轻摇匀,于30℃静置60min,离心后沉淀用0.5-1.0mol/lnacl洗涤2次并悬浮,获得悬浮液。(3)流式细胞分选融合子建立并选定流式细胞分选融合子方案。选择1个细胞群,调节确定合适的放大电压。以未染色的融合原生质体作为对照,选定红色荧光信号强的区域p2,再选定同时绿色荧光信号也强的区域p3,即融合子。进样分选出同时带两种荧光信号的融合子,收集于装有3ml1mol/l山梨醇溶液的收集管中,筛选到融合子占分选细胞总数的5%。实施例2(1)两亲本菌株原生质体的制备将pda斜面上生长5-7天的菌丝刮下,用无菌水洗涤离心2次,再以浓度0.5-1.0mol/lnacl溶液洗涤1次并离心,取1mg离心获得的湿菌体加入5ml混合酶解液,轻摇使离心后的菌丝体和酶解液充分混合,再置于28-32℃,转速70-150r/min的恒温摇床中,酶解4h,酶解液用四层高级擦镜纸过滤除去菌丝体碎片,于4℃,5000r/min离心10min,沉淀用0.5-1.0mol/lnacl溶液洗涤2次后离心获得原生质体;(2)两亲本菌株原生质体的荧光染色后融合处理将得到的两亲本原生质体分别悬浮于5mlpbs中,并分别加入lμl的dil(细胞膜红色荧光探针)和lμldio(细胞膜绿色荧光探针)荧光染色剂,37℃避光温育30min,离心去除染色剂,并用pbs缓冲液洗涤2次后悬浮。取等量荧光染色的两亲本原生质体悬液在离心管内混合,于4℃,5000r/min离心10min,弃上清留沉淀,向沉淀中加入5ml35%peg6000,轻轻摇匀,于35℃静置60min,离心后沉淀用0.5-1.0mol/lnacl洗涤2次并悬浮,获得悬浮液。(3)流式细胞分选融合子建立并选定流式细胞分选融合子方案。选择1个细胞群,调节确定合适的放大电压。以未染色的融合原生质体作为对照,选定红色荧光信号强的区域p2,再选定同时绿色荧光信号也强的区域p3,即融合子。进样分选出同时带两种荧光信号的融合子,收集于装有3ml1mol/l山梨醇溶液的收集管中,筛选到融合子占分选细胞总数的10%。实施例2的检测结果见表1表1高山被孢霉亲本株a、b及融合成功菌株的产量对比菌株生物量油脂含量aa含量(%)aa产量a33.6735.2545.445.39b29.5844.8539.275.21融合菌株31.5743.2846.256.32实施例3(1)两亲本菌株原生质体的制备将pda斜面上生长5-7天的菌丝刮下,用无菌水洗涤离心2次,再以浓度0.5-1.0mol/lnacl溶液洗涤1次并离心,取1mg离心获得的湿菌体加入5ml混合酶解液,轻摇使离心后的菌丝体和酶解液充分混合,再置于28-32℃、转速70-150r/min的恒温摇床中,酶解4h,酶解液用四层高级擦镜纸过滤除去菌丝体碎片,于4℃,5000r/min离心10min,沉淀用0.5-1.0mol/lnacl溶液洗涤2次后离心获得原生质体;(2)两亲本菌株原生质体的荧光染色后融合处理将得到的两亲本原生质体分别悬浮于5mlpbs中,并分别加入lμl的dil(细胞膜红色荧光探针)和lμldio(细胞膜绿色荧光探针)荧光染色剂,35℃避光温育60min。离心去除染色剂,并用pbs缓冲液洗涤2次后悬浮。取等量荧光染色的两亲本原生质体悬液在离心管内混合,于4℃,5000r/min离心10min,弃上清留沉淀,向沉淀中加入5ml35%peg6000,轻轻摇匀,于30℃静置60min,离心后沉淀用0.5-1.0mol/lnacl洗涤2次并悬浮,获得悬浮液。(3)流式细胞分选融合子建立并选定流式细胞分选融合子方案,选择1个细胞群,调节确定合适的放大电压。以未染色的融合原生质体作为对照,选定红色荧光信号强的区域p2,再选定同时绿色荧光信号也强的区域p3,即融合子。进样分选出同时带两种荧光信号的融合子,收集于装有3ml1mol/l山梨醇溶液的收集管中,筛选到融合子占分选细胞总数的7%。实施例1-3所述的原生质体荧光染色融合后进行流式细胞分选过程,经比较得到最适的荧光染色条件:37℃下避光染色30min。对流式筛选到的融合子涂布再生平板,接种接发酵验证产量,进一步挑选高产菌株。当前第1页12
相关技术
网友询问留言
已有0条留言
- 还没有人留言评论。精彩留言会获得点赞!
1