本发明涉及一株可用于生物催化不对称还原3-氯苯乙酮制备高光学纯度(R)-3-氯苯乙醇的新菌种——骚动厄斯考维菌(Oerskovia turbata)ZJPH1604及其应用。
(二)
背景技术:
(R)-3-氯苯乙醇的化学结构式为:
(R)-3-氯苯乙醇是一种重要的手性中间体,是多种药物分子的构建模块,例如,它可以用于合成治疗脊髓型肌肉萎缩症的活性化合物(R)-5-[1-(3-氯苯基)乙氧基]喹唑啉-2,4-二胺,还可以用于合成治疗抑郁症、糖尿病和肥胖的β3-肾上腺素受体激动剂,包括SR58611,Solabegron,CL316243,AJ-9677等。
采用化学法制备(R)-3-氯苯乙醇,需要使用价格昂贵的如铑、钌等金属催化剂,会对环境造成污染。采用微生物全细胞催化的生物不对称还原方法制备(R)-3-氯苯乙醇具有反应条件温和、立体选择性高、环境友好等优点。
已有文献报道,John Thurmond等(J.Med.Chem.2008,51,449–469)利用手性催化剂((S)-MeCBS和(R)-MeCBS)催化还原3-氯苯乙酮制备(R)-3-氯苯乙醇,Perna等(J.of Mol.Catal.B:Enzym.,2016,124:29–37)利用Lactobacillus reuteri静息细胞催化还原3-氯苯乙酮制备(R)-3-氯苯乙醇,转化率100%,对映体过量值(ee)>99%,当底物浓度>5g/L时,转化率低于70%。
(三)
技术实现要素:
本发明目的是提供一株可用于生物催化不对称还原3-氯苯乙酮制备高光学纯度(R)-3-氯苯乙醇的微生物新菌种——骚动厄斯考维菌(Oerskovia turbata)ZJPH1604,以及该菌种在催化不对称合成制备(R)-3-氯苯乙醇中的应用。
本发明采用的技术方案是:
本发明提供一株新菌株--骚动厄斯考维菌(Oerskovia turbata)ZJPH1604,保藏于中国典型培养物保藏中心,保藏编号:CCTCC NO:M 2016541,保藏日期:2016年9月30日,地址:中国,武汉,武汉大学,邮编:430072。
本发明还提供一种所述骚动厄斯考维菌ZJPH1604在微生物催化不对称还原3-氯苯乙酮制备(R)-3-氯苯乙醇中的应用,具体所述应用为:以3-氯苯乙酮为底物,以骚动厄斯考维菌ZJPH1604经发酵培养获得的湿菌体细胞为酶源,加入辅助底物,于pH为6.0~9.0的缓冲液中,在25~35℃下进行转化反应,反应结束后,反应液经分离纯化得到(R)-3-氯苯乙醇;所述辅助底物为葡萄糖、蔗糖、麦芽糖、异丙醇、甲醇或乙醇中的一种。
进一步,所述底物3-氯苯乙酮的初始浓度为20~200mmol/L缓冲液(优选25-150mmol/L),骚动厄斯考维菌ZJPH1604湿菌体细胞的添加量以湿重计为50~300g/L缓冲液(优选100-300g/L);所述辅助底物为葡萄糖、蔗糖或麦芽糖时,加入量为20~300g/L缓冲液(优选100-300g/L),所述辅助底物为甲醇、乙醇或异丙醇时,加入体积为缓冲液体积的10~30%(优选20%)。
进一步,所述酶源按如下方法制备:1)斜面培养:将骚动厄斯考维菌ZJPH1604接种至斜面培养基中,30℃培养1-2天,获得斜面菌体;所述斜面培养基组成为:葡萄糖10g/L,蛋白胨5g/L,酵母膏4g/L,(NH4)2SO4 2g/L,KH2PO4 1g/L,NaCl 0.5g/L,MgSO4·7H2O 0.5g/L,琼脂20g/L,溶剂为水,pH 6.5;
2)种子培养:从斜面挑一环菌体接入装有100mL种子培养基的250mL摇瓶中,30℃,200r/min培养24小时,获得种子液;所述种子培养基组成为:葡萄糖10-20g/L,蛋白胨5-10g/L,酵母膏4-8g/L,(NH4)2SO4 2-4g/L,KH2PO4 2-4g/L,NaCl 0.5-2g/L,MgSO4·7H2O 0.5-2g/L,溶剂为水,pH 6.5-8.0;优选所述种子培养基组成为:葡萄糖10g/L,蛋白胨5g/L,酵母膏4g/L,(NH4)2SO4 2g/L,KH2PO4 2g/L,NaCl 0.5g/L,MgSO4·7H2O 0.5g/L,溶剂为水,pH 6.5;
3)发酵培养:以体积浓度4-10%(优选8%)的接种量将种子液转接到装有100mL发酵培养基的250mL摇瓶中,30℃,180-220r/min(优选200r/min)培养36-48h(优选48h),将发酵液离心,收集湿菌体;所述发酵培养基终浓度组成如下:葡萄糖20~30g/L,酵母膏10~40g/L,(NH4)2SO4 1.0-6.0g/L,KH2PO4 2.0~6.0g/L,MgSO4·7H2O 0.3~0.6g/L,NaCl 0.2~0.8g/L,溶剂为水,pH 6.0~7.5,优选所述发酵培养基终浓度组成如下:葡萄糖15g/L,酵母膏30g/L,(NH4)2SO4 2.5g/L,KH2PO44g/L,MgSO4·7H2O 0.6g/L,NaCl 0.4g/L,溶剂为水,pH 6.5。
采用Box-Behnken旋转中心组合实验设计法对葡萄糖浓度、酵母膏浓度和KH2PO4浓度三个对产酶影响显著的因素进行优化,得到骚动厄斯考维菌(Oerskovia)ZJPH1604。菌株的优化培养基组成为:葡萄糖20~30g/L,酵母膏10~40g/L,(NH4)2SO4 1.0-6.0g/L,KH2PO42.0~6.0g/L,MgSO4·7H2O 0.3~0.6g/L,NaCl 0.2~0.8g/L,溶剂为水,pH 6.0~7.5。
骚动厄斯考维菌(Oerskovia)ZJPH1604的培养条件为:初始pH 6.0~7.5,摇瓶装液量80~120mL/250mL锥形瓶,培养温度30℃、摇床转速180~220rpm,接种量4~10%,培养时间36~48h。
本发明所述反应液分离纯化方法为:反应结束后,将转化液用等体积乙酸乙酯萃取,经离心后得到上清液,采用手性气相色谱法分析目的产物和残留底物的含量,以及产物的光学纯度。
本发明优选所述辅助底物为异丙醇,此时所得产物的光学纯度和产率最高。
本发明从土样中筛选获得了与以往同类研究报道不同的微生物新菌种,并且催化转化的底物浓度和产率均较高,从而在研究微生物催化法制备手性中间体(R)-3-氯苯乙醇方面提供了有益的参考。
本发明的有益效果主要体现在:本发明提供了一株可用于微生物催化不对称还原3-氯苯乙酮制备(R)-3-氯苯乙醇的微生物新菌种,采用该新菌种催化制备光学纯(R)-3-氯苯乙醇具有底物浓度高,立体选择性好,产物光学纯度高等优点。本发明通过采用骚动厄斯考维菌(Oerskovia turbata)ZJPH1604细胞为催化剂的手性生物催化,当底物浓度为80mmol/L时,目的产物(R)-3-氯苯乙醇的e.e达到99.9%,产率达到98.1%。
(四)附图说明
图1为底物标准品气相色谱图(含内标十二烷);
图2为消旋体产物标准品气相色谱图(含内标十二烷);
图3为骚动厄斯考维菌(Oerskovia turbata)ZJPH1604菌株生物还原反应萃取液气相色谱图(含内标十二烷)。
(五)具体实施方式
下面结合具体实施例对本发明进行进一步描述,但本发明的保护范围并不仅限于此:
本发明实施例所述底物,辅助底物及湿菌体的用量均以缓冲液体积计。
实施例1:菌株的筛选及鉴定
菌种来源:骚动厄斯考维菌(Oerskovia turbata)ZJPH1604菌株系从浙江省东钱湖附近的土样中分离筛选获得,具体筛选方法如下:
将采集的土样1g加入到装有50mL富集培养基的250mL摇瓶中,30℃,200rpm,培养5~6d,待培养液变混浊后,取1mL培养液转接至新鲜的富集培养基中,继续培养5~6d,如此重复富集培养3~4次。富集培养基中以3-氯苯乙酮为唯一碳源。富集培养基配方如下:3-氯苯乙酮25mmol/L,(NH4)2SO4 2g/L,KH2PO4 2g/L,NaCl0.5g/L,MgSO4·7H2O 0.5g/L,溶剂为水,pH 6.5。
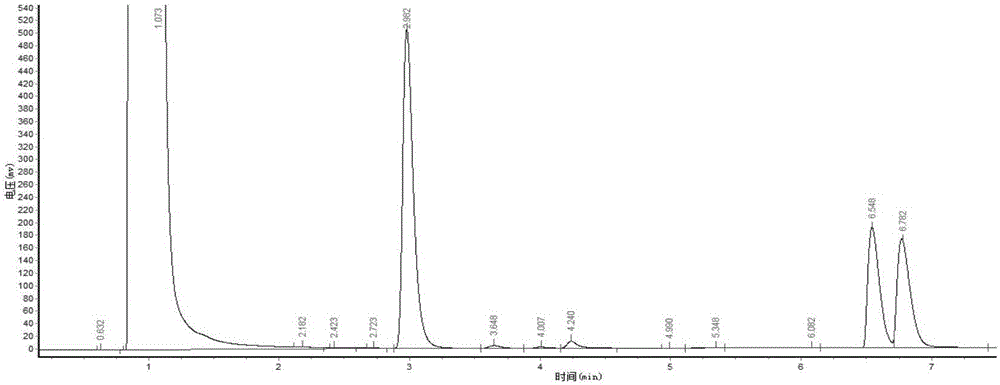
随后富集培养液经梯度稀释,涂布到分离平板上(平板培养基组成为富集培养基中加入15-20g/L的琼脂),经多次分离培养后获得单菌落菌株。挑取单菌落菌株接种到种子培养基,30℃培养24小时,再转接至产酶培养基中30℃培养42小时。以终浓度5mM的3-氯苯乙酮为底物,筛选得到的微生物细胞为催化剂(终浓度100g/L),在pH 6.5磷酸缓冲液10ml中,30℃生物转化24h后。转化结束后,转化液用等体积乙酸乙酯萃取,经离心后得到上清液采用手性气相色谱法检测转化液中目的产物(R)-3-氯苯乙醇的对映体过量值(e.e.值)和产率。用内标法定量,内标物为十二烷。取1mL萃取液加入1μL十二烷进行分析。气相色谱条件:日本岛津GC-2014气相色谱仪,浙大N2000色谱工作站;美国瓦里安CP-Chirasil-Dex手性毛细管气相色谱柱(25m×0.25mm×0.25μm)。载气为高纯氮气,流量为2mL/min;进样量1μL,分流比为15:1;检测器和进样口温度均为250℃;色谱柱温度120~160℃;升温速度:8℃/min;检测器为FID。用以上条件对样品进行检测,底物的保留时间为4.1min,如图1;消旋体产物标准品的保留时间,R型产物为6.5min,S型产物为6.7min,如图2;ZJPH1604菌株转化产物的保留时间为6.5min,如图3。内标物十二烷的保留时间为3.0min。
用相对校正因子分别计算出反应液中的底物和产物的浓度。进而求出反应的产率(Yield)。计算式为:
产率=Ci/C0×100%
式中C0、Ci分别为反应起始底物的摩尔浓度和反应结束时产物的摩尔浓度。
产物的光学纯度由对映体过量值(enantiomeric excess,e.e.)来表示。
e.e.=(CR-CS)/(CR+CS)×100%
式中CR和CS分别为R型和S型3-氯苯乙醇的摩尔浓度。
该新菌种的特征如下:
生理生化特征:革兰氏染色阳性,不生芽孢,不运动,无荚膜,碳水化合物发酵产酸,不产气,氧化酶阳性,接触酶阳性,专性需氧。可以利用的碳源有59种:糊精、D-麦芽糖、海澡糖、纤维二糖、龙胆二糖、蔗糖、水苏糖、棉子糖、乳糖、D-密二糖、D-(-)-水杨苷、N-乙酰-D-氨基葡萄糖、N-乙酰-α-D-甘露糖胺、N-乙酰-D-半乳糖胺、N-乙酰-神经氨(糖)酸、D-半乳糖、甲基双丙酮、D-岩藻糖、L-岩藻糖、甘氨酰基-L-脯氨酸、L-天门冬氨酸、L-谷氨酸、L-焦谷氨酸、L-丝氨酸、L-半乳糖酸内酯、D-葡糖酸、葡萄糖醛酸、葡糖醛酰胺、粘酸、奎尼酸、葡萄糖二酸、p-甲酚-苯乙酸、丙酮酸甲酯、丙醇酸甲酯、左旋乳酸、柠檬酸、α-酮-戊二酸、D-苹果酸、鼠李糖、肌苷、甘露糖醇、阿拉伯糖醇、肌醇、丙三醇、葡萄糖-6-磷酸、D-果糖-6-磷酸、天门冬氨酸、D-丝氨酸、左旋苹果酸、溴代琥珀酸、α-氨基丁酸、α-羟基异丁酸、α-羟基-D,L-丁酸、α-酮丁酸、乙酰乙酸、丙酸、乙酸、甲酸。
菌种的16S rDNA序列特性:以提取到的细胞总DNA为模板,利用通用引物P1和P2扩增菌株的16S rDNA基因,再将PCR产物进行1%的琼脂糖凝胶电泳。经测序确认所述菌株ZJPH1604的16S rDNA基因序列(SEQ ID NO.1)已提交GenBank(GenBank登录号为No.KY302675),将ZJPH1604菌株的16S rRNA序列在NCBI网站(http://www.ncbi.nlm.nih.gov)上进行同源性比对(BLAST),结果表明:ZJPH1604菌株与骚动厄斯考维菌(Oerskovia sp.)的部分菌株序列同源性较高。ZJPH1604菌株与Oerskovia菌株(GenBank登录号为No.HM563054.1)的序列同源性达到99%。
根据生理生化特性并结合分子生物学鉴定,该菌株被鉴定为厄斯考维菌(Oerskovia sp.),命名为骚动厄斯考维菌(Oerskovia sp.)ZJPH1604,保藏于中国典型培养物保藏中心,地址:中国,武汉,武汉大学,邮编:430072;保藏编号:CCTCC NO:M 2016541,保藏日期:2016年9月30日。
实施例2:湿菌体细胞的获得
种子培养基配方:葡萄糖10g/L,蛋白胨5g/L,酵母膏4g/L,(NH4)2SO4 2g/L,KH2PO42g/L,NaCl 0.5g/L,MgSO4·7H2O 0.5g/L,溶剂为水,pH 6.5。
发酵培养基配方:葡萄糖15g/L,酵母膏30g/L,(NH4)2SO4 4g/L,KH2PO4 4g/L,NaCl 0.6g/L,MgSO4·7H2O 0.8g/L,溶剂为磷酸盐缓冲液,pH 6.5。
斜面培养:将骚动厄斯考维菌ZJPH1604接种至斜面培养基中,30℃培养1-2天,获得斜面菌体;所述斜面培养基组成为:葡萄糖10g/L,蛋白胨5g/L,酵母膏4g/L,(NH4)2SO42g/L,KH2PO4 1g/L,NaCl 0.5g/L,MgSO4·7H2O 0.5g/L,琼脂20g/L,溶剂为水,pH 6.5;
从斜面挑一环菌体接入装有100mL种子培养基的250mL摇瓶中,30℃,200rpm培养24小时得种子液,再以体积浓度8%的接种量将种子液转接到装有100mL发酵培养基的250mL摇瓶中,30℃,200rpm培养48小时。培养结束后发酵液离心,沉淀用pH值6.5的磷酸盐缓冲液洗涤一次,收集湿菌体细胞,备用。
实施例3:
将实施例2所得的湿菌体悬浮于10mL磷酸盐缓冲液(pH 6.5)中,湿菌体以湿重计浓度为100g/L缓冲液;加入25mmol/L缓冲液的3-氯苯乙酮作为底物,再加入占缓冲液体积10%的异丙醇作为辅助底物,置于30℃,200r/min的摇床中反应24h。采用实施例1的检测方法,产物(R)-3-氯苯乙醇的浓度为17.8mmol/L,光学纯度ee值99.9%,产率70.9%。
实施例4:
将实施例2所得的湿菌体悬浮于10mL磷酸盐缓冲液(pH 6.5)中,湿菌体以湿重计浓度为100g/L缓冲液;加入25mmol/L缓冲液的3-氯苯乙酮作为底物,再加入占缓冲液体积10%的异丙醇作为辅助底物,置于37℃,200r/min的摇床中反应24h。采用实施例1的检测方法,产物(R)-3-氯苯乙醇的浓度为16.8mmol/L,光学纯度ee值99.9%,产率67.3%。
实施例5
将实施例2所得的湿菌体悬浮于10mL磷酸盐缓冲液(pH 6.5)中,湿菌体以湿重计浓度为200g/L缓冲液;加入25mmol/L缓冲液的3-氯苯乙酮作为底物,再加入占缓冲液体积10%的异丙醇作为辅助底物,置于30℃,200r/min的摇床中反应24h。采用实施例1的检测方法,产物(R)-3-氯苯乙醇的浓度为19.2mmol/L,光学纯度ee值99.9%,产率76.7%。
实施例6:
将实施例2所得的湿菌体悬浮于10mL磷酸盐缓冲液(pH 6.5)中,湿菌体以湿重计浓度为200g/L缓冲液;加入25mmol/L缓冲液的3-氯苯乙酮作为底物,再加入占缓冲液体积10%的异丙醇作为辅助底物,置于37℃,200r/min的摇床中反应24h。采用实施例1的检测方法,产物(R)-3-氯苯乙醇的浓度为20.4mmol/L,光学纯度ee值99.9%,产率88.8%。
实施例7:
将实施例2所得的湿菌体悬浮于10mL磷酸盐缓冲液(pH 7.0)中,湿菌体以湿重计浓度为150g/L缓冲液;加入25mmol/L缓冲液的3-氯苯乙酮作为底物,再加入300g/L的葡萄糖作为辅助底物,置于37℃,200r/min的摇床中反应48h。采用实施例1的检测方法,产物(R)-3-氯苯乙醇的浓度为3.4mmol/L,光学纯度ee值99.9%,产率13.7%。
实施例8:
将实施例2所得的湿菌体悬浮于15mL磷酸盐缓冲液(pH 6.5)中,湿菌体以湿重计浓度为200g/L缓冲液;加入80mmol/L缓冲液的3-氯苯乙酮作为底物,再加入占缓冲液体积20%的异丙醇作为辅助底物,置于37℃,200r/min的摇床中反应48h。采用实施例1的检测方法,产物(R)-3-氯苯乙醇的浓度为78.5mmol/L,光学纯度ee值99.9%,产率98.1%。
实施例9:
将实施例2所得的湿菌体悬浮于10mL磷酸盐缓冲液(pH 7.0)中,湿菌体以湿重计浓度为100g/L缓冲液;加入35mmol/L缓冲液的3-氯苯乙酮作为底物,再加入100g/L缓冲液的葡萄糖作为辅助底物,置于30℃,200r/min的摇床中反应24h。采用实施例1的检测方法,产物(R)-3-氯苯乙醇的浓度为7.7mmol/L,光学纯度ee值99.9%,产率22.2%。
实施例10:
将实施例2所得的湿菌体悬浮于20mL磷酸盐缓冲液(pH 7.0)中,湿菌体以湿重计浓度为200g/L缓冲液;加入35mmol/L缓冲液的3-氯苯乙酮作为底物,再加入2mL(占缓冲液体积10%,v/v)的异丙醇作为辅助底物,置于37℃,200r/min的摇床中反应48h。采用实施例1的检测方法,产物(R)-3-氯苯乙醇的浓度为34.6mmol/L,光学纯度ee值99.9%,产率99%。
实施例11:
将实施例2所得的湿菌体悬浮于10mL磷酸盐缓冲液(pH 8.0)中,湿菌体以湿重计浓度为300g/L缓冲液;加入25mmol/L缓冲液的3-氯苯乙酮作为底物,再加入1mL(占缓冲液体积10%,v/v)的异丙醇作为辅助底物,置于30℃,200r/min的摇床中反应24h。采用实施例1的检测方法,产物(R)-3-氯苯乙醇的浓度为19.9mmol/L,光学纯度ee值99.9%,产率79.7%。
实施例12
将实施例2所得的湿菌体悬浮于10mL磷酸盐缓冲液(pH 8.0)中,湿菌体以湿重计浓度为200g/L缓冲液;加入150mmol/L缓冲液的3-氯苯乙酮作为底物,再加入2mL(占缓冲液体积20%,v/v)的异丙醇作为辅助底物,置于30℃,200r/min的摇床中反应24h。采用实施例1的检测方法,产物(R)-3-氯苯乙醇的浓度为98.1mmol/L,光学纯度ee值99.9%,产率65.4%。
实施例13
将实施例2所得的湿菌体悬浮于10mL磷酸盐缓冲液(pH 8.0)中,湿菌体以湿重计浓度为250g/L缓冲液;加入150mmol/L缓冲液的3-氯苯乙酮作为底物,再加入2mL(占缓冲液体积20%,v/v)的异丙醇作为辅助底物,置于30℃,200r/min的摇床中反应36h。采用实施例1的检测方法,产物(R)-3-氯苯乙醇的浓度为121.8mmol/L,光学纯度ee值99.9%,产率71.2%。
实施例14:
将实施例2所得的湿菌体悬浮于10mL磷酸盐缓冲液(pH 9.0)中,湿菌体以湿重计浓度为100g/L缓冲液;加入25mmol/L缓冲液的3-氯苯乙酮作为底物,再加入2.5mL(占缓冲液体积20%,v/v)的异丙醇作为辅助底物,置于30℃,200r/min的摇床中反应48h。采用实施例1的检测方法,产物(R)-3-氯苯乙醇的浓度为11.2mmol/L,光学纯度ee值99.9%,产率44.1%。
实施例15:
将实施例2所得的湿菌体悬浮于10mL磷酸盐缓冲液(pH 9.0)中,湿菌体以湿重计浓度为100g/L缓冲液;加入35mmol/L缓冲液的3-氯苯乙酮作为底物,再加入2mL(占缓冲液体积20%,v/v)的异丙醇作为辅助底物,置于30℃,200r/min的摇床中反应48h。采用实施例1的检测方法,产物(R)-3-氯苯乙醇的浓度为34.6mmol/L,光学纯度ee值99.9%,产率99.1%。
SEQUENCE LISTING
<110> 浙江医药高等专科学校;浙江工业大学
<120> 一种骚动厄斯考维菌及在制备(R)-3-氯苯乙醇中的应用
<130>
<160> 1
<170> PatentIn version 3.5
<210> 1
<211> 1395
<212> DNA
<213> Oerskovia turbata
<400> 1
gatcactggg gaacgggtga gtaacacgtg agtaacctgc cccagactcc gggataagcc 60
ttggaaacga ggtctaatac tggatatgag atgcccctgc atggggagtg tctggaaaga 120
tttatcggtc tgggatggac tcgcggccta tcagcttgtt ggtggggtaa tggcctacca 180
aggcgacgac gggtagccgg cctgagaggg cgaccggcca cactgggact gagacacggc 240
ccagactcct acgggaggca gcagtgggga atattgcaca atgggcgaaa gcctgatgca 300
gcgacgccgc gtgagggatg aaggccttcg ggttgtaaac ctctttcagc agggaagaag 360
cgcaagtgac ggtacctgca gaagaagcgc cggctaacta cgtgccagca gccgcggtaa 420
tacgtagggc gcaagcgttg tccggaatta ttgggcgtaa agagctcgta ggcggtttgt 480
cgcgtctggt gtgaaaactc aaggctcaac cttgagcttg catcgggtac gggcagacta 540
gagtgcggta ggggtgactg gaattcctgg tgtagcggtg gaatgcgcag atatcaggag 600
gaacaccgat ggcgaaggca ggtctctggg ccgcaactga cgctgaggag cgaaagcatg 660
gggagcgaac aggattagat accctggtag tccatgccgt aaacgttggg cactaggtgt 720
ggggctcatt ccacgagttc cgtgccgcag caaacgcatt aagtgccccg cctggggagt 780
acggccgcaa ggctaaaact caaaggaatt gacgggggcc cgcacaagcg gcggagcatg 840
cggattaatt cgatgcaacg cgaagaacct taccaaggct tgacatacac cggaaacttc 900
cagagatggt tgccccgcaa ggtcggtgta caggtggtgc atggttgtcg tcagctcgtg 960
tcgtgagatg ttgggttaag tcccgcaacg agcgcaaccc tcgtcttatg ttgccagcac 1020
gtcatggtgg ggactcataa gagactgccg gggtcaactc ggaggaaggt ggggatgacg 1080
tcaaatcatc atgcccctta tgtcttgggc ttcacgcatg ctacaatggc cggtacaaag 1140
ggctgcgata ccgtaaggtg gagcgaatcc caaaaagccg gtctcagttc ggattggggt 1200
ctgcaactcg accccatgaa gtcggagtcg ctagtaatcg cagatcagca acgctgcggt 1260
gaatacgttc ccgggccttg tacacaccgc ccgtcaagtc acgaaagtcg gtaacacccg 1320
aagccggtgg cccaacccct tgtgggaggg agccgtcgaa agtgggactg gcgattggga 1380
ctaagtcgta acaag 1395