用作细胞外基质的合成的肽水凝胶制剂的制作方法
相关申请的交叉引用
本申请要求于2015年2月25日提交的名称为“syntheticpeptidehydrogelformulationsforuseasextracellularmatrix”的美国临时专利申请序列号62/120,783的优先权益,以整体引用的方式将其全部的公开内容并入本文用于所有目的。
一个或多个方面涉及可用于各种医学、研究和工业应用中的自组装肽水凝胶。更具体而言,涉及可用于细胞培养实验的经配制的水凝胶。
背景技术:
细胞培养实验通常涉及在受控的条件下于孔板的孔中的基质上使细胞生长。基质(substrate或matrix)通常提供支撑并促进细胞附着和生长。定期更换培养基以提供新鲜的养分。三维(3d)细胞培养是新兴的能够增加细胞增殖、细胞分化和细胞功能的平台技术。
技术实现要素:
根据一个或多个方面,细胞培养试剂盒包括合成的肽水凝胶溶液、稀释液和用于如下的说明书:用稀释液调节合成的肽水凝胶溶液的浓度,同时维持其渗透性(tonicity)处于血浆渗透压(plasmaosmolality)水平以及维持其ph处于约3.5以下的水平;并用经稀释的合成的肽水凝胶溶液进行细胞培养实验。
在一些方面,合成的肽水凝胶包括:radaradaradarada(rada16)。所述合成的肽水凝胶溶液可被配制以使所述合成的肽水凝胶溶液的ph水平为约3.5以下,并使所述合成的肽水凝胶溶液的渗透性在稀释前处于血浆渗透压水平。试剂盒可进一步包括混合溶液(cocktailsolution),所述混合溶液被配制用于将所述合成的肽水凝胶溶液的ph水平调节至约3.5以下,并用于将所述合成的肽水凝胶溶液的渗透性在稀释前调节至血浆渗透压水平。所述混合溶液和所述稀释液中的至少一种可包含一种或多种等渗剂以控制渗透性。一种或多种等渗剂可包括盐、糖及它们的混合物。所述混合溶液和所述稀释液中的至少一种可包含一种或多种碱性盐(alkalisalt)或酸性盐以控制ph。在一些方面,所述混合溶液可以是高渗的,并且具有处于约1至约14之间的ph水平。
在一些方面,所述试剂盒可进一步包含以下中的至少一种:待培养的细胞源、细胞培养基和等渗缓冲液。所述等渗缓冲液可包含pbs、盐水、糖(包括但不限于蔗糖)基等渗剂、或细胞培养基(包括但不限于dmem)。所述试剂盒可进一步包含洗涤液。所述说明书可进一步对如下提供指导:用洗涤液分离经培养的细胞,以及使经分离的细胞接受细胞表征或分子表征。在一些方面,所述说明书可指导3-d细胞培养方案,其中多个细胞悬浮在缓冲液中。在另外的方面,所述说明书可指导2-d细胞培养方案。所述说明书可对如下提供进一步指导:基于靶细胞类型选择血浆渗透压水平,以及使用混合溶液以在合成的肽水凝胶溶液中实现血浆渗透压水平。
根据一个或多个方面,细胞培养方法可包括:维持合成的肽水凝胶溶液的ph水平在约3.5以下;维持合成的肽水凝胶溶液的渗透性处于血浆渗透压水平;稀释肽水凝胶溶液至预定浓度;在肽水凝胶溶液中培养细胞预定时间段;以及分离经培养的细胞。
在一些方面,所述方法可进一步包括使经分离的细胞接受分子表征,所述分子表征涉及流式细胞分析和图像观察、细胞印迹或聚合酶链式反应(pcr)测试。所述合成的肽水凝胶溶液可包含radaradaradarada(rada16)。所述培养步骤可指导3-d细胞培养实验。在其它方面,所述培养步骤可指导2-d细胞培养实验。所述培养步骤可指导在体外或体内将细胞从周围细胞中募集到水凝胶中。所述培养步骤可指导体外细胞培养实验、离体细胞培养实验、或动物体内实验或人体内实验。在一些方面,所述培养步骤可涉及与药物、细胞因子、生长因子、肽和/或蛋白质的组合,以改善细胞培养并驱使细胞生长和细胞分化。所述方法可进一步包括基于细胞培养实验的靶物种或靶细胞类型来选择血浆渗透压水平的步骤。在一些方面,所述渗透性可处于约260mosm/l至约360mosm/l的范围内。
根据一个或多个方面,合成的肽水凝胶溶液可具有约1.5至约3.5的ph水平以及相对于靶物种和靶细胞类型的处于血浆渗透压水平的渗透性,所述血浆渗透压水平处于约260mosm/l至约360mosm/l的范围内。
在一些方面,靶物种可选自于由以下所组成的组:小鼠、大鼠、猪、兔、牛、人、昆虫、细菌和植物,但不限于此。靶细胞类型可选自于由以下所组成的组:成纤维细胞、干细胞、上皮细胞、内皮细胞、神经细胞、心脏细胞、肾细胞、血细胞、肌肉细胞、胰腺细胞、免疫细胞、树突状细胞、表皮细胞、癌细胞、星形胶质细胞、脂肪细胞、肝细胞、成骨细胞和软骨细胞,但不限于此。所述合成的肽水凝胶溶液可包含:radaradaradarada(rada16)。所述合成的肽水凝胶溶液的特征可在于当以1rad/sec和1pa的应力测量时,0.5%浓度下的储能模量为至少5pa。所述合成的肽水凝胶溶液可包含一种或多种等渗剂(包括盐、糖及它们的混合物)来控制渗透性,以及一种或多种碱性盐或酸性盐来控制ph水平。
这些示例性方面和实施方式的其它方面、其它实施方式和其它优点将在下文详细讨论。此外,应当理解,上述信息和以下详细描述仅仅是各方面和各实施方式的说明性示例,并且旨在提供概述或框架以理解所要求保护的方面和实施方式的性质和特征。附图被包括在内以对各方面和各实施方式提供说明和进一步的理解,并且被并入且构成本申请文件的一部分。附图与本申请文件的其余部分共同用于说明所描述的方面和实施方式及所要求保护的方面和实施方式的原理和操作。
附图说明
附图并不旨在按比例描绘。为清楚起见,可能未标记各组成部分。在附图中:
图1-图12涉及在所附的实施例中讨论的实施方式。
具体实施方式
根据一个或多个实施方式,自组装肽水凝胶可用作各种应用中的细胞培养的支架,例如,可从3-dmatrix有限公司商业上购买的
根据一个或多个实施方式,配制自组装肽水凝胶溶液可增加肽溶液的刚度(stiffness)和/或凝胶化动力学,以在向肽溶液中加入细胞培养基和更换细胞培养基时有益地克服肽水凝胶的脆性(fragility)。此外,制剂可在实验过程中为细胞和组织提供相对温和的ph环境。
根据一个或多个实施方式,目标ph水平和/或目标渗透性水平可至少部分基于待用于细胞培养实验的细胞或组织的类型来选择。例如,肽水凝胶的ph水平可调节至高达约3.5(例如高达约3.4),以通过提供更温和、不太苛刻的环境来改善细胞存活力。
关于渗透性,肽水凝胶溶液的渗透性可被调节以便紧紧地匹配靶细胞类型的血浆渗透压和/或靶物种的血浆渗透压。例如,肽水凝胶溶液的渗透性可基于任何给定的细胞类型的血浆渗透压来调节。渗透性水平可取决于待用于细胞培养实验的物种的类型和/或细胞或组织的类型而调整。在一些非限制性实施方式中,目标渗透性可处于约260mosm/l至约360mosm/l的范围内。在至少一些非限制性实施方式中,目标渗透性可处于约290mosm/l至约320mosm/l的范围内。在一些具体的非限制性实施方式中,目标渗透性可通常为约300mosm/l。对本领域普通技术人员而言,用于确定或测量细胞或组织的血浆渗透压和/或肽水凝胶溶液的渗透性的各种技术和计算是显而易见的。渗透压(osmolality)可基于一种或多种分子特征来计算。在一些实施方式中,渗透压可使用渗透压仪(如冰点下降渗透压仪或蒸气压下降渗透压仪)来测量。在至少一些实施方式中,首先确定靶细胞类型或靶组织类型的血浆渗透压,然后调节合成的肽水凝胶溶液的渗透性使得其与作为目标渗透性水平的血浆渗透压相匹配。
根据一个或多个实施方式,通过配制以提供有利的渗透性水平和/或ph水平可改善各种合成的肽水凝胶溶液(包括但不限于
根据一个或多个实施方式,制备的肽水凝胶可用于3d细胞培养。根据一个或多个实施方式,制备的肽水凝胶可用于肽水凝胶表面上的二维(2d)细胞培养。在所附的实施例中描述了可取决于肽溶液配方而使用的特定的2d细胞培养方案和3d细胞培养方案以及一些非限制性方案。根据一个或多个实施方式,制备的肽水凝胶可用于从体外周围细胞中或体内周围组织中将细胞募集到水凝胶中。根据一个或多个实施方式,制备的肽水凝胶可在体内实验、体外实验或离体实验中用于支撑生物材料、细胞递送和组织工程。根据一个或多个实施方式,制备的等渗且经ph调节的肽水凝胶可与药物、细胞因子、生长因子和蛋白质混合以改善细胞培养并驱使细胞生长和细胞分化。
根据一个或多个实施方式,可使用肽水凝胶洗涤液容易地将自组装肽水凝胶(例如本文配制的
根据一个或多个实施方式,可改善在肽溶液上加入细胞培养基时的肽水凝胶的结构稳定性。根据一个或多个实施方式,可获得对于培养细胞来说具有更温和的ph水平的毒性更低的环境。
根据一个或多个实施方式,可制备肽溶液以维持其渗透性处于相对于靶细胞类型而言的血浆渗透压以及维持其ph水平处于约1.0至约3.5(例如高达约3.4)的水平。肽溶液的渗透性可使用等渗剂来控制,所述等渗剂包括但不限于盐(如氯化钠)、糖(如蔗糖和右旋糖)、以及等渗剂的任意混合物(如pbs)。肽溶液的ph水平可使用碱性盐(包括但不限于氢氧化钠)或酸性盐(包括但不限于盐酸)来调节。渗透性和/或ph的调节可用本文所述的混合溶液或中间溶液来完成。
根据一个或多个实施方式,等渗且经ph调节的肽溶液临在细胞培养实验前通过将纯的肽水性溶液与混合溶液或中间溶液混合来配制,以维持其ph水平处于约1.5至约3.5的水平并维持其渗透性处于相对于靶细胞类型而言的血浆渗透压。混合溶液的渗透性可以是高渗的,从而使得与混合溶液配制的肽溶液处于特定的混合比例时可以是等渗的。混合溶液的渗透性可使用等渗剂来控制,所述等渗剂包括但不限于盐(如氯化钠和氯化钾)、糖(如蔗糖和右旋糖)以及等渗剂的任意混合物(如pbs)。混合溶液的ph水平可调节为约1.0至约14.0的水平,从而使得肽溶液可与混合溶液以特定混合比例配制,反过来又将其ph水平维持为约1.5至约3.5。混合溶液的ph水平可使用碱性盐(包括但不限于氢氧化钠)或酸性盐(包括但不限于盐酸)来调节。
随后,可将等渗且经ph调节的肽溶液与细胞或等渗缓冲液(含有细胞或不含有细胞)混合,以维持其ph水平(例如接近3.5以下)并维持其渗透性处于血浆渗透压,所述等渗缓冲液包括但不限于pbs、盐水、等渗蔗糖溶液和dmem。
根据一个或多个实施方式,可制备稀释液以维持渗透性处于血浆渗透压以及维持ph水平为约1.0至约3.5的水平。所述稀释液的渗透性可使用等渗剂来控制,所述等渗剂包括但不限于盐(如氯化钠)、糖(如蔗糖和右旋糖)以及等渗剂的任意混合物(如pbs)。所述稀释液的ph水平可使用碱性盐(包括但不限于氢氧化钠)和酸性盐(包括但不限于盐酸)来调节。等渗且经ph调节的稀释液可随后与肽溶液混合以稀释肽溶液的浓度,并同时维持其渗透性处于血浆渗透压以及维持其ph水平为约1.0至约3.5。
根据一个或多个实施方式,可制备肽水凝胶洗涤液以维持水凝胶的渗透性处于血浆渗透压并维持水凝胶的ph水平为约1.5至约3.5。所述洗涤液的渗透性可使用等渗剂来控制,所述等渗剂包括但不限于盐(如氯化钠)、糖(如蔗糖和右旋糖)以及等渗剂的任意混合物(如pbs)。所述洗涤液的ph值可使用碱性盐(包括但不限于氢氧化钠)和酸性盐(包括但不限于盐酸)来调节。等渗且经ph调节的洗涤液可与培养细胞的肽水凝胶混合以完全溶解水凝胶并纯化分离细胞。例如,使用肽水凝胶洗涤液可将自组装肽水凝胶(例如
根据一个或多个实施方式,细胞培养试剂盒可包括合成的肽水凝胶溶液。所述肽水凝胶溶液的渗透性和/或ph水平可以已如本文所述(例如基于靶细胞类型)进行了调节。另外,为该目的可提供混合溶液或中间溶液,并且它们的组成可根据用于培养实验的靶细胞的类型而变化。所述试剂盒可包括稀释液,以实现期望的肽水凝胶浓度。所述试剂盒可包括等渗缓冲液和/或洗涤液。所述试剂盒可包括用于进行如本文所述的3d细胞培养实验或2d细胞培养实验的说明书,以及用于促进细胞培养实验的其它材料(例如细胞或组织来源、孔板、移液管和细胞培养基,但不限于此)。
从如下非限制性实施例将更充分地理解这些和其它实施方式的功能和益处。所述的实施例本质旨在说明而并不会被认为限制了本文讨论的实施方式的范围。
实施例
如下实施例说明了自组装肽水凝胶用于细胞培养的用途。首先,以下详细描述了在本实施例部分使用的细胞培养方案和相关配方的六个实施例。
方法#1:可制备等渗且经ph调节的肽溶液和稀释液用于本方法。可将肽溶液与悬浮在pbs(ph7.4)中的细胞进行混合。将用于本方法的等渗且经ph调节的肽溶液和稀释液的配方方案列于表1中。用于本方法的3d细胞培养方案和2d细胞培养方案如表2所示。
表1方法#1所需组分的配方
表2用于方法#1的细胞培养方案
方法#2:可制备纯的水性肽溶液、用于调节肽溶液的ph和渗透性的混合溶液以及稀释液用于本方法。可将等渗且经ph调节的肽溶液与悬浮在pbs(ph7.4)中的细胞混合。用于本方法的纯的水性肽溶液、混合溶液和稀释液的配方方案列于表3中。用于本方法的3d细胞培养方案和2d细胞培养方案如表4所示。
表3方法#2所需组分的配方
表4用于方法#2的细胞培养方案
方法#3:可制备等渗且经ph调节的肽溶液和稀释液用于本方法。可将肽溶液与悬浮在等渗蔗糖溶液(10%)中的细胞混合。用于本方法的等渗且经ph调节的肽溶液和稀释液的配方方案列于表5中。用于本方法的3d细胞培养方案和2d细胞培养方案如表6所示。
表5方法#3所需组分的配方
表6用于方法#3的细胞培养方案
方法#4:可制备纯的水性肽溶液、用于调节肽溶液的ph和渗透性的混合溶液以及稀释液用于本方法。可将等渗且经ph调节的肽溶液与悬浮在10%蔗糖溶液中的细胞混合。用于本方法的纯的水性肽溶液、混合溶液和稀释液的配方方案列于表7中。用于本方法的3d细胞培养方案和2d细胞培养方案如表8所示。
表7方法#4所需组分的配方
表8用于方法#4的细胞培养方案
方法#5:可制备等渗且经ph调节的肽溶液和稀释液用于本方法。可将肽溶液与悬浮在dmem中的细胞混合。用于本方法的等渗且经ph调节的肽溶液和稀释液的配方方案列于表9中。用于本方法的3d细胞培养方案和2d细胞培养方案如表10所示。
表9方法#5所需组分的配方
表10用于方法#5的细胞培养方案
方法#6:可制备纯的水性肽溶液、用于调节肽溶液的ph和渗透性的混合溶液和稀释液用于本方法。可将等渗且经ph调节的肽溶液与悬浮在dmem中的细胞混合。用于本方法的纯的水性肽溶液、混合溶液和稀释液的配方方案列于表11中。用于本方法的3d细胞培养方案和2d细胞培养方案如表12所示。
表11方法#6所需组分的配方
表12用于方法#6的细胞培养方案
本实施例部分中所用的混合比例如下表13所示。
表13等渗且经ph调节的肽溶液与稀释液的混合比例
流变性质:
根据一个或多个实施方式,流变性质可随着用于细胞培养的肽水凝胶的制备方法而变化。
使用具有20mm平板的流变仪(dhr-1,tainstruments)来评估处于0.5%浓度的肽的流变性质。将肽溶液(200μl)置于流变仪平板上并且在25℃下用置于500μm的测量几何间隙处的平板测量模量;在25℃下,在2分钟的弛豫时间后进行测量。频率扫描测试在1pa的振荡应力下以1rad/sec-10rad/sec的频率进行。
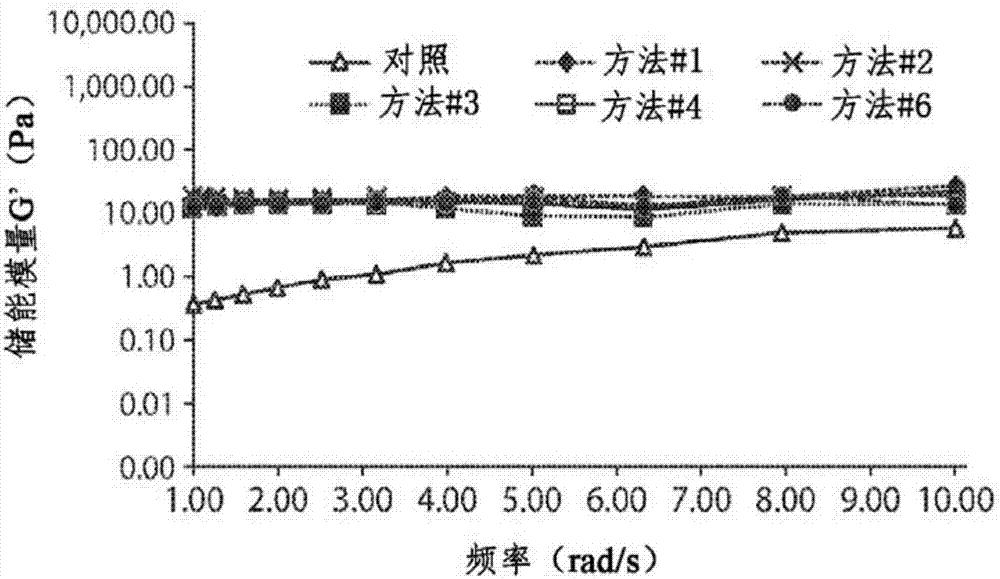
将在三种不同的等渗缓冲液中制备的
将肽溶液用dmem处理20min以诱导凝胶化。将在1rad/sec下的三个样品的储能模量示于图1中。以用10%蔗糖配制的等渗
等电点(pi)是特定分子不携带净电荷时的ph。
特别地,当将细胞培养基添加到肽溶液的上部时,对保持肽水凝胶的结构稳定性而言,
评估了由方法#1-方法#6制备的肽的流变性质并且结果示于图2和图3中。图2显示了由方法#1-方法#6制备的0.5%
凝胶化动力学:
根据一个或多个实施方式,肽的凝胶化动力学可随着肽等渗溶液的制备方法而变化。使用具有25mm平板的流变仪(dhr-1,tainstruments)来评估处于0.5%浓度的等渗肽溶液的凝胶化动力学。将肽溶液(200μl)置于流变仪平板上并且在25℃下用置于500μm的测量几何间隙处的平板测量凝胶化动力学;在25℃下,在2分钟的弛豫时间后进行测量。时间扫描测试在1hz和0.3%的应变下进行。在时间扫描过程中,在肽溶液周围加入10mldmem溶液。对该测试使用液体腔室以使肽溶液浸泡在dmem中。在时间扫描测试过程中,将在dmem被加入到位于两个平板之间的
由两种不同的等渗缓冲液制备的
当在肽溶液上添加细胞培养基时,对保持肽水凝胶的结构稳定性而言,等渗
结构稳定性
根据一个或多个实施方式,细胞培养过程中的肽水凝胶的结构稳定性可随着等渗且经ph调节的肽溶液的制备方法而变化。相比作为对照的具有10%蔗糖的等渗肽水凝胶(如
表14不同方法的水凝胶的表观结构稳定性
3d细胞培养:
根据一个或多个实施方式,肽水凝胶可用于3d细胞培养。按照方法#1-方法#6或如
将在以本文所述的方法和对照方法(遵循
所有肽水凝胶都是透明的,从而使得可通过显微镜观察在肽水凝胶中3-d包封的细胞。然而,如图6所示,用对照方法制备的具有细胞的肽水凝胶显示出繁密的破裂部分,而以方法#1和方法#3制备的具有细胞的肽水凝胶在整个区域上显示清晰且一致的基质可视化。由于以方法#2、方法#4-方法#6制备的其它水凝胶都是透明的并且具有与以方法#1和方法#3制备的水凝胶相似的刚度,所以它们可用于3d细胞培养。如图7所示,两种不同的细胞类型的水凝胶中的细胞3维分布良好。
2d细胞培养:
根据一个或多个实施方式,肽水凝胶可用于2d细胞培养。遵循方法1-方法#6,以1%的浓度制备各肽溶液,然后稀释至浓度为0.50%以下;将160μl的肽溶液置于48孔细胞培养板上,并在2℃-8℃放置12小时;将320μldmem沿着孔的侧边缓慢地下移添加到凝胶的上部,并在细胞培养箱中,将凝胶在37℃下孵育20min,然后小心地移除dmem;将细胞悬浮在320μldmem中至终浓度为5000个细胞/cm2或100,000个细胞/cm2,然后再置于凝胶的上部。
在以方法#1制备的肽水凝胶的表面上进行2-d培养的细胞的显微图像示于图8和图9中。具体而言,图8显示了nih3t3小鼠胚胎成纤维细胞的显微图像(a和c)和c57bl/6小鼠间充质干细胞(mmscs)的显微图像(b和d)。(a-b)对照:用遵循
以方法#1制备的肽水凝胶是透明的,如图8所示,从而使得可清楚地观察到在肽水凝胶上进行2-d培养的细胞。两种不同的细胞类型的水凝胶中的细胞2维分布良好。然而,用对照方法制备的具有细胞的肽水凝胶显示出繁密的破裂部分,使得细胞在损坏区域上不能接种或者下沉到塑料底部。如图9所示,在没有缺损的水凝胶的上部将细胞培养4天后,细胞开始汇合。由于以方法#2-方法#6制备的其它水凝胶都是透明的并且具有与以方法#1制备的水凝胶相似的刚度,所以它们可用于2d细胞培养。接种后的细胞均匀地分布在水凝胶表面,并在8小时内开始附着在表面上。在4天内,细胞在凝胶表面上良好地附着并汇合。然而,遵循
洗涤:
根据一个或多个实施方式,肽水凝胶可完全被洗出以从肽水凝胶中分离出包封或附着的细胞。肽水凝胶洗涤液可用等渗且经ph调节的缓冲液(如10%蔗糖和pbs)来制备,其ph可用酸性盐(如盐酸)调节至1.5-3.5。在本测试中,通过在pbs(ph7.4)缓冲液中加入1n盐酸用ph3.0的pbs来配制肽水凝胶洗涤液。将200μl1%
将用洗涤缓冲液洗涤两次后的肽水凝胶的显微图像示于图10中:a)用10%蔗糖溶液洗涤;(b)用pbs(ph7.4)洗涤;以及(c)用肽水凝胶洗涤液(ph3.0的pbs)洗涤。将肽水凝胶用10%蔗糖溶液、pbs(ph7.4)和pbs(ph3.0)洗涤两次。10%蔗糖溶液和pbs(ph7.4)未能成功地对肽水凝胶进行洗涤,显示出了大量的10μm-100μm左右的破裂的凝胶颗粒。然而,肽水凝胶洗涤液完全地洗出肽水凝胶。
细胞表征:
根据一个或多个实施方式,在肽水凝胶被完全洗出后,来自肽水凝胶的经分离的细胞可有益地用于分子水平表征(包括但不限于流式细胞分析)。将用肽洗涤液洗涤的经分离的细胞用荧光染料染色并进行流式细胞术测试而不会受到残留的肽水凝胶的干扰。将细胞在以方法#1-方法#6制备的水凝胶和遵循
图11显示出对nih3t3小鼠胚胎成纤维细胞进行碘化丙啶染色后的流式细胞术结果,将所述细胞在以方法#1-方法#6制备的肽水凝胶和遵循
细胞存活力:
根据一个或多个实施方式,由方法#1-方法#6制备的肽水凝胶与高的细胞存活力相关。实施细胞存活力(细胞毒性)分析以测量由方法#1-方法6制备的水凝胶在水凝胶组织培养系统中支持nih3t3小鼠胚胎成纤维细胞(一种常用细胞系)的存活力的能力。从碘化丙啶染色的流式细胞术结果分析nih3t3小鼠胚胎成纤维细胞的存活力。将成纤维细胞在以方法#1-方法#6制备的水凝胶和遵循
根据一个或多个实施方式,肽水凝胶可以是透明的,使得容易观察到2-d细胞图像或3-d细胞图像。以本公开的方法制备的肽水凝胶溶液通常更粘稠,因此3-d接种的细胞非常缓慢地下沉到底部从而使得三维上均匀分布。此外,在加入细胞培养基后,凝胶化时间相对较快,因此悬浮细胞能够均匀地分布在水凝胶中。对照的
应当理解的是,在申请中,本文讨论的方法和装置的实施方式不限于在本说明书中阐述的组分的排列和构造的细节或者在附图中说明的组分的排列和构造的细节。所述方法和装置能够在其它实施方式中实施并且可以各种方式被实践或施行。本文提供了具体实施的示例以仅用于说明目的而并非旨在限制。此外,本文使用的措辞和术语是为描述的目的,不应被视为限制。本文中使用的“包含”、“包括”、“具有”、“含有”、“涉及”及其变形意在涵盖其后列出的物品及其等同物以及附加物。提及“或”可被解释为包含性的,从而使得使用“或”描述的任何术语可指示单个、多于一个和全部所描述的术语中的任一者。对“前和后”、“左和右”、“上部和底部”、“上和下”,以及“垂直和水平”的任何提及都是为了方便描述而不是将本装置和方法或其组分限制在任何一个位置或任何一个空间方向上。
应当理解,本文已经描述了至少一个示例的多个方面,本领域技术人员将容易想到各种改变、各种修改和各种改进。例如,本文公开的示例也可在其它情况下使用。此类改变、修改和改进旨在成为本公开的一部分,并且旨在落入本文讨论的示例的范围内。因此,以上描述仅作为示例。
- 还没有人留言评论。精彩留言会获得点赞!