分离细胞的方法及用于该方法的器件与流程
本发明涉及从各自具备不同表面特性的多个细胞群中选择性地将具有特定表面特性的细胞群分离的方法。另外,本发明涉及将血液等含细胞的细胞悬浮液中所含的微小凝集物除去的方法及具备该微小凝集物除去机构的器件、以及具备细胞分离部分的器件。
背景技术:
从液态的混合试样(例如血液或培养液)中分离特定细胞是为了进行基础研究、诊断及治疗所需的手法。一般来说,已知使用离心分离法等对于分离具有固有密度(比重)的细胞(例如白细胞和红细胞)是有用的。另外,还已经清楚流式细胞仪法或磁力分离方法等方法对于该目的也是有用的,另外还已知如专利文献1所示那样从液态的混合试样中利用过滤器构造对细胞根据其大小进行分离的方法。进而,还已知如专利文献2那样利用使用了被称作确定性侧向位移法(deterministiclateraldisplacement:dld)的原理的流体器件对细胞根据其大小进行分离的方法。
但是,专利文献1、2所记载的分离方法中,由于是根据细胞自身的大小从液态的混合试样中进行分离的方法,因此即使是不同种类的细胞,也难以对大小接近的细胞进行分离。另外,专利文献3所记载的分离方法中使用了在将细胞制成复合粒子之后利用筛膜的分离方法,但使用这种分离方法时,具有伴随着洗涤工序等的处理会花费功夫或者产生细胞损失等问题,需要迅速、简便且高精度的分离纯化方法。除此之外还提出了专利文献4~6的方法。
另外,对于血液中的细胞,还尝试了利用细胞的大小等进行分离。但是,血液中的循环肿瘤细胞(ctc)的分离由于大小与白细胞(10~20μm)接近,因此基于上述dld原理的方法是难以分离的。
进而,专利文献1、2所记载的分离方法中,由于试样中存在的微小凝集物的影响,在分离的基本原理部分处会发生堵塞,因而有降低分离的精度或无法分离的情况。
微小凝集物是纤维蛋白、其他变性蛋白质、脂肪等凝集而成的。进而,微小凝集物由于是与白细胞等血细胞同等程度的大小,因此有超过200μm的情况,具有粘性是其特征。这些微小凝集物也存在于刚采集的新鲜试样中,有保存期间越长、保存温度越低、则其数量越增加、大小也越增加的倾向。另外,即便是采集时混合了抗凝剂等的试样,该微小凝集物也存在是其特征。
因此,当在不除去这些微小凝集物的情况下实施公知的细胞分离处理时,有由于微小凝集物在器件中的一部分发生堵塞、目标细胞的分离精度降低或者处理本身变难的情况。
对此,公开了如专利文献7、专利文献8中那样使用微小凝集物除去过滤器的微小凝集物除去的方法。但是,这些方法虽然可以对大量的试样进行处理,但会发生目标细胞的损失,在不使试样中所含的稀少细胞损失的情况下进行分离时是不适合的。另外,使用了市售的尼龙网过滤器的过滤除去方法中,有发生目标细胞的损失或者微小凝集物无法完全地除去的情况。
现有技术文献
专利文献
专利文献1:国际公报第2009/097247号
专利文献2:美国专利第7735652号
专利文献3:日本特表2008-507956号公报
专利文献4:国际公报第2011/111740号
专利文献5:日本特表2013-501924号公报
专利文献6:日本特开2013-142540号公报
专利文献7:日本特开2010-213820
专利文献8:日本特开2005-204781
非专利文献
非专利文献1:d.w.inglis,etal,criticalparticlesizeforfractionationbydeterministiclateraldisplacement,labonachip,6,655-658(2006)
技术实现要素:
发明要解决的技术问题
本发明的课题在于提供利用细胞的表面特性的差异,精度良好、迅速且简便地对因细胞的大小接近而难以根据大小分离的细胞进行分离的方法。另外,本发明的课题在于提供一种方法和一种器件,所述方法为在从血液等含细胞的细胞悬浮液中精度良好地分离所含目标细胞时的前处理中使用的方法,通过不损失试样中的目标细胞且精度良好地将试样中的微小凝集物除去,可以在之后的细胞分离中精度更为良好地将目标细胞分取。
用于解决技术问题的手段
本发明的一个方式涉及一种方法,其为应用确定性侧向位移法(dld)的原理将目标细胞或目标外细胞捕获到载体上而增加了粒子尺寸之后,基于dld原理,根据粒子尺寸将细胞分离的方法。
首先,本发明的第一方式是一种细胞的分离方法,其是从含有目标细胞及目标外细胞的2种以上细胞的细胞悬浮液中、在连续的液体流动中根据尺寸将细胞分离的方法,其具备以下工序:
将识别所述目标细胞的细胞表面的特征性构造的对象捕获物质添加在所述细胞悬浮液中,生成所述目标细胞和所述对象捕获物质的复合物的工序;
将含所述复合物的细胞悬浮液导入至具备具有dld微流路构造的分离区域的细胞分离器件中的工序,该工序中,在所述细胞分离器件的缓冲液导入口中加入缓冲液使其流入,并在样品导入口中加入所述细胞悬浮液使其流入,使其通过所述细胞分离器件的多个分离区域中;
从所述细胞悬浮液中将具有所确定的阈值以上的尺寸的复合物分离的工序,该工序中,具有小于阈值的尺寸的细胞与细胞悬浮液的流动一起移动,且具有阈值以上尺寸的复合物相对于流动向斜方向位移、移动,从而进行分离;以及
从排出口将所分离的所述复合物回收的工序。
另外,本发明的第二方式是一种细胞的分离方法,其是从含有目标细胞及目标外细胞的2种以上细胞的细胞悬浮液中、在连续的液体流动中根据尺寸将细胞分离的方法,其具备以下工序:
将识别所述目标外细胞的细胞表面的特征性构造的对象捕获物质添加在所述细胞悬浮液中,生成所述目标外细胞和所述对象捕获物质的复合物的工序;
将含所述复合物的细胞悬浮液导入至具备具有dld微流路构造的分离区域的细胞分离器件中的工序,该工序中,在所述细胞分离器件的缓冲液导入口中加入缓冲液使其流入,并在样品导入口中加入所述细胞悬浮液使其流入,使其通过所述细胞分离器件的多个分离区域中;
从所述细胞悬浮液中将具有所确定的阈值以上的尺寸的复合物分离的工序,该工序中,具有小于阈值的尺寸的细胞与细胞悬浮液的流动一起移动,且具有阈值以上尺寸的复合物相对于流动向斜方向位移、移动,从而进行分离;以及
从排出口将所分离的所述目标细胞回收的工序。
进而,本发明中,优选所述对象捕获物质由对所述目标细胞或所述目标外细胞的细胞表面的特征性构造进行识别的对象捕获分子与担载所述对象捕获分子的物质的结合体组成,所述对象捕获分子优选是抗体、肽适体、凝集素、细胞间粘附分子、糖链、细胞识别性的高分子,担载所述对象捕获分子的物质优选是聚苯乙烯或乳胶。
另外,本发明中,所确定的阈值优选是20~60μm、更优选是30~50μm。进而,本发明中,所述细胞悬浮液优选是血液,所述目标细胞优选是肿瘤细胞,更优选是循环肿瘤细胞或上皮系肿瘤细胞。
另外,本发明的另一方式为一种除去微小凝集物的方法,其是从含有目标细胞和微小凝集物的细胞悬浮液中、在连续的液体流动中将微小凝集物除去的方法,其具备以下工序:向具备具有第2微流路构造的除去机构的微小凝集物除去器件中流入细胞悬浮液或者细胞悬浮液与缓冲液的混合液,使其通过微小凝集物除去器件的微流路中,对微小凝集物进行捕获。该除去微小凝集物的方法作为将含微小凝集物的细胞悬浮液(血液等)中的微小凝集物除去的方法是有用的。另外,当将该除去微小凝集物的方法与上述细胞的分离方法组合使用时,可以更适宜地对细胞进行分离。
该目标细胞还可以含有目标细胞与载体物质的复合物。另外,该第2微流路构造优选由以大于30μm的间隔设置的柱状物构成。另外,对于该第2微流路构造的柱状物设置间隔,在从含微小凝集物的细胞悬浮液中分离目标细胞(例如从血液中分离循环肿瘤细胞[ctc])的情况下,在与上述分离细胞的方法组合使用时,柱状物设置间隔例如设定为80μm~250μm即可、更优选设定为100μm~230μm、进一步优选设定为120μm~220μm。
另外,该细胞悬浮液优选是血液,更优选该血液添加了抗血液凝固试剂,该抗血液凝固剂更优选是凝血酶抑制剂,该凝血酶抑制剂特别优选为ppack。
进而,本发明的又一方式为一种微小凝集物除去器件,其特征在于,其是具备具有第2微流路构造的除去机构的微小凝集物除去器件,其中,第2微流路构造由以大于30μm的间隔设置的柱状物构成,在第2微流路的前方具有试样导入口、在微流路的后方具有试样排出口。该第2微流路构造优选由2个分别的微流路构造部分构成,在该2个分别的微流路构造部分的中间具有缩窄流动宽度的部分。
进而,本发明的再一方式为一种一体型细胞分离器件,其特征在于,其是连续具备具有第2微流路构造的微小凝集物除去部分和对细胞进行分离的细胞分离部分的一体型细胞分离器件,其中,第2微流路构造由以大于30μm的间隔设置的柱状物构成,在第2微流路构造的前方具有试样导入口、在细胞分离部分的后方具有试样排出口,在除去微小凝集物的部分的后方连续地具备对细胞进行分离的部分。优选下述一体型细胞分离器件,其特征在于,该对细胞进行分离的部分是利用基于确定性侧向位移法(dld)的尺寸分级的分离构造。
发明效果
根据本发明,与现有技术相比,可以精度良好、迅速且简便地对利用细胞自身的大小差异难以分离的细胞进行分离。另外,根据本发明的方法,通过在导入至流路中的目标细胞和目标外细胞中产生大小的差异、将目标细胞与目标外细胞分离,由此除了施加于细胞自身的损伤小以外,还能够高精度且选择性地将目标细胞分离。另外,在目标细胞的分离时,不需要复杂的装置、工序,可以利用单纯构造的流路将目标细胞分离。
另外,根据本发明,与现有技术相比,没有目标细胞的损失,可以精度良好地将所含的微小凝集物除去。另外,根据本发明,在使用了细胞分离器件的手法中,通过制成一体型的连续的流路构造,在除去微小凝集物之后可以精度良好地将目标细胞分离。进而,使用本发明的一体型细胞分离器件时,与没有微小凝集物除去机构的器件相比,可以防止送液中的堵塞、可以从较多的溶液中将细胞分离、进行处理。
附图说明
图1为说明本发明实施方式的分离方法的基本原理的示意图。
图2为说明具备本发明实施方式的dld微流路的基本构造(分离区域)的分离器件的示意图。
图3为具备本发明实施方式的dld微流路的基本构造的分离器件的垂直方向截面示意图。
图4为说明本发明实施方式的具备送液部和回收部的分离装置的示意图。
图5为说明本发明实施方式的含细胞的细胞悬浮液及对象捕获物质的示意图。
图6为说明本发明实施方式的捕获目标细胞的分离方法的示意图。
图7为说明本发明实施方式的捕获目标外细胞的分离方法的示意图。
图8为用于说明本发明实施例1~3的示意图。
图9为用于说明本发明实施例4的示意图。
图10为说明本发明实施方式的除去微小凝集物的方法的示意图。
图11为说明本发明实施方式的微小凝集物除去器件的柱状物构造的示意图。
图12为说明本发明实施方式的微小凝集物除去器件的示意图。
图13为说明本发明实施方式的微小凝集物除去器件(具有2个微流路构造的方式)的示意图。
图14为本发明实施方式的微小凝集物除去器件的侧面方向的截面示意图。
图15为说明本发明实施方式的具备微小凝集物除去机构的细胞分离器件的示意图。
图16为用于说明本发明实施例的示意图。
图17a为表示用于说明本发明实施例的微小凝集物的除去样子(器件导入口附近)的图。
图17b为表示用于说明本发明实施例的微小凝集物的除去样子(器件中间部)的图。
图17c为表示用于说明本发明实施例的微小凝集物的除去样子(器件排出口附近)的图。
图17d为表示用于说明本发明实施例的微小凝集物的除去样子(处理前的试样)的图。
图17e为表示用于说明本发明实施例的微小凝集物的除去样子(处理后的试样)的图。
图18a为表示用于说明本发明实施例的分离器件中消除了堵塞的样子的图。
图18b为表示用于说明本发明实施例的分离器件中消除了堵塞的样子的图。
图19为表示用于说明本发明比较例的分离器件中的堵塞的样子的图。
图20a为表示一体型细胞分离器件的一例的俯视图。
图20b为表示一体型细胞分离器件的一例的侧视图。
图21为一体型的细胞分离器件的俯视图、缩窄流动宽度的部分的放大图及细胞分离部分的放大图。
图22为在血液样品中添加了附着有特定抗体的珠粒的样品的稀释溶液及其放大图(细胞分离前)。
图23为表示利用本发明的分离方法将目标细胞(珠粒[黑色部分]与肿瘤细胞[白色部分]的复合物:(c)和放大图(d))和目标外细胞(红细胞等(a))分离后的图。其中,照片(c)和照片(d)的拍摄条件不同。
图24表示分离前的稀释溶液和利用本发明的细胞分离方法分离后的目标细胞及其他血细胞等。
具体实施方式
1.本发明的分离细胞的原理
本发明涉及应用确定性侧向位移法(dld)的原理将目标细胞或目标外细胞捕获到载体上而增加了粒子尺寸之后、根据dld原理利用粒子尺寸将细胞分离的方法。
图1为说明本发明实施方式的分离方法的基本原理的示意图。分离的基本原理使用被称作确定性侧向位移法(deterministiclateraldisplacement:dld)的手法。
1-1.确定性侧向位移法(dld)
确定性侧向位移法(dld)是指下述的方法:将粒子的分散液流入到稍错开的柱状物构造时,大的粒子因柱状物周围所产生的流动的变化而斜向地流动,而小的粒子则搭乘到层流中、整体地直线行进,利用该性质,实现根据尺寸进行分选的方法(参照非专利文献1、图1)。在被称作确定性侧向位移法的使用错开地配置有规则的障碍物(微柱状物)的流路的方法中,小的粒子搭乘流动而直行,而大的粒子随着障碍物周围所产生的流动变化、沿着障碍物的偏移斜向地前进。
一般来说,该dld原理也被应用在细胞的分离,例如血液中的成分、红细胞、白细胞、ctc的分离中。通过将血液细胞流入至尺寸分选微柱构造上,使其通过使用了dld的微流体器件,从而根据细胞的大小,可以通过dld微流路选出大的细胞。但是,血液中存在的肿瘤细胞由于细胞大小与白细胞接近,因而难以将两者分开、进行分离。
本发明中,如后所述,通过将识别目标细胞或目标外细胞的细胞表面的特征性构造的对象捕获物质添加在细胞悬浮液中,生成目标细胞或目标外细胞与对象捕获物质的复合物,从而在大小中设置差异之后,利用具有dld微流路的基本构造的细胞分离器件,将细胞分离。
1-2.dld原理中向斜方向位移的粒子直径的阈值、细胞分离器件
根据非专利文献1所记载的dld原理,根据欲分离的粒径,可以设定向斜方向位移的粒子直径的阈值(dc)。更具体地说,阈值dc的设定可以由以下式子求得。
dc=2ηgε式1
dc:向斜方向位移的粒子直径的阈值
η:变量
g:柱状物间间隙
ε:柱状物的偏移角度(tanθ)
进而,解上述式1而获得下述的近似式2。
dc=1.4gε0.48式2
进而,由经验法则在0.06<ε<0.1左右时为良好,因此使用
ε=tanθ=1/15=0.067,
可以导出以下的关系式。
g≈2.62057dc式3
进而,由上述式子,基于向斜方向位移的粒子直径的阈值dc,计算柱状物间间隙g,可以制作具有设置了特定的柱状物间间隙的柱状物(障碍物构造)的基本构造部分的细胞分离器件。如此,可以制作具有带有目标阈值dc的dld微流路的细胞分离器件。
首先,图1显示了dld微流路的基本构造20(分离区域),设置有相对于朝向箭头方向的流体的流动方向、根据一定的规则斜向排列的障碍物构造21。在朝向箭头方向的流体中,在障碍物构造21周边部产生流动速度的变化。利用该连续排列的障碍物构造21所产生的流动速度的变化,以某个一定的大小作为阈值,对于流体中含有的粒子,可以依赖于大小地改变行进方向。
对于行进方向的变化,某个一定大小以上的粒子22随着连续排列的障碍物构造21的配置,向斜方向位移。另一方面,小于某个一定大小(阈值)的粒子23不随着上述粒子的行动、沿着流动方向一边在障碍物构造21中迂回一边直行。
如此,通过根据公知的方法(非专利文献1)设计进行了能够分离目标大小的阈值设定的障碍物构造21的排列图案,从而可以依赖于各种目标粒子的大小、在相对于流动方向直行的方向上将粒子分离。进而,通过在流动方向下游部分别设置不同的回收流路,可以将所分离的粒子分别回收。
另外,障碍物构造21的形状不仅限于图示的圆柱构造,只要是能够产生目标的流动速度变化的形状,例如还可制成三角柱等棱柱构造。
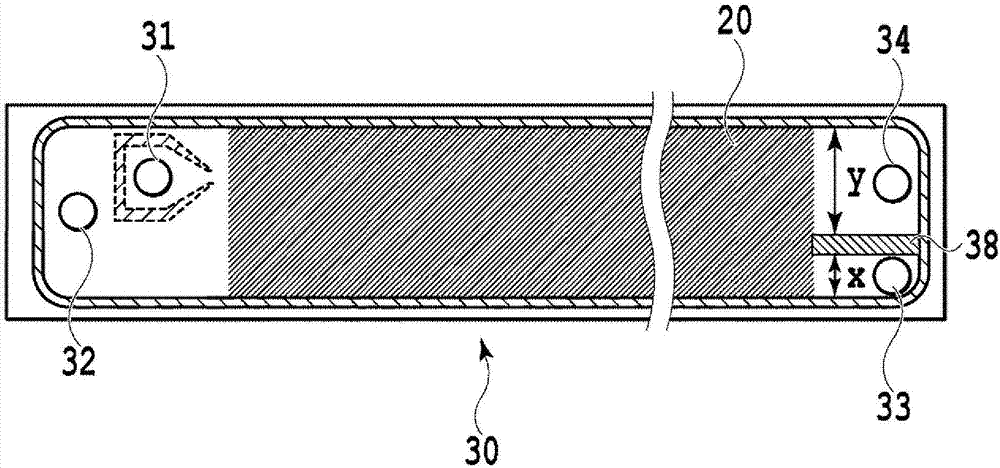
图2为说明本发明实施方式的具备dld微流路的基本构造的细胞分离器件30的示意图。以下利用俯视图对细胞分离器件30的基本构造进行说明。首先,作为流体的入口构造,具备样品导入口31及缓冲液导入口32。
另外,作为流体的出口构造,具备将向沿着斜向排列的障碍物构造部配置的方向位移而行进的、含有阈值(某个一定的大小)以上粒子的级分排出的第一排出口33;和将沿着流动方向直行的、含有小于某个一定大小的粒子的级分排出的第二排出口34。另外,第一排出口33及第二排出口34并非如示意图所示仅限定于分别为1个,还可以根据目标具有多个出口。
在细胞分离器件的样品导入口31及缓冲液导入口32与第一排出口33及第二排出口34之间,连续地配置有具有微柱状物构造的dld微流路的基本构造20,通过该连续构造部分,可以在垂直于大小流动方向的方向上、依赖于大小地将混合液中含有的粒子分离。关于基本构造20的连续配置部分,只要是恒定地相同设计的基本构造是连续的即可,也可根据目标设定逐渐改变了设计的区域。作为缓冲液液,为了避免对细胞的影响,可以使用1种或组合使用多种等渗液,例如使用生理盐水、pbs等即可。
关于从样品导入口31向流体器件30内的入口部分的构造,由于有必要使混合液如后所述那样地进行流动,因此优选设置图示那样的一定宽度的隔壁构造。从样品导入口31送液的混合液一边与从缓冲液导入口32送液的缓冲液溶液保持层流(平行于流动方向、形成层的流动),一边如图18a所示那样进行流动,比一定阈值大的粒子根据上述的分离原理、相对于流动方向向斜方向位移,从而如图18b所示那样从混合液的层分离。另一方面,小于一定阈值的大小的粒子随着混合液的层的流动而直行、流动。如此,从进行细胞分离的目的出发,样品导入口31的位置有必要靠近流体器件30的第二排出口34一侧进行设置。
另外,为了调整所排出的液量,第一排出口33及第二排出口34的构造可以根据目标适当地改变设计。例如,在从附图上部朝向下部按照达到1:1的间隔的方式设置排出口附近的隔壁38时,由各个排出口获得的液量大概变为1:1。与其相对,同样地,按照达到49:1的间隔的方式设置隔壁38时,可以将由第一排出口33获得的液量浓缩至大概50倍。如此,根据用途不仅可用于混合液中的粒子的分离、还可用于液量的浓缩。作为例子,通过将图2的隔壁38或图21的分支部39所示的y与x的比率设定为1:1或49:1等而可以实现。
图3为本发明实施方式的细胞分离器件的垂直方向截面的示意图。细胞分离器件30通过构成dld微流路的基本构造20、具备各个导入口、排出口构造部等形状的流路构造部36与平面构造部37的接合而制作,在其空间中具有流路空间35。另外,在各个样品导入口31、缓冲液导入口32、第一排出口33、第二排出口34部分上适当地接合管子,并设置与注射器等的接合部,从而也可以适当加以改变地进行使用。
流路空间35的高度只要是设定为复合物5能够通过的高度则无任何限定,为了进行精度良好的分离,优选设定为在流路空间35的高度方向上不会同时存在2个以上复合物5的高度。
流路构造部36的构件及流路构造的制作方法可以适当选择公知的任一种方法进行制作。作为构件的材料,例如可以使用玻璃、有机硅、二甲基聚硅氧烷、塑料等。另外,对于平面构造部37,只要是平坦且能够与流路构造部36接合的材料,则无特别限定,优选使用具有强度的玻璃、塑料等。
此外,本细胞分离器件30只要具备各个基本构造及导入口、排出口构造部等的形状、形成流路空间则没有任何问题,例如还可以是在图示的平面构造部37一侧的构件上具备各个基本构造及导入口、排出口构造部等形状的构造。
图4为说明本发明实施方式的具备送液部及回收部的分离装置的示意图。分离装置40在具有dld微流路的基本构造的细胞分离器件30中分别在样品导入口31上设有样品送液部41、在缓冲液导入口32上设有缓冲液送液部42。另外,在第一排出口33上设有第一回收部43、在第二排出口34上设有第二回收部44。
样品送液部41和缓冲液送液部42分别具有具备送液体系的机构,能够以一定的速度进行各自独立的送液。它们只要是能够以一定速度进行送液的机构则无特别限定,例如优选利用注射器泵等进行送液。另外,根据需要,样品送液部41中还可具备用于防止复合物5的沉淀及凝集的搅拌机构以及调整混合液4的自动化机构。
关于第一回收部43、第二回收部44,只要是能够回收排出液的机构则无特别限定,也可以在分离马上开始之前、分离开始之后具备能够进行排出液的分级的机构等。
2.本发明的细胞分离方法
以下一边参照附图一边说明本发明的分离方法。
本发明如上所述是在连续的液体流动中、利用尺寸对含有目标细胞及目标外细胞的2种以上细胞的细胞悬浮液将细胞分离的方法。其中作为“细胞悬浮液”,只要是含有目标细胞及目标外细胞的2种以上的细胞则无特别限定,例如可以示例血液、淋巴液、唾液、尿、泪等体液。
2-1.生成目标细胞或目标外细胞与对象捕获物质的复合物的工序
图5为说明本发明实施方式的含细胞的细胞悬浮液及对象捕获物质的示意图。首先,相对于含有目标细胞2及目标外细胞3的细胞悬浮液1,将作为识别目标细胞的细胞表面的特征性构造的对象捕获分子10与担载对象捕获分子10的物质11的结合体的对象捕获物质12混合在细胞悬浮液1中,从而在所得的混合液4中形成目标细胞2与对象捕获物质12的复合物5。
其中,细胞悬浮液1中所含的目标外细胞3并非限定于1种,只要是不具有对象捕获分子10识别的目标细胞的细胞表面的特征性构造的细胞,则种类或数量并无限定。另外,对象捕获分子10只要是识别目标细胞2的细胞表面的特征性构造的分子、且不识别目标细胞2以外的细胞的细胞表面的特征性构造的分子,则并非限定于1种,也可以适当选择多个所需种类或数量进行使用。
更详细地说,也可在担载对象捕获分子10的物质11上担载相同或不同种类的多个对象捕获分子10来制作对象捕获物质12。另外,在担载多个对象捕获分子10的物质11上还可担载相同种类或不同种类的对象捕获分子10,也可根据目标用途适当地选择,制作对象捕获物质12。其中,为了精度良好地获得目标细胞,优选将满足前述条件的对象捕获分子10组合多个进行使用。进而,担载对象捕获分子的物质11的大小还可根据目标用途分别使用多种大小。
例如,目标细胞2进一步具有a、b、…等各细胞表面的特征性构造时,通过分别使用具备对象捕获分子10a的物质11a、具备对象捕获分子10b的物质11b、…,利用与担载对象捕获分子的物质11a及担载对象捕获分子的物质11b、…的大小差异,在之后的分离工序中使其通过多个分离阈值区域,从而还可以将分别具有a、b、…的特征性构造的目标细胞分离、回收至各个排出口中。
另外,还可根据目标用途,形成目标外细胞3与对象捕获分子的复合物粒子,将目标外细胞除去。
更详细地说,通过在含目标细胞2及目标外细胞3的细胞悬浮液1中添加作为识别目标外细胞表面的特征性构造的对象捕获分子10与担载对象捕获分子10的物质11的结合体的对象捕获物质12,可以在混合液4中形成目标外细胞3与对象捕获物质12的复合物5(未图示)。
其中,此时同样,对于对象捕获分子10,只要是识别目标外细胞表面的特征性构造的分子、且不识别目标细胞2的细胞表面的特征性构造的分子,则并非限定于1种,也可以适当地选择多个所需种类或数量进行使用。
对象捕获分子10只要是识别形成复合物5的细胞的细胞表面的特征性构造的分子且不识别除此之外的细胞的细胞表面的特征性构造的分子,则无特别限定。作为对象捕获分子10,例如可以使用抗体、肽适体、凝集素、细胞间粘附分子、糖链、其他细胞识别性的高分子等中的任一个,或者从它们中将多个组合、适当地使用。
担载对象捕获分子的物质11可以使用由金属、无机材料、树脂等高分子形成的构件。该构件可以由单一材料形成,也可以组合使用多种。使用多种材料时,优选使用将各成分均匀地混炼而形成的构件。另外,作为担载对象捕获分子的物质11的材质,可以选择高分子聚合物,具体地可以使用聚苯乙烯或乳胶等。
该担载对象捕获分子的物质11只要是由上述材料形成,则构件并无特别限定,由于在之后的分离阶段中成为重要的要素,因此优选使用比重均匀者。进而,在细胞悬浮液1中进行反应时,当比重小时,由于在细胞悬浮液中的分散有变得不均匀的情况,因而优选选择比重接近于水或比重稍大于水的构件。
对象捕获物质12如上所述,是对象捕获分子10与担载对象捕获分子10的物质11的结合体。还可利用公知的方法将对象捕获分子10与担载其的物质11结合。例如,在将作为对象捕获分子的抗体固定化在物质11上时,可以使用利用物理吸附的方法、利用化学键合的方法等。利用化学键合时,例如由表面含有羟基的材质形成时,通过在将抗体中的羧基活性酯化之后使羟基与该酯基反应,可以将抗体固定化在表面上。另外,还可以使用介由proteina或proteing的结合方法。此外,对象捕获物质12还可以使用市售品,例如购买担载有抗体的珠粒进行使用。
对象捕获物质12的大小有必要按照复合物5的大小成为大于要区分的其他细胞的大小、且能够区别的尺寸的方式进行选择。例如,形成目标细胞2与对象捕获物质12的复合物5,进行与目标外细胞3的分离时,必须使复合物5的大小大于目标外细胞3。
更详细地说,当目标细胞2的直径为10~14μm、且目标外细胞3的直径为8~12μm时,有必要的是至少对象捕获物质的直径为2μm以上,为了精度更为良好地进行分离,优选为5μm以上,只要是不在后面实验中产生障碍的范围,则优选使用直径更大者。另外,由基于dld原理的细胞分离装置、一般的细胞的大小等出发,更具体地说,对象捕获物质12的大小为7μm~60μm、优选为15μm~50μm、更优选为20μm~40μm。特别是由于血液中的循环肿瘤细胞(ctc)与白细胞(10~20μm)的大小接近,因而在从血液中分离循环肿瘤细胞时,优选使用20μm~40μm直径的对象捕获物质。
2-2.使用细胞分离器件分离复合物的工序
本发明包含以下工序:将含复合物的细胞悬浮液导入至具备具有dld微流路构造的分离区域的细胞分离器件的工序,该工序中,在细胞分离器件的缓冲液导入口中加入缓冲液使其流入、并在样品导入口中加入细胞悬浮液使其流入,使其通过细胞分离器件的多个分离区域中;和从细胞悬浮液中将具有所确定的阈值以上尺寸的复合物分离的工序,该工序中,具有小于阈值的尺寸的细胞与细胞悬浮液的流动一起移动、且具有阈值以上尺寸的复合物相对于流动向斜方向位移、移动,从而进行分离。
2-2-1.制作与目标细胞的复合物、进行分离的工序
首先,本发明的第一方式为制作与目标细胞的复合物之后,使用具备具有dld微流路构造的分离区域的细胞分离器件,将具有所确定的阈值以上的尺寸的复合物分离。
图6为说明本发明实施方式的捕获目标细胞的分离方法的示意图。该方法中,首先在含有目标细胞2及目标外细胞3的细胞悬浮液中混合识别目标细胞的细胞表面的特征性构造的对象捕获物质12,从而形成目标细胞2与对象捕获物质12的复合物5。
接着,对于以预先用缓冲液充满流路空间部而除去了气泡的状态准备好的细胞分离器件30,从样品导入口31将具有所述目标外细胞3及复合物5的混合液4导入至细胞分离器件30中,且同时将缓冲液连续地从缓冲液导入口32导入。之后,在细胞分离器件30中,通过细胞分离器件30中连续设置的具有dld微流路构造的基本构造20(分离区域),目标外细胞3直行,而复合物5向与流动处于斜方向的方向位移、移动,进行分离。结果,由第一排出口33获得具有目标细胞2的复合物粒子5,由第二排出口34获得目标外细胞3。如上可进行细胞的分离。
本发明中,在第一工序中形成与目标细胞的复合物之后,将具有所确定的阈值以上的尺寸的复合物分离。此时,阈值虽依赖于复合物的大小,但可以从与复合物的大小、对象捕获物质的大小、目标细胞及待区分的目标外细胞的大小等的关系出发,选择适当的范围。
例如,当假设用于血液中的细胞的分离时,红细胞为6~8μm,但白细胞为9~15μm、较大,能够存在于血液中的循环肿瘤细胞(ctc)由于是10~20μm左右,因此为了与成为目标外细胞的白细胞进行分离,优选阈值为20μm以上、更优选为30μm以上。另一方面,为了精度良好地进行分离,优选使用较大尺寸的对象捕获物质,对象捕获物质的大小如上所述优选为15μm~50μm、更优选为20μm~40μm。因此,例如在使用大小为30μm的对象捕获物质时,可以预想到与作为目标细胞的循环肿瘤细胞(ctc)的复合物变为40~50μm左右的大小。另外,当使用优选范围的大小为20μm~40μm的对象捕获物质时,复合物的大小可以预想到成为30μm~60μm。为了简便且精度良好地分离目标细胞,优选综合上述情况所确定的阈值是待区分的目标外细胞的大小以上且是从目标细胞和对象捕获物质的大小假设的复合物大小的上限以下。具体地说,所确定的阈值dc优选设定为20~60μm、更优选设定为30~50μm。
另外,该阈值dc的范围由于根据对象捕获物质、目标细胞、目标外细胞及复合物的大小而变化,因此可以通过适当选择目标细胞、目标外细胞及对象捕获物质来进行确定。
2-2-2.制作与目标外细胞的复合物、进行分离的工序
本发明第二方式为制作与目标外细胞的复合物之后,使用具备具有dld微流路构造的分离区域的细胞分离器件,将具有所确定的阈值以上的尺寸的复合物分离。
图7为说明本发明实施方式的捕获目标外细胞的分离方法的示意图。相对于前述方法,该方法首先通过在含目标细胞2和目标外细胞3的细胞悬浮液中混合识别目标外细胞的细胞表面的特征性构造的对象捕获物质12,从而形成目标外细胞3与对象捕获物质12的复合物5。
接着,与前述方法同样,相对于以预先用缓冲液充满了流路空间部而除去了气泡的状态准备好的细胞分离器件30,将含有所述目标细胞2和复合物5的混合液4从样品导入口31导入至细胞分离器件30中、且同时将缓冲液连续地从缓冲液导入口32导入。之后,在细胞分离器件30中,通过连续地设置在细胞分离器件30中的基本构造部20,在与流动方向垂直的方向上将目标细胞2及复合物5分离。结果,从第一排出口33获得具有目标外细胞3的复合物5、从第二排出口34获得目标细胞2。如上所述,可以进行细胞的分离。
上述2个方法还可根据目标适当地分开使用。例如针对目标细胞2的对象捕获分子10明确且特异性高时,可以优选使用图6中说明的方法。另一方面,当针对目标细胞2的对象捕获分子10不明确时,可以使用图7中说明的方法将目标细胞2分离。另外,还可根据目标外细胞3的种类或数量,适当地分别使用各个手法。
进而,还可根据分离后的目标,分别使用所述2个方法。例如,对于目标细胞2,若想要以不形成复合物5、以原样的状态进行分取为目标时,可以利用图7中说明的方法进行实施。另外,利用图6说明的方法进行实施时,也可以采取使用公知的任一种方法将复合物5解离而分成目标细胞2和对象捕获物质12、进而使用公知的任一种方法仅将目标细胞2分离的手法,但由于步骤繁琐,因此此时优选用图7说明的方法进行实施。
2-3.进行回收的工序
本发明包含以下工序:将含有经分离的目标细胞的复合物从排出口回收的工序、或者将经分离的目标细胞从排出口回收的工序。当如本发明的第一方式所示生成目标细胞与对象捕获物质的复合物时,将复合物从排出口回收,在如本发明的第二方式所示生成目标外细胞与对象捕获物质的复合物时,将目标细胞从排出口回收。这些回收例如可以使用在排出口上安装管子、利用泵进行抽吸等适当公知的方法来进行。
2-4.将微小凝集物除去的工序
在本发明的分离细胞的方法中,当从血液等含有微小凝集物的细胞悬浮液中分离目标细胞时,在分离工序之前优选追加后述的除去微小凝集物的工序。该工序还可作为血液等的前处理进行,但与上述分离细胞的方法组合时,在与血液等生成所述复合物的工序之后、且在导入至细胞分离器件的工序之前,当设置该除去微小凝集物的工序时,可以有效地进行目标细胞的分离。
本发明的另一方式涉及利用具备具有微流路构造的除去机构的微小凝集物除去器件将血液等中含有的微小凝集物除去的方法、以及微小凝集物除去器件。
3.使用了本发明器件的微小凝集物的除去原理
3-1.本发明的微小凝集物除去器件
图10为说明本发明的除去微小凝集物的方法中使用的微小凝集物除去机构的基本构造110的示意图。相对于朝向箭头方向的流体的流动方向、在垂直方向上设置有构造物111,由于流动,试样中的微小凝集物112被构造物111捕获。通过在相对于流动方向的水平方向上以一定间隔设置多个该构造物111,依次用构造物将微小凝集物捕获,随着流向流动方向的下游,将试样中的微小凝集物除去。
图11为表示微小凝集物除去机构由一定间隔的柱状物构造121构成的说明图。通过配置遵循一定规则的柱状物构造,产生在依次捕获了微小凝集物的部分迂回的流动,可以高效率地依次将微小凝集物除去。如此,通过流动迂回,可以避免目标细胞等的损失、且可以在没有流速减少的情况下进行处理。
该柱状物的形状例如还可以是圆柱构造,但只要是能够捕获目标的微小凝集物的构造,则形状并无特别限定,例如还可以是其水平方向截面形状为菱形的棱柱构造。各柱状物的直径例如可以为5~30μm左右的大小。
进而,该柱状物构造还可以以一定间隔连续地配置形状的基本构造,还可根据目标逐渐地改变形状和配置来进行设置。如此,柱状物构造并非限定于以规则的间隔配置在微小凝集物除去机构整体的情况,也可以无规地设置。例如,还可以是在流动方向的上游部设置间隔宽、随着流向下游部、设置间隔逐渐地变窄的配置。进而,还可以是仅在除去机构的一部分上设置柱状物构造、或在除去机构的特定部分上设置不同基本构造的柱状物构造。另外,流路整体的宽度也可以并非相同,还可以是根据需要在途中缩窄流路宽度的形状。
该柱状物的设置间隔如果过窄,则由于是从流动方向的上游部开始依次地将微小凝集物捕获,因而易于从上游部开始优先地产生堵塞。因而,当在试样中存在大的微小凝集物或含有很多微小凝集物时,优选在流动方向的上游部加宽柱状物的设置间隔,优选按照在流动方向的下游部将在流动方向上游部无法捕获完全的小的微小凝集物的方式,与上游部相比、逐渐地缩窄设置间隔的配置。上游部的柱状物设置间隔从最初开始就很窄时,由于所捕获的微小凝集物而在除去机构中发生堵塞、有无法处理的可能性,或者将目标细胞等捕获而产生损失的可能性。
柱状物构造相对于流动方向配置成直线状时,有微小凝集物不会被捕获而直接原样地到达下游的可能性。因此,从本发明的捕获微小凝集物进行除去的目的出发,优选相对于流动方向、柱状物构造不配置成直线状。例如,柱状物相对于流动方向可以是每在流动方向上设置大致5~30个柱状物就偏移一列地配置,为了维持流动、效率良好地分离微小凝集物,优选是每在流动方向上设置10~20个柱状物就偏移一列地配置。
柱状物的设置间隔优选是细胞悬浮液中所含目标细胞(包含该目标细胞与载体物质的复合物)的大小以上。设置间隔小于目标细胞的大小时,由于将目标细胞(该目标细胞与载体物质的复合物)捕获到柱状物之间,因此会发生目标细胞的损失。
例如,由于一般来说血液中所含细胞的大小最大为30μm左右,因此若是为了进行以血液中的全部细胞为对象的分离时,则优选为其以上的大小,例如以红细胞、血小板的分离为目标,有必要将白细胞除去时等,可以设定为将这些细胞区分的大小即8μm以上的大小。
另外,还可以在预先使载体物质结合在细胞悬浮液中的目标细胞而制成复合物之后进行微小凝集物的除去。此时,由于将目标细胞(该目标细胞与载体物质的复合物)捕获到柱状物之间而产生目标细胞的损失,因而优选为该复合物的大小以上。具体地说,作为载体物质可举出标记有抗体等的珠粒等,并非限定于此,作为载体物质可以考虑任意的物质。
例如,使用30μm大小的载体物质制成与大致20μm大小的细胞的复合物时,柱状物的设置间隔优选为50μm以上。
另外,柱状物的设置间隔优选具有200μm以下的部分。微小凝集物中,由于还存在比较小的大小的物质,因此当使除去机构的柱状物设置间隔全部为200μm以上时,有可能不能将微小凝集物完全除去。但是,并无必要全部的柱状物设置间隔为200μm以下,也可根据目标设置其以上的设置间隔的柱状物构造。
如上所述,本发明的微小凝集物除去器件中,成为微小凝集物除去机构的微流路构造(本说明书中有时称作“第2微流路构造”)优选由以大于30μm的间隔设置的柱状物构成,另外优选由以200μm以下的间隔设置的柱状物构成。该微流路构造的柱状物设置间隔虽然取决于目标细胞(该目标细胞与载体物质的复合物)和除去的微小凝集物的大小,但以血液为对象、除去血液中的微小凝集物时,柱状物设置间隔例如设定为50μm~200μm即可、更优选设定为70μm~170μm、进一步优选设定为90μm~150μm。其中,该柱状物设置间隔在微流路构造中以2个以上不同的间隔设置柱状物时,是指平均的间隔。
另一方面,结合有目标细胞与载体物质的复合物与目标细胞相比,仅载体物质的大小增大。因此,在血液中形成该复合物时,为了将血液中的微小凝集物除去且将该复合物回收(防止堵塞),优选柱状物设置间隔仅扩大载体物质的大小。例如,使用直径为30~50μm的载体物质时,柱状物设置间隔例如设定为80μm~250μm即可、更优选设定为100μm~230μm、进一步优选设定为120μm~220μm。
微小凝集物除去器件中,如上所述,还可设置多个微流路构造部分。通过设置多个微流路构造部分,微小凝集物的除去效率提高,但从目标细胞(该目标细胞与载体物质的复合物)的回收效率或简化器件构造的方面出发,优选设置2个微流路构造部分。
设置2个微流路构造部分时,优选在其中间设置缩窄流动宽度的部分(图13)。该部分比微流路构造部分窄,且未设置柱状物。该部分上聚集了通过最初的微流路构造部分(构造部α)的微小凝集物,流向接下来的微流路构造部分(构造部β)(图13、图20a)。通过设置这种缩窄流动宽度的部分,可以效率良好地将微小凝集物除去。
如上所述设置2个以上的微流路构造部分时,在微小凝集物除去器件中,将排出目标细胞的下游部侧的微流路构造部分(构造部β)的柱状物设置间隔如上所述设定为80μm~250μm即可,优选设定为100μm~230μm,更优选设定为120μm~220μm。进而,通过将导入含目标细胞的溶液的上游部侧的微流路构造部分(构造部α)的柱状物设置间隔与下游部侧的微流路构造部分(构造部β)同等地设定、或者设定为更宽,可以提高微小凝集物的除去效率、防止因微小凝集物导致的堵塞,同时可以进行较多试样的处理。
进而,本发明的一个方式为具备具有上述微流路构造的除去机构的微小凝集物除去器件,在微流路的前方可以具有试样导入口、在微流路的后方可以具有试样排出口。
3-2.本发明的微小凝集物除去器件的具体例
图12为说明本发明一个实施方式的微小凝集物除去器件的示意图。
以下通过俯视图说明微小凝集物除去器件130的微流路的基本构造。首先,作为试样的入口构造具备样品导入口131、作为流体的出口构造具备样品排出口132,在样品导入口131及样品排出口132之间连续地设有用于除去微小凝集物的微流路的基本构造110(微小凝集物除去机构)。该微流路的基本构造如上所述,例如可以设置2个微流路构造部分(图13)。
图14为本发明实施方式的微小凝集物除去器件的垂直方向截面的示意图。微小凝集物除去器件130由微流路的基本构造110构成、具备各个导入口131、排出口132等形状的微流路构造部141与平面构造部142的接合而制作,在其空间中具有流路空间143。另外,通过在各个导入口131、排出口132部分适当地接合送液用的管子或设置与注射器等的接合部,还可以适当加以变更后使用。进而,就导入口131、排出口132而言,只要是能够进行试样的导入、回收排出液的构造则无特别限定,还可以在处理马上开始前或之后具备能够分级的机构等。
微流路构造部141的流路构造(例如柱状物的配置)可以适当选择公知的方法来制作。作为流路构造部的构件的材料,例如可以使用玻璃、有机硅、二甲基聚硅氧烷、塑料等。另外,对于平面构造部142而言,只要是平坦且能够与流路构造部141接合的材料,则无特别限定,优选使用具有强度的玻璃、塑料等。另外,为透明的构件时,则流路内部的观察容易,能够把握微小凝集物的除去或目标细胞损失的有无,因而优选。
另外,本发明的微小凝集物除去器件130可以是分别具备微流路的基本构造110、导入口131及排出口132等形状、形成微流路的流路空间143的构造,例如在图示的平面构造部142一侧的构件中分别具备基本构造110及导入口131、排出口132等形状的构造。
本发明的微小凝集物除去器件130可以单独使用,但通过使用排出口132所具备的送液用管子等连接于任意的细胞分离器件,可以作为连续的系统进行使用,也可根据目标选择使用方法。
3-3.一体型的细胞分离器件
图15为说明表示本发明的又一实施方式的一体型的微细胞分离器件150的示意图。如上所述,本发明的微小凝集物除去器件可作为连接于细胞分离器件而连续的系统进行使用。此时,从使用的简便性或制造成本的观点出发,优选作为将微小凝集物除去器件和细胞分离器件制成一体而具备的细胞分离器件来进行使用。另外,由于还能够减少连接中使用的管内的试样损失,因而也可根据需要制成一体型的器件。
另外,该细胞分离器件优选是根据进行分离的细胞的尺寸进行分级(尺寸分级)的分离机构。通过将试样中的微小凝集物除去,由于可以去除对分级的影响,因而可以最大限度地发挥分离机构的效果、提高分离精度。作为利用尺寸分级进行的分离机构,例如可举出基于dld原理的细胞分离器件。基于dld原理的细胞分离器件可以利用上述的方法制造。进而,该一体型的细胞分离器件中,如上所述,优选是在具备2个分别的微流路构造部分的微小凝集物除去器件的后方连接有基于dld原理的细胞分离器件的一体型细胞分离器件(图20a及图20b)。如图20a那样的一体型细胞分离器件中,将缓冲液从缓冲液导入口32导入,流过微小凝集物除去机构(构造部α、β)的外侧、与除去了微小凝集物的细胞悬浮液合流,流入细胞分离机构(细胞分离部分)中。即,图20a的方式中,从缓冲液导入口32导入的缓冲液不会被导入至微小凝集物除去机构。
4.本发明的除去微小凝集物的方法
本发明的除去微小凝集物的方法如上所述,是在连续的液体的流动中从血液等细胞悬浮液(试样)中除去微小凝集物的方法。其中,作为细胞悬浮液(试样)并无特别限定,例如可以示例血液、淋巴液、唾液、尿、泪等体液。这些可以直接使用,也可利用任意的缓冲液液进行稀释。另外,就所使用的缓冲液而言,可以根据成为对象的细胞悬浮液(试样)、进行分离的目标细胞、所含的微小凝集物适当选择后使用。作为缓冲液,为了避免对细胞的影响,可以使用1种或组合使用多种等渗液,例如使用生理盐水、pbs等即可。
本发明中被除去的微小凝集物也包含在培养细胞的悬浮液等中,但本发明的除去微小凝集物的方法特别是在作为细胞悬浮液(试样)使用血液时是优选的。血液中的微小凝集物来自于纤维蛋白、其他变性蛋白、脂肪等凝集而成者,由于特别地具有粘性,因而易于被除去机构的柱状物构造捕获,由于一旦被柱状物构造捕获之后就很少会脱离而流出至流动方向的下游,因而在本发明的方法中作为成为对象的试样是优选的。
本发明的第一方式是从含有目标细胞和微小凝集物的细胞悬浮液中、在连续的液体的流动中将微小凝集物除去的方法,其具备以下工序:向具备微流路构造(微小凝集物除去机构)的微小凝集物除去器件流入细胞悬浮液或细胞悬浮液与缓冲液的混合液,使其通过微小凝集物除去器件的微流路中,捕获微小凝集物。其中,还可在捕获微小凝集物的工序之后设置将目标细胞回收的工序。
本发明中,在上述本发明的微小凝集物除去器件中添加细胞悬浮液及缓冲液。此时,也可预先流入缓冲液、之后添加细胞悬浮液,还可将细胞悬浮液混合在缓冲液中进行稀释之后再添加。进而,如上所述,本发明的除去方法中,通过捕获微小凝集物的工序,将细胞悬浮液中的微小凝集物捕获、除去,将含目标细胞的细胞悬浮液从除去器件的排出口回收。另外,当除去器件的排出口具备送液用的管子等时,通过管子等将其回收。另外,如上所述,使其连接于细胞分离器件而制成连续的系统时(包含一体型的细胞分离器件),除去微小凝集物而回收的细胞悬浮液之后进行细胞的分离。其中,相对于缓冲液的细胞悬浮液的量并无特别限定,对于流过细胞悬浮液的速度也无特别限定。对于该流速而言,通过在本发明的微小凝集物除去器件的导入口或排出口的任一者或两者上设置泵等,可以适当地调整速度。
本发明的方法是从血液等含有细胞的细胞悬浮液中精度良好地分取所含目标细胞时的前处理中所使用的方法,通过不损失试样中的目标细胞且精度良好地除去试样中的微小凝集物,在之后的细胞分离中可以更为精度良好地将目标细胞分取。
本发明的另一方式中,在本发明的从血液中除去微小凝集物的方法中,包含添加抗血液凝固试剂的方式。血液中除了已经存在微小凝集物之外,在处理血液的过程中还有新生成微小凝集物的可能性。因而,通过上述本发明的方法,虽然可以将已经存在的微小凝集物除去,但为了防止在处理血液中新生成微小凝集物,优选在该稀释缓冲液的组成中添加抗血液凝固试剂。进而,通过添加抗血液凝固试剂,利用本发明的除去微小凝集物的方法,可以优选地将除去了微小凝集物的血液用于之后的血液检查、各种处理(包含血液成分的分离等)。
作为抗血液凝固试剂,可以示例柠檬酸钠、edta、肝素等,其中优选使用凝血酶抑制剂,更优选使用ppack等试剂。
柠檬酸钠、edta等阻碍钙离子、间接地阻碍血液凝固作用,但直接阻碍作为凝固因子的凝血酶更为有效。另外,作为凝血酶抑制剂,肝素仅阻碍游离凝血酶,但ppack(c21h31cln6o3·2hcl)[1-(2-amino-3-phenylpropanoyl)-n-[1-chloro-6-(diaminomethylideneamino)-2-oxohexan-3-yl]pyrrolidine-2-carboxamide](1-(2-氨基-3-苯丙酰基)-n-[1-氯-6-(二氨基甲叉氨基)-2-氧己烷-3-基]吡咯烷-2-甲酰胺)由于作用于游离凝血酶、结合凝血酶这两者,因为更为有效。
本发明的除去方法是将血液中已经存在的微小凝集物除去,其特征在于,通过并用ppack等凝血酶抑制剂,可以在抑制新生成血液中的微小凝集物的同时、将血液中已经存在的微小凝集物除去。
本发明中,通过将具有上述微流路构造的微小凝集物除去器件与含有凝血酶抑制剂的稀释缓冲液液并用,在本发明的微小凝集物除去器件及任意选择性连接的细胞分离装置的使用时,可以优选地消除微小凝集物的堵塞。结果,通过本发明的使用微小凝集物除去器件的除去方法,可以进行有效且连续的微小凝集物的除去及细胞成分的分离。
以上对本发明的实施方式进行了详述,但实际上并非限定于上述实施方式,只要未脱离本发明主旨的范围的变更则也包含在本发明中。
实施例
以下示出实施例详细地说明本实施方式。但实际上,本实施方式并非限定于下述实施例。
1.细胞分离的实施例
(1)实施例中使用的细胞分离器件
本实施例中,以血液中的肿瘤细胞的分离为目的。因此,作为对象捕获分子,使用担载有抗体的30μm的珠粒。进而,制作具备具有基于确定性侧向位移法的原理、使用二甲基聚硅氧烷(pdms)、以粒径40μm作为分离阈值dc而设定的dld微流路构造的基本构造(分离区域)的细胞分离器件。
具体地说,细胞分离器件具有如下的基本构造:
g≈2.62057dc式3
由将dc=40μm代入到上述式3获得的g=104.8μm,以间隔104.8μm排列直径为15μm的柱状物,另外,由作为优选分离条件的ε=tanθ=1/15,以每15段偏移1列地配置该柱状物(参照图1)。另外,流路空间的高度为50μm。
更具体地说,按照具有上述基本构造的方式,使用掩模制作抗蚀剂模之后,对二甲基聚硅氧烷(pdms)进行造型,制作以等间隔配置柱状物的pdms制流路,制成具有微柱状物构造的dld微流路的基本构造部36。进而,在该基本构造部36两端的一端上开孔,设置样品导入口31和缓冲液导入口32,在另一端上设置第一排出口33和第二排出口34。进而,使其接合于玻璃的基板37,在基本构造部与基板的空间中形成流路空间35。进而,在样品导入口31和缓冲液导入口32以及第一排出口33和第二排出口34上安装管子,制作细胞分离装置。在实施例1~3中使用该细胞分离装置。
实施例4中,除了具备以粒径10μm作为分离阈值而设定的构造部a(60a)、及以粒径40μm作为分离阈值而设定的构造部b(60b)的基本构造之外,制作具有同样构成的细胞分离器件进行使用。
(2)细胞是否分离的评价
实施例的细胞分离在显微镜试样台上进行,利用目视确认是否分离。具体地说,从缓冲液流路口以100μl/min流入pbs,从试样流入口以100μl/min流过细胞悬浮液10分钟。分选后,利用透射型光学显微镜及荧光显微镜观察所回收的试样。
(实施例1)
图8为用于说明本实施例的图。本实施例以分离混入到全血中的人乳腺癌来源细胞(mcf-7)为目的来进行。首先,将人乳腺癌来源细胞(dspharmabiomedical)51添加到用pbs缓冲液稀释过的正常全血内,制成试样样品。对该试样样品,添加担载有作为对象捕获分子的针对人epcam的单克隆抗体(抗epcam抗体)的粒径为30μm的抗epcam抗体标记珠粒(cd326(epcam),human,pluribeads、s-beads:pluriselect)55,一边在室温下搅拌一边孵育,获得样品50。预先用pbs充满以粒径40μm作为分离阈值设定的上述细胞分离器件30,以100μl/min的速度使用注射器泵将反应后的样品50送液至样品导入口31。另外,同时以100μl/min的速度将pbs送液至缓冲液导入口32。对于所回收的试样的显微镜观察而言,除了利用透射型光学显微镜进行形态观察之外,为了进行利用细胞性质进行的区别,在利用用于对癌细胞及白细胞进行染色的有核细胞染色试剂(hoechst33342solution:takara-bio)实施染色、利用用于对癌细胞进行染色的抗细胞角蛋白抗体(anti-pancytokeratin抗体[pck-26](fitc):abcam)实施染色、及利用对白细胞进行染色的抗cd45抗体(anti-cd45-apc,mono(ml2):funakoshi)实施染色之后,进行利用荧光显微镜的观察、确认。
结果确认到,全血中的成分中,白细胞52、红细胞53、血小板54等从第二排出口34被回收。另外,与抗epcam抗体标记珠粒55形成了复合物5的人乳腺癌来源细胞51选择性地从第一排出口33被排出。本实施例中如上所述,利用显微镜确认了能够将与抗epcam抗体标记珠粒55形成了复合物5的人乳腺癌来源细胞51选择性地分离(图8)。
(实施例2)
与实施例1同样,代替人乳腺癌来源细胞(mcf-7)而使用将人前列腺癌来源细胞(lncap)(dspharmabiomedical)添加到正常全血中的样品,同样地实施,结果确认到,全血中的成分中,白细胞、红细胞、血小板等从第二排出口被回收。另外,与抗epcam抗体标记珠粒形成了复合物的人前列腺癌来源细胞从第一排出口被选择性地排出。本实施例中如上所述,利用显微镜确认了能够将与抗epcam抗体标记珠粒55形成了复合物5的人前列腺癌来源细胞选择性地分离。
(实施例3)
与实施例1及2同样,代替在正常全血中添加了人来源癌细胞的样品而使用患癌患者来源的血液,同样地实施,结果利用显微镜确认了可以精度良好地将表达epcam的上皮系肿瘤细胞分离。
(比较例1)
作为比较例,使用细胞分离器件尝试对不使用抗epcam抗体标记珠粒的经稀释的患癌患者来源血液进行分离时,未能进行尺寸部分重叠的白细胞与上皮系肿瘤细胞的分离。
(实施例4)
已知存在于患癌患者血液中的上皮系肿瘤细胞中存在epcam的表达弱的细胞群。因此,在使用了抗epcam抗体标记珠粒的手法中,有目标上皮系肿瘤细胞逃掉的顾虑。因此,尝试更高精度地对患癌患者血液中存在的上皮系肿瘤细胞进行分离。图9为用于说明本实施例的图。
首先,利用氯化铵处理进行溶血处理,对除去了红细胞的患癌患者血液添加担载有作为对象捕获分子的针对人cd45的单克隆抗体(抗cd45抗体)的粒径为30μm的抗cd45抗体标记珠粒(pluriselect:cd45,human,pluribeads、s-beads)62,一边在室温下搅拌一边进行孵育,获得样品50。预先用pbs充满具备以粒径10μm作为分离阈值而设定的构造部a(60a)及以粒径40μm作为分离阈值而设定的构造部b(60b)的构造的细胞分离器件30,以100μl/min的速度、使用注射器泵将反应后的样品送液至样品导入口31。另外,同时以100μl/min的速度将pbs送液至缓冲液导入口32。
作为其结果,首先确认到利用构造部a(60a)将全血中的成分中小于10μm的大小的血小板54及细胞残渣从排出口a(a)回收。另外确认到,利用构造部b(60b)将粒径大于40μm的白细胞52及与抗cd45抗体标记珠粒62的复合物5从排出口b(b)被回收。进而,利用显微镜确认了粒径小于40μm的上皮系肿瘤细胞61自排出口c(c)被回收。
2.微小凝集物除去的实施例
本实施例中,以正常人全血[cosmobio株式会社制]作为试样,以试样中所含微小凝集物的除去为目的。
(实施例5)
图16为用于说明本发明实施例的示意图。以下,通过俯视图对实施例中使用的具有微小凝集物除去器件160的微流路构造的除去机构的构造进行说明。微小凝集物除去器件的微小凝集物除去机构具有图16所示的柱状物构造[柱状物直径:15μm、柱状物间隔:60μm、柱状物相对于流动方向每15段偏移1列地配置、流路深度:50μm]。
更具体地说,按照具有上述微流路构造的方式,使用掩模制作抗蚀剂模之后,对二甲基聚硅氧烷(pdms)进行造型,制作以等间隔配置柱状物的pdms制流路,制成具有图14的示意图所示的柱状物构造的基本构造部141。进而,在该基本构造部141上开孔、设置导入口31和排出口132。进而,使其接合于由玻璃基材形成的平面构造部142上,在基本构造部与基板的空间中形成流路空间143。进而,在导入口131和排出口132上安装管子,制作微小凝集物除去器件。在实施例中使用该微小凝集物除去器件。
微小凝集物除去的方式为从倒置显微镜台上以目视及图像进行观察,或拍摄成动画。具体地说,事先向上述微小凝集物除去器件的导入口通入含0.05%tween的pbs缓冲液,从流路中将气泡除去之后,利用注射器泵以20μl/min的恒定速度对1ml的用含0.05%tween的pbs缓冲液对上述血液稀释了2倍的液体进行处理。
结果,如图17a~图17e所示,观察到在微小凝集物除去器件内捕获微小凝集物的样子。确认到在导入口附近捕获了很多微小凝集物(图17a),随着接近排出口、微小凝集物有所减少(图17b),在排出口附近没有微小凝集物(图17c)。另外,在倒置显微镜下比较观察通过该微小凝集物除去器件前后的的试样。确认到在通过器件之前存在有微小凝集物(图17d),但通过器件处理之后、微小凝集物被除去(图17e)。
(比较例2)
与上述实施例5所记载的方法同样操作,使用仅使柱状物间隔为10μm所制作的微小凝集物除去器件,同样地进行试样的处理。结果观察到如下样子:除了微小凝集物以外,在柱状物间还堆积了白细胞等大型的细胞。
另外,在对1ml的总量进行处理结束之前,器件内发生了堵塞,未能进行总量的处理。
(实施例6~10)及(比较例3)
与实施例5同样,制作柱状物的间隔(间隙)分别为50μm、60μm、100μm、150μm及200μm的微小凝集物除去器件(分别为实施例2~6)。另外作为比较例2,制作柱状物间隔为60μm但柱状物的配置为一直线的器件。进而,对于如上制备的血液试样,将模仿了大细胞的直径为30μm的珠粒添加到试样中,利用与实施例1相同的方法,使其通过各个器件,将其结果示于表1。将微小凝集物(异物)能够除去的情况标记为◎、大致能够除去的情况标记为○、能够除去一部分的情况标记为△,另外,将有珠粒损失(堵塞)的情况标记为×、没有损失(堵塞)的情况标记为○。
表1
(实施例11)
使用按顺序串联地连接有实施例10(间隙宽:200μm)、实施例8(间隙宽:100μm)、实施例7(间隙宽:60μm)中使用的微小凝集物除去器件的构造的微小凝集物除去器件,对上述的血液试样进行处理,结果是,从1ml以上的血液试样中没有珠粒损失地除去了微小凝集物。
(实施例12)
首先,在实施例11中使用的微小凝集物除去器件的排出口上连接以分离阈值30μm的dld为分离原理的分离器件的样品导入口,制成一体型的细胞分离器件。预先用含1%bsa、5mmedta的pbs缓冲液充满该一体型的细胞分离器件。接着,向该一体型的细胞分离器件中,作为血液稀释缓冲液使用利用含1%bsa、5mmedta的pbs将血液稀释2倍、并添加了最终浓度为80μm的ppack的液体,将添加了模仿细胞的直径为30μm的珠粒的试样从微小凝集物除去器件的导入口流入。另外,从分离器件的缓冲液导入口流入缓冲液(含1%bsa、5mmedta的pbs)。结果如图18a所示,完全没有分离器件的堵塞,且如图18b的虚线包围的部分所示、可以将30μm的珠粒分离。
其中,以分离阈值30μm的dld为分离原理的分离器件如下制作。根据上述确定性侧向位移法(dld)的原理,使用二甲基聚硅氧烷(pdms),制作具备具有以粒径30μm作为分离阈值dc而设定的dld微流路构造的基本构造(分离机构)的细胞分离器件。
具体地说,该细胞分离器件具有如下的基本构造:
g≈2.62057dc式3
由将dc=30μm代入到上述式3获得的g=78.6μm,以间隔78.6μm排列直径为15μm的柱状物,另外,由作为优选分离条件的ε=tanθ=1/15,每15段偏移1列地配置该柱状物。另外,流路空间的高度为50μm。
具体地说,按照具有上述基本构造的方式,使用掩模制作抗蚀剂模之后,对二甲基聚硅氧烷(pdms)进行造型,制作以等间隔配置柱状物的pdms制流路,制成具有微柱状物构造的dld微流路的基本构造部。
(比较例4)
作为血液稀释缓冲液使用含有1%bsa、5mmedta的pbs,不使对血液稀释了2倍的液体通过微小凝集物除去器件、而是直接通入上述分离器件时,如图19所示,在分离器件的上游部产生堵塞,未能进行分离。
3.一体型分离器件的实施例
(1)一体型分离器件的制作
首先,与上述实施例5同样,设计串联连接有2个微流路构造部分(构造部α:柱状物的间隔为200μm、构造部β:柱状物的间隔为150μm)的微小凝集物除去器件(图13)。其中,为了防止构造部α、构造部β外侧的侧面、流路端部处的堵塞,在距离流路壁面为80μm以内的部分未设置柱状物。另外,在构造部α、构造部β之间设置有缩窄流动宽度的部分。在具有该2个构造部分的微小凝集物除去器件上一体化设计以分离阈值30μm的dld为分离原理的分离器件,制作一体型的细胞分离器件(图20a和20b)。
(2)试样样品的制备
与上述实施例1同样,在正常人全血(cosmobio株式会社)中掺入人乳腺癌来源细胞株(mcf-7)(dspharmabiomedical),制备模拟癌症患者血液检体,作为试样样品。在该试样样品中添加担载有作为对象捕获分子的针对人epcam的单克隆抗体(抗epcam抗体)的粒径为30μm的抗epcam抗体珠粒(cd326(epcam)、human,pluribeads、s-beads:pluriselect),一边在室温下搅拌一边孵育,获得样品。利用含有1%bsa、5mmedta的pbs缓冲液将所得样品稀释2倍,按照最终浓度达到80μm的方式添加凝血酶抑制剂(ppack),将其作为样品溶液(图22、图24[分离前])。
(实施例13)
预先用含1%bsa、5mmedta的pbs缓冲液充满上述一体型细胞分离器件。然后,使用注射器泵将上述样品溶液以50μl/min的速度送液至样品导入口31。另外,同时以500μl/min的速度将含1%bsa、5mmedta的pbs缓冲液送液至缓冲液导入口32,从各个回收口(33、34)进行回收。
对所回收试样的显微镜观察而言,利用透射型光学显微镜进行形态观察。另外。为了进行利用细胞性质进行的区别,在利用用于对癌细胞及白细胞进行染色的有核细胞染色试剂(hoechst33342solution:takara-bio)实施染色、利用用于对癌细胞进行染色的抗细胞角蛋白抗体(anti-pancytokeratin抗体[pck-26](fitc):abcam)实施染色、及利用对白细胞进行染色的抗cd45抗体(anti-cd45-apc,mono(ml2):funakoshi)实施染色之后,进行利用荧光显微镜的观察、确认。将一体型细胞分离器件的分离构造部的放大示于图23b中。
结果确认到,在器件内未发生堵塞,全血中的成分中,白细胞、红细胞、血小板等从第二排出口(34)被回收(图23a、图24[其他的血细胞])。另外,与抗epcam抗体标记珠粒形成了复合物的人乳腺癌来源细胞(mcf-7)从第一排出口(33)被选择性地排出(图23c和图23d、图24[目标细胞])。本实施例中如上所述,利用显微镜下的评价及目视确认到能够将与抗epcam抗体标记珠粒形成了复合物的人乳腺癌来源细胞(mcf-7)选择性地分离。
(实施例14)
与上述实施例13同样,代替人乳腺癌来源细胞(mcf-7)而使用在正常全血中添加了人前列腺癌来源细胞(lncap)(dspharmabiomedical)的样品,同样地实施,结果确认到,全血中的成分中,白细胞、红细胞、血小板等从第二排出口(34)被回收。另外,与抗epcam抗体标记珠粒形成了复合物的人前列腺癌来源细胞从第一排出口(33)被选择性地排出。本实施例中如上所述,利用显微镜下的评价确认到能够将与抗epcam抗体标记珠粒形成了复合物的人前列腺癌来源细胞选择性地分离。
(实施例15)
与上述实施例13同样,代替在正常全血中添加了人来源癌细胞的样品而使用患癌患者来源的血液,同样地实施,结果利用显微镜确认到能够精度良好地将表达epcam的上皮系肿瘤细胞分离。
(实施例16~18)
该实施例16中,在串联连接有2个微流路构造部分(构造部α:柱状物的间隔为200μm、构造部β:柱状物的间隔为200μm)的微小凝集物除去器件上连接以分离阈值30μm的dld为分离原理的分离构造部,制作一体型的细胞分离器件。进而,对于上述实施例13[人乳腺癌来源细胞(mcf-7)]、实施例14[人前列腺癌来源细胞(lncap)]及实施例15[患癌患者来源的血液]的样品,使用该一体型的细胞分离器件,同样地进行微小凝集物除去和细胞分离(实施例16~18)。结果确认到,任一情况下均未发生堵塞、能够将目标细胞分离。
(实施例19~21)
实施例19中,代替地在串联地连接有2个微流路构造部分(构造部α:柱状物的间隔为300μm、构造部β:柱状物的间隔为200μm)的微小凝集物除去器件上连接以分离阈值30μm的dld为分离原理的分离构造部,制作一体型的细胞分离器件。进而,对于上述实施例13[人乳腺癌来源细胞(mcf-7)]、实施例14[人前列腺癌来源细胞(lncap)]及实施例15[患癌患者来源的血液]的样品,使用该一体型的细胞分离器件,同样地将微小凝集物除去和进行细胞分离(实施例19~21)。结果确认到,任一情况下均未发生堵塞、能够将目标细胞分离。
(比较例5~7)
作为比较例5~7,制作不具有微小凝集物除去构造(微小凝集物除去器件)、仅具有以分离阈值30μm的dld为分离原理的分离构造部的细胞分离器件,对于上述实施例13~15中使用的样品,进行与实施例13~15相同的细胞分离。结果是,虽然可进行少量的样品的分离,但当增加溶液量时,在分离构造部产生了堵塞、未能进行接下来的分离。
产业上的可利用性
本发明的细胞分离方法、微小凝集物除去方法、具备微小凝集物除去部分和细胞分离部分的器件可以用于研究用途、诊断用途、药品的制造等中的细胞分离、纯化。
符号说明
1细胞悬浮液
2目标细胞
3目标外细胞
4混合液
5复合物
10对象捕获分子
11担载对象捕获分子的物质
12对象捕获物质
20dld微流路的基本构造
21障碍物构造
22一定大小以上的粒子
23小于一定大小的粒子
30具备dld微流路的细胞分离器件
31样品导入口
32缓冲液导入口
33第一排出口
34第二排出口
35流路空间
36流路构造部
37平面构造部
38隔壁
39分支部
40具备送液部和回收部的细胞分离装置
41样品送液部
42缓冲液送液部
43第一回收部
44第二回收部
50样品
51人乳腺癌来源细胞
52白细胞
53红细胞
54血小板
55抗epcam抗体标记珠粒
60a构造部a
60b构造部b
61上皮系肿瘤细胞
62抗cd45抗体标记珠粒
a排出口a
b排出口b
c排出口c
110基本构造
111构造物
112微小凝集物
121柱状物构造部
130微小凝集物除去器件
131导入口
132排出口
141流路构造部
142平面构造部
143流路空間
150具备微小凝集物除去构造的细胞分离器件
151微小凝集物除去机构
152细胞分离机构
160实施例中使用的微小凝集物除去器件
- 还没有人留言评论。精彩留言会获得点赞!