用于心肌组织再生的三维结构及其制备方法与流程
本发明涉及一种用于再生心肌组织的三维构造及其制备方法。更具体地,本发明涉及一种用于再生心肌组织的三维构造的制备方法以及用于再生心肌组织的三维构造,所述方法包括:形成三维构造的步骤,该步骤通过打印并交联第一生物打印组合物和第二生物打印组合物以交替布置第一生物打印层和第二生物打印层,其中所述第一生物打印组合物包括含有脱细胞的胞外基质和交联剂的形成组织工程学构造的溶液和心脏祖细胞,所述第二生物打印组合物包括所述形成组织工程学构造的溶液、间充质干细胞和血管内皮生长因子;和通过热胶凝化所述交联的三维构造获得交联-胶凝化的三维构造的步骤。
背景技术:
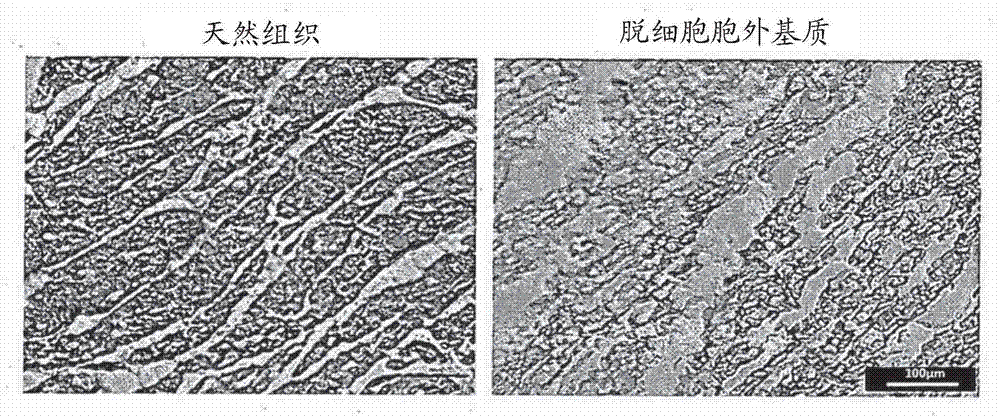
:三维打印意为将由复杂形状的组织或器官的医学数据获得的任意形状信息转换为g代码后,通过叠层方法来构建复杂的骨架结构。该三维打印也称作“三维生物打印(3d生物打印)”。例如,“多头组织和器官打印系统”是代表性的三维打印技术之一,它由两个气动喷射材料的气动注射器和两个采用步进马达以纳升为单位精确喷射的活塞型注射器组成,并且能同时使用多种材料。典型地,通过将热塑性生物可相容的聚合物连接到气动注射器来制备构造,其中热塑性生物可相容的聚合物诸如pla(聚乳酸)、pga(聚乙醇酸)、plga(聚乳酸-共-聚乙醇酸)、pcl(聚己内酯)或其混合物。进一步的,用具有水凝胶的活塞型注射器来制备三维构造,所述水凝胶由胶原蛋白、透明质酸、明胶、藻酸盐、壳聚糖或纤维蛋白等构成。因为生物打印需要含细胞的介质的分布,所以生物打印的一个重要方面是该打印工艺必须是细胞可相容的。这个限制因为需要在水性或水凝胶环境中实施因而减少了材料的选择。因此,已将使用诸如明胶、明胶/壳聚糖、明胶/藻酸盐、明胶/纤维蛋白、lutrolf127/藻酸盐、藻酸盐等材料的水凝胶用于制备从肝脏到骨骼的多种组织的生物打印。用于生物打印的水凝胶、或水凝胶和细胞的混合物等也称为“生物墨水”。通常,由于细胞不能维持或降解周围的藻酸盐凝胶基质,所以在整个孵育期间细胞特定地保持位于它们的初始位置上(fedorovich,n.e.等tissueeng.13,1905-1925(2007)。因此,虽然有一些对生物打印构造的生物打印的成功报道,但是最小限度的细胞材料相互作用(cell-materialinteractions)和劣质(inferior)组织形成是最重要的问题。确实,这些材料不能展示天然胞外基质(ecm)的复杂性,并且因此它们不足以复制具有典型细胞-细胞连接(cell-cellconnections)的微环境以及生物组织的三维(3d)细胞布局。因此,水凝胶中的细胞不能展示体内活组织的独特的形态学和功能。因此,理想的是给细胞提供类似于细胞亲本组织的天然微环境。对此,脱细胞的胞外基质(decm)是最好的选择,因为任何天然的或人造的材料不能复制所有的天然胞外基质特性。此外,每种组织的ecm在组成和拓扑学上是独特的,并且所述组成和解剖学特性是通过细胞和所处微环境间的动力学的和交互的相互作用产生的。近期对从组织和器官中分离的细胞和ecm的研究强调了对组织特异性的需要以保持选择的细胞功能和表型(sellaro,t.l.等tissueeng.parta16,1075-1082(2010);petersen,t.h.等science329,538-541(2010);uygun,b.e.等nat.med.16,814-821(2010);ott,h.c.等nat.med.16,927-933(2010);flynn,l.e.biomaterials31,4715-4724(2010))。由包括皮肤、小肠粘膜下层的多种组织收集的decm材料典型地被加工为二维(2d)支架(scaffold),并且在早期阶段,可透过的或接种的细胞依赖于氧和营养物的扩散而存活,直到建立起支持性血管网。然而,打印的组织类似物结构需要设计开放的多孔三维结构的制备方法以允许营养物的流动。本发明人已开发了一种用于用decm生物墨水打印装载细胞的结构的三维打印方法,所述decm生物墨水能提供适于三维结构组织生长的优化的微环境,并且所述装载细胞的结构能复制独特的细胞形态和功能(falgunipati,等,natcommun.5,3935(2014))。另一方面,局部缺血性心脏病在全球范围具有非常高的患病率,在整个单病种中是排名第一位的引起死亡的疾病。由于社会经济发展及西化的生活方式,韩国也正在经历局部缺血性心脏病患者的快速增加。此外,在严重的末期心脏衰竭患者中,除了心脏移植或机械左心室辅助装置外没有其他治疗方法。但存在诸如捐赠器官的缺乏、固定器官困难、高死亡率和昂贵的治疗费用等问题。期待利用干细胞多潜能性的治疗将根本上治疗受损组织的再生。近年来,已对心脏病治疗的有效性增加进行了多种研究,通过将成体干细胞与血管内皮细胞和其他基质细胞或各种水凝胶混合并注射,从而促进分化为心肌细胞并防止细胞从病灶分离。而且,已经通过用干细胞或干细胞和多种成体细胞来制备细胞膜片(cellsheets),活跃地开展了对刺激干细胞生物环境和使细胞间相互作用最大化的研究。技术实现要素:【技术问题】本发明的一种实施方式涉及一种用于再生心肌组织的三维构造的制备方法,所述方法包括:形成三维构造的步骤,该步骤通过打印并交联第一生物打印组合物和第二生物打印组合物以交替布置第一生物打印层和第二生物打印层,其中所述第一生物打印组合物包括含有脱细胞胞外基质和交联剂的形成组织工程学构造的溶液和心脏祖细胞,所述第二生物打印组合物包括所述形成组织工程学构造的溶液、间充质干细胞和血管内皮生长因子;和通过热胶凝化所述交联的三维构造获得交联-胶凝化的三维构造的步骤。本发明的另一实施方式涉及一种用于再生心肌组织的三维构造,所述三维构造通过交联并热胶凝化所述第一生物打印层和所述第二生物打印层而形成,其中所述第一生物打印层和所述第二生物打印层通过打印所述第一生物打印组合物和所述第二生物打印组合物来制备。【技术方案】本发明人已进行了多项研究以开发用于制备三维构造的方法,该方法实现了心肌组织的微环境。因此,本发明人已发现,当进行下述三维生物打印时,心肌组织的微环境能被有效实施,所述三维生物打印通过采用包括脱细胞的胞外基质和心脏祖细胞的生物打印组合物,以及包括脱细胞的胞外基质、间充质干细胞和血管上皮生长因子(vegf)的生物打印组合物的层叠工艺来交替进行。具体地,已发现,这种三维打印方法不仅等同地在所述构造中布置心脏祖细胞,而且在所述构造中实现由血管细胞组成的血管网,从而长期保持细胞活性并显著增强向心肌中的细胞转移有效性。因此,本发明的一个示例,涉及一种用于再生心肌组织的三维构造的制备方法,所述方法包括:(a)形成三维构造的步骤,该步骤通过打印并交联第一生物打印组合物和第二生物打印组合物以交替布置第一生物打印层和第二生物打印层,其中所述第一生物打印组合物包括含有脱细胞胞外基质和交联剂的形成组织工程学构造的溶液和心脏祖细胞,所述第二生物打印组合物包括所述形成组织工程学构造的溶液、间充质干细胞和血管内皮生长因子;和(b)通过热胶凝化所述交联的三维构造获得交联-胶凝化的三维构造的步骤。如上所述,通过采用包括脱细胞胞外基质和心脏祖细胞的第一生物打印组合物,以及包括脱细胞胞外基质、间充质干细胞和血管上皮生长因子(vegf)的第二生物打印组合物打印来交替进行层叠工艺而制备的所述三维构造具有显著增强向心肌中的细胞转移有效性的效果,因为通过不但等同地在所述构造中布置心脏祖细胞而且在所述构造中实现由血管细胞组成的血管网,心肌组织的微环境能被有效实现并且细胞活力能被长时间保持。所述脱细胞胞外基质可来源于心脏组织。具体来说,它可以通过对体外分离的心脏组织脱细胞而获得,并且可以通过对从人、猪、牛、兔、狗、山羊、绵羊、鸡、马等哺乳动物分离的组织脱细胞而获得,而且它可以通过优选从猪获得的组织、更优选从猪获得的心脏组织脱细胞而获得,但不限于此。可以使用或略微改变已知的方法来进行脱细胞,所说已知的方法例如,公开在ott,h.c.等nat.med.14,213-221(2008),和yang,z.等tissueeng.partcmethods16,865-876(2010)等中的方法。优选地,可使用本发明人报道的公开在falgunipati等,natcommun.5,3935(2014)中的脱细胞方法来实施。脱细胞的胞外基质可典型地以冻干粉的形式贮存。所用脱细胞的胞外基质的量没有特别限制,但例如,可以基于组合物的总重量以1~4wt%、1~3wt%、2~4wt%,优选2~3wt%的量来使用。例如:第一生物打印组合物中的脱细胞胞外基质可基于所述第一生物打印组合物的总重量以1~4wt%的量被包含;第二生物打印组合物中的脱细胞胞外基质可基于所述第二生物打印组合物的总重量以1~4wt%的量被包含。如果含量低,低于了上述范围,会出现材料不能层叠的问题,而如果含量高的话,会有被包封在其中的细胞被杀死的问题。心脏祖细胞和血管上皮细胞来源于包括人类的动物并且是可商购的,它们可以用已知方法被培养和增殖。心脏祖细胞在第一生物打印组合物中的含量可在105~108个细胞/ml、106~108个细胞/ml、105~5×107个细胞/ml的范围,优选106~~5×107个细胞/ml的范围。如果含量低,低于了上述范围,存在其功效低的问题,而如果含量高的话,存在三维形状不能保持的问题,因为脱细胞胞外基质不能被交联,即使覆盖细胞的生物墨水-脱细胞胞外基质是交联的。间充质干细胞在第二生物打印组合物中的含量可在105~108个细胞/ml、106~108个细胞/ml、105~5×107个细胞/ml的范围,优选106~5×107个细胞/ml的范围。如果含量低,低于了上述范围,存在其功效低的问题,而如果含量高的话,存在三维形状不能保持的问题,因为脱细胞胞外基质不能被交联,即使覆盖细胞的生物墨水-脱细胞胞外基质是交联的。此外,血管内皮生长因子在第二生物打印组合物中的含量可在50~1000ng/ml、50~900ng/ml、50~800ng/ml、50~700ng/ml、50~600ng/ml、50~500ng/ml、50~400ng/ml、50~300ng/ml、50~200ng/ml、100~1000ng/ml、100~900ng/ml、100~800ng/ml、100~700ng/ml、100~600ng/ml、100~500ng/ml、100~400ng/ml、100~300ng/ml的范围内,优选100~200ng/ml的范围内。如果含量低,低于了上述范围,存在其功效低的问题,而如果含量高的话,存在由于过度的血管生成造成的问题。优选,所述第一生物打印组合物和所述第二生物打印组合物具有ph在6.5~7.5范围内的粘弹性均质溶液的形式。因此,形成组织工程学构造的溶液可进一步包括酸;蛋白酶;和ph控制剂。所述酸、蛋白酶和ph控制剂可被包含在水性介质中,但不限于此。此外,所述酸可为选自由乙酸和盐酸所组成的组中的一种或多种,但不限于此。所述酸行使溶解脱细胞胞外基质的功能,并优选乙酸、盐酸等,更优选可以0.01~10m、0.01~9m、0.01~8m、0.01~7m、0.01~6m、0.01~5m、0.01~4m、0.01~3m、0.01~2m、0.01~1m、0.1~10m、0.1~9m、0.1~8m、0.1~7m、0.1~6m、0.1~5m、0.1~4m、0.1~3m、0.1~2m、0.1~1m的乙酸水溶液的形式使用,例如大约0.5m的乙酸水溶液,或者可以0.01~10m、0.01~9m、0.01~8m、0.01~7m、0.01~6m、0.01~5m、0.01~4m、0.01~3m、0.01~2m、0.01~1m、0.01~0.1m的盐酸水溶液的形式使用,例如大约0.01m的盐酸水溶液。蛋白酶行使对脱细胞胞外基质的端肽消化的功能,并且可为选自由胃蛋白酶和基质金属蛋白酶所组成组中的一种或多种,但不限于此。所用蛋白酶的量取决于脱细胞胞外基质的量的不同而不同,但基于100mg的脱细胞胞外基质可以5~30mg、5~25mg、10~30mg、优选10~25mg的比例使用。ph控制剂用于通过中和用来溶解脱细胞胞外基质的酸从而将组合物的ph值控制在ph6.5~7.5、ph6.6~7.4、ph6.7~7.3、ph6.8~7.2、ph6.9~7.1、优选ph7,例如它可以是氢氧化钠,但不限于此。在一个实施方式中,第一生物打印组合物和第二生物打印组合物各自独立地进一步包括:以各自组合物的总重量计,0.03~30wt%的一种或多种选自由乙酸和盐酸所组成组中的酸;0.1~0.4wt%的一种或多种选自由胃蛋白酶和基质金属蛋白酶所组成组中的蛋白酶;以及ph控制剂。第一生物打印组合物和第二生物打印组合物各自独立地、分别额外地包括选自由细胞、生长因子和酶所组成组中的一种或多种。所述细胞可为选自由内皮祖细胞、内皮细胞和心肌细胞所组成组中的一种或多种。所述生长因子可为选自由纤维母细胞生长因子(fgf)、血小板源生长因子(pdgf)、血管生成素-1、转化生长因子β(tgf-β)、红细胞生成素(epo)、干细胞因子(scf)、表皮生长因子(egf)和集落刺激因子(csf)所组成组中的一种或多种。所述酶可为选自由基质金属蛋白酶(mmp)和基质金属蛋白酶组织抑制剂(timp)所组成组中的一种或多种。在一个实例中,第一生物打印组合物和第二生物打印组合物,各自独立地,可额外包括:选自由内皮祖细胞、内皮细胞和心肌细胞所组成的细胞组中的一种或两种;和选自由纤维母细胞生长因子(fgf)、血小板源生长因子(pdgf)、血管生成素-1、转化生长因子β(tgf-β)、红细胞生成素(epo)、干细胞因子(scf)、表皮生长因子(egf)和集落刺激因子(csf)所组成的生长因子组中的一种或多种生长因子。此外,进一步包括一种或多种细胞和一种或多种生长因子的所述第一生物打印组合物和所述第二生物打印组合物,各自独立地,可进一步额外包括:选自由基质金属蛋白酶(mmp)和基质金属蛋白酶组织抑制剂(timp)所组成的酶组中的一种或多种酶。所述生长因子可以内皮细胞生长补充剂(ecgs)的形式被包含,但不限于此。优选地,第一生物打印组合物和第二生物打印组合物是当剪切速率增加时粘度降低的粘弹性材料,并且例如优选地,在剪切速率为1s-1时,在大约15℃下测量的粘度在1~30pa·s的范围内。所述粘度可以通过适当控制水性介质(例如,水、蒸馏水、pbs、生理盐水溶液等)的量而被控制。交替用第一生物打印组合物和第二生物打印组合物的打印可采用已知的三维打印方法(例如,使用‘多头组织和器官打印系统’的打印方法)来进行,根据公开在falgunipati等,natcommun.5,3935(2014)等中的方法,例如可使用多头组织和器官打印系统的双注射器来执行。也就是说,聚己内酯(pcl)骨架被装载到注射器中,并加热到约80℃以使聚合物熔化。上述预凝胶型三维打印组合物被装载到另一个注射器中,温度保持在约15℃之下,优选约4~10℃。气动压力在400~650kpa的范围被施加以制备pcl骨架。预凝胶形式的组合物用活塞型低剂量分配系统喷出。此外,交替用第一生物打印组合物和第二生物打印组合物的打印,可在没有聚己内酯骨架的情况下,用活塞型低剂量分配系统通过仅喷射预凝胶形式的组合物来执行。在一个实施方式中,交替用第一生物打印组合物和第二生物打印组合物的层叠体可层叠所述第一生物打印组合物和所述第二生物打印组合物以使其彼此具有一定的交叉角度。此外,第一生物打印组合物和第二生物打印组合物可以纤维、带或织物的形式打印。作为一个实例,第一生物打印组合物和第二生物打印组合物可分别以纤维的形式打印在一层上,并且该层可以是第一生物打印组合物打印的纤维和第二生物打印组合物打印的纤维彼此间隔以单一方向纤维的形式制备的层,而另一层可被层叠以与该层具有一定的交叉角度。即,可以是以0度方向堆叠一层和以90度方向堆叠一层从而被层叠的结构,该层叠形式的一个例子如图3所示。在一个实施方式中,所示交联剂可为核黄素。所述核黄素可基于所述第一生物打印组合物和第二生物打印组合物以0.001~0.1wt%的量,优选0.01~0.1wt%的量被包含。建立该范围的原因是其显示了与心脏组织类似的机械性能的效果。此外,各叠层工艺可通过在uva下打印和交联来进行。通过重复地在uva下进行打印和交联,即进行叠层工艺,来形成三维构造形状。在使用核黄素作为交联剂在uva下进行三维打印和交联来执行叠层工艺从而构建三维构造形状之后,通过热胶凝化所获得的三维构造形状从而制备的三维构造具有一致高机械强度的效果。在uva下的交联采用315~400nm、325~390nm、335~380nm、345~370nm、355~365nm,优选约360nm波长的uva。此外,在uva下的交联可进行1~10分钟、1~9分钟、1~8分钟、1~7分钟、1~6分钟、1~5分钟、1~4分钟、2~10分钟、2~9分钟、2~8分钟、2~7分钟、2~6分钟、2~5分钟、2~4分钟,优选约3分钟。也就是说,揭示了具有一致高机械强度的三维构造能够通过包括使用本发明的核黄素来交联-热胶凝化来制备。因此,不仅通过使用核黄素的交联-热胶凝化能够提供高机械强度,而且可以避免由印刷后交联造成的问题,其中印刷后交联需要使用有毒的诸如戊二醛的交联剂,并引起能够避免三维构造中的不均匀交联。因此,所述三维构造可具有在1rad/s下1~100kpa、1~90kpa、1~80kpa、1~70kpa、1~60kpa、1~50kpa、1~40kpa、1~30kpa、1~20kpa,例如10.58kpa的模量。建立上述范围是因为具有用类似心肌的机械强度来刺激周围环境的效果。在一个实施方式中,所述第一生物打印组合物和第二生物打印组合物可进一步包括基于各组合物的总重量,0.001~0.1wt%的核黄素;0.03~30wt%的一种或多种选自由乙酸和盐酸所组成组的酸;0.1~0.4wt%的一种或多种选自由胃蛋白酶和基质金属蛋白酶(mmp)所组成组的蛋白酶;和ph控制剂。通过以上实施方式制备的所述第一生物打印组合物和第二生物打印组合物,可通过包括以下步骤的制备方法来制备:将脱细胞胞外基质加入选自由乙酸和盐酸所组成的组中的一种或多种酸的溶液中的步骤;加入一种或多种选自由胃蛋白酶和基质金属蛋白酶所组成组的蛋白酶的步骤;和加入核黄素、ph控制剂和心脏祖细胞(在第一生物打印组合物的情况下)的步骤,或加入核黄素、ph控制剂、间充质干细胞和血管内皮生长因子(在第二生物打印组合物的情况下)的步骤。获得其中加入蛋白酶的溶液的步骤可通过在加入所述蛋白酶后搅拌来进行,并且所述搅拌可进行直到实现脱细胞胞外基质完全溶解,例如可典型地进行24~48小时,但不限于此。所述打印和交联可在15℃之下的温度下进行以防止胶凝,例如优选在4~15℃、优选4~10℃的低温下进行。此外,热胶凝化可在15℃之上进行,例如可在20℃和更高、25℃和更高,优选20~50℃、20~40℃、20~37℃、25~50℃、20~40℃,更优选25~37℃的温度下进行。通过所述方法制备的第一生物打印组合物和第二生物打印组合物为经ph-调节的预凝胶形式,优选在约4℃下冷藏。此外,热胶凝可在15℃之上进行,例如可在20℃和更高、25℃和更高,优选20~50℃、20~40℃、20~37℃、25~50℃、25~40℃,更优选25~37℃的温度下进行。建立上述范围是因为具有物理交联脱细胞胞外基质的效果。热胶凝可在孵育器(湿孵育器)中进行。进一步的,热胶凝可进行5~60分钟、10~50分钟、15~40分钟,优选20~30分钟。建立上述范围的原因是所述范围是引起物理交联反应所需要的。由上述方法制备的三维构造的厚度可依赖于要转移的细胞的量而被控制,它可具有的厚度为50~1000μm、50~900μm、50~800μm、50~700μm、50~600μm、50~500μm、100~1000μm、100~900μm、100~800μm、100~700μm、100~600μm、100~300μm、200~1000μm、200~900μm、200~800μm、200~700μm、200~600μm、200~500μm、300~1000μm、300~900μm、300~800μm、300~700μm、300~600μm、300~500μm、400~1000μm、400~900μm、400~800μm、400~700μm、400~600μm、400~500μm,例如500μm的厚度。本发明的制备方法不仅同等地在所述构造中布置心脏祖细胞,而且在所述构造中完成了由血管细胞构成的血管网,从而细胞的生存能力可被长时间保持,细胞向心肌的转移效率可被显著提高,心脏祖细胞被同等地布置在所述构造中的图如图9所示。本发明的另一实例涉及用于再生心肌组织的三维构造。所述用于再生心肌组织的三维构造,可包括一个或多个结构,其中通过打印和交联,所述第一生物打印组合物和所述第二生物打印组合物交替层叠,其中所述第一生物打印组合物包括含有脱细胞胞外基质和交联剂的形成组织工程学构造的溶液和心脏祖细胞,所述第二生物打印组合物包括所述形成组织工程学构造的溶液、间充质干细胞和血管内皮生长因子。与所述第一生物打印组合物、所述第二生物打印组合物、脱细胞胞外基质、心脏祖细胞和血管内皮生长因子相关的内容与以上描述相同。所述结构,其中通过打印和交联,所述第一生物打印组合物和所述第二生物打印组合物交替层叠,是所述第一生物打印组合物和所述第二生物打印组合物被层叠从而彼此具有一定的交叉角度的结构。此外,所述第一生物打印组合物和所述第二生物打印组合物可以纤维、带或织物的形式被打印。作为一个实例,第一生物打印组合物和第二生物打印组合物可分别以纤维的形式打印在一层上,并且该层可以是第一生物打印组合物打印的纤维和第二生物打印组合物打印的纤维彼此间隔以单一方向纤维的形式被制备的层,而另一层可被层叠以与该层具有一定的交叉角度。即,可以是以0度方向堆叠一层和以90度方向堆叠一层而被层叠的结构。每层被层叠一次的所述结构可具有约50μm的厚度。所述三维构造的厚度可依赖于要转移的细胞的量而被控制,它可具有的厚度为50~1000μm、50~900μm、50~800μm、50~700μm、50~600μm、50~500μm、100~1000μm、100~900μm、100~800μm、100~700μm、100~600μm、100~500μm、200~1000μm、200~900μm、200~800μm、200~700μm、200~600μm、200~500μm、300~1000μm、300~900μm、300~800μm、300~700μm、300~600μm、300~500μm、400~1000μm、400~900μm、400~800μm、400~700μm、400~600μm、400~500μm,例如500μm的厚度。【发明效果】本发明采用包括特定细胞(即心脏祖细胞和/或间充质干细胞和血管内皮生长因子(vegf))的生物打印组合物进行三维打印,从而有效实现了心肌组织的微环境。此外,本发明的制备方法不仅同等地在所述构造中布置心脏祖细胞,而且在所述构造中完成了由血管细胞构成的血管网,从而细胞的生存能力能长时间保持并且所述细胞向心肌的转移效率能显著提高。因此,本发明的制备方法能有效应用在用来治疗包括局部缺血性心脏病的多种心脏病的三维构造的制备中。附图说明图1是根据本发明的一个实施例,从心脏组织获得的脱细胞胞外基质(hdecm)的照片。图2是根据本发明的一个实施例,从心脏组织获得的脱细胞胞外基质(hdecm)的光学显微镜照片和组织染色照片。图3是根据本发明的一个实施例制备的三维构造模拟图。图4显示了根据本发明的一个实施例,采用pcl骨架制备的三维构造的形状的照片。图5是将根据本发明一个实施例制备的三维构造移植到大鼠心肌梗塞模型中,在构造移植之前和移植8周后的超声心动图的m-模式照片。图6是显示将根据本发明一个实施例制备的三维构造移植到大鼠心肌梗塞模型中,在构造移植之前和移植4周和8周后测定的数字形式的心脏功能的图。图7是在移植根据本发明一个实施例制备的三维构造之后,在8周后处死动物进行组织学分析的结果,是通过马松三色染色法观察的心肌组织纤维化程度及心肌壁厚度改变的照片。图8是根据本发明的一个实施例通过免疫荧光染色显示功能性心肌的再生程度和心肌梗塞区域血管的再生程度的照片。图9是显示根据本发明的一个实施例制备的用于再生心肌组织的三维构造中心脏祖细胞均匀布置的照片。具体实施方式以下将更详细地通过下面的实施例来描述本发明。然而,这些实施例仅用于说明本发明,本发明的范围不受限于这些实施例。制备例1:第一生物打印组合物的制备1-1:制备脱细胞胞外基质根据falgunipati等,natcommun.5,3935(2014)中公开的方法采用猪的心脏组织来制备脱细胞胞外基质(下称‘hdecm’)。制备好的hdecm最终冻干,并在使用前冷冻保存。光学显微照片和组织染色照片示于图2中。1-2:制备预凝胶形式的形成组织工程学构造的溶液倾入液氮以获得冻干的hdecm中,并随后用研钵和研磨棒粉碎。在0.5m乙酸水溶液(10ml)中加入所获得的hdecm粉(330mg)以及胃蛋白酶(33mg)(p7125,sigma-aldrich)后,在室温下搅拌48小时。将所得溶液保持在10℃之下,加入核黄素(2mg)和冷却到10℃之下的10mnaoh溶液,从而控制ph为约ph7。所获得的预凝胶形式的形成组织工程学构造的溶液在约4℃下冷藏。1-3:制备含有预凝胶形式的形成组织工程学构造的溶液和细胞的打印组合物在进行打印工艺前,5×106个细胞/ml的心脏祖细胞加入到所述预凝胶形式的形成组织工程学构造的溶液中,从而制备第一生物打印组合物。所述心脏祖细胞获得自釜山国立大学医学院的生理系的来源于人心肌组织的心脏祖细胞。制备例2:第二生物打印组合物的制备2-1:制备脱细胞胞外基质根据falgunipati等,natcommun.5,3935(2014)中公开的方法采用猪的心脏组织来制备脱细胞胞外基质(下称‘hdecm’)。制备好的hdecm最终冻干,并在使用前冷冻保存。光学显微照片和组织染色照片示于图2中。2-2:制备预凝胶形式的形成组织工程学构造的溶液将液氮倾入到获得的冻干的hdecm中,并随后用研钵和研磨棒粉碎。在0.5m乙酸水溶液(10ml)中加入所获得的hdecm粉(330mg)以及胃蛋白酶(33mg)(p7125,sigma-aldrich)后,在室温下搅拌48小时。将所得溶液保持在10℃之下,加入核黄素(2mg)和冷却到10℃之下的10mnaoh溶液,从而控制ph为约ph7。所获得的预凝胶形式的形成组织工程学构造的溶液冷藏在约4℃的温度下。2-3:制备含有预凝胶形式的形成组织工程学构造的溶液和细胞的打印组合物在进行打印工艺前,5×106个细胞/ml的间充质干细胞和血管内皮生长因子(序列号:293-ve-10,r&d系统公司)(100ng/ml)分别加入到所述预凝胶形式的形成组织工程学构造的溶液中,从而制备第二生物打印组合物。所述间充质干细胞获得自韩国catholic大学耳鼻喉科学医学科学系的来源于下鼻甲的间充质干细胞。对比例1:用于组织工程学的三位构造的制备根据公开在falgunipati等,natcommun.5,3935(2014)中的方法用由以上制备例1获得的第一生物打印组合物来制备三维构造。具体地,聚己内酯(pcl)骨架加载在多头组织和器官打印系统的注射器(第一注射器)上(jin-hyungshim等,j.micromech.microeng.22085014(2012)),并加热到约80℃以融化聚合物。由制备例1得到的预凝胶形式的第一生物打印组合物加载在另一注射器(第二注射器)上,并将温度保持再约10℃之下。具有低于约100μm线宽、约300μm间隙和120μm厚度的薄pcl骨架通过对第一注射器施加约600kpa的气动压力来制备,将第二注射器中的内容物喷射到pcl骨架上之后,用约360nm的uva辐照3分钟,从而交联。然后,通过喷射第二注射器中的内容物并交联来进行逐层层叠工艺,从而形成三维构造形状。将所得到的三维构造形状放置在约37℃的孵育器(湿润孵育器)中并保持30分钟来热胶凝化,从而制备三维构造(称为‘cpc打印的’)。所得的三位构造具有约300~400μm厚度。实施例1:制备用于组织工程学的三维构造用制备例1和2中制备的第一生物打印组合物和第二生物打印组合物来制造三位构造。具体来说,聚己内酯(pcl)骨架加载在多头组织和器官打印系统的注射器(第一注射器)上(jin-hyungshim等,j.micromech.microeng.22085014(2012)),并加热到约80℃以融化聚合物。由制备例1得到的预凝胶形式的第一生物打印组合物和制备例2制得的第二生物打印组合物分别加载在另外的注射器(第二和第三注射器)上,并将温度保持在约10℃之下。具有约100μm之下线宽、约300μm间隙和120μm厚度的薄pcl骨架通过对第一注射器施加约600kpa的气动压力来制备,将第二注射器中的内容物喷射到pcl骨架上之后,用约360nm的uva辐照3分钟,从而交联。然后,通过喷射第二和第三注射器中的内容物并交联来进行逐层层叠工艺,从而形成三位构造形状。将所得到的三维构造形状放置在约37℃的孵育器(湿润孵育器)中并保持30分钟来热胶凝化,从而制备用于组织工程学的三维构造(称为‘cpc/msc打印的’)。所得的三维构造具有约300~400μm厚度,其形状与图3所示相同。测试例1.检测添加有核黄素或未添加核黄素情况下的复数模量。在将由制备例1得到的预凝胶形式的溶液用约360nm的uva辐照3分钟而交联后,放到约37℃的孵育器(湿润孵育器)中并保持30分钟,从而诱导热胶凝化并形成水凝胶(交联的水凝胶a)。此外,根据制备实施例1相同的方法,只是不使用核黄素,而制备的预凝胶形式的形成组织工程学构造的溶液放到约37℃的孵育器(湿润孵育器)中并保持30分钟,从而诱导热胶凝化并形成水凝胶(水凝胶b)。然后,对所获得的各水凝胶在1rad/s的频率下测量复数模量,结果示于以下表1中。表1:种类模量(n=3,1rad/s)交联的水凝胶a10.58±3.4kpa水凝胶b0.33±0.13kpa从上表1的结果可见,根据本发明的交联的水凝胶a在1rad/s具有10.58kpa的模量,这说明它具有大约超过水凝胶b(其仅在未交联的情况下进行了胶凝处理)三十多倍的强度增强。测试例2.切开4~5周龄大鼠(重量300±30g)的胸部,并永久扎结左前降动脉(lad),从而诱导心肌梗塞。7天后,将由对比例1制备的三维构造(cpc打印的)和由实施例1制备的三维构造(cpc/msc打印的)分别切为8mm直径,并在移植到心肌梗塞区域后,缝合(分别,n=7)。移植后的4周和8周通过超声波心动图确认左心室的直径(lv直径)的结果示于图5中,通过计算出显示心肌功能的左心室射血分数(lvef)和分数缩短(fs),通过学生t检验进行的实验样品间的显著性评估的结果示于图6。从图5和6可见,与移植了实施例1的三维构造后的4周和8周未做任何处理的实验组(对照组)相比,左心房内直径显著减小了。此外,可观察到,与cpc组相比,在cpc/msc组的左心室收缩功能显著增强了,这表明心脏重塑被构造所抑制。在移植后8周获取大鼠的心脏,并在同一位置(基线方向距心脏尖端约1/3的点)对每个对象收集组织(3μm厚),进行马松三色染色。心肌(红色)和心肌梗塞区的瘢痕组织(蓝色)用染色方法辨别,结果示于图7。由图7可见,在移植根据本发明制备的三维构造8周后左心室的内壁厚度始终比对照组厚,并且心肌梗塞区域的瘢痕组织的形成更少。此外,与如在对比例1中仅用第一生物打印组合物形成的(cpc打印的)三维构造相反,如实施例1中用第一和第二生物打印组合物形成的(cpc/msc打印的)三维构造被移植时,瘢痕组织的形成被更有效地抑制了,左心室的内壁厚度没有变薄并被保持。从图8可见,在移植了根据本发明制备的三维构造的心肌梗塞区,代表心肌组织收缩性的β-肌球蛋白重链(βmhc)的表达以及代表血管新生的分化31(cd31)簇显著增加,当通过第一和第二生物打印组合物形成的(cpc/msc打印的)三维构造(实施例1)被移植时,该效果更加最大化。因此,证明了由本发明的制备方法制备的三维构造通过在构造内实现血管网从而能长时间保持细胞存活力(即,通过有效实现心肌组织的微环境),从而显著增强了细胞向心肌的转移效率。当前第1页12
相关技术
网友询问留言
已有0条留言
- 还没有人留言评论。精彩留言会获得点赞!
1