液态培养基组合物的制造方法、及用于该方法的制造装置和套件与流程
本发明涉及液态培养基组合物的制造方法、及用于实施该方法的制造装置和套件。更详细而言,本发明涉及将为了形成所述培养基组合物而需要混合的至少2种液体(含有特定的化合物的第一液体、及含有可以使该特定的化合物之间结合而形成结构体的物质的第二液体)适宜地混合,由此制造分散有所述结构体的培养基组合物的方法,以及能够实现这样的分散的制造装置和套件。
背景技术:
近年来,用于对在动物和植物机体内发挥不同作用的多种器官、组织及细胞进行体外增殖或维持的技术在不断发展。对这些器官、组织进行的体外增殖或维持分别被称为器官培养、组织培养,对从器官、组织分离的细胞在体外进行的增殖、分化或维持则被称为细胞培养。
细胞培养是将经分离的细胞在培养基中,在体外进行增殖、分化或维持的技术,是为了详细分析生物体内各种器官、组织、细胞的功能和结构而必不可少的技术。
此外,通过该技术培养的细胞和/或组织被用于以下多个领域:化学物质、药品等的药效和毒性评价;酶、细胞生长因子、抗体等有用物质的大规模生产;对因疾病、肢体欠损而失去的器官、组织、细胞加以弥补的再生医疗;植物品种改良;基因重组作物的制造;等等。
作为用于培养细胞等(器官、组织、细胞)的培养基之一,可举出液体培养基,本申请的发明人成功开发了能在悬浮状态下对细胞等进行培养的液态培养基组合物(专利文献1及2)。
专利文献1中记载的液态培养基组合物的构成为:特定的化合物(尤其是具有阴离子性官能团的高分子化合物)介由2价金属阳离子等聚集而形成无定形的结构体,该结构体在液体培养基中分散并且成为悬浮状态。以下,将具有阴离子性官能团的高分子化合物等上述特定的化合物称为“特定化合物”,将使该特定化合物彼此结合的2价金属阳离子等物质称为“连接物质”。
该培养基组合物能够在悬浮状态下对细胞进行培养,而不伴有存在引起细胞等的障碍、功能丧失的风险的震荡、旋转等操作,是理想的液态培养基。
现有技术文献
专利文献
专利文献1:国际公开第2014/017513号
专利文献2:us2014/0106348a1
技术实现要素:
发明所要解决的课题
上述专利文献1中记载的液态培养基组合物原本意图的理想状态是特定化合物之间以少量的方式彼此结合、形成微小的结构体而大量分散于液体中的状态。
然而,本申请的发明人对该液态培养基组合物的实际制造工序进行了详细研究,结果发现,为了得到上述那样的理想状态,必须注意不能使结构体以偏在于培养基组合物中的局部的方式形成。例如,特定化合物为脱酰基结冷胶的情况下,该脱酰基结冷胶在与液体培养基混合时,介由液体培养基中的连接物质(例如,钙离子)而形成无定形的结构体,该结构体成为用于使细胞等悬浮的载体。但是,在一边搅拌含有连接物质的液体培养基、一边向其中注入高浓度地含有特定化合物的液体的混合方法中,特定化合物在两种液体合流的瞬间即与连接物质连接而形成结构体,由此,该结构体成为在混合液中较长地连接为绳状而悬浮的状态(或者,绳状的结构体互相缠绕为块状的状态),存在无法形成原本意图的分散状态的情况。另外,发现即使以较高的速度进行搅拌,上述那样的状态仍然会发生。另外,一旦在液体培养基中形成上述那样的绳状的结构体,则分子链所形成的双螺旋会彼此介由连接物质(例如,钙离子)而形成牢固的三维网,由于该结构体的这一性质,将该结构体切碎而使其分散于母材中也是困难的。
为了得到上述结构体在液体培养基中微细地分散的状态,可进行下述为了分散的特殊处理,即,使用粉末状的培养基或浓缩培养基等成分已知的液体培养基,将含有特定化合物的液体稀释,通过将二者混合而创造出微细的结构体进行分散的状态。
然而,为了实现这样的分散的特殊处理需要耗费劳力,另外,就通常的液体培养基、特殊的液体培养基而言,存在难以实施这样的特殊处理的情况,因此,适合培养的细胞等也受到限制。
本发明的目的在于,解决上述的课题,提供能够将高浓度地含有特定化合物的液体与含有2价金属阳离子等连接物质的任意液体容易地混合、并且能够制造分散有微细的结构体的液态培养基组合物的方法,以及用于该方法的制造装置和套件。
用于解决课题的手段
本申请的发明人经过锐意研究,结果发现,仅仅使含有特定化合物的液体以成为特定的值以上的流量的方式通过具有特定范围的截面积的贯穿孔、并以该流量射入含有连接物质的液体中,即能够得到微细的结构体良好地分散于液体培养基中而形成的液态培养基组合物,而无需使用特殊的搅拌装置,从而完成了本发明。
本发明的主要构成如下所述。
〔1〕液态培养基组合物的制造方法,包括以下工序:
使含有下述(i)的特定化合物的第一液体以成为1.7ml/秒以上的流量的方式通过设于喷嘴部的横截面积0.01mm2~5.00mm2的贯穿孔,
将上述第一液体以上述流量注入含有下述(ii)的连接物质的第二液体中,由此,形成上述特定化合物介由上述连接物质结合而成的结构体,并且,使该结构体分散于上述两种液体的混合液中,
(i)特定化合物,其是具有阴离子性的官能团的高分子化合物,并且,所述特定化合物能通过介由2价金属阳离子的结合而使细胞或组织悬浮;
(ii)作为2价金属阳离子的连接物质。
〔2〕如上述〔1〕所述的制造方法,其中,将第二液体容纳于下述(a)的容器中,从供给装置送出第一液体,且使第一液体以成为上述流量的方式通过下述(a)的容器的贯穿孔,由此将第一液体以上述流量注入该容器内的第二液体中,
(a)具有主体和盖的容器,在该主体或该盖上设有喷嘴部,该喷嘴部具有连通容器外与容器内的贯穿孔,并且,该贯穿孔的横截面积为0.01mm2~5.00mm2。
〔3〕如上述〔2〕所述的制造方法,其中,
所述供给装置为注射器,
所述喷嘴部设于容器的盖上,并且,在该喷嘴部的容器外部侧,用于嵌入所述注射器的前端部的筒状部自该盖的外表面突出。
〔4〕如上述〔1〕所述的制造方法,其中,
将第二液体容纳于容器中,将容纳有第一液体的下述(b)的供给装置的喷嘴部的前端部插入所述容器内,从该供给装置送出第一液体,且使所述第一液体以成为所述流量的方式通过该供给装置的喷嘴部的贯穿孔,由此将第一液体以所述流量注入容器内的第二液体中。
(b)供给装置,其具有用于容纳液体的容纳部、和用于使容纳的液体从贯穿孔通过而进行注射的喷嘴部,并且,该喷嘴部的贯穿孔的横截面积为0.01mm2~5.00mm2。
〔5〕如上述〔4〕所述的制造方法,其中,
所述供给装置为注射器,所述喷嘴部为安装于所述注射器的注射针,
在所述容器的盖上设有能使所述注射针的针管部从容器外向容器内贯穿的可贯穿部分,并且,在该可贯穿部分的容器外部侧,用于嵌入注射针的针基部的筒状部自盖的外表面突出。
〔6〕如上述〔1〕~〔5〕中任一项所述的制造方法,其中,
所述(i)的特定化合物为脱酰基结冷胶,第一液体为含有该脱酰基结冷胶的水溶液,
所述(ii)的连接物质为钙离子及镁离子中的一者或两者,第二液体为含有钙离子及镁离子中的一者或两者的液体培养基。
〔7〕制造装置,其用于实施上述〔1〕所述的制造方法,所述制造装置具有:
用于送出第一液体的供给装置;
用于容纳第二液体、同时用于接纳从所述供给装置送出的第一液体的容器;和
喷嘴部,所述喷嘴部具有将第一液体从所述供给装置送出至所述容器内时需要通过的贯穿孔;
其中,所述贯穿孔的横截面积为0.01mm2~5.00mm2,
所述供给装置构成为能够以1.7ml/秒以上的流量送出第一液体,
所述制造装置构成为能够使第一液体以所述流量通过所述贯穿孔,从而将第一液体以1.7ml/秒以上的流量注入所述容器内。
〔8〕如上述〔7〕所述的制造装置,其中,
具有贯穿孔的喷嘴部被设计成所述容器的一部分,
所述容器具有主体和盖,在容器的主体或盖上以使所述贯穿孔将容器外与容器内连通的方式设有所述喷嘴部。
〔9〕如上述〔8〕所述的制造装置,其中,
所述供给装置为注射器,
所述喷嘴部设于容器的盖上,并且,在该喷嘴部的容器外部侧,用于嵌入所述注射器的前端部的筒状部自该盖的外表面突出。
〔10〕如上述〔7〕所述的制造装置,其中,
所述供给装置为注射器,所述喷嘴部为安装于所述注射器的注射针,
在所述容器的盖上设有能够使所述注射针从容器外向容器内贯穿的可贯穿部分,并且,在该可贯穿部分的容器外部侧,用于嵌入注射针的针基部的筒状部自该盖的外表面突出。
〔11〕套件,其用于实施上述〔1〕所述的制造方法,所述套件构成为至少具有第一容器、注射器和第二容器,其中,
第一容器为容纳有上述〔1〕所述的第一液体的容器,
注射器为上述〔3〕所述的(a)的容器,作为用于送出所述第一液体的供给装置而发挥作用,
第二容器为〔2〕所述的(a)的容器,用于容纳上述〔1〕所述的第二液体,如上述〔3〕所述,喷嘴部设于该容器的盖,并且,在该喷嘴部的容器外部侧,用于嵌入所述注射器的前端部的筒状部自该盖的外表面突出。
〔12〕如上述〔11〕所述的套件,其中,
第二容器还附带有密封用盖,所述密封用盖不具有喷嘴部,且所述密封用盖构成为能够将该容器的主体内密封,并且,上述〔2〕所述的(a)的容器的盖与所述密封用盖能够保持互换性地安装于该容器的主体的开口部。
〔13〕如上述〔11〕或〔12〕所述的套件,其中,
所述注射器还附带有管状部件,所述管状部件插入第一容器内,用于抽吸第一液体,
该管状部件具有细管部,所述细管部具有能插入第一容器内的外径、和能从第一容器内抽吸第一液体的长度,并且,在所述细管部的一端具有连接部,所述连接部能安装于所述注射器的外筒的前端部。
发明效果
如上述背景技术的说明中所述,在一边搅拌含有连接物质的液体培养基(第二液体)、一边向其中注入高浓度地含有特定化合物的液体(第一液体)的通常的搅拌·混合方法中,结构体有时会在混合液中较长地连接成绳状而悬浮。其原因在于,即使使搅拌子在液体培养基中高速旋转,实际上以高速移动的也仅仅是搅拌子,第二液体整体(尤其是注入了第一液体的液面附近)并未以搅拌子那样的高速进行移动。
为了改善这种现象,可以考虑如下构成,即,使搅拌子接近注入了第一液体的合流部分,在切割合流的同时进行搅拌的构成,但从避免生物性污染的观点考虑,为此需要能够在无菌或密封状态下运用的特殊搅拌装置。另外,在希望在许多小容量容器中分别地制作培养基组合物等情况下,由于在向容器插入搅拌机时即成为开放体系,因此需要设置洁净室、净化操作间等保障无菌状态的特殊设施,等等,从这些方面考虑,将这样的特殊搅拌装置个别地用于每个小容量的容器是困难的。
相对于此,本发明的制造方法、制造装置中的两种液体的混合手法的原理与上述以往的混合手法的原理完全相反,不是以高速搅拌第二液体,而是使第一液体从具有规定的横截面积s的贯穿孔通过而以成为规定值以上的流量q(或流速v)的方式射出,使第一液体以该流量q(或流速v)冲入第二液体中。由此,能够可靠地提高在两种液体合流的部分处的两种液体的速度差,使两种液体冲击性地接触,从而充分地抑制结构物较长地连接为绳状的情况。并且,在一时性地形成微细的结构物时,即使该微细的结构物在混合液中的一部分聚集,通过进一步进行搅拌,仍然能够使微细的结构物在容器内的混合液整体中均等地分散。
本发明中,为了使第一液体为1.7ml/秒(l表示升)以上的流量,将喷嘴部的贯穿孔的横截面积s限定为0.01mm2~5.00mm2。所谓贯穿孔的横截面是指,与从该贯穿孔的入口到出口为止的中心轴线相垂直地切割时的该贯穿孔的截面,所谓贯穿孔的横截面积是指该贯穿孔的横截面的面积。
通过贯穿孔的出口的第一液体的流量q、贯穿孔的横截面积s、与通过该贯穿孔的出口的第一液体的流速v之间存在q=s×v的关系。
首先,使用了大于上述横截面积那样的大口径的贯穿孔的情况下,第一液体形成粗液流而冲入第二液体中。在这样的粗液流中,会发生位于其中心部分的第一液体在失速前无法与第二液体接触的情况。相对于此,贯穿孔的横截面积在上述的范围内时,射出液流恒定地形成细液流,位于该液流的中心的第一液体能够在失速前与第二液体接触的概率升高。由此,本发明中,将贯穿孔的横截面积限定为上述范围。
另外,在细胞等的培养的现场中,为了送出第一液体而使用的、实际应用中优选的供给装置如后文所述,为手动的注射器。由此,就大于上述横截面积那样的大口径的贯穿孔而言,难以可靠地以能够达成优选流速那样的流量实施送出。
由此,本发明中,在大容量的容器内一次性地制作大量的培养基组合物时,也会一直使用具有上述范围的横截面积的贯穿孔。需要说明的是,可以根据需要而使用复数的贯穿孔、将第一液体并列地射入第二液体中,另外,也可以使用单一的贯穿孔,多次将第一液体射入第二液体中。这种情况下的供给装置可根据其排出能力而设置1个、或对应贯穿孔的数量而并列地设置。
附图说明
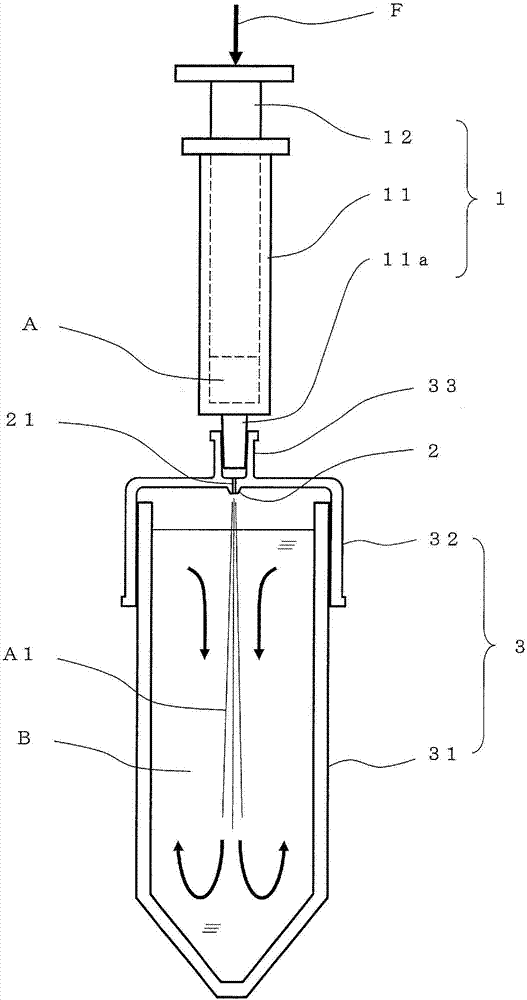
[图1]图1为用于说明本发明的制造方法及制造装置的构成概要的剖视图。为了对区域进行区别强调,对喷嘴部的剖面施加了阴影。图1中的各符号各自表示的构成要素为:a:第一液体,b:第二液体,a1:被射出的第一液体的液流,1:供给装置,2:喷嘴部,21:贯穿孔,3:容器。
[图2]图2为表示本发明的制造方法及制造装置的具体实施方式例的剖视图。该图的实施方式例中,喷嘴部属于容器侧且以第一液体被射出至容器的中心的方式形成。该图中,以剖视图的形式显示容器的主体和盖的剖面,作为供给装置的注射器1显示为外观而非剖面(图3、图6也同样)。另外,针对剖面省略了阴影(图3~图7也同样)。
[图3]图3为表示本发明的制造方法及制造装置的其他具体实施方式例的图。该图的实施方式例中,喷嘴部属于容器侧且以第一液体被射出至自容器的中心偏心的位置的方式形成。
[图4]图4为将图2、图3中的喷嘴部局部性放大得到的图。图4(a)为喷嘴部的俯视图,图4(b)为将图2、图3中的喷嘴部局部性放大得到的剖视图,图4(c)为从图4(b)图的x方向仅对图4(b)的上部进行观察得到的侧视图。
[图5]图5为表示本发明的制造装置中的容器的盖的实施方式例的图。图5(a)为该盖的俯视图,图5(b)为该盖的侧视图,是沿图5(a)中的y-y线切割该盖时的剖视图。
[图6]图6为表示本发明的制造方法及制造装置的其他具体实施方式例的图。该图的实施方式例中,喷嘴部为属于作为供给装置的注射器的部件(针),另外,喷嘴部以第一液体射出至自容器的中心偏心的位置的方式形成。
[图7]图7为示意性表示本发明的套件的构成例之一的图。该图中,容器和盖以剖视图的形式显示。作为供给装置的注射器1显示为外观而非剖面。
具体实施方式
以下,一边说明本发明的制造装置的结构,一边说明本发明的制造方法。本发明的制造装置的具体结构的说明也是对于具体如何实施本发明的制造方法的说明。另外,本发明的制造方法的说明也是本发明的制造装置的使用方法的说明。
本发明的制造方法是可以令人满意地制造上述专利文献1中记载的那样的液态培养基组合物的方法,包括以下工序:如图1所示的那样,使含有下述(i)的特定化合物的第一液体a以成为1.7ml/秒以上的流量q的方式通过设于喷嘴部2且具有0.01mm2~5.00mm2的横截面积s的贯穿孔21,将上述流量q的该第一液体注入含有下述(ii)的连接物质的第二液体b中,由此将两种液体混合。
此处,上述(i)的特定化合物为具有阴离子性的官能团的高分子化合物,并且,所述特定化合物能够通过介由2价金属阳离子结合而形成能使细胞或组织悬浮的结构体。
另外,上述(ii)的连接物质为2价金属阳离子。
上述的特定化合物、连接物质、及分别含有它们的第一液体、第二液体的详细情况见后述。
通过以上述流量q进行射出,在上述两种液体a、b的混合液中形成特定化合物介由连接物质结合而成的结构体,同时,能够得到该结构体微细地分散于该混合液中而形成的液态培养基组合物。
第一液体a的流量q可以为1.7ml/秒以上,相对于具有上述范围的横截面积s的贯穿孔而言,流量q越大,则第一液体以强劲的势头冲入第二液体中,从而抑制结构体较长地连接的情况。
流量的上限没有特别限定,在考虑贯穿孔的横截面积s的情况下,从第一液体的送出能力的方面考虑,可举出10ml/秒左右,5ml/秒左右在实际操作上是更适宜的。
喷嘴部的贯穿孔21的横截面积s可以为0.01mm2~5.00mm2,更优选为0.05mm2~2.00mm2,特别优选为0.10mm2~0.70mm2。通过将贯穿孔的横截面积限定为上述的范围,即使被从供给装置送出的第一液体的液量存在若干差异,仍然能够得到令人满意的搅拌结果(即,结构体的令人满意的分散结果)。
将第一液体注入第二液体中时的第一液体的液流的方向不受特别限定,如图1所示的那样,可以从上方向下方射出,也可以是从水平向向侧方的射出、从下方向上方的射出。
本发明的制造装置是构成为能够实施本发明的制造方法的装置,如图1所示的那样,构成为除了具有上述贯穿孔21的喷嘴部2以外,至少具有供给装置1和容器3。
上述供给装置1是用于送出第一液体a的装置,构成为能够以上述的流量q(mm3/秒)送出第一液体。
容器3是用于容纳第二液体b的容器,并且,也是用于接纳从上述供给装置1送出的第一液体、从而形成由两种液体组成的混合液(即,需制造的液态培养基组合物)的容器。
喷嘴部2具有第一液体在被从上述供给装置送出至上述容器内时需要通过的上述横截面积(mm2)的贯穿孔21。喷嘴部2可以是属于供给装置1的部件,可以是属于容器的主体、盖的部分,另外,也可以不属于任一方,而是作为存在于供给装置与容器之间的独立接头构件。
在该制造装置的使用时,第一液体a被以上述流量q(mm3/秒)从供给装置1送出,通过设于喷嘴部2的上述横截面积s(mm2)的贯穿孔21,冲入容纳于容器3内的第二液体中。如上所述,该一系列操作即为本发明的制造方法的实施,由此能够得到令人满意的液态培养基组合物。
需要混合的第一液体与第二液体的体积比率没有特别限定,通用的比率是,为(第一液体∶第二液体)=(1∶1)~(1∶1000)左右,优选为(1∶5)~(1∶500)左右,更优选为(1∶10)~(1∶100)左右。
实际的细胞等的培养操作中,从在使用时制备新鲜的培养基组合物的观点考虑,较之在大容量的一个容器中一次性地制作大量的培养基组合物后分配至各小容量的容器中贮存的操作而言,有时更优选针对1~1000ml左右、优选10~200ml左右的各小容量的容器个别地制作培养基组合物。
针对每个上述的那样的小容量的容器制作培养基组合物时,作为被混合的两种液体各自的具体体积,优选的是,容纳于容器中的第二液体为1ml~1000ml左右,更优选为10ml~200ml左右,射入第二液体中的第一液体为0.01ml~100ml左右,更优选为0.1ml~20ml左右。
供给装置1和容器3的容量可根据这样的组合而适宜选择。
第一液体与第二液体的混合液可以是作为制造目标的培养基组合物,也可以向该混合液中进一步加入添加物,由此形成作为制造目标的培养基组合物。
与本发明相反地,通过预先在容器中容纳少量的第一液体、向其中射入大量的第二液体也有可能得到作为制造目标的培养基组合物,但第一液体的粘度高而不易混合、相对于总液量而言无法忽略向壁面等分散的液体的量等,接触状态、稀释条件与使少量的液体以细且快的流速冲入大量的液体中的情况有很大不同。另外,会产生射出需要时间、容器内的压力上升等问题。因此,本发明中,推荐以上述比率将第一液体射入第二液体中。
对于供给装置而言,为具有能够以上述的流量q(1.7ml/秒以上)送出第一液体的排出能力的装置即可,可举出例如蠕动泵、隔膜泵、注射器等。该供给装置的驱动源可以是手动式,也可以是使用了马达等驱动装置。其中,如图2、图3、图6中所示的那样的注射器(注射筒)为简单的构成,容易操作、且廉价(因此也可用后即弃),即使通过手动按压也能够达成上述流量,因此是优选的供给装置。例如,泰尔茂公司制预防接种用泰尔茂注射器(1ml,型号为ss-01p)~泰尔茂公司制泰尔茂注射器(50ml,型号为ss-50esz)等之类的塑料制的能够用后即弃的注射器是适于针对每个上述的小容量的容器而制作培养基组合物的注射器。
需要说明的是,本发明中的所谓“注射器”是具有外筒和柱塞(按压件)而构成的装置。本发明包括直接使用注射器的方式、和在注射器的前端部进一步安装注射针的方式。
送出第一液体时的流量q(在每单位时间内通过液流中的某截面的体积:mm3/秒)的上限不受特别限定,为更大的流量时,通过上述喷嘴部的贯穿孔而导致更高的流速,第一液体以更高的冲击性冲入第二液体中,因此,能够使结构体更理想地细分化而分散。
使用注射器作为供给装置的情况下,如图2所示的那样,使第一液体a通过贯穿孔21,以能够实现上述流量或流速的按压力(负荷)f推进柱塞(活塞部分)12,送出容纳于外筒11内的第一液体a即可。
即,本发明中所谓“使第一液体以成为1.7ml/秒以上的流量的方式通过设于喷嘴部的横截面积为0.01mm2~5.00mm2的贯穿孔”,表示以使第一液体能够以1.7ml/秒以上的流量通过该横截面积的贯穿孔的方式,通过供给装置1向第一液体施加按压力f,利用该按压力将第一液体以上述排出流量向该贯穿孔内按出。
使用注射器作为供给装置的情况下,通过调节柱塞的整个移动过程需要的时间,能够调节从该注射器送出的第一液体的流量。即,对于注射器而言,即使在利用人力按压的情况下,也可以通过调节柱塞的行程需要的时间来调节目标的流量(mm3/秒),因此是优选的。
利用人力按压注射器时能够得到的流量的上限因个人的力量而不同,大致为5ml/秒左右。
作为使用少容量的注射器的情况的例子,贯穿孔的横截面积为0.2mm2、注射器为泰尔茂公司制预防接种用泰尔茂注射器(1ml,型号为ss-01p),在该注射器内容纳1.7ml的第一液体,这种情况下,将第一液体全部按出需要的柱塞的总移动时间t1为1秒以下时,能够达成1.7ml/秒以上的流量的送出。手动操作注射器的情况下,考虑按出柱塞的力,柱塞的总移动时间t1为0.2秒~1秒左右是适宜的,此时能够得到的流量为1.7ml/秒~8.5ml/秒。
另外,作为使用大容量的注射器的情况的例子,贯穿孔的横截面积与上述同样地为0.2mm2、注射器为泰尔茂公司制泰尔茂注射器(50ml,型号为ss-50esz)、在该注射器内容纳20ml的第一液体,这种情况下,就相同口径的贯穿孔而言,将第一液体全部按出需要的柱塞的总移动时间t2为12秒以下时,能够达成1.7ml/秒以上的流量的送出。手动操作注射器的情况下,考虑按出柱塞的力,柱塞的总移动时间t2为2.5秒~12秒左右是适宜的,此时能够得到的流量为1.7ml/秒~8.0ml/秒。此时需要的按压力(负荷)与上述的使用少容量的注射器的情况同样。
利用人力按压柱塞的情况下,难以将该柱塞的移动速度严密地保持为恒定,但为上述的移动时间的范围时,即使是人力也能够使该柱塞不脱离该范围地进行移动,从而能够在没有较大误差的情况下达成目标的流量和由该流量带来的贯穿孔的出口处的流速。
喷嘴部的贯穿孔为具有上述范围的横截面积s、且能够得到上述范围的流量的贯穿孔即可。该贯穿孔优选为直管状,也可以具有用于树脂成型的拔模斜度。对于从该贯穿孔射出时的第一液体的液流a1而言,与扩散为喷雾状相比,优选为尽可能地保持该贯穿孔的横截面的线状的液流,由此,第一液体能够强且深地冲入第二液体中。贯穿孔的孔内的形状可以形成这样的液流的方式而适宜设计。
贯穿孔的横截面的形状不受特别限定,可以为圆形、椭圆形、扁圆形、矩形、长方形、异形等。从贯穿孔的形成容易的观点考虑,贯穿孔的横截面的形状优选为圆形。另外,为了使被射出的第一液体的液流意图性地进行散乱的扩散,也可以使贯穿孔的横截面的形状适宜变形。
贯穿孔的长度不受特别限定。将喷嘴部设于容器(主体或盖)时,贯穿孔的长度优选为0.01mm~10mm左右,喷嘴部为注射器的注射针时,贯穿孔的长度优选为1.0mm~100mm左右。
喷嘴部2可以如图2所示的那样,以将第一液体a射出至容器3的中央的方式,位于该容器的开口的中央等。通过使第一液体从喷嘴部冲入容器的中央,能够得到如在图2的容器内以箭头示出的那样,第一液体深深地进入第二液体中、然后在容器的底部形成分开的液流而在容器内回旋的效果。
另外,喷嘴部2也可以如图3所示的那样,以将第一液体a射出至从容器的中央向缘部偏心的位置的方式,位于自该容器的开口的中央偏心的位置。通过使第一液体冲入从容器的中央向缘部偏心的位置,能够得到如在图3的容器内以箭头示出的那样,第一液体深深地进入第二液体中、然后在容器的底部大幅度转向,作为1条液流而在容器内回旋的效果。
喷嘴部的位置可根据例如第一、第二液体的粘性、液量、容器的形状等而适宜确定。
容器为能容纳上述第二液体、且能够接纳第一液体的射出、进而容纳这些液体的混合液的容器即可。在保持气密的状态下,向容纳有第二液体的容器注入第一液体后,容器内的压力会上升,但只要为上述的具体的混合比率左右,则压力的上升不会导致问题。
该容器的容量不受特别限定,从上述的具体的混合比率的观点考虑,可例示5ml~1000ml左右作为优选容量。容器的横截面形状不受特别限定,从利用混合时的对流达成顺畅的循环的观点考虑,优选为圆形。
容器的内部的深度l1与口径d1的比率(l1/d1)没有特别限定,即使是相同容量的容器,比率(l1/d1)过大时,就整体而言会成为过度细长的容器,混合时的对流受到阻碍,因此不优选。另外,比率(l1/d1)过小时,就整体而言会成为浅盘那样的容器,混合时的对流受到阻碍,因此不优选。优选比率(l1/d1)可以从0.5~30左右、优选1.0~15左右、进一步优选2.0~8.0的范围中适宜确定。
容器内容纳有第二液体时,该液体占据的部分(浸液部)的深度z与口径d的比率(z/d)也没有特别限定,可以从0.5~20左右、优选1.0~10左右、进一步优选1.3~4.0左右的范围中适宜确定。
图2、图3、图6的例子中,将容器的底部的形状画成朝向最深部而变细的圆锥状,但可以是半球状、平坦状等,不受特别限定。从根据液量、粘性而设想对流状态的变化的观点、离心分离细胞等使其高效地沉淀从而提高回收率等实用方面的操作性的观点考虑,有时会优选如图2、图3、图6那样的具有朝向最深部而变细的圆锥状的底部的容器(也称为圆锥底管(conicaltube))。作为优选容器的制品例,可举出nipponbectondickinsoncompany,ltd.制圆底管(roundtube)5ml(352003)、圆锥底管15ml(352095)、圆锥底管50ml(352070)、圆锥底管175ml(352076)、圆锥底管225ml(352075)、住友电木株式会社制15ml离心管(ms-56150)、50ml离心管(ms-56500)、旭硝子公司制离心管15ml(2322-015)、离心管50ml(2342-050)、离心管230ml(2386-230)等。
从能利用作为理化学设备的通常的容器主体的观点、液体的出入的操作的观点考虑,容器3优选如图2、图3、图6所示的那样为具有具备开口的主体31、和安装于该开口部(开口和其周围的壁部)的盖32而形成的容器。
该容器的材料不受特别限定,除了例如聚乙烯、聚丙烯、聚苯乙烯、聚对苯二甲酸乙二醇酯、聚碳酸酯等塑料以外,可举出玻璃、金属等。容器的主体和盖的材料可以彼此不同。
从使该制造方法的该制造装置的操作简单化的观点考虑,优选将喷嘴部设计为上述容器的一部分(流入部)、或上述供给装置的一部分(排出部)。
将喷嘴部设计为容器的一部分的情况下,该喷嘴部可以设于该容器的主体(图中未显示)、另外,也可以设于盖上(图2、图3)。这些情况下的贯穿孔贯穿该喷嘴部,成为连通容器外与容器内的流路。第一液体通过该贯穿孔,射入容器内的第二液体中。
从能利用作为理化学设备的通常的容器主体的观点考虑,优选如图2、图3所示的那样,喷嘴部2设于盖32上的方案。喷嘴部2优选为与盖32一体地设置的方案,也可以是将独立形成的部件组入盖的方案。
图2、图3中例示的方案中,供给装置1为注射器,喷嘴部2设于容器3的盖32上。在任一种方案中,在喷嘴部2的容器外部侧,用于嵌入注射器的外筒11的前端部(筒前端)11a的筒状部33自该盖32的外表面突出。
如上述那样,喷嘴部2可以位于盖的中央(图2),也可以位于从盖的中央向缘部偏心的位置(图3)。
使喷嘴部偏心的情况下,容器的开口形状为圆形,该开口的半径为r(mm),自该开口的中心向缘部偏心的距离为r(mm),r中r所占比例〔(r/r)×100〕为40%~80%左右时,偏心的效果变得显著。若喷嘴部的偏心过大,则第一液体的液流过于接近容器的壁部,存在阻碍适宜的搅拌的可能性。
从喷嘴的前端部直到液面为止的距离优选为0mm至200mm以内,更优选为150mm以内,进一步优选为85mm以内。
图4为详细地显示图2、图3的方案中设于盖的喷嘴部和其外侧的结构例的部分放大图。
如图4(b)所示的那样,喷嘴部2的前端部(容器内部侧)向容器内部侧突起,从而确保贯穿孔21的长度,并使从该贯穿孔射出时的第一液体的液流成为尽可能地保持该贯穿孔的横截面的线状的液流。在该喷嘴部的前端部、与容纳于容器中的第二液体的液面之间可以存在空间,另外,喷嘴部的前端部可以以与第二液体接触的方式较长地延伸。
另外,作为优选的选项,图4(a)~(c)的例中,在自盖的外表面突出的筒状部33的前端部,用于与卢尔锁(luerlock)型的注射器的前端部的内螺纹卡合的突起部34、35在侧方突起,从而能够旋入该注射器进行固定。在该突起部34、35各自的下部,如图4(c)中显示的那样,设有能够与该注射器的前端部的内螺纹卡合的倾斜部(日语:勾配)34a、35a。
容器的主体31与盖32之间的连接结构、密封性、注射器的前端部11a与盖的筒状部33之间的连接结构、该前端部11a与筒状部的内面33a的嵌合度、密封性可适宜进行设定。
图5示出了向图3中所示的盖的细微部分添加实用性结构的实施例。该图的例中,为了能够利用市售的理化学实验用的容器作为主体,使该容器与本来附带的盖具有互换性。
如图5(b)所示的那样,在该盖32的内侧,以能够与市售的理化学实验用的容器主体的开口部螺合的方式设有螺纹牙36。另外,在该盖32的内侧的最内面,环状的密封部37突起,所述密封部37用于在使该盖与容器的开口部螺合时将该开口密封。另外,如图5(a)所示的那样,在盖的外周侧表面与原本的盖同样地设有滚花38,使得用手旋转盖时不会滑动。
图6中例示的方案中,将喷嘴部设计为供给装置的一部分。同图的例子中,供给装置1为注射器,喷嘴部为安装于该注射器的前端部的注射针13,该注射针13是具有针基部13a和针管部13b而形成的。针管部13a并非必须是锐利的。
该图的方案中,针管部的内部的管路成为本发明中的贯穿孔,其横截面积为0.01mm2~5.00mm2。该图的方案中,针管部的前端部构成为进入容纳于容器内的第二液体的内部。
在容器的盖32上设有可贯穿部分39,所述可贯穿部分39能够使注射针13的针管部13b从容器外向容器内贯穿,在该可贯穿部分39的容器外部侧,用于嵌入注射针的针基部13a的筒状部33自该盖32的外表面突出。该筒状部33并非是必需的,但是为用于在使用时保持注射器的优选结构。
可贯穿部分39只要以使针管部在使用时能够通过的方式形成即可,可以是适合针管部的外径的贯穿孔,也可以是针管部能够突破的脆弱部、薄膜部。
根据本发明的制造方法,在将第一液体注入第二液体中时,形成搅拌第二液体的状态,并将第一液体射入该状态的第二液体中。
作为搅拌方法,可举出通过对于容器施加例如手动振荡、机械振荡(直线往复运动、偏心回旋运动及8字回旋运动)、超声波振动、涡旋搅拌等来使容器内的第二液体成为搅拌状态的方法。
第一液体含有具有阴离子性的官能团的高分子化合物作为特定化合物,所述高分子化合物能够通过介由2价金属阳离子结合而形成能使细胞或组织悬浮的结构体。
作为阴离子性的官能团,可举出羧基、磺基、磷酸基及它们的盐,优选为羧基或其盐。本发明中使用的高分子化合物可含有选自上述阴离子性的官能团的组中的1种或2种以上。
作为本发明中使用的高分子化合物的优选具体例,没有特别的限制,可以举出10个以上单糖类(例如三碳糖、四碳糖、五碳糖、六碳糖、七碳糖等)聚合而成的多糖类,更优选举出具有阴离子性官能团的酸性多糖类。此处所谓的酸性多糖类只要在其结构中具有阴离子性官能团即可,没有特殊的限制,例如,为具有糖醛酸(例如,葡糖醛酸、艾杜糖醛酸、半乳糖醛酸、甘露糖醛酸)的多糖类、一部分结构中具有硫酸基或磷酸基的多糖类、或者具有这两种结构的多糖类,不仅包括来自天然的多糖类,还包括由微生物产生的多糖类、基因工程产生的多糖类、或者使用酶通过人工合成的多糖类。更具体而言,可以例示由选自透明质酸、结冷胶、脱酰基结冷胶(以下有时也称为dag)、鼠李聚糖胶(rhamsangum)、迪特胶(diutangum)、黄原胶(xanthangum)、角叉菜胶、汉生胶(zanthangum)、已糖醛酸(hexuronicacid)、岩藻多糖(fucoidan)、果胶、果胶酸(pectinacid)、果胶酯酸(pectinicacid)、硫酸乙酰肝素(heparansulfate)、肝素、硫酸类肝素(heparitinsulfate)、硫酸角质(keratosulfate)、硫酸软骨素(chondroitinsulfate)、硫酸皮肤素(dermatansulfate)、硫酸鼠李聚糖(rhamnansulfate)及它们的盐组成的组中的1种或者2种以上构成的多糖类。多糖类优选为透明质酸、dag、迪特胶、黄原胶、角叉菜胶或它们的盐,更优选为dag或其盐。dag也可使用经磷酸化的dag。该磷酸化可利用已知的手法进行。
此处的所谓盐可举出例如锂、钠、钾等碱金属的盐,钙、钡、镁等碱土金属的盐,或铝、锌、铜、铁、铵、有机碱及氨基酸等的盐。
这些高分子化合物(多糖类等)的重均分子量优选为10000至50000000,更优选为100000至20000000,进一步优选为1000000至10000000。例如,该分子量可以采用利用凝胶渗透色谱法(gpc)进行的普鲁兰多糖(pullulan)换算来测定。
本发明中,可以组合多种(优选2种)上述具有阴离子性的官能团的多糖类进行使用。关于多糖类的组合的种类,只要能够通过介由2价金属阳离子结合而在液体培养基中形成上述的结构体即可,不受特别限定,优选该组合至少含有dag或者其盐。即,优选的多糖类的组合中,包括dag或者其盐、以及dag或者其盐以外的多糖类(例如,黄原胶、藻酸、角叉菜胶、迪特胶、甲基纤维素、刺槐豆胶(locustbeangum)或者它们的盐)。作为具体的多糖类的组合,可以举出dag与鼠李聚糖胶、dag与迪特胶、dag与黄原胶、dag与角叉菜胶、dag与汉生胶、dag与刺槐豆胶、dag与κ-角叉菜胶、dag与藻酸钠、dag与甲基纤维素等,不限于这些。
所谓脱酰基结冷胶,是以4分子的糖(即,1-3键合的葡萄糖、1-4键合的葡糖醛酸、1-4键合的葡萄糖及1-4键合的鼠李糖)为结构单元的直链状的高分子多糖类,是下述通式(i)中,r1、r2均为氢原子、n为2以上的整数时所示的多糖类。其中,r1可以包括甘油基,r2可以包括乙酰基,乙酰基及甘油基的含量优选为10%以下,较优选为1%以下。
[化学式1]
特定化合物可以是采用化学合成法得到的物质,该特定化合物为天然物的情况下,也可以是采用常用技术从含有该化合物的各种植物、各种动物、各种微生物中提取及分离纯化而得到的物质。例如,结冷胶可以如下制造,即,通过在发酵培养基中对生产微生物进行培养,将在菌体外产生的粘膜物利用常用纯化方法回收,经干燥、粉碎等步骤后制成粉末状而制造。另外,为脱酰基结冷胶的情况下,可以在回收粘膜物时实施碱处理,将与1-3键合的葡萄糖残基键合的甘油基和乙酰基脱酰基化后回收。作为结冷胶的生产微生物的例子,可以举出多沼鞘氨醇单胞菌(sphingomonaselodea)及改变该微生物基因而得到的微生物,但并不限定于此。
为脱酰基结冷胶的情况下,可以使用市售物,例如三晶株式会社制“kelcogel(cp·kelco公司的注册商标)cg-la”、三荣源f·f·i株式会社制“kelcogel(cp·kelco公司的注册商标)”等。另外,作为天然型结冷胶,可以使用三荣源f·f·i株式会社制“kelcogel(cp·kelco公司的注册商标)ht”等。
第一液体通常为特定化合物的溶液。用于该溶液的溶剂只要能溶解特定化合物即可,不受特别限定,通常为水或亲水性溶剂,优选为水。即,在优选方案中,第一液体为特定化合物的水溶液。
第一液体中含有的特定化合物的浓度只要满足以下条件即可,不受特别限定:与第二液体混合时,在混合液中,特定化合物能够通过介由2价金属阳离子结合而形成能使细胞或组织悬浮的结构体,并且,该结构体在混合液中均匀地分散,此外,最终得到的液态培养基组合物只要能够通过含有该结构体而对细胞或组织进行悬浮培养即可,不受特别限定。根据以下详细说明的能够悬浮培养细胞或组织的培养基组合物中的特定化合物的浓度,以及第一液体的体积相对于利用最终产物得到的培养基组合物的体积而言的比率,可以算出第一液体中的特定化合物的浓度。例如,将体积为v1的第一液体和体积为v2的第二液体进行混合,最终得到体积为v1+v2的液态培养基组合物的情况下,为了使该液态培养基组合物中的特定化合物的浓度为c%(w/v),使第一液体中的特定化合物的浓度为c×(v1+v2)/v1%(w/v)即可。作为具体的例子,使用dag或其盐作为特定化合物的情况下,第一液体中的dag浓度例如为0.02~2.5%(w/v),优选为0.1~2.0%(w/v),更优选为0.5~1.5%(w/v)。dag浓度大于2.5%(w/v)时,从溶解度的观点考虑,dag变得难以溶解于溶剂中,另外,在将第一液体与第二液体混合时,结构体局部性地形成,进而成为互相缠绕为块状的状态,难以分散于培养基组合物中的风险升高。另一方面,dag浓度小于0.02%(w/v)时,为了制造作为目标的培养基组合物而需要的第一液体的体积增大。结果,采用通常的液体培养基作为第二液体的情况下,与第一液体混合后,来源于该液体培养基的成分被大幅度稀释。
第一液体中的2价金属阳离子浓度必须小于第一液体中的特定化合物形成结构体的浓度。作为2价金属阳离子,可举出钙离子、镁离子、锌离子、锰离子、铁离子、铜离子等。尤其是钙离子及镁离子中的一者或两者(以下,也表示为“钙离子及/或镁离子”)有助于dag等的特定化合物的结构体形成。
第一液体中可以含有除了特定化合物、溶剂以外的因子。作为该因子,可举出生理上可接受的缓冲剂、盐、等渗剂,但不限于这些。
第一液体的制备可通过以下方式进行:向上述溶剂(例如水)中添加特定化合物,于该特定化合物能溶解的温度(例如,60℃以上、80℃以上、90℃以上)进行搅拌,溶解直到成为透明的状态为止。如上述那样,使用经脱2价金属阳离子处理的dag时,可以无需加热而溶解于水中,因此溶解操作容易。需要时,可对得到的特定化合物的溶液实施脱2价金属阳离子处理,使溶液中的2价金属阳离子浓度小于结构体形成浓度。根据需要,可以在溶剂中预先加入特定化合物以外的因子,也可以在得到的特定化合物的溶液中加入特定化合物以外的因子。第一液体优选进行灭菌处理。作为灭菌处理的方法,可举出高压釜、过滤灭菌等,但不限于这些。
第二液体含有2价金属阳离子作为连接物质。作为2价金属阳离子,可举出钙离子、镁离子、锌离子、锰离子、铁离子、铜离子等。2价金属阳离子的种类只要能够使第一液体中含有的特定化合物通过介由该2价金属阳离子结合而形成能使细胞或组织悬浮的结构体即可,不受特别限定,优选为钙离子。
第二液体通常为连接物质(即,2价金属阳离子)的溶液。用于该溶液的溶剂只要能溶解特定化合物即可,不受特别限定,通常为水或亲水性溶剂,优选为水。即,优选方案中,第二液体为连接物质(即,2价金属阳离子)的水溶液。
第二液体中含有2价金属阳离子,所述2价金属阳离子的浓度对于在第一液体与第二液体进行混合时,第一液体中的特定化合物形成结构体而言是充分的。例如,使用钙离子或镁离子作为连接物质的情况下,第二液体中的钙离子或镁离子浓度通常为0.001mm以上、优选为0.01mm以上。第二液体中的2价金属阳离子浓度的上限值理论上为饱和溶液的浓度(即,溶解度),但2价金属阳离子浓度过高时,存在对于在制得的培养基组合物中培养的细胞等造成不良影响的可能性。因此,例如,使用钙离子或镁离子作为连接物质的情况下,优选的是,第二液体中的钙离子或镁离子浓度的上限值通常为100mm以下,优选为10mm以下。需要说明的是,第二液体同时含有钙离子和镁离子时,优选的是,各离子浓度的总和为100mm以下,优选为10mm以下。
第二液体中可含有连接物质(即,2价金属阳离子)、溶剂以外的因子。作为该因子,可举出适于要培养的细胞的培养基构成成分。作为该培养基构成成分,可举出缓冲剂(碳酸缓冲剂、磷酸缓冲剂、hepes等)、无机盐(nacl等)、各种氨基酸、各种维生素(胆碱、叶酸等)、糖类(葡萄糖等)、抗氧化剂(硫代甘油等)、丙酮酸、脂肪酸、血清、抗生素、胰岛素、转铁蛋白、乳铁蛋白、胆固醇、各种细胞因子、各种激素、各种生长因子、各种细胞外基质等,但不限于这些。第二液体优选进行灭菌处理。作为灭菌处理的方法,可举出高压釜、过滤灭菌等,但不限于这些。
优选方案中,第二液体为含有结构体形成浓度的2价金属阳离子(优选为钙离子及/或镁离子)的液体培养基。即,第二液体中,除了结构体形成浓度的2价金属阳离子(优选为钙离子及/或镁离子)及水以外,还含有适于要培养的细胞的培养基构成成分。通常使用的细胞培养用液体培养基中的钙离子浓度的范围为0.1~2.0mm左右,镁离子浓度为0.1~1.0mm左右,因此,对于利用dag等特定化合物的结构体形成而言是充分的。
本方案中,通过利用本发明的制造方法将第一液体与第二液体混合,能够直接得到作为目标的液态培养基组合物,所述液态培养基组合物含有由第一液体中含有的特定化合物介由第二液体中含有的连接物质结合而形成的结构体。
尤其是第二液体中,可以不含部分或全部的上述的细胞培养用培养基构成成分。这种情况下,本发明的制造方法中,将第一液体与第二液体混合,得到含有结构体的混合液,向该混合液中加入部分或全部的上述细胞培养用液体培养基构成成分,由此能够得到作为目标的液态培养基组合物,所述结构体是第一液体中含有的特定化合物介由第二液体中含有的连接物质结合而形成的。
能够利用本发明的制造方法得到的液态培养基组合物含有结构体,所述结构体是第一液体中含有的特定化合物介由第二液体中含有的连接物质(即,2价金属阳离子)结合而形成的,并且,该结构体均匀地分散于该培养基组合物中,因此,使用该培养基组合物时,能够在维持悬浮状态的情况下对细胞、组织进行培养。
成为培养对象的细胞、组织的来源的生物的种类不受特别限定,不仅包括动物(昆虫、鱼类、两栖类、爬行类、鸟类、泛甲壳类、六足类、哺乳类等),也包括植物。
一个方案中,成为培养对象的细胞为支持物依赖性的细胞。使用利用本发明的制造方法能够得到的液态培养基组合物时,可以不使用成为支持物的载体,而在持续维持悬浮状态的条件下培养支持物依赖性的细胞。
本发明中,所谓细胞及/或组织的悬浮是指细胞及/或组织能与培养容器的底面接触但不发生粘附的状态(非粘附)。此外,在本发明中,使细胞及/或组织增殖、分化或维持时,在不伴有相对于液体培养基组合物而言的来自外部的压力、振动或者不伴有在该组合物中的振荡、旋转操作等的情况下,细胞及/或组织在该液体培养基组合物中均匀地分散并处于悬浮状态,将上述状态称为“悬浮静置”,将在该状态下培养细胞和/或组织称为“悬浮静置培养”。另外,作为在“悬浮静置”中能够使其悬浮的时间,包括:5分钟以上、1小时以上、24小时以上、48小时以上、7日以上等,但只要能够保持悬浮状态,则不限于上述时间。
利用本发明的制造方法能够得到的液体培养基组合物能够于能进行细胞、组织的维持、培养的温度范围(例如,0~40℃)中的至少1个温度点,实现细胞及/或组织的悬浮静置。本发明中使用的培养基组合物能够于优选为25~37℃的温度范围中的至少1个温度点、最优选为37℃的条件下实现细胞及/或组织的悬浮静置。
关于悬浮静置是否可能,可通过例如下述方法进行评价:使培养对象的细胞以2×104个细胞/ml的浓度均匀地分散于作为评价对象的培养基组合物中,向15ml圆锥底管中注入10ml,于37℃静置至少5分钟以上(例如1小时以上、24小时以上、48小时以上、7天以上),观察该细胞的悬浮状态是否得以维持,由此进行评价。全部细胞中的70%以上为悬浮状态的情况下,可以得出维持了悬浮状态的结论。也可以代替细胞而使用聚苯乙烯珠(尺寸为500-600μm,polysciencesinc.制)进行评价。
优选方案中,利用本发明的制造方法能够得到液态培养基组合物通过含有上述结构体,其粘度并未实质性地提高。所谓“不实质性地提高液体的粘度”,是指液体的粘度不超过8mpa·s。此时的该液体的粘度(即,利用本发明的制造方法能够得到液态培养基组合物的粘度)于37℃为8mpa·s以下,优选为4mpa·s以下,更优选为2mpa·s以下。包含结构体的液体的粘度可在37℃条件下使用e型粘度计(东机产业株式会社制,tv-22型粘度计,机种:tve-22l,conerotor:标准转子1°34’×r24,转速100rpm)测定。
利用本发明的制造方法能够得到液态培养基组合物中的特定化合物的浓度取决于特定化合物的种类,可以在特定化合物在液体培养基组合物中形成上述的结构体(优选不实质性地提高该液体培养基的粘度)、且能使细胞及/或组织均匀地悬浮(优选使其悬浮静置)的范围内,适宜进行设定。例如,dag的情况下,为0.001%至1.0%(w/v),优选为0.003%至0.5%(w/v),更优选为0.005%至0.3%(w/v),进一步优选为0.01%至0.05%(w/v),最优选为0.01%至0.03%(w/v)。黄原酸胶的情况下,为0.001%至5.0%(w/v),优选为0.01%至1.0%(w/v),更优选为0.05%至0.5%(w/v),最优选为0.1%至0.2%(w/v)。κ-角叉菜胶及刺槐豆胶混合体系的情况下,作为两种化合物的总和,为0.001%至5.0%(w/v),优选为0.005%至1.0%(w/v),更优选为0.01%至0.1%(w/v),最优选为0.03%至0.05%(w/v)。天然型结冷胶的情况下,为0.05%至1.0%(w/v),优选为0.05%至0.1%(w/v)。
作为特定化合物,将上述多糖类组合多种(优选2种)进行使用时,对于该多糖类的浓度,可以在该多糖类的组合能够在液体培养基组合物中形成上述结构体、(优选不实质性地提高该液体培养基的粘度)且能使细胞及/或组织均匀地悬浮(优选悬浮静置)的范围内,适当地设定。例如,使用dag或其盐、与除dag或其盐以外的多糖类的组合时,作为dag或其盐的浓度,可例示0.005~0.02%(w/v),优选为0.01~0.02%(w/v),作为dag或其盐以外的多糖类的浓度,可例示0.0001~0.4%(w/v),优选为0.005~0.4%(w/v),更优选为0.1~0.4%(w/v)。作为具体的浓度范围的组合,可以例示如下。
dag或其盐:0.005~0.02%(优选为0.01~0.02%)(w/v)
dag以外的多糖类
黄原酸胶:0.1~0.4%(w/v)
藻酸钠:0.0001~0.4%(w/v)(优选为0.1~0.4%(w/v))
天然结冷胶:0.0001~0.4%(w/v)
刺槐豆胶:0.1~0.4%(w/v)
甲基纤维素:0.1~0.4%(w/v)(优选为0.2~0.4%(w/v))
角叉菜胶:0.05~0.1%(w/v)
迪特胶:0.05~0.1%(w/v)
需要说明的是,该浓度可以由下式算出。
浓度[%(w/v)]=特定化合物的重量(g)/培养基组合物的容量(ml)×100
优选方案中,使用dag或其盐作为特定化合物,使用钙离子作为连接物质。第一液体为dag或其盐的水溶液。该水溶液中的dag浓度通常为0.05~1.5%(w/v),优选为0.1~1.2%(w/v),更优选为0.5~1.0%(w/v)。第二液体为含有钙离子的液体培养基。该液体培养基中的钙离子浓度为dag形成结构体的浓度,通常为0.1~2.0mm左右。需要混合的第一液体与第二液体的体积比率为(第一液体∶第二液体)=(0.5~10∶100),优选为(1~5∶100),更优选为(1.5~3∶100)。第一液体的体积例如为0.1~20ml,优选为0.3~12ml,更优选为0.6~6ml。第二液体的体积例如为1~1000ml,优选为10~500ml,更优选为40~200ml。作为结果得到的液态培养基组合物中的dag浓度优选为0.01%~0.05%(w/v),最优选为0.01%~0.03%(w/v)。
该液态培养基组合物中包含dag介由钙离子结合而形成的结构体,所述结构体均匀地分散,由此,能够在不实质性地提高粘度的情况下,使细胞及/或组织均匀地悬浮(优选使其悬浮静置)。
使用利用本发明的制造方法得到的液态培养基组合物时,能够在不伴有存在引起细胞等的障碍、功能丧失的风险的振荡、旋转等操作的条件下,于悬浮状态下对细胞及/或组织进行培养。此外,若使用该培养基组合物,则在培养时,能够容易地交换培养基,并且,还能够容易地回收培养的细胞及/或组织。使用该培养基组合物时,能够在悬浮状态下培养以往需要在平板上以单层、粘附于细胞容器的状态的培养的细胞,因此,能够高效、大量地制备粘附性的细胞,而不会损害细胞的功能。
接下来,对本发明的套件进行说明。本发明的套件如图7所示的那样,是将用于实施上述的本发明的制造方法的构成要素整合而成的套装。
如图7所示的那样,本发明的套件中包含容纳有上述的第一液体第一容器的k1,并且,构成为至少具有:上述中说明的、作为用于送出上述第一液体的供给装置1的注射器k2,和参考图2~图5进行说明的作为容器3的第二容器k3。第二容器k3如上述中针对容器3说明的那样,是具有附带喷嘴部的盖k32和主体k31而形成的容器,在该喷嘴部的容器外部侧,还有用于嵌入上述注射器的前端部的筒状部自该盖的外表面突出。
第一容器k1只要为仅以使用者需要的量容纳上述的第一液体、且能够将其送达使用者的容器即可,材料、大小没有限定。第一容器k1优选具有容器主体、和封闭该容器主体的开口的盖的方案,盖优选与容器主体螺合的方案。
第二液体可包含于套件进行提供,也可以是使用者通常使用的液体培养基。
本发明的套件的优选方案中,如图7所示的那样,第二容器k3还附带有以能够将该容器的主体k31内密封的方式构成的、且不具有喷嘴部的密封用盖k32。该密封用盖k32与容器的盖k32具有互换性,能够安装于该容器的主体k31的开口部。
通过提供该密封用盖k32,在使用具有喷嘴部的盖k32而在容器的主体k31内制造液态培养基组合物后,能够在容器的主体k31内将该液态培养基组合物密封。
容器的主体k31为市售品的情况下,该密封用盖k32也可以是该市售品的容器的主体原本附带的盖。
本发明的套件的优选方案中,如图7所示的那样,还附带能够安装于上述注射器k2的前端部的管状部件k21。该管状部件为插入第一容器内、用于将第一液体抽吸至注射器内的抽吸用管。该管状部件为具有能插入第一容器k1内的外径、和能从第一容器内抽吸第一液体的长度的细管部,并且,在上述细管部的一端,具有能够安装于上述注射器的外筒的前端部的连接部。该管状部件可以是注射针,优选为廉价的树脂成型部件。
[实施例]
以下,示出评价本发明的制造装置及制造方法的各种试验例。以下的各试验例中的“比较例”是为了调查本发明的优选数值、条件而进行的实验例,是沿袭本发明的技术构想而实施的,并非表示现有技术。
需要说明的是,各试验中使用的培养基中的2价阳离子浓度如下述表1所示。
[表1]
(试验例1:用于评价本发明的制造装置及制造方法的试验)
制作本发明的制造装置的方案之一,并使用该装置实施本发明的制造方法,观察得到的培养基组合物中的结构体的分散的情况,将试验结果所示如下。另外,示出了作为比较例而使第一液体的射出的流量降低的情况下的试验的结果。
实施例1~9及比较例1~16中,特定化合物为脱酰基结冷胶,第一液体为脱酰基结冷胶溶液,将含有钙离子及镁离子作为用于连接脱酰基结冷胶而形成结构体的连接物质的液体培养基用作第二液体。
〔制造装置的规格〕
实施例1~9及比较例1~16中,制作了图3所示的类型的制造装置。
作为容器,使用市售的圆锥底管(容量225ml(225000mm3)或容量50ml(50000mm3),住友电木株式会社制)的主体部分,以配合该主体的方式制作图5所示的盖。贯穿孔的口径均为0.5mm。因此,贯穿孔的横截面积为约0.2mm2。
作为供给装置,使用容量5ml(5000mm3)或容量1ml(1000mm3)的一次性注射器,使该注射器的外筒的前端部能够以嵌入在盖的外侧突起的圆筒部33的方式连接。
〔第一液体的制备〕
将脱酰基结冷胶(kelcogelcg-la,三晶株式会社制)混悬于超纯水(milli-q水)中使其为0.75%(w/v)后,通过一边于90℃加热一边搅拌而溶解,将该水溶液于121℃进行高压釜灭菌20分钟。
〔液态培养基组合物品的制备〕
作为第二液体,将200ml达尔伯克改良伊格尔培养基(dulbecco’smodifiedeagles’smedium:dmem高葡萄糖,和光纯药公司制)容纳于225ml圆锥底管(住友电木株式会社制),冷却至4℃。dmem中的钙离子浓度为1.80mm,镁离子浓度为0.8mm。
卸下填充有冷却至4℃的第二液体的上述圆锥底管的盖,安装作为本发明的制造装置而制作的盖。
将填充有4ml(4000mm3)上述的经灭菌的脱酰基结冷胶水溶液的一次性注射器的前端部嵌入盖的圆筒部而连接,构成图3中所示的类型的本发明的制造装置。
该状态下,利用人力按压注射器的柱塞,一边使其以均等速度移动,一边将注射器内的脱酰基结冷胶水溶液射入容器内,制作培养基组合物。
变更各液体的浓度、体积、第一液体的射出的流量等的条件,作为实施例1~9及比较例1~16。此处,各例的第一液体的流量通过调节注射器的柱塞的移动时间而达成。另外,实施例3、5、8、比较例3、5、10、14、16中,使用涡旋混合器(2500rpm),一边使第二液体为涡状的搅拌状态,一边射出第一液体。
射出后,分别将适配盖交换为圆锥底管的盖,塞严。
〔评价〕
在制作的培养基组合物中添加用于模拟重现悬浮的细胞的聚苯乙烯珠(直径500~600μm,polysciencesinc.制)并进行搅拌,在自搅拌停止起10分钟后,通过目视确认液中的珠的分散状态。
结构体在液中适宜地微细分散的情况下,珠也维持在液中分散而悬浮的状态。另一方面,结构体的分散不充分时,相应地,珠也会沉淀。
另外,结构体在液中适宜地微细分散的情况下,无法通过目视确认该结构体。另一方面,结构体连接为绳状而聚集时,能够以使光散射的物体、或虽然为透明但由于光的折射而呈现无定形的绳状的物体的形式视认该结构体。
实施例1~9及比较例1~16中的各试验条件、结果产物中的珠的分散状态、结构体的状态示于表2。
表2中,关于珠的分散状态,将理想地分散并悬浮的状态表示为○,虽然分散但部分沉淀的状态表示为△,全部的珠沉淀的状态表示为×。
另外,如下所示,以○、△、×表示结构体为无法视认的状态(视作适宜地微细分散)、或者形成绳状·块状。
○表示与市售的液态培养基组合物fcem(注册商标)同样地,结构体无法视认为悬浮物的状态。
△表示在光下暴露时,能够以使光散射的物体、或虽然为透明但由于光的折射而呈现无定形的绳状的物体的形式视认的状态。
×表示结构体能够视认明显的纤维状析出物的悬浮或沉淀的状态。
[表2]
由表2的结果可知,搅拌第二液体的状态与不搅拌的状态之间没有差异。另外,由比较例1~16表明,即使使用相同的贯穿孔,第一液体的流量小时,流速也降低,微细的结构体不会分散。由上可知,利用本发明的制造方法,能够通过单纯的射出容易地得到结构体理想地分散而形成的培养基组合物。
(试验例2:关于喷嘴部的贯穿孔的口径的试验)
本试验例2中,在以同样的按压力从相同规格的注射器中射出相同量的第一液体的情况下,对使喷嘴部的贯穿孔的口径阶段性变化时的流量和流速的变化、以及与上述试验例1同样的珠的分散状态(悬浮性)、结构体的状态(析出物)的情况进行了评价。
使用的第一液体、注射器、第二液体、圆锥底管与上述试验例1同样。需要说明的是,本试验例2中,为了使喷嘴部的贯穿孔的口径阶段性变化,在注射器的前端部安装了各种规格(gauge)(内径)的注射针。即,本试验例中,注射针的内部通路成为贯穿孔。珠的分散状态(悬浮性)、结构体的状态(析出物)的情况的评价基准与上述试验例1同样。
本试验例2中,使用规号(gaugenumber)18的注射针作为实施例10,相对于此,将相同规号、延长添加时间(减小流量)的试验例作为比较例17。
同样地,使用规号20的注射针作为实施例11,相对于此,将相相同规号、延长添加时间的试验例作为比较例18、19。
同样地,使用规号22的注射针作为实施例12,相对于此,将相同规号、延长添加时间的试验例作为比较例20、21。
此外,作为参考试验,使用小口径的规号25的注射针,实施改变了添加时间的试验,作为比较例21、22、23。
各试验例(实施例、比较例)中的珠的分散状态、结构体的状态示于表3。
此外,下述表4是将上述表3中的记载排列顺序变更,分成实施例10~12、比较例17~24进行记载的表。
表4的结果也表明,即使贯穿孔的内径相同,如果不能以适宜的流量射出第一液体,则无法同时满足良好的珠的分散状态(良好的悬浮性)和良好的结构体的状态(无析出物)。
另外,比较例17~24的结果也表明,即使贯穿孔的截面积在本发明的范围内,向第二液体以1.7ml/秒以下的流量添加第一液体的情况下,无法同时满足良好的珠的分散状态(良好的悬浮性)、和良好的结构体的状态(无析出物)。
(试验例3:关于第一液体的射出方向的试验)
对以下情况珠的分散状态(悬浮性)是否不同进行了评价:上述试验例2中,将第一液体从注射器注入容器内时,在射出的方向为从上方朝向下方射出的情况;和上下翻转容器,使射出的方向为从下方朝向上方射出的情况。
使用的第一液体、注射器、第二液体、圆锥底管与上述试验例1同样。
各试验例中的珠的分散状态(悬浮作用)示于表5。
表5的结果也表明,本发明的制造方法能够与射出方向无关地得到令人满意的悬浮作用。
(试验例4:关于容器的形状、从喷嘴部的出口直到液面为止的距离的试验)
本试验例4中,针对容器的长度(深度方向的尺寸)l与容器的外径d之比(纵横比l/d)、保持于容器内的第二液体的深度z与容器的内径d之比(纵横比z/d)以及从喷嘴部的出口直到液面为止的距离如何影响混合时的悬浮性能进行了考察。
将各试验例中的珠的分散状态(悬浮作用)示于表6。
表6的结果也表明,即使使用相同纵横比l/d的容器,若浸液部浅、纵横比z/d小,从喷嘴部的出口到液面为止的距离大,则存在无法得到令人满意的悬浮性的趋势。得到了以下结果:上述试验例4的条件中,浸液部的纵横比z/d为1.24以下时,无法得到令人满意的悬浮性,而纵横比z/d大于1.24时,能够得到令人满意的悬浮性。
(试验例5:关于改变培养基种类的情况下的悬浮性的试验)
本试验例5中,对变更作为第二液体的培养基的种类而制作液态培养基组合物的情况下的悬浮性进行了调查。将容纳于容器内的第二液体的温度维持为37℃,第一液体的温度为室温(rt)。
各试验例中的珠的分散状态(悬浮作用)和结构体的状态示于表7。
[表7]
表7的结果表明,即使第二液体不同,仍然能够将第一液体与第二液体良好地混合,得到令人满意的悬浮性。
(试验例6:使用了低粘附板的a549细胞的细胞增殖试验)
将脱酰基结冷胶(kelcogelcg-la,三晶株式会社制)以成为0.3%(w/v)或0.75%(w/v)的方式混悬于超纯水(milli-q水)中,通过一边于90℃加热一边搅拌而溶解,将该水溶液于121℃进行高压釜灭菌20分钟。使用0.3%溶液制备培养基组合物,该培养基组合物在含有10%(v/v)胎牛血清的dmem培养基(wako公司制)中添加有最终浓度为0.015%(w/v)的脱酰基结冷胶。向采用现有方法(使用日本专利第5629893号实施例记载的均质混合器的方法)或者实施例7的方法制备的培养基组合物中添加胎牛血清,使其为10%(v/v)。
将人肺癌细胞株a549(dspharmabiomedical公司制)以成为33333个细胞/ml的方式接种至上述的含有胎牛血清、且添加有脱酰基结冷胶的培养基组合物(现有方法)或实施例7的培养基组合物,然后以每1孔150μl注入96孔平底超低粘附表面微量培养板(corning公司制,#3474)的孔中。需要说明的是,作为阴性对照,注入在不含脱酰基结冷胶的与上述同样的培养基中混悬a549细胞而成的物质。接着,将该培养板在co2培养箱(37℃,5%co2)以静置状态培养7天。向刚刚接种之后的0天及培养7天后培养液中添加150μl的atp试剂(celltiter-glotmluminescentcellviabilityassay,promega公司制)进行混悬,于室温静置约10分钟后,使用flexstation3(moleculardevices公司制)测定发光强度(rlu值),减去仅有培养基时的发光值,由此测定活细胞的数量。将以上的试验实施3次以上。
与现有方法相比,使用利用本发明的制造方法得到的培养基组合物的方法呈现了相同程度的a549细胞的增殖性。静置培养的培养天数为0天及7日后的rlu值(atp测定、发光强度)以3次试验的平均值的形式示于表8。
[表8]
表8的结果也表明,与采用现有方法制造的培养基组合物同样,利用本发明的制造方法制造的培养基组合物能够实现细胞的悬浮培养,并暗示了促进细胞的增殖的情况。
(试验例7:低粘附板情况下的使用了曲美替尼及mk-2206a549的细胞增殖抑制试验)
将脱酰基结冷胶(kelcogelcg-la,三晶株式会社制)以成为0.3%(w/v)或0.75%(w/v)的方式混悬于超纯水(milli-q水)中,通过一边于90℃加热一边搅拌而溶解,将该水溶液于121℃进行高压釜灭菌20分钟。使用0.3%溶液制备培养基组合物,该培养基组合物在含有10%(v/v)胎牛血清的dmem培养基(wako公司制)中添加有最终浓度为0.015%(w/v)的脱酰基结冷胶。另外,向实施例7中制备的培养基组合物中添加胎牛血清,使其为10%(v/v)。
将人肺癌细胞株a549(dspharmabiomedical公司制)以14800细胞/ml接种至上述的添加有脱酰基结冷胶的培养基组合物(现有方法)或实施例7的培养基组合物,然后以每1孔135μl注入96孔平底超低粘附表面微量培养板(corning公司制,#3474)的孔中。需要说明的是,作为阴性对照,注入在不含脱酰基结冷胶的与上述相同的培养基中混悬a549细胞而成的物质。接着,将各培养板在co2培养箱(37℃,5%co2)以静置状态进行培养。在培养第1天,分别添加含有10倍浓度的各抗癌剂(以使最终浓度成为0.001至30μm)和最终浓度为0.015%(w/v)的脱酰基结冷胶的培养基组合物15μl(现有方法及本发明的制造方法)、及仅含有10倍浓度的各抗癌剂的培养基组合物15μl(未添加法),继续培养7天。抗癌剂使用了曲美替尼(santacruz公司制,mek抑制剂)及mk-2206(santacruz公司制,akt抑制剂)。向第5天及第8天的培养液中添加150μl的atp试剂(celltiter-glotmluminescentcellviabilityassay,promega公司制)进行混悬,于室温静置约10分钟后,使用flexstation3(moleculardevices公司制)测定发光强度(rlu值),减去仅有培养基时的发光值,由此测定活细胞的数量。
对于各抗癌剂对于a549细胞增殖的抑制效果而言,使用本发明的制造方法制造的培养基组合物和采用现有方法制造的培养基组合物没有确认到差异,为同样的结果,这表明,本发明的培养基组合物也以高水平呈现了mk-2206的药效。另外,静置培养第4天的rlu值(atp测定、发光强度)的%control值示于表9,静置培养第7天的rlu值(atp测定、发光强度)的%control值示于表10。
[表9]
[表10]
表9、表10的结果也表明,与采用现有方法制造的培养基组合物同样,利用本发明的制造方法制造的培养基组合物也能够实现细胞的悬浮培养,并暗示了抗癌剂对于癌细胞的增殖抑制效果得以增强。
(试验例8:针对用各增殖因子刺激的panc02、03细胞的增殖作用与单层培养法进行的比较)
将脱酰基结冷胶(kelcogelcg-la,三晶株式会社制)以成为0.75%(w/v)的方式混悬于超纯水(milli-q水)中后,通过一边于90℃加热一边搅拌而溶解,将该水溶液于121℃进行高压釜灭菌20分钟。与实施例7同样地操作,以使胎牛血清为15%(v/v)的方式制备培养基组合物,作为实施例13,该培养基组合物在rpmi1640培养基(wako公司制)中添加有最终浓度为0.02%(w/v)的脱酰基结冷胶。
将人胰腺癌细胞株panc02、03(atcc公司制)以37000个细胞/ml接种至上述实施例13的培养基组合物(利用本发明的制造方法制作),然后以每1孔135μl的方式注入96孔平底超低粘附表面微量培养板(corning公司制,#3474)的孔中。需要说明的是,作为阴性对照,注入在不含脱酰基结冷胶的与上述相同的培养基中混悬panc02、03细胞而成的物质。对于单层培养法而言,将人胰腺癌细胞株panc02,03细胞以2200个细胞/ml接种至上述的不含脱酰基结冷胶的培养基组合物,然后每1孔135μl注入96孔平底超低粘附表面微量培养板(corning公司制,#3585)的孔中。各培养板在co2培养箱(37℃、5%co2)内以静置状态进行培养。在培养第1天,分别以15μl添加含有以下增殖因子及最终浓度为0.015%(w/v)的脱酰基结冷胶的培养基组合物(利用现有方法及本发明的制造方法制作):10倍浓度的人hb-egf(peprotech公司制)(以使最终浓度为30、100ng/ml);10倍浓度的人egf(peprotech公司制)(以使最终浓度为3、30ng/ml);10倍浓度的人fgf2(peprotech公司制)(以使最终浓度为10、100ng/ml);10倍浓度的人tgf-β1(peprotech公司制)(以使最终浓度为3、30ng/ml);10倍浓度的人pdgf-bb(peprotech公司制)(以使最终浓度为10ng/ml);10倍浓度的人igf-1(peprotech公司制)(以使最终浓度为10、100ng/ml)。单层培养组或阴性对照组中,分别添加15μl仅含有10倍浓度的各增殖因子的培养基组合物。培养持续5天。向第6天的培养液中添加150μl的atp试剂(celltiter-glotmluminescentcellviabilityassay,promega公司制)进行混悬,于室温静置约10分钟后,使用flexstation3(moleculardevices公司制)测定发光强度(rlu值),减去仅有培养基时的发光值,由此测定活细胞的数量。
结果,通过使用了利用本发明的制造方法得到的培养基组合物的panc02、03细胞增殖试验法,可知较之单层培养法、阴性对照组而言,可以更强地呈现人hb-egf和人egf的药效。另外,培养第6天的rlu值(atp测定、发光强度)的%control值示于表11。
[表11]
表11的结果也表明,与采用现有方法制造的培养基组合物同样,利用本发明的制造方法制造的培养基组合物能够实现细胞的悬浮培养,并暗示了hb-egf或egf刺激导致的细胞增殖得以促进。
产业上的可利用性
根据本发明,能够将含有特定化合物的液体与含有2价金属阳离子等连接物质的任意液体(尤其是液体培养基)容易地混合,并且,能够制造微细的结构体分散而形成的液态培养基组合物。
本申请以在日本提出申请的日本特愿2015-078795(申请日:2015年4月7日)为基础,上述申请的内容全部包括在本说明书中。
- 还没有人留言评论。精彩留言会获得点赞!