嵌合抗原受体(CAR)、组合物及其使用方法与流程
相关申请案之交叉参考
本申请案为国际pct申请案,其主张2015年6月25日申请之美国临时申请案第62/184,321号;2015年10月1日申请之第62/235,840号;及2015年10月21日申请之第62/244,435号之优先权,其皆以全文引用之方式併入本文中。
背景技术:
t细胞,淋巴细胞的一种,在细胞介导之免疫性中起重要作用。其与其他淋巴细胞(诸如b细胞及自然杀手细胞(nk细胞))之区别在于细胞表面上存在t细胞受体(tcr)。t辅助细胞,亦称为cd4+t或cd4t细胞,在其表面上表达cd4糖蛋白。辅助t细胞在暴露于由mhc(主要组织相容复合体)ii类分子呈递之肽抗原时活化。一旦活化,此等细胞快速增殖且分泌可调节免疫反应之细胞因子。细胞毒性t细胞,亦称为cd8+t细胞或cd8t细胞,在细胞表面上表达cd8糖蛋白。cd8+t细胞在暴露于由mhci类分子呈递之肽抗原时活化。记忆t细胞,一种t细胞亚群,长期留存并回应于其等同源抗原,因此向免疫系统提供针对过去感染及/或肿瘤细胞之「记忆」。
经基因改造后,t细胞可于其表面产生特殊受体,称为嵌合抗原受体(car)。car为允许t细胞识别肿瘤细胞上之特定蛋白(抗原)之蛋白。此等经工程改造之cart细胞接着在实验室中生长直至其数目达到数十亿。接着将扩增之cart细胞群输注至患者中。
迄今为止,临床试验已证实嵌合抗原受体(car)t细胞在对标准化学疗法具有抗性之血液科恶性疾病中具有巨大前景。最值得注意的是,特定之cd19car(cd19car)t细胞疗法具有显著效果,包括b细胞恶性肿瘤之长期缓解(kochenderfer,wilson等人2010,kalos,levine等人2011,porter,levine等人2011,davila,riviere等人2013,grupp,frey等人2013,grupp,kalos等人2013,kalos,nazimuddin等人2013,kochenderfer,dudley等人2013,kochenderfer,dudley等人2013,lee,shah等人2013,park,riviere等人2013,maude,frey等人2014)。
尽管car疗法在b细胞白血病及淋巴瘤中取得成功,但尚未有明确之car疗法应用于t细胞恶性肿瘤。鉴于t细胞恶性肿瘤之疗法比b细胞恶性肿瘤之疗法具有明显更差之效果(abramson,feldman等人2014),因此car疗法具有进一步解决巨大临床需求之潜力。
迄今为止,当前成果集中于在治疗多种b细胞恶性肿瘤中有显示功效之cart细胞。尽管在使用cd19car之b-all中约90%之初始缓解率为常见的,但大部分在一年内复发。至少部分复发原因归于抗原逃逸。因此,现时迫切地需要更有效的cart细胞治疗以防止复发。标靶探索及选择为初始步骤,因为不存在可确保或引导有效car设计之一般法则。
现时存在一些阻碍car治疗性方法之更广泛应用之障碍。其中最常见挑战为:(1)抗原标靶及嵌合抗原受体之选择;(2)car设计;(3)肿瘤异质性,尤其肿瘤抗原之表面表达之差异。靶向单一抗原具有免疫逃逸之风险,此可由靶向多个所需抗原来解决。
大部分car嵌合抗原受体为来源于单株抗体之scfv且部分此等单株抗体已用于临床试验或疾病治疗。然而,单株抗体具有有限功效,表明需要替代的及更强效的靶向方法,诸如car。scfvs为car之最常用的嵌合抗原受体。然而,抗原上所识别之抗原决定基之car亲和结合及位置可影响功能。此外,t细胞或nk细胞之表面car表达量受适合的前导序列及启动子影响。此外,过表达之car蛋白可对细胞具有毒性。
因此,现时仍然需要经改良之基于嵌合抗原受体之疗法,其可慮及t细胞相关恶性肿瘤之更有效、安全及有效靶向。
技术实现要素:
本发明在一个实施例中,本发明提供经工程改造之细胞,其具有第一嵌合抗原受体多肽,其包括第一抗原识别域、第一信号肽、第一铰链区、第一跨膜域、第一共刺激域及第一信号传导域;及第二嵌合抗原受体多肽,其包括第二抗原识别域、第二信号肽、第二铰链区、第二跨膜域、第二共刺激域及第二信号传导域;其中第一抗原识别域与第二抗原识别域不同。
在另一实施例中,本发明提供经工程改造之多肽,其包括嵌合抗原受体及强化子。
在另一实施例中,本发明提供经工程改造之多肽,其包括嵌合抗原受体多肽及强化子。
在另一实施例中,本发明提供经工程改造之嵌合抗原受体多肽,该多肽包括:信号肽、cd45抗原识别域、铰链区、跨膜域、至少一个共刺激域及信号传导域。在另一实施例中,本发明提供编码前述多肽之聚核苷酸。
在另一实施例中,本发明提供经工程改造之细胞,其具有上述经工程改造之多肽或聚核苷酸。
在另一实施例中,本发明提供降低标靶细胞数量之方法,其包括以下步骤(i.)使该等标靶细胞与有效量之具有至少一个嵌合抗原受体多肽之经工程改造之细胞接触,经工程改造之细胞具有多个嵌合抗原受体多肽,各嵌合抗原受体多肽为独立的;及(ii.)视情况分析该等细胞之数量之降低。标靶细胞包括至少一个选自由以下组成之群的细胞表面抗原:介白素6受体、ny-eso-1、α胎蛋白(afp)、磷脂酰肌醇聚糖-3(gpc3)、baff-r、bcma、taci、ley、cd5、cd13、cd14、cd15cd19、cd20、cd22、cd33、cd41、cd45、cd61、cd64、cd68、cd117、cd123、cd138、cd267、cd269、cd38、flt3受体及cs1。
在另一实施例中,本发明提供向有需要之患者投与任一种上述经工程改造之细胞来治疗b细胞淋巴瘤、t细胞淋巴瘤、多发性骨髓瘤、慢性骨髓性白血病、b细胞急性淋巴细胞白血病(b-all)及细胞增殖性疾病之方法。
图式简单说明
图1.ccar构筑体(下文中,「多个car或化合物car」)之示意图。多样或复合的car靶向多种抗原(例如细胞类型1或细胞类型2或相同细胞类型)。多样的或ccart细胞免疫疗法包含个别组件car,其包含不同或相同的抗原识别域、铰链区、跨膜域、多种共刺激域及胞内信号传导域。
图2a.ccar-t构筑体之示意图。构筑体包含驱使由p2a肽连接之car之多个模组单元之表达的sffv启动子。在连接子裂解后,ccar裂解且在标靶表达cd33及/或cd123时接合。作为新颖的ccar构筑体,构筑体之活化域可包括(但不限于)cd33car区段上之4-1bb及cd123car上之cd28区域。
图2b.描绘经转导之cd33cd123ccar-t细胞之表达之蛋白印迹法。该图描绘两种不同car蛋白质,亦即cd33car及cd123car之表达。在连接子裂解时表达cd33及cd123car之ccar-t细胞产生两种不同且始终强烈的蛋白质谱带。包括绿色萤光蛋白质(gfp)作为阴性对照。
图2c.表达转导效率之流式细胞术。上图展示在用于ucb(脐带血)及pb(外周血)t细胞之前,在293fthek(人胚肾)细胞上测试以检验最大转导效率之cd33cd123ccar(亦称为cd33cd123-2g-car)之慢病毒效价。下图展示经包含cd33cd123ccar构筑体之慢病毒载体转导之cd33cd123ccar(亦称为cd33cd123-2g-car)t细胞及作为对照物之经gfp转导之细胞。由黄色环指示之百分比为转导效率之替代物。
图3.展示产生高效复合car(ccar)之方法的示意图。
图4.cd33cd123-2gcar-t细胞(ccar)与前髓细胞性白血病细胞系hl60一起培育之共培养分析。比较ccar-t细胞(下图)与对照性经gfp转导之t细胞(上图)。藉由在培育约24小时之后留存之cd33+细胞群体(黄色环中包围)来测量杀伤力。
图5.ccar-t细胞与骨髓性白血病细胞系kg-1a一起培育之共培养分析,其表达约100%cd33及约50-80%cd123。比较ccar-t细胞(下图)与对照性经gfp转导之t细胞(上图)。藉由在培育约24小时之后留存之cd33+细胞群体来测量杀伤力。
图6.ccar-t细胞与aml患者样品(此处称为aml-9)一起培育之共培养分析。患者细胞包括混合细胞群,诸如白血病细胞、单核细胞及其他类型之原始细胞。cd33充当car-t作用标记物以及cd34(白血病细胞之特异性标记物)之标记物。比较car-t图(右侧)与对照性经gfp转导之t细胞(中间)。藉由在培育至少24小时之后留存之cd33+/cd34+细胞群体来测量杀伤力。
图7.ccar-t细胞与b-all患者样品(此处称为sp-bm-b6)一起培育之共培养分析。患者细胞包括混合细胞群,诸如白血病细胞、单核细胞及其他类型之原始细胞。cd34充当白血病细胞之特定标记物。比较car-t图(右侧)与对照性经gfp转导之t细胞(中间)。借由在培育至少24小时之后留存之cd34+细胞群体来测量杀伤力。
图8.nk-92细胞中之cd33cd123ccar表达。使用山羊抗小鼠抗体f(ab)2侦测cd33cd123ccar表达。
图9.ccarnk-92细胞与hl-60一起培育之共培养分析。比较ccarnk-92细胞与经gfp转导之nk-92细胞。藉由在培育约24小时之后留存之cd33+细胞群体来测量杀伤力。
图10.ccarnk-92细胞与kg1a一起培育之共培养分析。比较ccarnk细胞图与经gfp转导之nk-92细胞。藉由在培育约24小时之后留存之cd33+细胞群体来测量杀伤力。
图11.具有hl-60或kg1a之cd33cd123ccar(car-cd33/123)nk-92细胞之剂量反应。藉由在培育约24小时之后留存之cd33+细胞群体来测量杀伤力。
图12.两个kg11细胞群中cd33cd123ccarnk-92细胞杀伤力与对照物之比较。在car-cd33/123(cd33cd123ccarnk-92细胞)及标靶细胞kg1a之不同比率下进行分析。藉由在培育约24小时之后留存之cd33+cd123+或cd33+cd123-细胞群体来测量杀伤力。
图13.ccar之示意图。构筑体包含驱使由连接子连接之car之多个模组单元之表达的sffv启动子。当连接子裂解时,ccar裂解且在标靶表达多种标靶抗原(cd19及/或cd20,及/或cd22及/或138)之组合时接合。多种ccar使用相同或不同共刺激域,诸如(但不限于)4-1bb(亦标记为4-bb)及/或cd28。
图14a-c.bcma-cs1ccar构筑体组合(bc1ccar)。(a)构筑体由驱使由p2a肽连接之car之两个模组单元之表达的sffv启动子组成。当此p2a肽裂解时,ccar裂解且在标靶表达bcma及/或cs1时接合。两个单元car使用相同共刺激域4-1bb。(b)关于载体(左侧)及对f(ab)2展示15.3%阳性之bc1ccar(右侧,由正方形突出显示)之t细胞表面上bc1ccar表达之流式细胞术分析。针对同型对照物进行闸控。(c)藉由共培养经bcmacdna(bcma-k562)转导之k562细胞(自kochenderfer,nih获得)进行bc1ccar-t细胞之基本功能性验证。柱状图展示bcma-k562细胞系之溶解对比对照性t细胞以及野生型k562(wt-k562)之溶解对比对照物。
图14d.各单元使用两种不同共刺激域(4-1bb或cd28)之bcmacs1-2g构筑体。构筑体包括驱使由p2a肽连接之car之两个模组单元之表达的sffv启动子。当此p2a肽裂解时,ccar裂解且接合表达bcma及/或cs1之标靶。两个单元car使用不同共刺激域,亦即4-1bb或cd28。关于载体(左侧)及对f(ab)2展示罕见阳性细胞之bc1ccar(右侧,由正方形突出显示)之t细胞表面上bc1ccar表达之流式细胞术分析。针对同型对照物进行闸控。
图14e.hek-293ft细胞中bc1ccar及bcma-cs1-2g之蛋白表达。hek-293ft细胞用gfp(道1)、bc1ccar(道2)、cd269-cs1-2g(道3)之慢病毒质体转染48小时,在转染之后移出上清液,且亦移出细胞。细胞与小鼠抗人类cd3z抗体一起溶解以用于蛋白印迹法及调查。
图15a-b.mm1s细胞系共培养。在24小时下进行共培养后收集且经由流式细胞术分析。标靶mm1s细胞(骨髓瘤细胞)用cytotracker(cmtmr)染料标记以区分其与效应子t细胞。藉由抗bcma(cd269)及抗cs1(cd319)抗体闸控群体。图15a:共培养之流式细胞术绘图。图15b:右侧:溶解对比e:t比率之概览图。
图16a-b.rpmi-8226细胞系共培养。在24小时下进行共培养后收集且经由流式细胞术分析。标靶rpmi-8226细胞用cytotracker(cmtmr)染料标记以区分其与效应子t细胞。藉由抗bcma(cd269)及抗cs1(cd319)抗体闸控群体。图16a:共培养之流式细胞术绘图。图16b:溶解对比e:t比率之概览图。
图17a-b.u266细胞系共培养。在24小时下进行共培养且收集,且经由流式细胞术分析。标靶u266细胞用cytotracker(cmtmr)染料标记以区分其与效应子t细胞。藉由抗bcma(cd269)及抗cs1(cd319)抗体闸控群体。左侧:共培养之流式细胞术绘图,右侧:溶解对比e:t比率之概览图。
图18a-b.mm10-g原发性患者样品共培养及比溶胞率。在24小时下进行共培养且收集且经由流式细胞术分析。标靶mm10-g细胞用cytotracker(cmtmr)染料标记以区分其与效应子t细胞。借由抗bcma(cd269)及抗cs1(cd319)抗体闸控群体。值得注意的是,闸控展示呈现不同bcma+及cs1+群体之mm10-g。图18a:共培养之流式细胞术绘图。图18b:溶解对比e:t比率之概览图。
图19a-b.mm7-g原发性患者样品共培养及比溶胞率。在24小时下进行共培养且收集且经由流式细胞术分析。标靶mm7-g细胞用cytotracker(cmtmr)染料标记以区分其与效应子t细胞。借由抗bcma(cd269)及抗cs1(cd319)抗体闸控群体。图19a:共培养之流式细胞术绘图。图19b:溶解对比e:t比率之概览图。
图20a-b.mm11-g原发性患者样品共培养及比溶胞率。在24小时下进行共培养且收集且经由流式细胞术分析。标靶mm11-g细胞用cytotracker(cmtmr)染料标记以区分其与效应子t细胞。借由抗bcma(cd269)及抗cs1(cd319)抗体闸控群体。图20a:共培养之流式细胞术绘图。图20b:溶解对比e:t比率之概览图。
图21.cd269cs1-bbcarnk细胞展现活体内抗白血病作用。nsg小鼠以亚致死剂量辐射且在第二天静脉内注射表现萤光素酶之mm.1s多发性骨髓瘤细胞以诱导可测量之肿瘤形成。在3天之后,向小鼠静脉内注射8×106个cd269-cs1-bbcarnk细胞或载体对照性nk对照细胞。在第3、6及8天,向小鼠皮下注射redijectd-萤光素且让小鼠经历ivis成像。比较经cd269-cs1-bbcarnk注射之小鼠与经载体对照性nk注射之小鼠之平均光强度。
图22.测量小鼠之存活百分比且基于来自图21之研究在两个组之间进行比较。
图23.crispr/cas9干扰系统。分别藉由u6及sffv促进剂驱使sgrna及cas9嘌呤霉素之表达。cas9藉由e2a自裂解序列与嘌呤霉素抗性基因连接。
图24.提供用于产生靶向恶性血液疾病之cart或nk细胞之步骤之实例的示意图。
图25.使用crispr/cas9慢病毒系统之表达稳定cd45阻断基因nk-92细胞之产生及分选。流式细胞术分析指示nk-92细胞表面上之cd45表达量(左图)。在sgcd45bcrispr转导至nk-92细胞中之后,经转导之细胞在含有嘌呤霉素之培养基中培养数周。使用cd45抗体测定cd45阴性nk-92细胞且进行分选。藉由流式细胞术分析测定稳定nk45i-92(表达cd45阻断基因)nk-92细胞之纯度(右图)。此资料证实成功产生及获得nk45i-92细胞。
图26.野生型、经gfp转导之nk-92或nk45i-92nk细胞之细胞生长曲线。为了评估nk-92细胞中由cd45阻断基因表达(kd)引起之细胞增殖作用,在接种至24孔板中之后第48小时及第96小时对nk-92(●)、经gfp转导之-92(■)及nk45i-92(▲)细胞之数目进行计数。在第48小时时间点时添加il-2(一式两份地进行n=3独立实验)。资料为平均值±s.d.。此等资料指示nk-92上cd45受体之阻断基因表达与未经转导之nk-92或经gfp转导之nk-92细胞相比展示类似的细胞生长曲线。
图27a-b.用ccrf-cem(标靶:t)及gfpnk-92或gfpnk45i-92细胞(效应子:e),5:1(e:t)比率进行之共培养分析。16小时培育。(a)对仅ccrf-cem(左图中之蓝点)、在与ccrf-cem及对照性经gfp转导之nk-92细胞(中间图)或gfpnk45i-92细胞(右图)之共培养之流式细胞术分析。所有图中之蓝点指示残余标靶ccrf-cem细胞且红点展示共培养分析法之效应细胞。总培育时间为16小时且效应子t细胞:标靶细胞之比率为5:1。一式两份地进行所有实验。(b)柱状图指示在用ccrf-cem进行之共培养分析法中,经gfp转导之nk45i-92细胞与对照性经gfp转导之nk92细胞相比之细胞溶解百分比。此等资料表明与gfp对照性nk-92细胞活体外共培养分析法相比,nk-92细胞中cd45之阻断基因表现在针对ccrf-cem细胞之杀伤活性方面没有显著差异。蓝点位于左上方部分中。
图28a-b.用ccrf-cem(标靶:t)及gfpnk-92、cd5carnk-92或cd5carnk45i-92细胞(效应子:e)进行之共培养分析法。5:1(e:t)比率。16小时培育(a)自右向左,对仅ccrf-cem(左图)、在与ccrf-cem及对照性gfpnk-92细胞(中间左图)、cd5carnk-92细胞(中间右图)、cd5carnk45i-92细胞(右图)之共培养之流式细胞术分析。所有图中之蓝点指示残余标靶ccrf-cem细胞且红点展示共培养分析法之效应细胞。总培育时间为16小时且效应子t细胞:标靶细胞之比率为5:1。一式两份地进行所有实验。(b)柱状图指示在用ccrf-cem进行之共培养分析法中,cd5carnk-92细胞或cd5carnk45i-92细胞与对照性gfpnk92细胞相比之细胞溶解百分比。资料为平均值±s.d.。与对照性gfpnk-92细胞相比,cd5carnk细胞及cd5carnk45i-92细胞皆展示针对cd5阳性ccrf-cem之约100%细胞杀伤活性。此等资料表明与gfp对照性nk-92细胞活体外共培养分析法相比,cd5carnk细胞及cd5carnk45i-92细胞可有效地溶解表达cd5之ccrf-cem细胞,且提供cd45之阻断基因表达不影响nk-92细胞中关于杀伤活性之细胞功能的证据。蓝斑位于自左侧开始之前面两个图之左上方部分中。
图29a-b.cd45car构筑体之组织及其表达。(a)cd45car慢病毒载体(lentiviralvector)之示意图。cd45car构筑体为模组化信号传导域,其含有:前导序列、抗cd45scfv、铰链域(h)、跨膜域(tm)、两个定义构筑体为第3代car之共刺激域(cd28及4-1bb)及胞内信号传导域cd3ζ。(b)hek-293ft细胞用gfp(道1)及cd45car(道2)之慢病毒质体转染。在转染之后48小时,移出上清液,且亦移出细胞。细胞与小鼠抗人类cd3z抗体一起溶解以用于蛋白印迹法及调查。
图30a-b.将cd45car转导至nk45i-92细胞中且将经cd45car转导之细胞进行细胞分选。(a)在cd45car慢病毒转导至nk45i-92细胞中之后,与nk45i-92细胞(左图)相比,藉由流式细胞术分析测定之nk45i-92上cd45car之表达量(中间图中之蓝圈)。分选表达cd45car之nk45i-92细胞且藉由流式细胞术分析测定细胞表面上之cd45表达量(右图)。(b)藉由流式细胞术分析侦测到细胞表面上约87%cd45car表达。
图31a-31b.用ccrf-cem(标靶:t)及gfpnk-92或cd45carnk45i-92细胞(效应子:e)进行共培养分析。5:1(e:t)比率。16小时培育。(a)对与ccrf-cem及对照性经gfp转导之nk-92细胞(左图)或cd45carnk45i-92细胞(右图)之共培养之流式细胞术分析。所有图中之蓝点指示残余标靶ccrf-cem细胞且红点展示共培养分析法之效应子nk-92细胞。总培育时间为16小时且效应子t细胞:标靶细胞之比率为5:1。一式两份地进行所有实验。(b)柱状图指示在用ccrf-cem进行之共培养分析法中,与对照性gfpnk92细胞相比,cd45carnk45i-92细胞之细胞溶解百分比。资料为平均值±s.d.。与对照性gfpnk-92细胞相比,cd45carnk45i-92细胞展示针对ccrf-cem细胞之约70%细胞溶解。此等资料表明与gfp对照性nk-92细胞活体外共培养分析法相比,cd45carnk45i-92细胞有效溶解表达cd45之ccrf-cem细胞。
图32a-c.与jurkat细胞(标靶:t)及gfp对照组或cd45carnk45i-92细胞(效应子:e)之共培养分析。5:1或2:1(e:t)比率。6小时培育。(a)在用cmtmr细胞追踪剂染料将jurkat细胞染色之后,进行流式细胞术分析。此等资料证实jurkat细胞为cd45阳性(左图)且大部分为cd56阴性细胞(右图)。(b)对与jurkat细胞(标靶:t)及对照物或cd45carnk45i-92细胞(效应子:e)之共培养之流式细胞术分析。以5:1或2:1(e:t)之比例进行共培养分析。左图展示以5:1(e:t)比率进行之与对照性gfp或cd45car/cd45kdnk-92细胞之共培养且右图指示以2:1(e:t)比率进行之与对照性gfp或cd45carnk45i-92细胞之共培养。图中之蓝点指示残余标靶jurkat细胞且红点表示共培养分析法之效应细胞。总培育时间为6小时。一式两份地进行所有实验。(c)柱状图展示在5:1或2:1(e:t)比率下,与对照性gfpnk92细胞相比,cd45carnk45i-92细胞之细胞溶解百分比。资料为平均值±s.d.。在两种条件下,与对照性gfpnk-92细胞相比,cd45carnk45i-92细胞展示针对jurkat细胞之约60%细胞溶解。此资料表明与gfp对照性nk-92细胞活体外共培养分析法相比,cd45carnk45i-92细胞有效溶解在细胞表面上表达cd45之jurkat细胞。
图33a-c.用gfp-nk-92细胞(标靶:t)及未经转导之nk-92细胞或cd45carnk45i-92细胞(效应子:e)进行之共培养分析法。5:1或2:1(e:t)比率。6小时培育(a)使用gfp对照性nk-92细胞进行流式细胞术分析。此等资料证实gfp对照性nk-92细胞为约99%gfp阳性细胞(绿点)。(b)对与gfp对照性nk-92细胞(标靶:t)及未经转导或cd45carnk45i-92细胞(效应子:e)之共培养分析法之流式细胞术分析。以5:1或2:1(e:t)进行共培养分析法之比率。左图展示以5:1(e:t)比率进行之与未经转导或cd45carnk45i-92细胞之共培养且右图指示以2:1(e:t)比率进行之与未经转导或cd45carnk45i-92细胞之共培养。图中之绿点指示残余标靶gfpnk-92细胞且红点表示共培养分析法之效应细胞。培育时间为6小时。一式两份地进行所有实验。(c)柱状图展示在5:1或2:1(e:t)比率下,与未经转导之nk-92细胞相比,由cd45carnk45i-92细胞进行之gfpnk-92细胞之细胞溶解百分比。资料为平均值±s.d.。与未经转导之nk-92细胞相比,针对gfpnk-92细胞,cd45carnk45i-92细胞在2:1(e:t)比率下展示约20%细胞溶解且在5:1(e:t)比率下展示约55%细胞溶解。此资料表明与未经转导之nk-92细胞活体外共培养分析法相比,cd45carnk45i-92细胞有效溶解在细胞表面上表达cd45之gfpnk-92细胞。绿点位于各图之右上方部分中。
图33d-e.将cd45b-bb或cd45b-28转导至nk45i-92细胞中且进行经cd45b-bb或cd45b-28转导之nk45i-92细胞之细胞分选。(d)在cd45b-bb或cd45b-28慢病毒转导至nk45i-92细胞中之后,与nk45i-92细胞(左图)相比,藉由流式细胞术分析来测定nk45i-92上cd45b-bbcar或cd45b-28car之表面表达量(中间图中之蓝圈)。(e)藉由流式细胞术分析分选表达cd45b-bb或cd45b-28car之nk45i-92细胞。藉由流式细胞术分析侦测到细胞表面上约74%cd45b-bbcar或82%cd45b-28car表达。
图33f-g.与reh细胞(标靶:t)及gfpnk-92细胞或cd45carnk45i-92细胞或cd45b-bbnk45i-92细胞或cd45b-28nk45i-92细胞(效应子:e)之共培养分析法。5:1(e:t)比率。20小时培育。(f)对仅reh细胞(左图)、与reh细胞及对照性经gfp转导之nk-92细胞(左侧第2个图)、cd45carnk45i-92细胞(中间图)、cd45b-bbnk45i-92细胞(左侧第4个图)或cd45b-28nk45i-92细胞(右图)之共培养之流式细胞术分析。所有图中之蓝点指示残余标靶reh细胞且红点展示共培养分析法之效应子gfp或car-nk-92细胞。reh为b急性淋巴细胞白血病细胞系。总培育时间为20小时且效应子nk-细胞:标靶细胞之比率为5:1。一式两份地进行所有实验。(g)柱状图指示在用reh细胞进行之共培养分析法中,与对照性gfpnk92细胞相比,cd45carnk45i-92细胞、cd45b-bbnk45i-92细胞或cd45b-28nk45i-92细胞之细胞溶解百分比。资料为平均值±s.d.。与对照性gfpnk-92细胞相比,针对reh细胞,cd45carnk45i-92细胞展示约76%细胞溶解,cd45b-bbnk45i-92细胞展示约79%细胞溶解且cd45b-28nk45i-92展示100%细胞溶解。此等资料表明所有三种cd45car皆有效溶解reh细胞。
图34a-b.说明t或nk细胞中构筑体及其表达之示意图。(a)在表现载体上组装car(第三代)、sushi/il-15之组合且藉由sffv启动子驱使其表达。具有sushi/il-15之car与p2a裂解序列连接。sushi/il-15部分由与sushi域融合之il-2信号肽组成且经由26胺基酸聚脯胺酸连接子连接至il-5。(b)car及sushi/il15存在于t或nk细胞上。
图35a-b.cd4il15ra-car表达。(a)hek-293ft细胞用gfp(道1)及cd4il15racar(道2)以及阳性对照cd4car(道3)之慢病毒质体转染。在转染之后48小时,移出上清液,且亦移出细胞并用小鼠抗人类cd3z抗体进行蛋白印迹法。(b)hek-293细胞用来自经转染之hek-293ft细胞之gfp(左侧)或cd4il15racar(右侧)病毒上清液转导。在3天培育之后,收集细胞,用山羊抗小鼠f(ab')2染色且藉由流式细胞术分析。
图36.用cd4il15racar进行之nk细胞之转导。nk-92细胞用来自经转染之hek-293ft细胞之gfp(左侧)或cd4il15racar(右侧)病毒上清液转导。在第一次转导之后24小时进行第二次转导。在第二次转导之后24小时,收集细胞,洗涤且与新鲜的培养基及il-2一起移至组织培养盘中。在3天培育之后,收集细胞且用山羊抗小鼠f(ab')2抗体或山羊igg(对照物)以1:250染色30分钟。洗涤细胞且用抗生蛋白链菌素-pe结合物以1:500染色,洗涤,悬浮于2%福马林(formalin)中且藉由流式细胞术分析。
图37.用cd4il15racar转导t细胞。左侧为蛋白印迹法。hek-293ft细胞用gfp(道1)及cd4il15ra-car(道2)之慢病毒质体转染。在转染之后48小时,移出上清液,且亦收集细胞并用小鼠抗人类cd3ζ抗体进行蛋白印迹法。右侧为cd4il15racar表达。来自脐带血白血球层之经活化之t细胞用来自经转染之hek-293ft细胞之gfp(左侧)或cd4il15racar(右侧)病毒上清液转导。在第一次转导之后24小时进行第二次转导。在第二次转导之后24小时,收集细胞,洗涤且与新鲜培养基及il-2一起移至组织培养盘中。在3天培育之后,收集细胞且用山羊抗小鼠f(ab')2或同型对照染色30分钟。用gfp(左侧)或cd4il15ra(右侧)转导。洗涤细胞且用抗生蛋白链菌素-pe结合物以1:250染色,洗涤,悬浮于2%福马林(formalin)中且藉由流式细胞术分析。
图38a-b.cd4carnk-92细胞及cd4il15racarnk-92细胞消除共培养中之karpas299t白血病细胞。经gfp对照物(右上方)、cd4car(左下方)或cd4il15ra(右下方)慢病毒上清液转导之nk-92细胞以5:1之比率与karpas299细胞一起培育。在4小时共培养之后,细胞用小鼠抗人类cd4(apc)及cd3(percp)抗体染色且藉由流式细胞术(n=2)分析。左上图展示单独的经标记之karpas299细胞。溶解之标靶细胞之百分比展示于图中。
图39.cd4carnk-92细胞及cd4il15racarnk-92细胞消除共培养中表达cd4之molt4t白血病细胞。经gfp对照物(左侧)、cd4car(中间)或cd4il15ra(自右侧起第二个)慢病毒上清液转导之nk-92细胞以1:1或2:1之效应子:标靶比率与molt4细胞一起培育。在隔夜共培养之后,细胞用小鼠抗人类cd4(apc)及cd56(percp)抗体染色且藉由流式细胞术(n=2)分析。右上图展示单独的经标记之molt4细胞。溶解之标靶细胞之百分比展示于图中。
图40.cd4il15racart细胞展示比cd4car更强效的活体内抗白血病作用。nsg小鼠以亚致死剂量辐射且在第二天静脉内(尾部静脉)注射表现萤光素酶之molm13细胞以诱导可测量之肿瘤形成。在3天之后,向小鼠静脉内注射一个疗程之8×106个cd4car,或cd4il15racart细胞或载体对照性t对照细胞。在第3、6、9及11天,在小鼠皮下注射redijectd-萤光素并让小鼠经历ivis成像。
图41.测量小鼠中之肿瘤减小百分比且基于来自图40之研究在三个组之间进行比较。比较经cd4car及cd4il15racart注射之小鼠之所测量的平均光强度与经载体对照性t注射之小鼠,且与剩余肿瘤负荷相关。在每个由两种注射情况组成之组中,cd4cart位于左侧且cd4il15racart位于右侧。
图42.在6孔组织培养盘中,在具有10%fbs之dmem中,使用所指示之体积,hek293细胞用ef1-gfp或sffv-gfp病毒上清液转导。在第二天早晨更换培养基。四十八小时之后,在10×下使用gfp在evos萤光显微镜上观测经转导之细胞。
图43.使用来自前述图之体积,使经ef1-gfp或sffv-gfp病毒上清液转导之hek293细胞胰蛋白酶化,悬浮于福马林中且用流式细胞术分析,使用fitc通道以测定gfp+细胞之百分比。
图44a-44b.在转导之后第7、14、21及28天,在少量或大量病毒上清液情况下,使经ef1-gfp或sffv-gfp病毒上清液转导之经活化之脐带血白血球层t细胞胰蛋白酶化,悬浮于福马林中且用流式细胞术分析,使用fitc通道以测定gfp+细胞之百分比。
(a)在少量或大量上清液情况下经转导之细胞之gfp+t细胞百分比。
(b)相对于在少量sffv-gfp上清液情况下经转导之t细胞中之gfp+细胞百分比,在大量ef1-gfp上清液情况下经转导之gfp+t细胞之百分比。(使用50μlsffv-gfp及1mlef1-gfp上清液)。(n=2)。
图45.恶性浆细胞中之配位体受体相互作用。april配位体结合tac1或bcma。baff配位体结合tac1、bcma或baff-r。
实施方式
本发明提供嵌合抗原受体(car)组合物,其制造及使用方法。
嵌合抗原受体(car)多肽包括信号肽、抗原识别域、铰链区、跨膜域、至少一个共刺激域及信号传导域。
第一代car包括cd3z作为胞内信号传导域,而第二代car包括来源于多种蛋白质之至少一个单一共刺激域。共刺激域之实例包括(但不限于)cd28、cd2、4-1bb(cd137,亦称为「4-bb」)及ox-40(cd124)。第三代car包括两个共刺激域,诸如(但不限于)cd28、4-1bb、cd134(ox-40)、cd2及/或cd137(4-1bb)。
如本文中所使用,术语「肽」、「多肽」及「蛋白质」可互换使用,且是指具有由肽键共价连接之胺基酸残基之化合物。蛋白质或肽必须含有至少两个胺基酸,且对可包括蛋白质或肽序列之胺基酸最大数目无限制。多肽包括任何具有两个或更多个藉由肽键彼此接合之胺基酸之肽或蛋白质。如本文所使用之术语是指短链(其在此项技术中亦通常称为例如肽、寡肽及寡聚物)及长链(其在此项技术中通常称为蛋白质,其存在多种类型)。「多肽」尤其包括例如生物活性片段、实质上同源多肽、寡肽、均二聚体、杂二聚体、多肽变异体、经修饰之多肽、衍生物、类似物、融合蛋白。多肽包括天然肽、重组型肽、合成肽或其组合。
「信号肽」包括肽序列,其引导细胞内肽及任何连接之多肽之传递及定位,例如传递及定位至某一细胞器(诸如内质网)及/或细胞表面。
信号肽为任何分泌或跨膜蛋白之肽,其引导所揭示之多肽传递至细胞膜及细胞表面,且提供本发明之多肽之正确定位。特定言之,本发明之信号肽将本发明之多肽引导至细胞膜,其中多肽之细胞外部分在细胞表面上显示,跨膜部分横跨质膜,且活性域位于细胞质部分或细胞之内部中。
在一个实施例中,信号肽在通过内质网(er)之后裂解,亦即为可裂解之信号肽。在一个实施例中,信号肽为i、ii、iii或iv型人类蛋白质。在一个实施例中,信号肽包括免疫球蛋白重链信号肽。
「抗原识别域」包括对以下各者具有选择性或靶向以下各者之多肽:标靶之抗原、受体、肽配位体或蛋白质配位体;或标靶之多肽。
抗原识别域可自与配位体结合及/或信号转导相关之广泛多种细胞外域或分泌蛋白质中之任一者获得。抗原识别域可包括与ig轻链之一部分连接之ig重链之一部分,其组成特异性结合于标靶抗原之可变单链片段(scfv)。抗体可为单株或多株抗体或可具有任何特异性结合于标靶抗原之类型。在另一实施例中,抗原识别域可为受体或配位体。在特定实施例中,标靶抗原对特定疾病病状具有特异性且该疾病病状可为任何类型,只要其具有细胞表面抗原即可,该细胞表面抗原可由化合物car架构中存在之嵌合受体构筑体中之至少一者识别。在特定实施例中,嵌合受体可用于任何其中存在特异性单株或多株抗体或能够产生特异性单株或多株抗体之癌症。特定言之,诸如神经母细胞瘤、小细胞肺癌、黑素瘤、卵巢癌、肾细胞癌、结肠癌、霍奇金氏淋巴瘤(hodgkin'slymphoma)及儿童急性淋巴细胞白血病之癌症具有对嵌合受体具有之抗原。
标靶特异性抗原识别域较佳包括来源于针对标靶之抗原之抗体的抗原结合域,或结合标靶之抗原之肽,或结合抗体(其结合标靶之抗原)之肽或蛋白质,或结合标靶上之受体之肽或蛋白质配位体(包括(但不限于)生长因子、细胞激素或荷尔蒙),或来源于结合标靶上之肽或蛋白质配位体之受体(包括(但不限于)生长因子受体、细胞激素受体或荷尔蒙受体)之域。
在一个实施例中,抗原识别域包括针对标靶(对标靶具有选择性)之单株或多株抗体之结合部分或可变区。
在另一实施例中,抗原识别域包括骆驼科(camelid)单域抗体,或其部分。在一个实施例中,骆驼科单域抗体包括在骆驼中发现之重链抗体,或vhh抗体。骆驼科(例如骆驼、单峰驼、大羊驼及羊驼)之vhh抗体系指骆驼单链抗体之可变片段(参见nguyen等人,2001;muyldermans,2001),且亦包括经分离之骆驼vhh抗体、重组型骆驼vhh抗体或合成骆驼vhh抗体。
在另一实施例中,抗原识别域包括接合其同源受体之配位体。作为实例,april为结合tac1受体或bcma受体之配位体。根据本文中所揭示之发明,抗原识别域包括april,或其片段。作为另一实例,baff为结合baff-r受体或bcma受体之配位体。根据本文中所揭示之发明,抗原识别域包括baff,或其片段。在另一实施例中,抗原识别域经人类化。
抗原识别域可在其序列内包括一些可变性且仍对本文中所揭示之标靶具有选择性。因此,预期抗原识别域之多肽可与本文中所揭示之抗原识别域多肽具有至少95%、至少90%、至少80%或至少70%一致性,且仍对本文中所描述之标靶具有选择性且属于本发明之范畴内。
标靶包括介白素6受体、ny-eso-1、α胎蛋白(afp)、磷脂醯肌醇蛋白聚糖-3(gpc3)、bcma、baff-r、taci、ley、cd5、cd13、cd14、cd15cd19、cd20、cd22、cd33、cd41、cd61、cd64、cd68、cd117、cd123、cd138、cd267、cd269、cd38、flt3受体、cs1、cd45、ror1、psma、magea3、糖脂、磷脂醯肌醇蛋白聚糖3、f77、gd-2、wt1、cea、her-2/neu、mage-3、mage-4、mage-5、mage-6、α-胎蛋白、ca19-9、ca72-4、ny-eso、fap、erbb、c-met、mart-1、cd30、egfrviii、免疫球蛋白κ及λ、cd38、cd52、cd3、cd4、cd8、cd5、cd7、cd2及cd138。
在另一实施例中,标靶包括任何部分介白素6受体、ny-eso-1、α胎蛋白(afp)、磷脂醯肌醇蛋白聚糖-3(gpc3)、bcma、baff-r、taci、ley、cd5、cd13、cd14、cd15cd19、cd20、cd22、cd33、cd41、cd61、cd64、cd68、cd117、cd123、cd138、cd267、cd269、cd38、flt3受体、cs1、cd45、taci、ror1、psma、magea3、糖脂、磷脂醯肌醇蛋白聚糖3、f77、gd-2、wt1、cea、her-2/neu、mage-3、mage-4、mage-5、mage-6、α-胎蛋白、ca19-9、ca72-4、ny-eso、fap、erbb、c-met、mart-1、cd30、egfrviii、免疫球蛋白κ及λ、cd38、cd52、cd3、cd4、cd8、cd5、cd7、cd2及cd138。
在一个实施例中,标靶包括以下各者之表面暴露部分:介白素6受体、ny-eso-1、α胎蛋白(afp)、磷脂醯肌醇蛋白聚糖-3(gpc3)、bcma、baff-r、taci、ley、cd5、cd13、cd14、cd15cd19、cd20、cd22、cd33、cd41、cd61、cd64、cd68、cd117、cd123、cd138、cd267、cd269、cd38、flt3受体、cs1、cd45、taci、ror1、psma、magea3、糖脂、磷脂醯肌醇蛋白聚糖3、f77、gd-2、wt1、cea、her-2/neu、mage-3、mage-4、mage-5、mage-6、α-胎蛋白、ca19-9、ca72-4、ny-eso、fap、erbb、c-met、mart-1、cd30、egfrviii、免疫球蛋白κ及λ、cd38、cd52、cd3、cd4、cd8、cd5、cd7、cd2及cd138多肽。
在另一实施例中,标靶抗原包括病毒或真菌抗原,诸如来自人类乳突状瘤病毒(hpv)之e6及e7,或ebv(埃-巴二氏病毒(epsteinbarrvirus))抗原;其部分;或其表面暴露区域。
在一个实施例中,taci抗原识别域包括seqidno:24。
在一个实施例中,bcma抗原识别域包括seqidno:25。
在一个实施例中,cs1抗原识别域包括seqidno:26。
在一个实施例中,baff-r抗原识别域包括seqidno:27。
在一个实施例中,cd33抗原识别域包括seqidno:28。
在一个实施例中,cd123抗原识别域包括seqidno:29。
在一个实施例中,cd19抗原识别域包括seqidno:30。
在一个实施例中,cd20抗原识别域包括seqidno:31。在另一
实施例中,cd20抗原识别域包括seqidno:32。
在一个实施例中,cd22抗原识别域包括seqidno:33。
在一个实施例中,cd45抗原识别域包括seqidno:34。
铰链区为安置于例如包括(但不限于)嵌合抗原受体与至少一个共刺激域及信号传导域之间的序列。可获得铰链序列,包括例如来自任何属之任何适合的序列,包括人类或其部分。此项技术中已知此类铰链区。在一个实施例中,铰链区包括人类蛋白质之铰链区,包括cd-8α、cd28、4-1bb、ox40、cd3-ζ、t细胞受体α或β链、cd3ζ链、cd28、cd3ε、cd45、cd4、cd5、cd8、cd8a、cd9、cd16、cd22、cd33、cd37、cd64、cd80、cd86、cd134、cd137、icos、cd154、其功能衍生物及其组合。
在一个实施例中,铰链区包括cd8a铰链区。
在一些实施例中,铰链区包括选自(但不限于)免疫球蛋白(例如igg1、igg2、igg3、igg4及igd)之一者。
跨膜域包括横跨细胞膜之疏水性多肽。特定言之,跨膜域自细胞膜之一侧(细胞外)横跨细胞膜之另一侧(细胞内或细胞质)。
跨膜域可呈α螺旋或β筒或其组合形式。跨膜域可包括异地同型蛋白质,其具有多个跨膜区段,各呈α-螺旋、β片或其组合形式。
在一个实施例中,使用与car中之一个域天然相关之跨膜域。在另一实施例中,选择跨膜域或藉由胺基酸取代修饰以避免此类域与相同或不同表面膜蛋白质之跨膜域之结合,从而最小化与受体复合物之其他成员之相互作用。
举例而言,跨膜域包括以下各者之跨膜域:t细胞受体α或β链、cd3ζ链、cd28、cd3ε、cd45、cd4、cd5、cd7、cd8、cd9、cd16、cd22、cd33、cd37、cd64、cd80、cd86、cd68、cd134、cd137、icos、cd41、cd154、其功能衍生物及其组合。
在一个实施例中,跨膜域经人工设计使得域中超过25%、超过50%或超过75%胺基酸残基为疏水性残基,诸如白胺酸及缬胺酸。在一个实施例中,在合成跨膜域之各端发现苯丙胺酸、色胺酸及缬胺酸之三联体。
在一个实施例中,跨膜域为cd8跨膜域。在另一实施例中,跨膜域为cd28跨膜域。此类跨膜域为此项技术中已知的。
信号传导域及共刺激域包括可活化免疫细胞以刺激或活化免疫细胞信号传导路径之至少一些态样之多肽。
在一个实施例中,信号传导域包括以下各者之功能性信号传导域之多肽:cd3ζ、共同fcrγ(fcer1g)、fcγrlla、fcrβ(fcεrib)、cd3γ、cd3δ、cd3ε、cd79a、cd79b、dnax活化蛋白质10(dap10)、dnax活化蛋白质12(dap12)、其活性片段、其功能衍生物及其组合。此类信号传导域为此项技术中已知的。
在一个实施例中,car多肽进一步包括一或多个共刺激域。在一个实施例中,共刺激域为来自包括以下之蛋白质之功能性信号传导域:ox40;cd27;cd28;cd30;cd40;pd-1;cd2;cd7;cd258;自然杀手第2组成员c(nkg2c);自然杀手第2组成员d(nkg2d)、b7-h3;结合于cd83、icam-1、lfa-1(cdlla/cd18)、icos及4-1bb(cd137)中之至少一者之配位体;cds;icam-1;lfa-1(cd1a/cd18);cd40;cd27;cd7;b7-h3;nkg2c;pd-1;icos;其活性片段;其功能衍生物;及其组合。
如本文中所使用,至少一个共刺激域及信号传导域可共同称为胞内域。如本文中所使用,铰链区及抗原识别可共同称为细胞外域。
本发明亦提供编码上述嵌合抗原受体多肽之聚核苷酸。
如本文所使用之术语「聚核苷酸」定义为核苷酸链。聚核苷酸包括dna及rna。此外,核酸为核苷酸之聚合物。因此,如本文所使用之核酸及聚核苷酸为可互换的。熟习此项技术者具有核酸为聚核苷酸之常识,聚核苷酸其可水解成单体「核苷酸」。单体核苷酸可水解成核苷。如本文所使用,聚核苷酸包括(但不限于)藉由此项技术中可使用的任何手段获得的所有核酸序列,包括(但不限于)重组手段,亦即使用一般选殖技术自重组型文库或细胞基因体选殖核酸序列,及聚合酶链反应(pcr),及其类似手段,及藉由合成成段。
编码car之聚核苷酸可藉由任何习知方法自指定car之胺基酸序列容易地制备。关于各域之胺基酸序列,编码胺基酸序列之基底序列可自前述ncbirefseqid或genbenk之寄存编号获得,且本发明之核酸可使用标准分子生物及/或化学程序制备。举例而言,基于基底序列,可合成聚核苷酸,且可藉由组合dna片段来制备本发明之聚核苷酸,该等dna片段系使用聚合酶链反应(pcr)自cdna文库获得。
在一个实施例中,本文中所揭示之聚核苷酸为基因之一部分,或表现或选殖卡匣。
上述聚核苷酸可选殖至载体中。「载体」为物质之组合物,其包括经分离之聚核苷酸,且其可用于将经分离之聚核苷酸传递至细胞内部。此项技术中已知的大量载体包括(但不限于)线性聚核苷酸、与离子性或两性化合物相关之聚核苷酸、质体、噬菌粒、黏质体及病毒。病毒包括噬菌体、噬菌体衍生物。因此,术语「载体」包括自主复制质体或病毒。该术语亦应视为包括非质体及非病毒化合物,其促进核酸转移至细胞中,诸如聚离胺酸化合物、脂质体及其类似物。病毒载体之实例包括(但不限于)腺病毒载体、腺相关病毒载体、反转录病毒载体、慢病毒载体及其类似物。在一个实施例中,载体包括选殖载体、表现载体、复制载体、探针产生载体、整合载体及测序载体。
在一实施例中,载体为病毒载体。在一个实施例中,病毒载体为反转录病毒载体或慢病毒载体。在一个实施例中,经工程改造之细胞以病毒方式转导以表现聚核苷酸序列。
已针对基因转移至哺乳动物细胞中开发出许多基于病毒之系统。举例而言,反转录病毒提供基因传递系统之适宜平台。所选基因可插入载体中且使用此项技术中已知之技术封装于反转录病毒粒子中。接着可分离重组型病毒且活体内或离体传递至患者之细胞中。此项技术中已知许多反转录病毒系统。在一些实施例中,使用腺病毒载体。此项技术中已知许多腺病毒载体。在一个实施例中,使用慢病毒载体。
病毒载体技术为此项技术中熟知的且描述于例如sambrook等人(2001,molecularcloning:alaboratorymanual,coldspringharborlaboratory,newyork)及其他病毒学及分子生物学手册中。适用作载体之病毒包括(但不限于)反转录病毒、腺病毒、腺相关病毒、疱疹病毒及慢病毒。通常,适合的载体含有在至少一种生物体、启动子序列、适宜的限制内切酶位点及一或多种可选标记物中具有功能性的复制起点(例如wo01/96584;wo01/29058;及美国专利第6,326,193号)。
已熟知慢病毒载体将基因高效转移至人类t细胞中之能力,但载体编码之基因之表达取决于驱使其表达之内部启动子。对于具有其他编码增生性细胞激素之共刺激域或基因之第三代或第四代car,强启动子尤其重要,因为增加之car主体尺寸并不确保等效表达量。存在多种具有不同强度及细胞类型特异性之启动子。使用cart细胞之基因疗法依赖于t细胞表达充分的car主体及长时间段维持表达之能力。通常选择ef-1α启动子用于car表达。
本发明是关于含有用于t细胞或nk细胞中高基因表达量之强启动子之表现载体。在其他实施例中,本发明者揭示适用于t细胞或nk细胞中之高car表达量之强启动子。在特定实施例中,强启动子与sffv启动子有关,其被选择性引入表现载体中,以在t细胞或nk细胞中获得高表达量及长时间段维持表达。所表达之基因偏好car、t细胞共刺激因子及用于免疫疗法之细胞激素。
适合的启动子之一个实例为前早期巨细胞病毒(cmv)启动子序列。此启动子序列为能够驱使任何与其以操作方式连接之聚核苷酸序列之高表达量的强组成性启动子序列。适合的启动子之另一实例为延长生长因子-1a(ef-1a)。然而,亦可使用其他组成性启动子序列,包括(但不限于)猴病毒40(sv40)早期启动子、小鼠乳房肿瘤病毒(mmtv)、人类免疫缺陷病毒(hiv)长末端重复序列(ltr)启动子、momulv启动子、禽类白血病病毒启动子、埃-巴二氏病毒前早期启动子、劳斯肉瘤病毒启动子(roussarcomaviruspromoter),以及人类基因启动子,诸如(但不限于)肌动蛋白启动子、肌球蛋白启动子、血红蛋白启动子及肌酸激酶启动子。此外,本发明不应限于使用组成性启动子,亦涵盖诱导性启动子作为本发明之一部分。诱导性启动子之使用提供分子开关,该分子开关能够在需要此类表达时打开其以操作方式连接之聚核苷酸序列表现,或在不需要时关闭表现。诱导性启动子之实例包括(但不限于)金属硫蛋白启动子、糖皮质激素启动子、孕酮启动子及四环素启动子。
可使用例如表现载体获得嵌合抗原受体聚核苷酸之表达,包括(但不限于)sffv(脾病灶形成病毒)(例如seqidno:23)或人类延长因子11α(ef)启动子、cag(具有cmv强化子之鸡β-肌动蛋白启动子)启动子人类延长因子1α(ef)启动子中之至少一者。所使用之强度较弱/表达量较低之启动子之实例可包括(但不限于)猴病毒40(sv40)早期启动子、巨细胞病毒(cmv)前早期启动子、泛素c(ubc)启动子及磷酸甘油酸激酶1(pgk)启动子或其部分。嵌合抗原受体之诱导性表达可使用例如四环素反应启动子获得,包括(但不限于)tre3gv(tet反应元件,包括所有世代且较佳为第3代)、诱导性启动子(clontechlaboratories,mountainview,ca)或其部分或组合。
在一个较佳实施例中,启动子为sffv启动子或其衍生物。且意外发现sffv启动子在根据本发明之经转导之细胞中提供更强表达及更大程度的持久性。
「表现载体」是指包括重组性聚核苷酸之载体,该重组性聚核苷酸包含与待表现之核苷酸序列以操作方式连接之表现控制序列。表现载体包括足够的顺式作用元素用于表现;用于表现之其他元素可由宿主细胞供应或在活体外表现系统中。表现载体包括此项技术中已知之所有表现载体,诸如并入重组性聚核苷酸之黏质体、质体(例如裸露或含于脂质体中)及病毒(例如慢病毒、反转录病毒、腺病毒及腺相关病毒)。表现载体可为双顺反子或多顺反子表现载体。双顺反子或多顺反子表现载体,可包括(1)与每个开放阅读框架融合之多个启动子;(2)在基因之间插入编接信号;表达由单个启动子驱使之基因之融合;(3)在基因(自裂解肽)之间插入蛋白水解分裂位点;及(iv)在基因之间插入内部核糖体进入位点(ires)。
在一个实施例中,本发明提供具有至少一个嵌合抗原受体多肽或聚核苷酸之经工程改造之细胞。
「经工程改造之细胞」意谓任何生物体之经修饰、经转型或借由基因、dna或rna序列或蛋白质或多肽之添加或修饰而操作之任何细胞。本发明之经分离之细胞、宿主细胞及经基因工程改造之细胞包括经分离之免疫细胞,诸如含有编码嵌合抗原受体或嵌合抗原受体复合物之dna或rna序列且在细胞表面上表达嵌合受体之nk细胞及t细胞。经分离之宿主细胞及经工程改造之细胞可用于例如增强nk细胞活性或t淋巴细胞活性、治疗癌症及治疗感染性疾病。
在一个实施例中,经工程改造之细胞包括免疫调节细胞。免疫调节细胞包括t细胞,诸如cd4t细胞(辅助t细胞)、cd8t细胞(细胞毒性t细胞、ctl)及记忆体t细胞或记忆体干细胞t细胞。在另一实施例中,t细胞包括自然杀手t细胞(nkt细胞)。
在一个实施例中,经工程改造之细胞包括自然杀手细胞。自然杀手细胞为此项技术中所熟知的。在一个实施例中,自然杀手细胞包括细胞系,诸如nk-92细胞。nk细胞系之其他实例包括nkg、yt、nk-ys、hank-1、yts细胞及nkl细胞。
nk细胞在无gvhd风险情况下介导抗肿瘤作用且相对于t细胞为短生命期。因此,nk细胞将在毁坏癌细胞之后不久耗竭,减少对car构筑体上将消融经修饰之细胞之诱导性自杀基因之需要。
根据本发明,吾人意外发现nk细胞提供易于获得的经工程改造以含有及表达本文中所揭示之嵌合抗原受体多肽之细胞。
同种异体或自体nk细胞诱导快速免疫反应,但归因于其有限使用寿命而自循环相对快速地消失。因此,申请人意外发现使用基于car细胞之疗法可减少持续性副作用问题。
本发明包括产生ccar之方法。在一些实施例中,使用t细胞产生ccar。在其他实施例中,ccar为使用自外周血或脐带血及nk-92细胞分离之原生nk细胞,使得其「现成地」投与任何患有疾病或癌症之哺乳动物。
根据本发明之一个态样,nk细胞可用根据本发明之car聚核苷酸扩增及转染,nk细胞可来源于脐带血、外周血、ips细胞及胚胎干细胞。根据本发明之一个态样,nk-92细胞用car扩增及转染。nk-92为连续生长细胞系,其具有自然杀手(nk)细胞之特性及特征(arai,meagher等人2008)。nk-92细胞系为il-2依赖性且已证实为安全(arai,meagher等人2008)及可行的。表达car之nk-92细胞可在与或不与饲养细胞共培养之情况下,在不含血清之培养基中扩增。可藉由分选获得携带相关car之nk-92之纯群体。
在一个实施例中,经工程改造之细胞包括自供体获得之同种异体t细胞,其经修饰以不活化涉及mhc识别之tcr(t细胞受体)之组分。因此,tcr缺失型t细胞将不引起移植体对抗宿主疾病(gvhd)。
在一些实施例中,经工程改造之细胞可经修饰以防止细胞表面抗原之表达。举例而言,经工程改造之细胞可经遗传修饰以缺失原生cd45基因,以防止其表达及细胞表面呈现。
在一些实施例中,经工程改造之细胞包括诱导性自杀基因(「安全开关」)或安全开关之组合,其可在载体上组装,诸如(但不限于)反转录病毒载体、慢病毒载体、腺病毒载体或质体。引入「安全开关」可极大地增加安全概况及限制化合物car之命中标靶或偏离肿瘤毒性。「安全开关」可为诱导性自杀基因,诸如(但不限于)半胱天冬酶9基因、胸苷激酶、胞嘧啶脱胺酶(cd)或细胞色素p450。其他用于消除不合需要之经修饰之t细胞之安全开关涉及t细胞中cd20或cd19或经截短之表皮生长因子受体之表现。已涵盖所有有可能的安全开关且在本发明中实施。
在一些实施例中,将自杀基因整合至经工程改造之细胞基因体中。
在一个实施例中,本发明提供具有cd45嵌合抗原受体聚核苷酸之经工程改造之细胞。
在一个实施例中,cd45car多肽包括seqidno:13及相应的聚核苷酸序列seqidno:14。在另一实施例中,cd45car多肽包括seqidno:15,及相应的聚核苷酸序列seqidno:16。在另一实施例中,cd45car多肽包括seqidno:17,及相应的聚核苷酸序列seqidno:18。
多个car单元
本发明提供具有至少两种不同的car多肽之经工程改造之细胞。
如本文中所使用,化合物car(ccar)或多个car是指具有至少两种不同的嵌合抗原受体多肽之经工程改造之细胞。如本文中所使用,「不同的嵌合抗原受体多肽」具有独特抗原识别域、信号肽、铰链区、跨膜域、至少一个共刺激域及信号传导域。因此,两个独特的嵌合抗原受体多肽将具有不同的抗原识别域。在两个不同的嵌合抗原受体多肽之间,信号肽、铰链区、跨膜域、至少一个共刺激域及信号传导域可相同或不同。如本文中所使用,嵌合抗原受体(car)单元是指不同的嵌合抗原受体多肽,或编码不同的嵌合抗原受体多肽之聚核苷酸。
如本文中所使用,独特抗原识别域为对单个标靶或标靶之单个抗原决定基具有特异性或靶向其之抗原识别域。
在一些实施例中,化合物car靶向相同抗原。举例而言,ccar靶向单个抗原之不同抗原决定基或部分。在一些实施例中,化合物car中之car单元中之每一者靶向对相同或不同疾病病状或由疾病病状引起之副作用具有特异性的不同抗原。
在一些实施例中,化合物car靶向两种不同抗原。
产生携带不同car单元之化合物car可极具挑战性:(1)car与car之间的相互作用可具有不利影响且适合的car设计为抵消此作用之关键;(2)单一构筑体中之化合物car可增加表达盒之长度,其可引起病毒效价及蛋白质表达量降低;(3)需要适合的设计以包括多种car主体元素,尤其选择策略以在单一载体中表达多个car;(4)强启动子对于携带其他car单元之化合物car尤其重要;(5)car中之铰链区需要经设计使得较佳避免各car单元之间铰链区之相互相用;(6)表达于细胞中之两个或更多个car单元可引起毒性作用(car-car相互相用)。本文中之申请人提供可解决此等障碍之新颖及出人意料的car组合物及方法。
在一个实施例中,本发明提供具有多个car单元之经工程改造之细胞。此使得单个经工程改造之细胞靶向多个抗原。一个多个car单元同时靶向多个表面标记物或抗原可防止抗性纯系之选择及减少肿瘤复发。尚未研发用于任何恶性肿瘤之多个cart细胞免疫疗法,其中每个个别组分car包含多个域及活化位点。
在本发明之一个态样中,ccar包括多个car单元。在一些实施例中,ccar包括至少两个car单元。在另一实施例中,ccar包括至少三个car单元。在另一实施例中,ccar包括至少四个单元。
在一个实施例中,本发明提供经工程改造之细胞,其具有至少两种不同的嵌合抗原受体多肽,各自具有不同的抗原识别域。
在一个较佳实施例中,具有至少两种不同嵌合抗原受体多肽之经工程改造之细胞为自外周血或脐带血及nk-92细胞分离之原生nk细胞,使得其「现成地」投与任何患有疾病或癌症之哺乳动物。
在一个实施例中,经工程改造之细胞包括(i.)第一嵌合抗原受体多肽,其包含第一抗原识别域、第一信号肽、第一铰链区、第一跨膜域、第一共刺激域及第一信号传导域;及(ii.)第二嵌合抗原受体多肽,其包含第二抗原识别域、第二信号肽、第二铰链区、第二跨膜域、第二共刺激域及第二信号传导域。第一抗原识别域与第二抗原识别域不同。
在一个较佳实施例中,每个经工程改造之car单元聚核苷酸具有不同核苷酸序列以避免同源重组。
在一个实施例中,第一抗原识别域之标靶选自由以下组成之群:介白素6受体、ny-eso-1、α胎蛋白(afp)、磷脂醯肌醇蛋白聚糖-3(gpc3)、baff-r、bcma、taci、ley、cd5、cd13、cd14、cd15、cd19、cd20、cd22、cd33、cd41、cd61、cd64、cd68、cd117、cd123、cd138、cd267、cd269、cd38、flt3受体及cs1;且第二识别域之标靶选自由以下组成之群:介白素6受体、ny-eso-1、α胎蛋白(afp)、磷脂醯肌醇蛋白聚糖-3(gpc3)、baff-r、bcma、taci、ley、cd5、cd13、cd14、cd15cd19、cd20、cd22、cd33、cd41、cd61、cd64、cd68、cd117、cd123、cd138、cd267、cd269、cd38、flt3受体及cs1。
在一个实施例中,经工程改造之细胞包括具有cd19抗原识别域之第一嵌合抗原受体多肽及具有cd20识别域之第二嵌合抗原受体多肽。在一个实施例中,此经工程改造之细胞包括seqidno:3之多肽及相应的seqidno:4之聚核苷酸。
在一个实施例中,经工程改造之细胞包括具有cd19抗原识别域之第一嵌合抗原受体多肽及具有cd22识别域之第二嵌合抗原受体多肽。在一个实施例中,此经工程改造之细胞包括seqidno:5之多肽及相应的seqidno:6之聚核苷酸。
在一个实施例中,经工程改造之细胞包括具有cd19抗原识别域之第一嵌合抗原受体多肽及具有cd123识别域之第二嵌合抗原受体多肽。在一个实施例中,此经工程改造之细胞包括seqidno:7之多肽及相应的seqidno:8之聚核苷酸。
在一个实施例中,经工程改造之细胞包括具有cd33抗原识别域之第一嵌合抗原受体多肽及具有cd123抗原识别域之第二嵌合抗原受体多肽。在一个实施例中,此经工程改造之细胞包括seqidno:9之多肽及相应的seqidno:10之聚核苷酸。在另一实施例中,此经工程改造之细胞包括seqidno:11之多肽及相应的seqidno:12之聚核苷酸。
在一个实施例中,经工程改造之细胞包括具有baff-r抗原识别域之第一嵌合抗原受体多肽及具有cs1抗原识别域之第二嵌合抗原受体多肽。
在一个实施例中,经工程改造之细胞包括具有cd269抗原识别域之第一嵌合抗原受体多肽及具有cs1识别域之第二嵌合抗原受体多肽。在一个实施例中,经工程改造之细胞包括有包括seqidno:19之多肽及相应的聚核苷酸seqidno:20。在一个实施例中,经工程改造之细胞包括有包括seqidno:21之多肽及相应的聚核苷酸seqidno:22。
在一个实施例中,经工程改造之细胞包括具有cd33抗原识别域之第一嵌合抗原受体多肽及具有cd123识别域之第二嵌合抗原受体多肽。
在一个实施例中,各car单元包括相同或不同铰链区。在另一实施例中,各car单元包括相同或不同跨膜区。在另一实施例中,各car单元包括相同或不同胞内域。
在一个实施例中,各car单元包括cd3ζ链信号传导域。
在一个实施例中,每个不同的car单元包括不同的共刺激域以避免相互相用。举例而言,第一嵌合抗原受体多肽包括4-bb共刺激域;且第二嵌合抗原受体多肽包括cd28共刺激域。
在另一实施例中,铰链区经设计以排除可能引起不合需要的分子内或分子间相互作用之胺基酸。举例而言,铰链区可经设计以排除或最小化半胱胺酸残基以防止形成二硫键。在另一实施例中,铰链区可经设计以排除或最小化疏水性残基以防止不合需要之疏水相互作用。
化合物car可独立地或组合杀死细胞。多重或化合物car包含相同或不同铰链区、相同或不同跨膜、相同或不同共刺激及相同或不同细胞内域。较佳选择铰链区以避免相互相用位点。
本发明之化合物car可靶向t或nk细胞中之相同或不同肿瘤群。第一个car例如可靶向大型肿瘤群且随后或第二个car例如可根除癌症或白血病干细胞,以避免癌症复发。
根据本发明,意外发现t或nk细胞中靶向不同或相同肿瘤群之化合物car对抗可引起对car杀死活性之抗性之癌细胞的肿瘤因子,借此产生自癌细胞表面之标靶抗原之下调。亦意外发现此能够引起癌细胞「躲避」car疗法,称为「抗原逃逸」,及肿瘤非均质性,由此不同肿瘤细胞可呈现不同表面抗原表达概况。
具有car多肽及强化子之经工程改造之细胞
在另一实施例中,本发明提供具有至少一个嵌合抗原受体多肽及强化子之经工程改造之细胞。
在一个实施例中,本发明提供具有至少两种不同嵌合抗原受体多肽及强化子之经工程改造之细胞。
如本文中所使用,强化子包括生物分子,其促进或增强具有嵌合抗原受体多肽之经工程改造之细胞之活性。强化子包括细胞激素。在另一实施例中,强化子包括il-2、il-7、il-12、il-15、il-21、pd-1、pd-l1、csf1r、ctal-4、tim-3及tgfrβ、其受体及其功能片段。
强化子可由本文中所描述之经工程改造之细胞表达且在经工程改造之细胞之表面上呈现,或强化子可由经工程改造之细胞分泌至周围细胞外空间中。表面呈现及分泌之方法为此项技术中所熟知的。举例而言,强化子可为融合蛋白,其具有提供表面呈现或对细胞外空间之分泌的肽。
强化子之作用可由其他因子补充,诸如强化子受体及其功能片段。其他因子可与强化子一起以融合蛋白形式共表达或表达为单独的肽且分泌至细胞外空间中。
在一个实施例中,强化子为il-15。在此情况下,其他因子为il-15受体,及其功能片段。功能片段包括il-15受体、il-15ra及il-15ra之sushi域。适合的域之实例包括seqidno:35。根据本发明,本文中所揭示之任何嵌合抗原受体多肽包括具有人类介白素2信号肽seqidno:36之人类介白素15。
介白素(il)-15及其特异性受体链il-15rα(il-15-ra)在多种效应细胞(包括nk及cd8t细胞)中起关键功能性作用。cd8+t细胞可经修饰以表达自分泌生长因子,包括(但不限于)il-2、il-7、il21或il-15,以在活体内转移后维持存活。不希望受理论约束,il-15可解决cd4缺陷以诱导原生及召回记忆体cd8t细胞。cd8t细胞上il-15-ra或il-15il-ra融合物之过度表达显著增强其存活期以及活体外及活体内增殖。在一些实施例中,cd4car或任何car可包括表达各部分、il-15、il15ra及il-15/il-15r或il-15-ra/il-15中之任一或多者或其一部分或组合,以增强cart或nk之存活或增殖,及改良记忆体carcd8+t细胞之扩增。
本发明是关于经工程改造之细胞,其具有如本文中所描述之car及il-15、il15ra及il-15/il-15r或il15-ra/il-15之部分中之任一或多者或其一部分或组合,以增强cart或nk之存活期或持续性或增殖以用于治疗患者中之癌症。
在一个实施例中,经工程改造之细胞包括cd4嵌合抗原受体多肽及il至15ra(seqidno:1),及相应的聚核苷酸(seqidno:2)。
产生经工程改造之细胞之方法
可藉由此项技术中已知之任何方法将本文中所揭示之任一种聚核苷酸引入经工程改造之细胞。
在一个实施例中,藉由如本文中所揭示之任何病毒载体将car聚核苷酸传递至经工程改造之细胞中。
在一个实施例中,为了获得增强之安全概况或治疗指数,将本文中所揭示之任一种经工程改造之细胞构筑为经短暂rna修饰之「可生物降解」版本或衍生物,或其组合。本发明之经rna修饰之car可电致孔至t细胞或nk细胞中。化合物car之表达可在数天内逐渐减弱。
在本发明之一些实施例中,本文中所揭示之任一种经工程改造之细胞可在转座子系统(亦称为「睡美人(sleepingbeauty)」)中构筑,其在无病毒载体情况下将cardna整合至主体基因体中。
产生具有多个car单元之经工程改造之细胞之方法
在另一实施例中,本发明提供制造具有至少两个car单元之经工程改造之细胞之方法。
在一些实施例中,使用双顺反子或多顺反子表现载体在t或nk细胞中表达多个car单元。存在若干种可用于构筑双顺反子或多顺反子载体之策略,包括(但不限于)(1)多个启动子与car之开放阅读框架融合;(2)在car单元之间插入编接信号;表达由单个启动子驱使之car之融合;(3)在car单元(自裂解肽)之间插入蛋白水解分裂位点;及(iv)插入内部核糖体进入位点(ires)。
在一个较佳实施例中,多个car单元表达于单个开放阅读框架(orf)中,借此产生具有多个car单元之单个多肽。在此实施例中,含有高效裂解位点之胺基酸序列或连接子安置在各car单元之间。
如本文中所使用,高裂解功效定义为超过50%、超过70%、超过80%或超过90%经转译之蛋白质裂解。可藉由蛋白印迹分析测量裂解功效,如由kim2011所描述。
此外,在一个较佳实施例中,存在等量裂解产物,如蛋白印迹分析所示。
高效裂解位点之实例包括猪捷申病毒-12a(porcineteschovirus-12a;p2a)、fmdv2a(本文中简称为f2a);马鼻炎a病毒(erav)2a(e2a);及明脉扁刺蛾β四体病毒(thoseaasignavirus)2a(t2a)、细胞质多角体病毒2a(bmcpv2a)及软化病病毒(flacherievirus)2a(bmifv2a)或其组合。在一个较佳实施例中,高效裂解位点为p2a。高效裂解位点描述于kimjh,lees-r,lil-h,parkh-j,parkj-h,leeky等人,(2011)highcleavageefficiencyofa2apeptidederivedfromporcineteschovirus-1inhumancelllines,zebrafishandmice.plosone6(4):e18556中,其内容以引用之方式并入本文中。
在其中在单个开放阅读框架(orf)中表达多个car单元之实施例中,表现受强启动子控制。强启动子之实例包括sffv启动子,及其衍生物。
具有car多肽及强化子之经工程改造之细胞
在另一实施例中,本发明提供制造表达至少一个car单元及强化子之经工程改造之细胞之方法。
在一些实施例中,使用双顺反子或多顺反子表现载体在t或nk细胞中表达至少一个car单元及强化子。存在若干种可用于构筑双顺反子或多顺反子载体之策略,包括(但不限于)(1)多个启动子与car之开放阅读框架融合;(2)在car单元之间插入编接信号;表达由单个启动子驱使之car之融合;(3)在car单元(自裂解肽)之间插入蛋白水解分裂位点;及(iv)插入内部核糖体进入位点(ires)。
在一个较佳实施例中,在单个开放阅读框架(orf)中表达至少一个car单元及强化子,借此产生具有至少一个car单元及强化子之单个多肽。在此实施例中,在各car单元之间及在car单元与强化子之间安置含有高效裂解位点之胺基酸序列或连接子。在此实施例中,orf受强启动子控制。强启动子之实例包括sffv启动子,及其衍生物。
此外,在一个较佳实施例中,存在等量裂解产物,如蛋白印迹分析所示。
使用本文中所揭示之组合物之治疗方法
在另一实施例中,本发明提供在癌症治疗中在同种移植之前靶向cd45以用于调节之方法。cd45亦称为白细胞共同抗原(lca)且为在除红血球及血小板以外的几乎所有造血来源细胞上表达之酪胺酸磷酸酶。大部分血液科恶性疾病表达cd45。举例而言,85%至90%急性淋巴及骨髓白血病表达cd45。在非造血来源中未发现cd45。此外,cd45以每个细胞约200,000个分子之高密度平均复本数表达于恶性细胞及白细胞上。cd45呈现多种血液科恶性疾病之理想标靶。然而,cart及nk细胞亦表达cd45。在无内源性cd45之不活化情况下,具有靶向cd45car之cart或nk细胞可引起自杀。
cd45与tcr复合物之结合体在调节t细胞活化中是必需的,以回应于抗原。cd45缺失型t细胞呈现抗原之不可能性是归因于经由t细胞受体(tcr)之信号传导降低。tcr为在回应于抗原呈现之t细胞活化中起重要作用的细胞表面受体。tcr通常由两个链,即α及β制成,该两个链与转导子单元cd3相关联以形成呈现于细胞表面上之t细胞受体复合物。
意外发现本发明之多个car(化合物car、ccar)对抗癌细胞用于抵抗car活性之重要机制,亦即来自癌细胞表面之标靶抗原之下调或不均匀表达。此机制使得癌细胞「躲避」car疗法,一种称为『抗原逃逸』之现象。本发明藉由识别可快速消除肿瘤之两种或更多种抗原之组合来抢占癌症抗原逃逸。
本发明提供使用ccar同时靶向多个抗原之方法,其藉由基于标靶抗原损失或下调而最小化肿瘤选择之可能性来引起改良之肿瘤控制。
所揭示之本发明包括靶向肿瘤细胞中呈现之不同或相同表面抗原之t或nk细胞中之化合物(多重或化合物)ccar。本发明之化合物嵌合抗原受体至少包含多个由连接子连接之嵌合受体构筑体且靶向相同或不同抗原。举例而言,化合物car(ccar)构筑体中之每个car构筑体包括抗原识别域、细胞外域、跨膜域及/或细胞质域。细胞外域及跨膜域可来源于此类域之任何所需来源。多个car构筑体由连接子连接。化合物car构筑体之表达由启动子驱使。连接子可为肽或蛋白质之一部分,其产生蛋白质或肽之后自裂解(亦称为自裂解肽)。
在一个实施例中,本发明之化合物car靶向骨髓发育不良症候群及急性骨髓白血病(aml)群体。骨髓发育不良症候群(mds)仍为不可治愈的造血干细胞恶性疾病,其最通常在老年人中发生,在美国每年出现约14,000例新病例。约30-40%mds病例发展成aml。mds之发病率随人群老化而持续增加。尽管已广泛研究mds及aml,但未研发出令人满意的治疗。
本发明之组合物及方法可用于产生传递用于癌症治疗(尤其肺癌、黑素瘤、乳癌、前列腺癌、结肠癌、肾细胞癌、卵巢癌、脑癌、肉瘤、白血病及淋巴瘤之治疗)中之免疫疗法之原发性及共刺激信号之t淋巴细胞或nk细胞群体。
免疫治疗剂通常依赖于使用免疫效应细胞及分子以靶向及摧毁癌细胞。效应子可为携带直接或间接与肿瘤细胞标靶相互作用之表面分子的淋巴细胞。多种效应细胞包括细胞毒性t细胞、nk细胞及nk-92细胞。本发明中所描述之组合物及方法可与其他类型之癌症疗法结合使用,诸如化学疗法、手术、放射、基因疗法等。本发明中所描述之组合物及方法可用于其他依赖于免疫反应之疾病病状,诸如炎症、免疫疾病及感染性疾病。
在一些实施例中,本发明之化合物car藉由实现具有微小残留病及不再对化学疗法起反应之患者之完全缓解而可充当骨髓移植之桥梁。在其他实施例中,化合物car消除白血病细胞,接着解救骨髓干细胞以支援白细胞减少症。
在一些实施例中,本发明之化合物car可藉由下调标靶抗原来对抗癌细胞用于抵抗car活性之重要机制。在另一实施例中,本发明化合物car亦可对抗癌细胞之非均质性,该非均质性在常规cart/nk细胞疗法中产生显著挑战。在另一实施例中,所揭示之化合物car经设计使得第一个car靶向大型肿瘤群体且另一个根除癌症或白血病干细胞以避免癌症复发。
在一个实施例中,本发明提供毁坏具有cd33抗原或cd123抗原之细胞之方法,或藉由使该等细胞与含有具有cd33抗原识别域之嵌合抗原受体多肽及具有cd23抗原识别域之嵌合抗原受体多肽中之至少一者之经工程改造之细胞接触。经工程改造之细胞可为t或nk细胞。
具有cd33抗原及cd123抗原中之至少一者之细胞包括急性骨髓白血病、前驱体急性淋巴母细胞白血病、慢性骨髓增生性赘瘤、慢性骨髓性白血病、骨髓发育不良症候群、母细胞性浆细胞样树突状赘瘤(bpdcn)、霍奇金氏淋巴瘤、肥大细胞增多症及毛细胞白血病细胞。
在另一实施例中,本发明提供可提供用于造血干细胞移植之脊髓抑制调节方案之方法。在此实施例中,向有需要之患者投与具有cd33单元及cd123单元之t或nk经工程改造之细胞。
在其他实施例中,本发明提供根除或杀死表达cd123或cd33或其两者之白血病干细胞(lsc)或主体白血病细胞之方法。在此实施例中,向有需要之患者投与具有cd33单元及cd123单元之t或nk经工程改造之细胞。
在其他实施例中,t或nk细胞中之化合物car可用于根除或杀死表达cd123或cd33或其两者之cd34+cd38-白血病干细胞或主体白血病细胞。
在一些实施例中,化合物car靶向表达cd19或cd20抗原或其两者之细胞。在另一实施例中,化合物car靶向表达cd19或cd22抗原或其两者之细胞。所靶向之细胞可为癌细胞,诸如(但不限于)b细胞淋巴瘤或白血病。在其他实施例中,标靶抗原可包括(但不限于)此群中之至少一者:ror1、psma、magea3、糖脂、磷脂醯肌醇蛋白聚糖3、f77、gd-2、wt1、cea、her-2/neu、mage-3、mage-4、mage-5、mage-6、α-胎蛋白、ca19-9、ca72-4、ny-eso、fap、erbb、c-met、mart-1、cd30、egfrviii、免疫球蛋白κ及λ、cd38、cd52、cd3、cd4、cd8、cd5、cd7、cd2及cd138。标靶抗原亦可包括病毒或真菌抗原,诸如来自人类乳突状瘤病毒(hpv)之e6及e7或ebv(埃-巴二氏病毒)抗原。
在一些实施例中,化合物car靶向表达cd19或cd123抗原或其两者之细胞。所靶向之细胞为癌细胞,诸如(但不限于)b细胞淋巴瘤或白血病。
在其他实施例中,化合物car靶向表达cs1及/或b细胞成熟抗原(bcma)或其两者之细胞。在另一实施例中,标靶细胞为恶性浆细胞,诸如(但不限于)多发性骨髓瘤。
在一些实施例中,化合物car靶向表达多个抗原之细胞,包括(但不限于)cs1、bcma、cd267、baff-r、cd38、cd138、cd52、cd19、cd20、介白素6受体及ny-eso-1抗原。在另一实施例中,标靶细胞为恶性浆细胞,诸如(但不限于)多发性骨髓瘤。
在一些实施例中,化合物car靶向表达多个抗原之细胞,包括(但不限于)α胎蛋白(afp)及磷脂醯肌醇蛋白聚糖-3(gpc3)。在另一实施例中,标靶细胞为肝细胞癌、纤维板层癌瘤、肝母细胞瘤、未分化之胚胎肉瘤及肝脏之间叶细胞错构瘤、肺鳞状细胞癌、睪丸非精原细胞性生殖细胞肿瘤、脂肪肉瘤、卵巢及性腺外卵黄囊肿瘤、卵巢绒膜癌、畸胎瘤、卵巢透明细胞癌瘤及胎盘位点滋养层肿瘤。
根据本发明,包含靶向不同或相同抗原之化合物car之t或nk细胞可抵消肿瘤逃逸且同时能够靶向肿瘤细胞。
包含本文中所揭示之化合物car之t或nk宿主细胞在本发明中实施。化合物car之核苷酸及多肽构筑体、序列、宿主细胞、载体视为本发明之一部分且在本文中实施。
在一些实施例中,化合物car与当前正在研究或市场上可获得的任何化学疗法试剂组合投与。在一些实施例中,化合物car作为疾病之第一线治疗投与,包括(但不限于)血液科恶性疾病、癌症、非血液科癌瘤、发炎疾病、感染性疾病,诸如hiv及htlv等。在一个实施例中,表达化合物car之t细胞与作为适应性免疫疗法之表达相同或不同化合物car之nk细胞共同投与。化合物carnk细胞提供靶向细胞之快速、先天性活性,而化合物t细胞提供相对持久的适应性免疫活性。
在一个实施例中,表达化合物car之细胞作为用于哺乳动物之骨髓茎干移植之桥投与,例如对化学疗法具有抗性且不适合骨髓干细胞移植之患者。
在一些实施例中,化合物car在标靶肿瘤病灶中共同表达转基因且释放转殖基因产物(诸如il-12)且进一步调节肿瘤微环境。
在一个实施例中,疾病治疗的一部分是用表达化合物car之细胞来消除哺乳动物的骨髓。
在一个特定实施例中,投与哺乳动物(例如人类)之表达化合物car之细胞(可为t细胞或nk细胞)。本发明包括藉由投与化合物car来治疗患有病症或疾病之哺乳动物之方法。标靶细胞可为诸如癌细胞,或受任何其他疾病病状(诸如感染性疾病、炎症及自身免疫病症)影响之细胞。
本发明意欲包括保留诱导t/nk细胞之刺激及增殖之能力的化合物car或抗原之片段、突变体或变异体(例如经修饰之形式)之用途。「蛋白质之形式」意欲意谓与至少一种car或抗原共有显著同源性且能够实现t/nk细胞之刺激及增殖的蛋白质。如本文中所使用,术语「生物活性」或「蛋白质之生物活性形式」意谓包括能够实现细胞之抗肿瘤活性的蛋白质或变异体之形式。
本发明之组合物及方法可用于产生可传递用于癌症之治疗之免疫疗法的主要及共同刺激信号的t/nk细胞群体,尤其肺癌、黑素瘤、乳癌、前列腺癌、结肠癌、肾细胞癌、卵巢癌、神经母细胞瘤、横纹肌肉瘤、白血病及淋巴瘤之治疗。本发明中所描述之组合物及方法可与其他类型之癌症疗法结合使用,诸如化学疗法、手术、放射、基因疗法等。
在一些实施例中,本发明揭示藉由投与患者car或化合物cart细胞或nk细胞来消耗自体免疫疾病患者中之b细胞、不成熟b细胞、记忆体b细胞、浆母细胞、长寿浆细胞或浆细胞之方法。car靶向之细胞为表达抗原、bcma、taci及baff-r中之一者或两者之b或浆细胞。自身免疫疾病包括全身性硬皮病、多发性硬化、牛皮癣、皮肤炎、发炎性肠病(诸如克罗恩氏病(crohn'sdisease)及溃疡性结肠炎)、全身性红斑性狼疮症、脉管炎、类风湿性关节炎、休格连氏症候群(sjorgen'ssyndrome)、多发性肌炎、肉芽肿及脉管炎、艾迪森氏病(addison'sdisease)、抗原-抗体复合物介导之疾病及抗肾丝球底膜疾病。
目前正在研究多种细胞外细胞标记物作为肿瘤相关抗原且因此作为cart/nk细胞疗法之潜在标靶的价值。然而,除脱靶毒性以外,健康组织上引起命中标靶、偏离肿瘤不良事件之此等抗原之表达仍为主要安全性问题。此外,cart/nk细胞疗法之主要限制为在靶向非肿瘤发生所必需之分子时可能选择抗原逃逸变异体。因此,保持极少标靶抗原表达或不表达标靶抗原之恶性细胞可躲避cart/nk细胞,即使其具有高亲和力作用。
根据本发明,自然杀手(nk)细胞表示car驱使杀死之替代性细胞毒性效应子。与t细胞不同,nk细胞无需预先活化及组成性呈现溶胞功能。nk细胞中ccar之进一步表达使nk细胞可有效杀死癌症,尤其对nk细胞治疗具有抗性之癌细胞。
此外,已知nk细胞可介导抗癌作用而无诱导移植物抗宿主病(gvhd)之风险。
研究展示cd34+cd38-aml细胞上cd123之异常过表达,而正常骨髓对应物cd34+cd38-不表达cd123(jordan,upchurch等人2000)。将此cd123+、cd34+cd38-群体视为lsc,因为此等细胞能够起始及维持免疫缺陷小鼠中之白血病过程。
可使用cd34+/cd38-/cd123+lsc之数目来预测aml患者之临床结果。
cd34+/cd38-/cd123+细胞(在aml患者中大于15%)与未完全缓解及不利细胞遗传学概况相关联。此外,存在超过1%cd34+/cd38-/cd123+细胞亦可对无疾病存活期及总存活期具有不利影响。
当前,mds及aml之疗法集中于白血病母细胞,因为其极充分且明确地代表患者之大部分面临的问题。重要的是,白血病干细胞(lsc)与其他白血病细胞(「母」细胞)显著不同,且其组成罕见的子群。尽管杀死母细胞可提供短期缓解,但若不摧毁,则lsc将始终重新生长,引起患者复发。必须摧毁lsc以实现mds疾病之持久治愈。不幸的是,标准药物方案对mds或amllsc无效。因此,重要的是发展新疗法,其可特定靶向白血病干细胞群体及大型白血病群体。本发明中所揭示之化合物car靶向此等群体且在本文中实施。
根据本发明,意外发现nk细胞提供现成的产物,其可用作治疗之同种异体产物。因此,根据本发明,如当前技术水平需要,需要基于患者特异性进行ccar细胞疗法。本发明之申请人发现新颖的免疫疗法,其中无需分离患者之淋巴细胞或肿瘤浸润之淋巴细胞即可实现有效的基于car细胞之疗法。
预期同种异体或自体nk细胞可诱导快速免疫反应,但由于其有限的使用寿命而自循环相对快速地消失。因此,申请人意外发现使用基于ccar细胞之疗法可减少持续性副作用问题。
根据本发明之一个态样,nk细胞可用根据本发明之ccar扩增及转染。nk细胞可来源于脐带血、外周血、ips细胞及胚胎干细胞。根据本发明之一个态样,nk-92细胞用ccar扩增及转染。nk-92为连续地生长细胞系,其具有自然杀手(nk)细胞之特性及特征。nk-92细胞系为il-2依赖性且已证实为安全及可行的。表达ccar之nk-92细胞可在与或不与饲养细胞共培养之情况下,在不含血清之培养基中扩增。可藉由分选获得携带相关ccar之nk-92之纯群体。
适合的表面标靶抗原之鉴别为在适应性免疫疗法中产生cart/nk细胞之前提条件。
在本发明之一个态样中,cd123抗原为ccar疗法之标靶之一。cd123(介白素3受体之α链)在多种血液科恶性疾病中过表达,包括急性骨髓白血病(aml)、b细胞急性淋巴母细胞白血病(b-all)、毛细胞白血病及母细胞性浆细胞样树突状赘瘤。cd123在正常造血干细胞上不存在或最低限度地表达。更重要的是,cd123在与白血病干细胞(lsc)有关之白血病细胞之子集上表达,消除该等白血病干细胞为预防疾病难治性及复发所必需的。
在本发明之一个态样中,cd33抗原为ccar疗法之标靶之一。cd33为在急性骨髓白血病中表达于90%恶性细胞上之跨膜受体。因此,根据本发明,cd123及cd33标靶抗原在安全性观点方面尤其有吸引力。
根据本发明,化合物cd33cd123car可在慢性骨髓性白血病(cml)群体之治疗性治疗中极有效。在慢性骨髓性白血病(cml)中,存在罕见的细胞子集,其为cd34+cd38-。认为此群体包含lsc。增加之lsc数目与疾病之进程相关。证实小分子bcr-abl酪胺酸激酶抑制剂(tki)可显著改良cp-cml患者之总存活期。然而,认为lsc对tki疗法具有抗性。迫切地需要靶向cml抗性lsc之新颖疗法以用于治疗cml,且新颖疗法以本发明中所揭示之化合物cd33cd123car形式实施。cd34+cd38-群体中之cd123表达较高。根据本发明,化合物cd33cd123car在此群体之治疗性治疗中极有效。
在本发明之一个实施例中,使用在ccar中表达cd123及cd33之白血病细胞作为治疗性治疗。cd33表达于骨髓系细胞、骨髓白血病母细胞及成熟单核细胞而非正常多能性造血干细胞上(griffin,linch等人1984)。cd33广泛表达于cml、骨髓增生赘瘤及mds中之白血病细胞中。
由于大量急性骨髓白血病(aml)患者难以用标准化学疗法方案治疗或在治疗后经历疾病复发(burnett2012),aml之cart细胞免疫疗法之研究具有解决巨大临床需要之潜力。在大部分此等患者中,白血病细胞表达cd123及cd33,提供本文中所揭示之化合物cd33cd123car之广泛临床适用性。因此,本发明揭示新颖的多重ccart/nk细胞构筑体,其包含靶向多个白血病相关抗原之多重car,借此抵消抗原逃逸机制,藉由共刺激域活化之协同效应靶向白血病细胞,包括白血病干细胞,且借此提供更强效、安全且有效的疗法。
本发明亦揭示化合物car构筑体,其具有增强之针对共同表达标靶抗原之细胞之抗肿瘤活性效能,且仍保持对仅表达一个抗原之肿瘤细胞之敏感性。此外,化合物car中之各car包括一个或两个共刺激域及在特定标靶存在下之强效杀伤力。
在靶向实体肿瘤(包括乳癌及上皮卵巢癌)之双重特异性、反信号传导car之临床前研究中,自来自第二代car之共刺激域分离cd3ζ胞内信号传导域。换言之,一个car含有第一代car而无任何共刺激域,且另一个不具有cd3ζ胞内域。因此,需要存在两种标靶抗原以用于t细胞活化及强效杀死。因此,提出其作为降低由两种标靶抗原中之一者之健康组织表达引起的偏离肿瘤毒性之方式,增加标靶特异性,但以敏感性为代价。在一个实施例中,化合物car为化合物cd123cd19car。已证实群体子集中超过90%b-all表达cd123。与aml及mds类似,认为b-all中存在罕见的lsc群体。因此,根据本发明,靶向白血病干细胞及大型白血病群体可应用于b-all。根据本发明,表达于b-all中之cd123及cd19表面抗原可为标靶,因为cd19在b细胞淋巴群体之不同阶段中大量表达。
多发性骨髓瘤(mm)为在美国第二最常见的恶性血液病,且由在骨髓或髓外位点中积聚之纯系浆细胞引起。mm为不可治愈的疾病,其中值存活期为约4.5年(kumar,rajkumar等人2008)。已研究临床前研究中之抗骨髓瘤car且car标靶包括cd38、cs1、b细胞成熟抗原(bcma)及cd38。然而,恶性浆细胞中通常存在表面抗原表达之非均质性(ruiz-arguelles及sanmiguel1994),使得其难以成为car之标靶。恶性浆细胞亦表达少量cd19。先前已证实骨髓瘤干细胞亦表达一些b细胞标记物,包括cd19。与标准及其他骨髓瘤car疗法结合,靶向此群体可在骨髓瘤之治疗中有效。
多发性骨髓瘤(mm)为具有浆细胞之纯系扩增之血液恶性疾病。尽管治疗获得重要发展,但骨髓瘤仍未不可治愈的疾病;因此迫切地需要新颖的治疗方法。
cs1(亦称为cd319或slamf7)为由slamf7基因编码之蛋白质。表面抗原cs1为正常浆细胞及骨髓瘤细胞(恶性浆细胞)之稳定标记物。
肿瘤坏死因子受体超家族,成员17(tnfrsf17),亦称为b细胞成熟抗原(bcma)或cd269在浆细胞及恶性浆细胞之末期几乎完全表达。其他组织中不存在其表达,表明作为cart或nk细胞之标靶的潜力。
恶性浆细胞显示可变程度之cd269及cs1之抗原非均质性。靶向cd269或cs1之单一car单元产物可靶向主体肿瘤中之大部分细胞,引起初始稳定抗肿瘤反应。接着,残余的极少数未经靶向之细胞扩增且引起疾病复发。尽管多发性骨髓瘤尤其为异质性,但此现象必然适用于其他白血病或肿瘤。在nih使用bcmacart细胞之当前临床试验展示有前景的结果,其中在一些多发性骨髓瘤患者中具有完全反应。然而,此等患者在17周之后复发,其可归因于抗原逃逸。亦在cd19car及ny-eso1cart细胞治疗中发现抗原逃逸。因此,迫切需要更有效的cart细胞治疗以防止复发。
在本发明之一个态样中,bcma及cs1为bcmacs1car疗法之标靶。
在一些实施例中,化合物car靶向表达bcma或cs1抗原或其两者之细胞。标靶细胞可为癌细胞,诸如(但不限于)淋巴瘤,或白血病或浆细胞赘瘤。在其他实施例中,浆细胞赘瘤选自浆细胞白血病、多发性骨髓瘤、浆细胞瘤、重链疾病、淀粉样变性、瓦尔登斯特伦氏巨球蛋白血症(waldestrom'smacroglobulinema)、重链疾病、孤立性骨浆细胞瘤、意义不明确之单株球蛋白症(mgus)及郁积型多发性骨髓瘤。
baff(b细胞活化因子)及april(增殖诱导之配位体)为两种tnf同系物,其以高亲和力特异性结合taci(亦称为tnfrsf13b或cd267)及bcma。baff(亦称为blys)结合baff-r且在功能性方面涉及b细胞之存活及晚期增殖之促进。已证实baff与一些自身免疫病症有关。april在促进抗体类别转换中起重要作用。已表明baff及april为恶性浆细胞之生长及存活因子。
恶性浆细胞中之配位体-受体相互作用描述于下文中:
恶性浆细胞中配位体与受体相互作用
在一些实施例中,化合物car靶向表达taci或cs1抗原或其两者之细胞。在另一实施例中,化合物car靶向表达taci或cs1抗原或其两者之细胞。标靶细胞可为癌细胞,诸如(但不限于)淋巴瘤,或白血病或浆细胞赘瘤。在其他实施例中,浆细胞赘瘤选自浆细胞白血病、多发性骨髓瘤、浆细胞瘤、重链疾病、淀粉样变性、瓦尔登斯特伦氏巨球蛋白血症、重链疾病、孤立性骨浆细胞瘤、意义不明确之单株球蛋白症(mgus)及郁积型多发性骨髓瘤。标靶细胞亦可为一种或两种或多种不同细胞类型之b细胞、不成熟b细胞、原生b细胞、中心母细胞、中心细胞、记忆体b细胞、浆母细胞、长寿浆细胞、浆细胞。此等细胞与自身免疫疾病有关,包括全身性硬皮病、多发性硬化、牛皮癣、皮肤炎、发炎性肠病(诸如克罗恩氏病及溃疡性结肠炎)、全身性红斑性狼疮症、脉管炎、类风湿性关节炎、休格连氏症候群、多发性肌炎、肉芽肿及脉管炎、艾迪森氏病、抗原-抗体复合物介导之疾病及抗肾丝球底膜疾病。
在一些实施例中,化合物car靶向表达baff-r或cs1抗原或其两者之细胞。在另一实施例中,化合物car靶向表达baff-r或cs1抗原或其两者之细胞。标靶细胞可为癌细胞,诸如(但不限于)淋巴瘤,或白血病或浆细胞赘瘤。在其他实施例中,浆细胞赘瘤选自浆细胞白血病、多发性骨髓瘤、浆细胞瘤、重链疾病、淀粉样变性、瓦尔登斯特伦氏巨球蛋白血症、重链疾病、孤立性骨浆细胞瘤、意义不明确之单株球蛋白症(mgus)及郁积型多发性骨髓瘤。
在一些实施例中,化合物car(ccar)靶向表达baff-r、bcma、taci及cs1抗原中之一者或两者或全部之细胞。
在一些实施例中,ccar中car之单元可包含:1)针对baff-r、bcma、taci及cs1之scfv;2)铰链区;3)共刺激域及胞内信号传导域。
在一些实施例中,ccar中car之单元可包含:1)bcma或taci或baff-r结合域,或april结合域;2)铰链区;3)共刺激域及胞内信号传导域。
在另一实施例中,bcma或tac1或baff-r结合域可为整个april及baff分子或其一部分。
在一些实施例中,ccar中car之单元可包含:1)针对bcma或cs1之scfv;2)铰链区;3)共刺激域及胞内信号传导域。
在其他实施例中,ccar可包含一个或两个或多个car之单元。各单元car可具有相同或不同铰链区及共刺激域。
在其他实施例中,标靶抗原可包括(但不限于)此群中之至少一者:ror1、psma、magea3、糖脂、磷脂醯肌醇蛋白聚糖3、f77、gd-2、wt1、cea、her-2/neu、mage-3、mage-4、mage-5、mage-6、α-胎蛋白、ca19-9、ca72-4、ny-eso、fap、erbb、c-met、mart-1、cd30、egfrviii、免疫球蛋白κ及λ、cd38、cd52、cd3、cd4、cd8、cd5、cd7、cd2及cd138。标靶抗原亦可包括病毒或真菌抗原,诸如来自人类乳突状瘤病毒(hpv)之e6及e7或ebv(埃-巴二氏病毒)抗原。
在一些实施例中,ccar靶向表达cd19或cd20抗原或其两者之细胞。在另一实施例中,ccar靶向表达cd19或cd22抗原或其两者之细胞。标靶细胞为癌细胞,诸如b细胞淋巴瘤或白血病。
急性移植物抗宿主病(gvhd)仍为同种异体造血干细胞移植之后最重要的致病率及死亡率起因。在gvhd之效应子阶段,t细胞受体(tcr),α及β链之杂二聚体,表达于t细胞之表面上,tcr识别宿主细胞上hla分子上之一些抗原,增强t细胞增殖,且释放引起对宿主细胞之损害的细胞毒素剂。tcr基因在防止潜在移植物抗宿主反应中为有效的。tcr之不活化可引起防止同种异体抗原且因此gvhd之tcr识别。
cd45对nk细胞之作用与t细胞显著不同。来自cd45缺失型小鼠之nk细胞具有针对原型肿瘤细胞系yac-1之正常细胞毒活性。此外,cd45缺失型nk细胞会正常增殖且对il15及il-21起反应。因此,破坏或删除cd45将不影响nk细胞之杀死及增殖性。
本发明包括在t或nk细胞中永久删除cd45之后接着稳定引入cd45-特异性car的方法。因此,经工程改造之t细胞显示重新导向针对cd45之特异性之所需特性,而不引起自杀及对抗原呈现之反应。在另一实施例中,经工程改造之t细胞可具有作为用于治疗恶性病或其他疾病之现成的疗法之功效。
本发明是关于一种方法,其中t细胞经工程改造,以允许在经由内源性cd45不活化或删除而降低或损失tcr信号传导时仍可以进行增殖。降低或损失tcr信号传导之结果可以防止gvhd。
在另一实施例中,藉由cd45之不活化而降低或损失tcr信号传导之t细胞可用作「现成的」治疗产品。
本发明包括经修饰之t或nk细胞之方法,其包含:(a)藉由不活化cd45来修饰t或nk细胞;(b)扩展此等经修饰之细胞;(c)分选不表达cd45之经修饰之t或nk细胞;(d)引入cd45car。
在实施例中,cd45car基因编码嵌合抗原受体(car),其中car包含抗原识别域、铰链区、跨膜域及t细胞活化域中之至少一者,且抗原识别域重新导向针对细胞上呈现之cd45表面抗原。抗原识别域包括针对cd45抗原之单株抗体或多株抗体。抗原识别域包括单株或多株抗体之结合部分或可变区。
在一些实施例中,自同种异体供体获得经修饰之t细胞且用作「现成的产物」。
使用cart或nk细胞靶向cd45可引起自杀,因为t及nk细胞表达此表面抗原。为了克服此缺点,本发明人提出使用经工程改造之crispr/cas9系统、锌指核酸酶(zfn)及tale核酸酶(talen)及大范围核酸酶不活化cd45基因。t或nk细胞中cd45之损失由靶向表达cd45之赘瘤之car进一步转导。
本发明包括用于消除或减少骨髓、血液及器官中之异常或恶性细胞之方法。在一些实施例中,表达cd45之恶性细胞存在于以下疾病之患者中:急性白血病、慢性白血病、b及t细胞淋巴瘤、骨髓白血病、急性淋巴母细胞性淋巴瘤或白血病、原发性渗出性淋巴瘤、网状组织细胞瘤、唐氏症候群(down'ssyndrome)之短暂性骨髓增生病症、淋巴细胞主导性霍奇金氏淋巴瘤、骨髓白血病或肉瘤、树突细胞瘤、组织细胞肉瘤、肌腱外鞘之巨细胞瘤、啮合树突状细胞肉瘤、移植后淋巴增生病症等。
在一些实施例中,cd45car细胞可用于藉由移除造血细胞来在骨髓中制造用于骨髓干细胞移植之空间,同时移除能够移植排斥之白血病/淋巴瘤细胞或免疫细胞。
在另一实施例中,cd45car细胞可用于在患者经历骨髓移植以接收干细胞之前预先治疗患者。在另一实施例中,cd45car可用作造血干细胞移植之脊髓抑制调节方案。
在一些实施例中,cd45car细胞用于治疗或预防干细胞移植及/或化学疗法之后的残余疾病。
在一些实施例中,cd45car为表现基因或卡匣之一部分。在一个较佳实施例中,除cd45car以外,表现基因或卡匣可包括附件基因或标签或其部分。附件基因可为诱导性自杀基因或其一部分,包括(但不限于)半胱天冬酶9基因、胸苷激酶、胞嘧啶脱胺酶(cd)或细胞色素p450。「自杀基因」消除方法可仅在由特定化合物或分子启动时改良基因疗法之安全性且杀死细胞。在一些实施例中,自杀基因为诱导性且使用特定的二聚作用化学诱导剂(cid)活化。
在一些实施例中,安全开关可包括附件标签,其为c-myc标签、cd20、cd52(campath)、经截短之egfr基因(egfrt)或其一部分或组合。附件标签可用作非免疫基因选择工具或用于追踪标记物。
在一些实施例中,安全开关可包括24残基肽,其对应于rsvf糖蛋白a2菌株之残基254-277(nsellslindmpitndqkklmsnn)。在一些实施例中,安全开关可包括由单株抗tnfα药物结合之tnfα之胺基酸序列。
本文中所描述之任何经工程改造之细胞之用法可与car增强剂一起应用。car增强剂之实例包括免疫调节药物增强car活性,诸如(但不限于)靶向免疫核查点路径之药剂,用于更好的治疗结果之群落刺激因子-1受体(csf1r)之抑制剂。靶向免疫核查点路径之药剂包括结合抑制性免疫受体ctla-4、pd-1及pd-l1且引起ctla-4及pd-1/pd-l1阻断之小分子、蛋白质或抗体。如本文中所使用,增强剂包括如上文所描述之强化子。
如本文中所使用,「患者」包括哺乳动物。本文中参考之哺乳动物可为任何哺乳动物。如本文所使用,术语「哺乳动物」是指任何哺乳动物,包括(但不限于)啮齿目(rodentia)之哺乳动物(诸如小鼠及仓鼠)及兔形目(logomorpha)之哺乳动物(诸如兔)。哺乳动物可来自食肉目(carnivora)包括猫科动物(felines)(猫)及犬科动物(canines)(犬)。哺乳动物可来自偶蹄目(artiodactyla),包括牛科动物(bovines)(奶牛)及猪科动物(swines)(猪)或奇蹄目(perssodactyla),包括马科动物(equines)(马)。哺乳动物可为灵长目、四足猴目(ceboids)或猴目(simoids)(猴)或类人猿目(anthropoids)(人类及猿)。哺乳动物较佳为人类。患者包括个体。
在某些实施例中患者为年龄为0至6个月、6至12个月、1至5岁、5至10岁、5至12岁、10至15岁、15至20岁、13至19岁、20至25岁、25至30岁、20至65岁、30至35岁、35至40岁、40至45岁、45至50岁、50至55岁、55至60岁、60至65岁、65至70岁、70至75岁、75至80岁、80至85岁、85至90岁、90至95岁或95至100岁之人类。
如本文所使用,术语经工程改造之细胞之「有效量」及「治疗有效量」意谓足以提供所需治疗性或生理学或作用或结果之经工程改造之细胞之量。此类作用或结果包括细胞疾病之症状之减少或改善。不合需要的作用,例如副作用有时与所需治疗性作用一起显现;因此,医师在确定何为适合的「有效量」时针对潜在风险平衡潜在益处。视患者之物种、年龄及一般健康状况、投药模式及其类似因素而定,所需精确量将在各患者之间不同。因此,有可能不能指定精确「有效量」。然而,在任何个别情况下之适合的「有效量」可由一般技术者仅使用常规实验来确定。通常,经工程改造之细胞以足以降低标靶细胞之增殖的量及条件投与。
在投与用于治疗、抑制或预防癌症之传递系统之后,可以熟习此项技术者熟知的多种方法评估治疗性经工程改造之细胞之功效。举例而言,一般熟习此项技术者应理解,藉由观测到治疗性经工程改造之细胞降低癌细胞负荷或防止癌细胞负荷进一步增加,与化学佐剂结合传递之治疗性经工程改造之细胞可有效治疗或抑制患者中之癌症。癌细胞负荷可藉由此项技术中已知的方法测量,例如使用聚合酶链反应分析法以侦测是否存在某些癌细胞核酸或鉴别血液中之某些癌细胞标记物,使用例如抗体分析法以侦测来自个体或患者之样品(例如(但不限于)血液)中是否存在标记物,或藉由患者中循环癌细胞抗体含量之含量。
遍及本说明书,由范围以及范围之下限及上限定义量。各下限可与各上线组合以定义范围。下限及上限应各自视为单独的元素。遍及本说明书,对「一个实施例」或「一个实例」之参考意谓在本发明实施例之至少一个实施例中包括结合该实施例或实例所描述之特定特性、结构或特征。因此,遍及本说明书,在多处出现之短语「在一个实施例中」或「一个实例」未必皆参考相同实施例或实例。此外,在一或多个实施例或实例中,特定特性、结构或特征可以任何适合的组合及/或子组合形式组合。此外,应了解,与其一起提供之图式系出于对一般熟习此项技术者说明目的且图式未必按比例绘制。
如本文中所使用,术语「包含(comprises/comprising)」、「包括(includes/including)」、「具有(has/having)」或其任何其他变体意欲涵盖非排他性的包涵。举例而言,包含元素列表之过程、物件或装置未必仅限于此等元素,而是可包括未明确列举或此类制程、物件或装置所固有的其他元素。
此外,除非明确地相反陈述,否则「或」是指包涵性「或」且不为排他性「或」。举例而言,条件a或条件b藉由以下中之任一者得以满足:a为真(或存在)且b为假(或不存在);a为假(或不存在)且b为真(或存在);以及a与b皆为真(或存在)。
此外,本文中提供之任何实例或说明不应视为以任何方式对其所使用之任何术语造成约束、限制或表示定义。实情为,此等实例或说明视为关于一个特定实施例描述且仅为说明性。一般熟习此项技术者将了解,与此等实例或说明一起使用之任何术语将涵盖可或可不与其一起提供或在说明书中之其他地方提供之其他实施例,且所有此等实施例意欲包括在该或该等术语之范畴内。指定此类非限制性实例及说明之语言包括(但不限于):「举例而言」、「例如」及「在一个实施例中」。
在本说明书中,描述含有多个成员之多种参数之群。在参数群内,各成员可与任何一或多个其他成员组合以形成其他子群。举例而言,若群成员为a、b、c、d及e,则特定涵盖之其他子群包括该等成员中之任一、二、三或四者,例如a及c;a、d及e;b、c、d及e等。
如本文中所使用,xxxx抗原识别域为对xxxx具有选择性之多肽。因此,xxxx为标靶。举例而言,cd38抗原识别域为对cd38具有特异性之多肽。
如本文中所使用,cdxcar系指具有cdx抗原识别域之嵌合抗原受体。
可参考下文阐述之实例更好地理解本发明。提供以下实例以向一般熟习此项技术者提供如何制造及评估本文中主张之化合物、组合物、物品、装置及/或方法之完全揭示内容及说明,且意欲仅为例示性且不意欲限制本发明。
实例
产生化合物car(ccar)
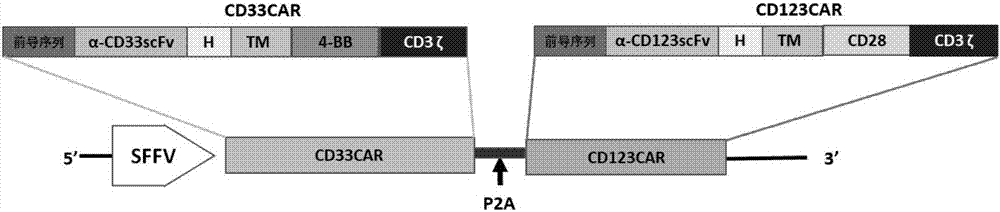
cd33cd123ccar之建筑遵循图1a中之示意图。其包括驱动具有两个不同car单元之功能性化合物car(ccar)之表达的sffv(脾病灶形成病毒)启动子。抗原受体朝向,抗cd33及抗cd123之scfv(单链可变片段)核苷酸序列。由于对于双顺反子基因构筑体之自裂解动力学之高效机制而使用来源于小rna病毒之p2a肽。自裂解p2a肽用于在表达期间将car、cd33car及cd123car中之两个独立单元连接在一起。此方法相比于文献中通常使用之内部核糖体进入位点(ires)之优势包括其尺寸较小及在2a肽之两个上游及下游单元蛋白质之间的高裂解功效。此外,当使用ires时,使用自裂解p2a肽可避免ires之前及之后基因之间的表达量差异问题。
模组单元,cd33car包括cd33scfv域、cd8a铰链区、cd8a跨膜域、4-bb共刺激域及cd3ζ链之胞内域。第二模组car,cd123car具有与cd33car相同的铰链、跨膜及细胞内信号传导域,但具有不同的scfv及共刺激域。cd33car识别其相应抗原且cd123car结合于其相应抗原。铰链区经设计使得避免其中二硫化物相互作用之序列。使用不同的共刺激域4-bb及cd28。将cd33cd123化合物car次选殖至慢病毒质体中。
产生高效化合物car(ccar)
借由根据制造商说明用脂染胺2000(lipofectamine2000)转染hek-293ft细胞来产生化合物car慢病毒,但由于插入物之尺寸较大而使用2倍载体dna以增加效价,如图2中所示。在约12-16小时培育之后,移出含有脂染胺之培养基且置换为含有10%fbs、20mmhepes、1mm丙酮酸钠及1mm丁酸钠之dmem。在约24小时之后,收集且冷藏上清液,且置换为新鲜培养基。在约24小时之后,收集上清液且与前述上清液合并,且经由0.45μm滤片过滤。将上清液分成等分试样,用液氮急骤冷冻且在-80℃下储存。收集hek-293ft细胞,冷冻储存,且溶解用于后续电泳及蛋白印迹法。
pb(外周血)或cb(人类脐带血)白血球层细胞用抗cd3抗体及il-2活化2天。将ccar慢病毒上清液旋涂在经重组人纤维蛋白片段涂布之多孔培养盘上。在多个孔中用慢病毒上清液以约0.3×106个细胞/毫升之低浓度转导经活化之t细胞,以增加转导功效(图2)。
在第一次隔夜转导之后,除非细胞看起来不健康,否则细胞在不洗涤情况下直接添加至第二个经病毒涂布之盘中以用于第二次转导。在第二次隔夜转导之后,洗涤细胞,合并且在经组织培养物处理之培养盘中培育。使cart细胞扩增至多约5天,随后进行共培养杀死分析。在培育约3天之后,细胞与结合有生物素之山羊抗小鼠f(ab')2或山羊igg(同型)抗体一起培育,洗涤且接着与抗生蛋白链菌素-pe及结合之抗人类cd3一起培育。在洗涤且悬浮于2%福马林中之后,接着藉由流式细胞术分析细胞以测定转导功效百分比。
cd33cd123ccar之表征
经转染之cd33cd123ccarhek293t细胞经历蛋白印迹分析以确认化合物构筑体。用抗cd3ζ单株抗体进行之免疫印迹法展示化合物carcd3ζ融合蛋白之预测尺寸之谱带(图1b)。重要的是,如所预期,在信号传导p2a肽之成功高裂解作用之墨点上观测到具有类似强度之两个不同谱带。如所预期,未发现gfp对照载体之cd3ζ表达。亦在hek293细胞(图1c)及原生t细胞(图1c)上测试scfv之表面表达。
在hek293细胞系中测试化合物cd33cd23car慢病毒之转导功效且藉由流式细胞术分析(beckmancoulter)(图1c)。流式细胞术表明约67%hek细胞表达cd33cd123car。人类外周血(pb)通常用于自体t细胞疗法。人类pb白血球层细胞用抗cd3抗体及il-2活化,且用cd4car或对照性(gfp)慢病毒转导。在转导之后,流式细胞术分析表明约22%t细胞表达cd33cd123car(图1c)。
结果
来源于脐带血(ucb)及外周血(pb)之cd33cd123ccart细胞特异性杀死表达cd33之肿瘤细胞
分别在约100,000、200,000、500,000、约1百万或2百万个效应细胞至约50,000、100,000、200,000个标靶细胞下,cd33cd123ccart细胞或gfpt细胞(对照物)以0.5:1、50:1范围内之比率,较佳以约2:1、5:1、10:1、20:1、50:1之比率与标靶细胞一起在约1-2mlt细胞培养基中,在无il-2之情况下培育约24小时。标靶细胞为来自白血病患者之白血病细胞系及白血病细胞。在共培养约24小时之后,细胞用小鼠抗人类cd33、cd123、cd34及cd3抗体染色。
产生表达cd33car及cd123car之cd33cd123ccart细胞且使用hl60及kg-1a细胞系测试抗白血病功能。hl60细胞系为高度富集cd33之前髓细胞性白血病细胞系。约100%其细胞群体为cd33+,其中其小型子集(<10%)为dimcd123+。在培养物中,测试此细胞系以测定cd33cd123car之效用,其中强调靶向表达cd33之白血病细胞。此外,归因于hl60中之强cd33表达,cd33cd123ccar作用可为显著的。实际上,在具有多种效应子:标靶细胞之比率之24小时共培养条件期间,cd33cd123ccar呈现显著白血病细胞杀死特性(图3)。首先测试cb衍生之cd33cd123cart细胞杀死hl60细胞之能力。在约24小时培育及在约0.5:1至50:1,较佳1:1至约5:1,更佳约2:1至4:1范围内之低效应子:标靶(e:t)比率下,当与gfp对照物比较时,cd33cd123car细胞消除约55%表达cd33之hl60细胞。在约5:1之比率下,杀伤作用提升至约82%。
来源于外周血单核细胞(pbmc)之cd33cd123car与骨髓性白血病细胞系kg1a共培养,与hl60及50-80%cd123相比,kg1a亦以适度表达约100%cd33。因此,kg1a为相对双重标靶细胞群体,其对由cd33cd123car靶向之抗原具有双重阳性。使用约24小时培育及约0.5:1至50:1范围内之低效应子:标靶(e:t)比率。尽管在约2:1之低e:t比率下,cd33cd123car仍呈现适度的约26%之抗白血病活性,与gfp对照物相比,e:t比率增加至10:1可引起杀死约62%kg1a(图4),表明cd33标记物之强度可为杀伤力之指示物,其中强烈呈现hl60且与kg1a相比利用更多的car作用。此等实验提供完全cd33cd123car针对其相关抗原呈现细胞群体之功能的证据。
已产生其他化合物car,cd33cd123-bbccar。此化合物car包含两个独立car单元,cd33及cd123。第一car包含结合于cd33之scfv且第二car具有不同的识别cd123之scfv。两个car皆含有相同铰链区、跨膜、共刺激及细胞内域。产生cd33cd123-bbccar慢病毒且在kg-1a细胞中测试其杀伤力。如图5中所示,在约10:1之比率下存在实质性杀死,但其与cd33cd123ccar相比强度较弱。
cd33cd123ccar具有针对表达cd33及/或cd123之患者样品之活性
除细胞系实验以外,亦对患者样品进行研究以测试每个个别car单元之功能。使用侵袭性急性骨髓白血病(aml),aml-9测试cd33cd123ccar之功效。归因于患者细胞群体之非均质性,该细胞群体包括aml-9样品中之多种细胞类型,用cd34及cd33闸控白血病母细胞,因为其对此等两种标记物呈阳性。在cart细胞:标靶细胞之某一比率下,观测到白血病细胞之此cd33+cd34+群体之消耗比gfp对照物高48%(图6)。
亦测试cd123阳性且cd33阴性之白血病细胞。为此目的,选择人类b细胞急性淋巴细胞白血病(b-all)样品,sp-bm-b6。此样品中之所有白血病母细胞为cd34+cd33-,且超过约50%对cd123呈阳性。与gfp对照物相比,cd33cd123ccart细胞之cd34+白血病细胞群体消耗率为约86%(图7)。基于细胞系及人类样品研究,吾人之资料明确表明化合物cd33cd123car能够靶向表达cd33或cd123或其两者之白血病细胞。
cd33cd123ccarnk细胞靶向表达cd33或cd23或其两者之白血病细胞
自然杀手(nk)细胞为cd56+cd3-且可有效杀死受感染及肿瘤细胞类cd8+t细胞。与cd8+t细胞不同,nk细胞发起针对肿瘤之细胞毒性而无需活化以杀死细胞。nk细胞比效应细胞更安全,因为其可避免细胞激素风暴(cytokinestorms)之潜在致死性并发症。然而,完全未探索使用cd33或cd123或两种carnk细胞杀死白血病。
产生cd33cd123ccarnk细胞
nk-92细胞用cd33cd123car慢病毒上清液转导两个连续隔夜,转导之间的变化在于经重组人纤维蛋白片段涂布之培养盘及经病毒涂布之培养盘。经转导之细胞扩增3或4天且接着藉由流式细胞术分析car表达。收集细胞且以约1:250与山羊抗小鼠f(ab')2一起培育约30分钟。洗涤细胞,悬浮且用抗生蛋白链菌素-pe染色约30分钟。洗涤细胞且悬浮于2%福马林中,且藉由流式细胞术分析。接着如上文所述标记表达cd33cd123ccar之nk-92细胞且在facsaria上分选,其中收集且培养顶部0.2%表达f(ab')2之细胞。经分选、扩增之细胞之后续标记展示约89%nk-92细胞对抗小鼠f(ab')2呈阳性(图8)。
cd33cd123ccarnk细胞有效溶解或消除白血病细胞
首先,吾人藉由评估cd33cd123ccarnk-92细胞杀死共培养物中hl-60癌细胞系之能力来测试其功能。几乎所有hl-60细胞皆高度表达cd33,但此细胞系中之cd123表达仅小于10%(弱)。因此,cd33cd123ccar之杀伤力可能取决于ccar正确靶向cd33之能力。
cd33cd123ccarnk-92细胞与hl-60细胞一起在无il-2之nk细胞培养基中共培养约24小时。在培育之后,标记cd33cd123ccarnk-92细胞且与非car之对照物gfpnk-92细胞比较。与对照物gfpnk-92细胞相比,观测到cd33cd123ccarnk-92细胞显著杀死hl-60细胞。此外,cd33cd123ccarnk-92细胞之杀伤力具有剂量依赖性,其中与对照物比较,约10:1比率为约100%(图9及11)。
使用kg1a、使用骨髓白血病细胞系进行第二共培养实验,kg1a在所有细胞中表达cd33,但与hl-60相比以中等量表达。cd123抗原表达于约50-80%kg1a细胞中。实验设计与上述hl-60杀死分析法之第一实验类似,其具有相同培育时间、效应子:癌细胞比率及gfpnk-92细胞对照物。结果展示与gfpnk-92细胞对照物相比,cd33cd123ccarnk-92细胞以剂量依赖性方式显著杀死kg1a细胞。在10:1之效应子:标靶之比率下,与gfp对照物相比,cd33cd123ccarnk-92细胞杀死约85%kg1a细胞(图10及11)。
kg1a细胞之分析展示两种不同群体cd33+cd123-及cd33+cd123-。图11展示在两个群体中发现之细胞杀死之剂量依赖性增加。惊人的是,双重阳性群体在各增加之比率下展示较高有效杀死,表明cd33及cd123之两个模组car之可能的协同作用(图12)。
产生cd19cd20、cd19cd22、cd19cd138ccar
已使用与上述cd33cd123ccar类似之策略产生三种ccar(图13)。
产生包括bcmacs1ccar及bcmacd19ccar之用于治疗多发性骨髓瘤之ccar
已进行ccar之临床前研究以靶向表面抗原,包括cd38、cs1、cd138、b细胞成熟抗原(bcma)及cd38。cd19car亦在i期临床试验中显示一些用于治疗多发性骨髓瘤之功效。然而,鉴于恶性浆细胞中通常存在表面抗原表达之非均质性(ruiz-arguelles及sanmiguel1994),单个标靶不大可能足以消除此疾病。产生bcmacs1ccar、bcmacd19ccar、bcmacd38ccar及bcmacd138ccar且实验设计与如上文所描述之cd33cd123ccar类似。
产生包括bcmacs1ccar(bc1ccar)之用于治疗多发性骨髓瘤之ccar
产生及表征bcma-cs1ccar(bc1ccar)构筑体
bc1ccar之模组设计由藉由自裂解p2a肽与抗cd319(cs1)融合之抗cd269(bcma,b细胞成熟抗原)单链可变片段(scfv)区域、cd8衍生之铰链(h)及跨膜(tm)区域以及连接至cd3ζ信号传导域之串联4-1bb共活化域组成(图14a)。强脾病灶形成病毒启动子(sffv)及cd8前导序列用于t细胞表面上bc1ccar)car分子之有效表达。两个单元car使用相同共刺激域4-1bb。经转染之bc1ccarhek293t细胞经历蛋白印迹分析以确认化合物构筑体。用抗cd3ζ单株抗体进行之免疫印迹法展示化合物carcd3ζ融合蛋白之预测尺寸之谱带(图14e)。重要的是,如所预期,在信号传导p2a肽之成功高裂解作用之墨点上观测到具有类似强度之两个不同谱带。如所预期,未发现gfp对照载体之cd3ζ表达。
产生bc1ccar(ccar)t细胞
在活化2天之后,自脐带血(ucb)白血球层分离之t细胞用bc1ccar慢病毒转导。两个单元car使用相同共刺激域4-1bb。测定bc1ccar之转导功效为约15%,如藉由流式细胞术所测定(图14b)。首先在对骨髓瘤标记物bcma及cs1呈阴性之cml(慢性骨髓性白血病)细胞系上测试bc1ccart细胞。如所预期,不存在针对野生型k562之对照物t细胞或bc1ccart细胞引起之溶解(图14c)。bcma-k562(kochenderfer,nih)为用表达cdna之bcma转导以在>80%细胞群体中表达bcma之k562细胞。bc1ccart细胞以2:1及5:1之e:t比率与此细胞系共培养且与对照物相比展示超过30%溶解(不可侦测)(图14c)。此等结果与在经抗原转导之其他car之细胞系(诸如cs1cart细胞)上进行其他培养相容。
然而,当bcma-cs1-2g(ccar)使用不同的共刺激域时,对于各单元使用4-bb或cd28,侦测到罕见的表面car表达,其表明适合的共刺激域选择对于确保t细胞上之表面car表达可为重要的(图14d)。
尽管在hek细胞藉由蛋白印迹法侦测蛋白质(图14e),但吾人不能在经cd269-cs1-2g慢病毒上清液转导之经活化之t细胞中侦测表面表达。此可归因于无法将经表达之蛋白质汇出至细胞膜。在未来,吾人可能需要最佳化此构筑体之序列以允许更大的细胞表面表达。
bc1ccart细胞特异性溶解bcma+及cs1+细胞系
为了评估bc1ccart细胞之细胞毒性能力,吾人用骨髓瘤细胞系:mm1s(bmca+cs1+)、rpmi-8226(bcma+cs1-)及u266(bcma+cs1dim)进行共培养分析。藉由流式细胞术分析定量bc1ccart细胞溶解标靶细胞之能力,且标靶细胞用cytotracker染料(cmtmr)染色。在24小时共培养中,bc1ccar呈现mm1s细胞之几乎完全溶解,其中在2:1之e:t比率下消耗超过90%标靶细胞且在5:1之e:t下消耗超过95%(图15)。在rpmi-8226细胞中,bc1ccar在2:1之e:t比率下溶解超过70%bcma+标靶细胞,且在5:1之e:t下溶解超过75%标靶细胞(图16)。在与u266标靶细胞之24小时共培养中,bc1ccar在2:1之e:t比率下溶解80%bcma+u266细胞,达到饱和(图17)。
原生患者骨髓瘤样品中bc1ccart细胞特异性靶向bcma+及cs1+群体
对mm10-g患者样品之流式细胞术分析显示不同及不变的bcma+及cs1+群体子集(图18)。mm7-g样品展示完全bcma+cs1+表达型,而mm11-g呈现有杂质的bcmadimcs1dim表达型,可能可归因于其作为骨髓抽出物之性质。在24小时之后,bc1ccart细胞展示mm7-g原生患者样品之稳定消除,其中在5:1之e:t比率下溶解超过75%,在10:1下增加至超过85%(图19)。针对mm11-g(图20),bc1ccart细胞在10:1之e:t下能够溶解超过45%bcma+cs1+群体。
bc1ccar藉由在24小时内在mm10-g共培养中显著消除bcma+cs1+及bcma-cs1+群体子集来展示靶向及比溶胞率能力。在2:1之e:t比率下,bc1ccart细胞消除超过60%bcma+cs1+群体,且消除70%单独的cs1+群体。在5:1之e:t比率下,单独的cs1+群体之消除增加至80%(图18)。
bc1ccart细胞呈现活体内肿瘤之显著控制及降低
为了评估bc1ccart细胞之活体内抗肿瘤活性,吾人研究使用经亚致死剂量辐射且静脉内注射表现萤光素酶之mm.1s细胞(一种多发性骨髓瘤细胞系)以诱导可测量之白血病形成的nsg小鼠之异种小鼠模型。在肿瘤细胞注射之后第三天,以单次给药方式向小鼠静脉内注射8×106个bc1ccart细胞或载体对照细胞。在第3、6及8天,向小鼠皮下注射redijectd-luciferin(perkinelmer)且让小鼠经历ivis成像以测量肿瘤负荷(图21)。比较所测量之经bc1ccart细胞注射之小鼠之平均光强度与经载体对照物注射之小鼠之平均光强度以测定经处理之小鼠对比对照小鼠中之肿瘤细胞百分比(图21及22)。不成对t测试分析显示在第8天两个组之间的极显著差异(p=0.0001),其中经bc1ccart细胞注射之组与对照组相比具有较低光强度且因此具有较低肿瘤负荷(p<0.0001)。在第1天且随后每隔一天,测量肿瘤尺寸面积且比较两个组之间的平均肿瘤尺寸(图21)。总而言之,此等活体内资料表明当与载体对照性nk对照细胞相比时,cd269-cs1-bbcart细胞显著降低经mm.1s注射之nsg小鼠中之肿瘤负荷。
cd45car疗法
用chopchop设计三对sgrna以靶向相关基因。接着将基因特异性sgrnas选殖至与e2a自裂解连接子连接之表现人类cas9及嘌呤霉素抗性基因之慢病毒载体(lentiu6-sgrna-sffv-cas9-puro-wpre)中。u6-sgrna卡匣位于cas9元件之前。sgrna及cas9puro之表现分别由u6启动子及sffv驱使(图23)。
使用及构筑以下基因特异性sgrna序列。
在本发明之非限制性实施例中,已如下文所阐述设计及构筑例示性基因特异性sgrna:
cd45sgrna构筑体:
lenti-u6-sgcd45a-sffv-cas9-purogtggtgtgagtaggtaa
lenti-u6-sgcd45b-sffv-cas9-purogagttttgcattggcgg
lenti-u6-sgcd45c-sffv-cas9-purogagggtggttgtcaatg
图24展示产生靶向血液科恶性疾病之cd45cart或nk细胞之步骤。
crispr/cas核酸酶靶向nk细胞上之cd45
使用具有基因特异性sgrna之慢病毒转导nk-92细胞。藉由流式细胞术分析测定nk-92细胞上cd45表达之减少。分选及扩增nk-92细胞之cd45阴性群体(图25)。使用经分选及扩增之cd45阴性nk-92细胞产生cd45carnk细胞。使用所得cd45carnk细胞测试其杀死cd45+细胞之能力。
在crispr/cas核酸酶标靶之后,经cd45不活化之nk-92细胞(nk45i-92)之功能性表征。吾人证明,在cd45之crispr/cas核酸酶不活化之后,nk45i-92细胞之生长与野生型nk-92细胞类似(图26)。
cd45之不活化不显著影响nk-92之细胞增殖。此外,吾人证实当细胞与白血病细胞ccrf共培养时,nk45i-92细胞之溶解能力与野生型nk-92相容(图27)。
为了说明经cd45不活化之nk-92与car溶解相容,nk45i-92细胞及其野生型nk-92用表达cd5car或gfp之慢病毒转导。藉由facs分选所得cd5carnk45i-92细胞及gfpnk45i-92且用于比较其杀死标靶细胞之能力。cd5carnk45i-92细胞在其与ccrf-cem细胞共培养时,在2:1及5:1之比率(e:t)下显示稳定杀死cd5标靶白血病细胞之能力。吾人cd5carnk45i-92与cd5carnk-92细胞之间存在类似的活体外ccrf-cem细胞消除功效(图28)。此表明cd45表达之减少不会降低carnk细胞之抗肿瘤活性。
产生cd45car构筑体
吾人随后研究白血病细胞中nk45i-92细胞中cd45car对cd45抗原之反应吾人产生cd45car。cd45car由抗cd45单链可变片段(scfv)区域,cd8衍生之铰链(h)及跨膜tm)区域以及连接至cd3ζ信号传导域之串联cd28及4-1bb共活化域组成(图29a)。使用强脾病灶形成病毒启动子(sffv)及cd8前导序列。使用适合的载体对照经cd45car慢病毒质体转染之hek293-ft细胞之蛋白印迹法表征cd45car蛋白质。此外,抗cd3ζ单株抗体免疫印迹法显示cd45car蛋白质之预测尺寸之谱带,其中载载对照物中未观测到谱带(图29b)。
cd45carnk45i-92nk细胞
在经萤光活化之细胞分选(facs)以富集nk45i-92细胞之后,测定cd45carnk-92转导功效为87%,如在分选之后藉由流式细胞术测定(图30)。在nk45i-92细胞之facs收集之后,cd45car表达量在至少10次继代中保持始终稳定。
cd45carnk45i-92细胞特异性溶解cd45+白血病细胞
为了评估cd45carnk45i-92抗白血病活性,吾人使用t-all细胞系,ccrf-cem及jurkat以及nk细胞系及nk-92细胞进行共培养分析,因为其皆表达cd45(图31,32及其吾人证明cd45carnk45i-92细胞持续显示白血病细胞之稳定溶解。在针对标靶细胞之中低有效性下培育6小时(e:t比率5:1)之后,cd45carnk45i-92细胞有效溶解超过60%ccrf-cem细胞(图31)。在6小时共培养之后,cd45carnk45i-92细胞在2:1或5:1之间e:t比率下亦能够消除约60%jurkat细胞(图32)。在6小时共培养之后,cd45carnk45i-92细胞在2:1之间e:t比率下有效溶解20%cd45阳性nk-92细胞,其中5:1之e:t下将近60%溶解(图33a-33c)。
为了进一步分析血液科恶性疾病之cd45标靶,吾人亦产生另外两种car:cd45-28及cd45-bb,且使用表cd45-28或cd45-bbcar之间慢病毒转导nk45i-92细胞.cd45-28和cd45-bbcar含有新型抗cd45scfv,其与上述cd45car不同.cd45-28car使用cd28共刺激域,而cd45-bb具有4-bb共刺激域。cars使用cd8衍生之铰链(h)跨膜(tm)区域和cd3ζ信号传导域。cd45car显示b急性淋巴细胞性细胞系reh之稳定溶解。cd45carnk45i-92细胞溶解约76%reh细胞与对照性gfpnk-92细胞相比,cd45b-bbcarnk45i-92细胞和cd45b-28carnk45i-92细胞分解展示约79%及100%reh细胞溶解(图33d-g)。cd45b-28carnk45i-92细胞呈现最高的reh细胞溶解能力。
il15及其受体增强cart及nk细胞功能
近期研究表明t细胞持久性与cart细胞治疗功效良好相关。当前试验表明强效和持续性抗肿瘤活性可以输入少数cart细胞产生,表明输入产物之品质而非数量对促进抗肿瘤活性更重要。介白素(il)-15为促进淋巴细胞之发育及止血之细胞激素。增加之含量之il-15可促进t细胞增殖及增强t细胞效应子反应。来自近期研究之资料证实il-15对记忆体cd8t细胞(一种与抗肿瘤活性相关之重要因子)之产生及维持为重要的.il-15结合il-15受体α链(亦称为il15ra或ra),促进il-15介导之作用,诸如t细胞存活,增殖及记忆体t细胞产生。
il-15rα的结合t细胞之表面中之βγ复合物且il15藉由与t细胞及其他类型之细胞之细胞表面上之此il-15rα的/βγ复合物结合来进行信号传导。
当前资料表明单独的il-15转染不显示影响t细胞功能,但il-15/1il-15ra使t细胞自发地存活及增殖。
所有投与之单独的il-15之功能可受自由il-15ra及其短半衰期之可可用性限制投与可溶性il-15/ra复合物极大增强活体内ii-15半衰期及生物可用性因此,用这种复合物而非单独的il-15处理小鼠可引起记忆体cd8t细胞及nk细胞之稳定增殖及维持。近期研究表明il-15ra之一部分细胞外区(称为sushi域)为其与il15之间结合所需的(wei等人,j.immunol。,第167卷(1卷),第277-282页,2001)。含有连接子之il-15/ra融合蛋白或il-15/sushi融合蛋白比较单独的il-15及可溶性il-15ra更强效.il-15/ra或il-15/sushi组合可最大化il-15活性。然而,尚不明确在同一个构筑体中合并有car及il-15/ra或il15/sushi之设计能否维持其在t或nk细胞中之所需生物特性,因为插入物序列长度能够影响转染功能及基因达量。
本发明提供经工程改造之细胞,其在单一构筑体中具有car及il15/ra或il15/sushi。在一些实施例中,本发明包括产生较高病毒效价及使用更强的启动子驱动car及其中的il15/ra或il-15/sushi之方法。
在一些实施例中,本发明提供经工程改造之细胞,其具有:(1)靶向抗原之car,该抗原包括(但不限于)cd4,cd2,cd3,cd7,cd5,cd45,cd20,cd19,cd33,cd123,cs1及b细胞成熟抗原(bcma);及(2)15;(3)il15ra(ra)或sushi。在其他实施例中,car包含嵌合抗原受体,共刺激胞内域中一或多者,诸如cd28,cd2,4-1bb及ox40以及cd3ζ在其他实施例中,强启动子可为(但不限于)sffv,car,il-15/ra或sushi及诱导性自杀基因(「安全开关」),或可在载体(诸如慢病毒载体,腺病毒载体及反转录病毒载体或质体)上组装组合。引入“安全开关”可显示增加安全概况,并限制car之命中标靶或偏离肿瘤毒性。
表征cd4il15ra-car
已生产cd4il15ra-car,其含有连接至il15ra之第三代cd4car(图34)。在表现载体上组装(第三代),sushi/il-15之组合且藉借sffv启动子驱动其表现具有sushi/il-15之car与p2a裂解序列连接。sushi/il-15部分由与sushi域融合之il-2信号肽组成且经经26胺基酸聚脯胺酸连接子连接至il-5(图34)。
为了验证cd4il15ra构建体,hek293ft细胞用gfp(对照物)或cd4il15ra之前的病毒质体转染。在转染之后约60小时,收集hek-293ft细胞及上清液。细胞溶解于含有蛋白酶抑制剂混合物之ripa缓冲液中和进行电泳。凝胶转移至immobilonfl墨点膜,阻断且在1:500下用小鼠抗人类cd3z抗体探测。在洗涤之后,薄膜用山羊抗小鼠hrp结合物探测,洗涤,且在用hyglohrp受质处理之后暴露于薄膜。cd4il15ra-car在hek293细胞中成功表达(道2,图35a,如紧道3中之重组型il-15蛋白质所示(箭头))。藉由新鲜hek-293细胞之转导进一步检验cd4il15ra-car慢病毒上清液(图35a)。hek-293细胞来源经转染之hek-293ft细胞之gfp或cd4il15ra-car病毒上清液转导添加凝聚胺达到4μl/ml。在16小时之后更换培养基和用不含病毒上清液或凝聚胺之培养基置换。在转导之后三天,收集细胞和用山羊抗小鼠f(ab')2抗体以1:250染色30分钟洗涤细胞且使用抗生蛋白链菌素-pe结合物以1:500染色,洗涤,悬浮于2%福马林中而通过流式细胞术分析图34b展示经cd4il15ra-car慢病毒转导之hek-293细胞对f(ab)2-pe呈现80%阳性(圆圈,图35b),而经gfp对照慢病毒转导之细胞对f(ab)2-pe最小(图35b,左侧)。
产生cd4il15ra-carnk细胞
nk-92细胞用cd4il15ra-car慢病毒上清液转导。在培育5天之后,收集细胞且以1:250与山羊抗小鼠f(ab')2一起培育30分钟。洗涤细胞,悬浮且用抗生蛋白链菌素-pe染色30分钟。洗涤细胞且悬浮于2%福马林中,且藉由流式细胞术分析,引起约70%经转导之细胞表达cd4il15ra-car(圆圈,图36)。cd4il15ra-car之其他实验测试将包括活体外及活体内白血病/淋巴瘤杀死分析,及经cd4car转导之细胞之标靶杀死及增殖率之对比。本发明者亦使用与上文所述相同的策略产生cd19il15ra-car。
产生cd4il15ra-cart细胞
人类脐带白血球层细胞用cd4il15ra-car慢病毒上清液转导。在培育5天之后,收集细胞且以1:250与山羊抗小鼠f(ab')2一起培育30分钟。洗涤细胞,悬浮且用抗生蛋白链菌素-pe染色30分钟。洗涤细胞且悬浮于2%福马林中,且藉由流式细胞术分析,引起63%经转导之细胞表达cd4il15ra-car(圆圈,图37)。cd4il15ra-car之其他实验测试将包括活体外及活体内白血病/淋巴瘤杀死分析,及经cd4car转导之细胞之标靶杀死及增殖率之对比。
藉由将cd4il15racarnk细胞与以下cd4阳性细胞系共培养来测试其相对于cd4carnk细胞之活体外抗白血病活性:karpas299及molt4
karpas299细胞系来源于具有多形性大型t细胞淋巴瘤之患者。自19周岁急性淋巴母细胞白血病(t-all)患者之外周血产生表达cd4之molt4细胞系。在4小时共培养实验期间,cd4il15racarnk细胞在5:1之效应子:标靶比率下,在甚至高于cd4carnk细胞之比率下展示karpas299细胞之显著杀死(95%)(82%,图38)。类似地,当以1:1与molt4细胞共培养时,在隔夜分析法中,cd4il15racarnk细胞以高于cd4carnk细胞之比率(84%至65%)溶解标靶细胞(图39)。此等结果证实cd4il15carnk细胞至少可与cd4carnk细胞相同地消除肿瘤细胞。
cd4car及cd4il15racart细胞呈现比cd4car更强效的活体内抗肿瘤活性
为了评估cd4car及cd4il15racart细胞之活体内抗肿瘤活性,及测定cd4il15racart细胞相对于cd4cart细胞之持久性之可能增加,吾人研究使用经亚致死剂量辐射及静脉内注射表现萤光素酶之molm13细胞(一种急性骨髓白血病细胞系(m5),其为100%cd4)以诱导可测量之肿瘤形成之nsg小鼠的异种小鼠模型。在肿瘤细胞注射之后三天,向6只小鼠各自静脉内注射8×106个cd4car、cd4il15racart细胞或载体对照性t细胞之疗程。在第3、6、9及11天,向小鼠皮下注射redijectd-luciferin(perkinelmer)且让小鼠经历ivis成像以测量肿瘤负荷(图40)。在第6天,经cd4cart细胞处理之小鼠相对于对照物具有52%肿瘤负荷降低,而经cd4il15racart细胞处理之小鼠具有74%肿瘤负荷降低(图41)。在第11天,在此等组中之两者中,几乎所有肿瘤细胞溶解。在第9天,不成对t测试分析显示对照物与两个组之间的极显著差异(p=0.0045),其中与对照物相比经cd4car及cd4il15racart细胞处理之组中存在较低光强度且因此存在较低肿瘤负荷。
使用gfp报导子之启动子测试
hek293ft细胞在sffv、ef1或cag启动子下用表达gfp之慢病毒质体转染。在转染之后约60小时,自各样品收集上清液。藉由首先用来自3种启动子中之每一者之上清液转导hek293细胞来测定相对病毒效价。用来自3种经转染之hek-293ft细胞中之每一者之gfp病毒上清液转导hek-293细胞。添加凝聚胺达到4μl/ml。在16小时之后更换培养基且用不含病毒上清液或凝聚胺之培养基置换。在转导之后三天,收集细胞且洗涤,悬浮于2%福马林中,且藉由流式细胞术分析gfp表达(fitc)。在各样品中发现gfp表达,但在经使用sffv启动子制得之病毒转导之细胞中最高。
经活化之人类脐带白血球层细胞用来自各启动子之gfp慢病毒上清液(基于hek293转导功效之结果的量)转导。在培育5天之后,收集细胞,洗涤且悬浮于2%福马林中,且藉由流式细胞术分析gfp表达。43%细胞大量(>103)表达gfp,而经使用启动子ef1(15%)及cag(3%)之病毒转导之细胞之gfp表达显著较低。五天后,以相同方式分析之细胞展示几乎相同的各百分比(分别为46%、15%及3%;图23)。此等结果表明,sffv启动子引起比ef1或cag启动子更强的表达,且该表达在转导后至少10天保持较高。其他实验测试将包括除10天窗口以外的经转导之细胞之更长培育时间。
提供产生包括t抗原识别部分(cd4、cd8、cd3、cd5、cd7及cd2中之至少一者或其一部分或组合)、铰链区及t细胞活化域中之至少一者的car基因之方法。
提供产生靶向抗原之多个car(ccar)单元之方法,该(该等)抗原包括cd33、cd123、cd19、cd20、cd22、cd269、cs1、cd38、cd52、ror1、psma、cd138及gpc3中之至少一者,或铰链区及t细胞活化域之一部分或组合。本文中所引用及/或揭示之所有参考文献以全文引用的方式并入本文中。
所提供之方法亦包括:1)产生靶向表达cd45之白血病及淋巴瘤之cart或nk细胞且避免自杀;2)产生「披甲」cart或nk细胞,其经设计以克服抑制性肿瘤微环境且呈现增强之抗肿瘤活性及长期持久性。本发明不限于上文描述及例示之实施例,且能够在随附申请专利范围之范畴内进行变化及修改。贯穿本说明书引用多种公开案,包括专利案、公开申请案、技术论文及学术论文。各所引用之公开案以全文引用的方式并入本文中且用于所有目的。贯穿本说明书及申请专利范围使用与本发明之态样相关之多种术语。除非另有指示,否则此类术语将具有其在此项技术中之普通含义。其他特定定义之术语以符合本文中提供之定义的方式解释。
上清液中病毒载体粒子之功能性效价(如藉由流式细胞术所测定之gfp细胞%允许代理病毒效价调节,因为较高效价病毒浸润较多细胞,引起较高gfp细胞群%)。
为了测定每种吾人之上清液中病毒载体粒子之功能性效价,在12孔经组织培养物处理之盘中,hek293细胞以30μl(低)、125μl(中等)或500μl(高)/孔用ef1-gfp或sffv-gfp病毒上清液转导。在第二天早晨将培养基更换成dmem加10%fbs。
接着使经转导之细胞胰蛋白酶化,洗涤且悬浮于福马林中且经历流式分析。使用fitc通道藉由流式细胞术测定各条件下gfp+细胞之百分比(图43)。在各种情况下,经sffv-gfp转导之细胞中之gfp+百分比高于经相应体积之ef1-gfp病毒上清液转导之细胞(50%对18%(低),80%对40%(中等)及82%对70%(高))。由此,吾人确定就效价而言,使用最高体积之ef1启动子病毒与使用最低体积之sffv启动子病毒类似,且将比较以下转导实验之相对启动子浓度。
亦在各孔之相同曝光条件下,使用gfp在20×下在evos萤光显微镜上观测经转导之细胞(图42)。经sffv-gfp病毒上清液转导之细胞明显比经ef1-gfp转导之细胞更亮。此外,比较在高病毒体积负荷下ef1启动子之影像与使用低病毒体积负荷之sffv启动子之影像可展示类似的萤光强度。此表明sffv启动子为更强的基因表现驱使物。
原生t细胞中不同启动子之表面表阿迪及持久性之对比(如藉由流式细胞术所测定之t细胞转导之gfp细胞%展示如自hek293细胞之先前实验预期之gfp细胞群中之预期差异)
为了测定原生t细胞中之启动子转导功效及表面表达持久性,在预先涂有重组人纤维蛋白片段(clontech)之12孔经组织培养物处理之培养盘中,经活化之脐带血白血球层t细胞用50μlsffv-gfp或1mlef1-gfpef1-gfp病毒上清液转导。在两次隔夜转导之后,细胞在t细胞培养基上与300iu/mlil-2(peprotech)一起培养且保持在1.0-4.0×106个/毫升的浓度下。在转导之后第7、14、21及28天,洗涤细胞,悬浮于福马林中,且经历流式细胞术分析,使用fitc通道以测定gfp+细胞之百分比。与经ef1-gfp转导之t细胞相比,经sffv-gfp转导之t细胞之gfp+细胞百分比始终较高(图44a),即使在此周期内总gfp+细胞百分比降低。另一对比证实,在第7天与第28天之间,相对于经较低量(50μl,或低20倍)sffv-gfp转导之gfp+细胞之百分比,经较高(1ml)量之ef1-gfp上清液转导之t细胞之百分比实际上降低,自超过60%降低至低于40%(图44b)。此表明使用sffv启动子之转导引起经转导之细胞之较大持久性。
靶向表达bcma或taci或baff-rcar抗原中之至少一者之bcma或taci或baff-rcarnk细胞或t细胞
为了评估靶向bcma或taci或baff-rnk细胞或t细胞中之至少一人之car之细胞毒性能力,用表bcma或taci或baff-r中之至少一者之细胞系或原生人类细胞进行共培养分析。藉由流式细胞术分析来定量前述carnk细胞或t细胞溶解标靶细胞之能力,且标靶细胞用cytotracker染料(cmtmr)染色。在持续24小时的培养中观测溶解。
靶向表达bcma或taci或baff-r抗原中之至少一者之细胞之baff或aprilcarnk或t细胞。
car中之嵌合抗原受体为bcma或taci或baff-r之配位体。
为了评估靶向bcma或taci或baff-rnk或t细胞中之至少一者之后car之细胞毒性能力,用表bcma或taci或baff-r中之至少一者之细胞系或人类原生细胞进行共培养分析。藉由流式细胞术分析来定量前述carnk或t细胞溶解标靶细胞之能力,且标靶细胞用cytotracker染料(cmtmr)染色。在持续24小时的培养中观测溶解。
参考文献
arai,s.,r.meagher,m.swearingen,h.myint,e.rich,j.martinsonandh.klingemann(2008)."infusionoftheallogeneiccelllinenk-92inpatientswithadvancedrenalcellcancerormelanoma:aphaseitrial."cytotherapy10(6):625-632.
boissel,l.,m.betancur-boissel,w.lu,d.s.krause,r.a.vanetten,w.s.welsandh.klingemann(2013)."retargetingnk-92cellsbymeansofcd19-andcd20-specificchimericantigenreceptorscomparesfavorablywithantibody-dependentcellularcytotoxicity."
oncoimmunology2(10):e26527.
burnett,a.k.(2012)."treatmentofacutemyeloidleukemia:arewemakingprogress?"hematology-americansocietyhematologyeducationprogram:1-6.
chu,j.,y.deng,d.m.benson,s.he,t.hughes,j.zhang,y.peng,h.mao,l.yi,k.ghoshal,x.he,s.m.devine,x.zhang,m.a.caligiuri,c.c.hofmeisterandj.yu(2014)."cs1-specificchimericantigenreceptor(car)-engineerednaturalkillercellsenhanceinvitroandinvivoantitumoractivityagainsthumanmultiplemyeloma."leukemia28(4):917-927.
corbin,a.s.,a.agarwal,m.loriaux,j.cortes,m.w.deiningerandb.j.druker(2011)."humanchronicmyeloidleukemiastemcellsareinsensitivetoimatinibdespiteinhibitionofbcr-ablactivity."jclininvest121(1):396-409.
dinndorf,p.a.,r.g.andrews,d.benjamin,d.ridgway,l.wolffandi.d.bernstein(1986)."expressionofnormalmyeloid-associatedantigensbyacuteleukemiacells."blood67(4):1048-1053.
djokic,m.,e.bjorklund,e.blennow,j.mazur,s.soderhallanda.porwit(2009)."overexpressionofcd123correlateswiththehyperdiploidgenotypeinacutelymphoblasticleukemia."haematologica94(7):1016-1019.
ehninger,a.,m.kramer,c.rollig,c.thiede,m.bornhauser,m.vonbonin,m.wermke,a.feldmann,m.bachmann,g.ehningerandu.oelschlagel(2014)."distributionandlevelsofcellsurfaceexpressionofcd33andcd123inacutemyeloidleukemia."bloodcancerj4:e218.
firor,a.e.,a.jaresandy.ma(2015)."fromhumblebeginningstosuccessintheclinic:chimericantigenreceptor-modifiedt-cellsandimplicationsforimmunotherapy."expbiolmed(maywood).
garfall,a.l.,m.v.maus,w.t.hwang,s.f.lacey,y.d.mahnke,j.j.melenhorst,z.zheng,d.t.vogl,a.d.cohen,b.m.weiss,k.dengel,n.d.kerr,a.bagg,b.l.levine,c.h.juneande.a.stadtmauer(2015)."chimericantigenreceptortcellsagainstcd19formultiplemyeloma."nengljmed373(11):1040-1047.
ghosh,n.andw.matsui(2009)."cancerstemcellsinmultiplemyeloma."cancerlett277(1):1-7.
griffin,j.d.,d.linch,k.sabbath,p.larcomands.f.schlossman(1984)."amonoclonalantibodyreactivewithnormalandleukemichumanmyeloidprogenitorcells."leukres8(4):521-534.
jilani,i.,e.estey,y.huh,y.joe,t.manshouri,m.yared,f.giles,h.kantarjian,j.cortes,d.thomas,m.keating,e.freireichandm.albitar(2002)."differencesincd33intensitybetweenvariousmyeloidneoplasms."amjclinpathol118(4):560-566.
jordan,c.t.,d.upchurch,s.j.szilvassy,m.l.guzman,d.s.howard,a.l.pettigrew,t.meyerrose,r.rossi,b.grimes,d.a.rizzieri,s.m.lugerandg.l.phillips(2000)."theinterleukin-3receptoralphachainisauniquemarkerforhumanacutemyelogenousleukemiastemcells."leukemia14(10):1777-1784.
klingemann,h.(2014)."arenaturalkillercellssuperiorcardrivers?"oncoimmunology3:e28147.
kumar,s.k.,s.v.rajkumar,a.dispenzieri,m.q.lacy,s.r.hayman,f.k.buadi,s.r.zeldenrust,d.dingli,s.j.russell,j.a.lust,p.r.greipp,r.a.kyleandm.a.gertz(2008)."improvedsurvivalinmultiplemyelomaandtheimpactofnoveltherapies."blood111(5):2516-2520.
lang,s.,n.l.vujanovic,b.wollenbergandt.l.whiteside(1998)."absenceofb7.1-cd28/ctla-4-mediatedco-stimulationinhumannkcells."eurjimmunol28(3):780-786.
lanitis,e.,m.poussin,a.w.klattenhoff,d.song,r.sandaltzopoulos,c.h.juneandd.j.powell,jr.(2013)."chimericantigenreceptortcellswithdissociatedsignalingdomainsexhibitfocusedantitumoractivitywithreducedpotentialfortoxicityinvivo."cancerimmunolres1(1):43-53.
loke,j.,j.n.khan,j.s.wilson,c.craddockandk.wheatley(2015)."mylotarghaspotentanti-leukaemiceffect:asystematicreviewandmeta-analysisofanti-cd33antibodytreatmentinacutemyeloidleukaemia."annalsofhematology94(3):361-373.
maus,m.v.,j.a.fraietta,b.l.levine,m.kalos,y.zhaoandc.h.june(2014)."adoptiveimmunotherapyforcancerorviruses."annurevimmunol32:189-225.
olson,j.a.,d.b.leveson-gower,s.gill,j.baker,a.beilhackandr.s.negrin(2010)."nkcellsmediatereductionofgvhdbyinhibitingactivated,alloreactivetcellswhileretaininggvteffects."blood115(21):4293-4301.
ruiz-arguelles,g.j.andj.f.sanmiguel(1994)."cellsurfacemarkersinmultiplemyeloma."mayoclinproc69(7):684-690.
testa,u.,e.pelosianda.frankel(2014)."cd123isamembranebiomarkerandatherapeutictargetinhematologicmalignancies."biomarkres2(1):4.
vergez,f.,a.s.green,j.tamburini,j.e.sarry,b.gaillard,p.cornillet-lefebvre,m.pannetier,a.neyret,n.chapuis,n.ifrah,f.dreyfus,s.manenti,c.demur,e.delabesse,c.lacombe,p.mayeux,d.bouscary,c.recherandv.bardet(2011)."highlevelsofcd34+cd38low/-cd123+blastsarepredictiveofanadverseoutcomeinacutemyeloidleukemia:agroupeouest-estdesleucemiesaiguesetmaladiesdusang(goelams)study."haematologica96(12):1792-1798.
wilkie,s.,m.c.vanschalkwyk,s.hobbs,d.m.davies,s.j.vanderstegen,a.c.pereira,s.e.burbridge,c.box,s.a.ecclesandj.maher(2012)."dualtargetingoferbb2andmuc1inbreastcancerusingchimericantigenreceptorsengineeredtoprovidecomplementarysignaling."jclinimmunol32(5):1059-1070.
【符号说明】
无
- 还没有人留言评论。精彩留言会获得点赞!
- 金黄色葡萄球菌肠毒素C2的核酸适配体C203及其筛选方法和应用与制造工艺
- 一种全人源化EGFRvIII嵌合抗原受体T细胞及其制备方法与制造工艺
- 嵌合抗原受体及制备方法与制造工艺
- 检测外周血CAR‑T细胞的TaqMan实时荧光定量PCR试剂盒的制造方法与工艺
- CD20特异性嵌合抗原受体及其应用的制造方法与工艺
- 一种用于辣根过氧化物酶染色的染色剂及其制备方法、染色组合、应用及标记酶染色试剂盒与制造工艺
- 对SSEA4抗原具有特异性的嵌合抗原受体的制造方法与工艺
- 具有针对CD79和CD22的特异性的分子的制造方法与工艺
- 具有针对CD45和CD79的特异性的分子的制造方法与工艺
- 一种检测嵌合抗原受体T细胞对肝癌细胞抑制作用的模型和方法与制造工艺
- 抗cd33嵌合抗原受体、编码基因、重组表达载体及其构建方法和应用
- 抗cd138嵌合抗原受体、编码基因、重组表达载体及其构建方法和应用
- 用修饰的嵌合抗原受体靶向肿瘤新生血管的制作方法
- Cd19靶向性的嵌合抗原受体和nkt细胞及其制法和应用
- 表达嵌合抗原受体的脐血有核细胞及其应用
- 嵌合抗原受体及其基因和重组表达载体、工程化her2靶向性的nkt细胞及其应用
- 嵌合抗原受体及其基因和重组表达载体、工程化cd33靶向性的nkt细胞及其应用
- 嵌合抗原受体及其基因和重组表达载体、工程化cd138靶向性的nkt细胞及其应用
- 嵌合抗原受体及其基因和重组表达载体、工程化cd138靶向性的nkt细胞及其应用
- 嵌合抗原受体及其基因和重组表达载体、工程化cd19靶向性的nkt细胞及其应用
- 抗EGFRvIII嵌合抗原受体、编码基因、重组表达载体及其构建方法和应用
- 抗cd 30 嵌合抗原受体及其用图
- 嵌合抗原受体及其基因和重组表达载体、car133-nkt细胞及其制备方法和应用
- Trop2嵌合抗原受体修饰的T淋巴细胞及其应用
- Ror1特异性嵌合抗原受体及其应用
- 嵌合抗原受体及其基因和重组表达载体、car20-nkt细胞及其制备方法和应用
- 嵌合抗原受体及其基因和重组表达载体、car138-nkt细胞及其制备方法和应用
- 嵌合抗原受体及其基因和重组表达载体、carmsln-nkt细胞及其制备方法和应用
- 嵌合抗原受体及其基因和重组表达载体、carher1-nkt细胞及其制备方法和应用
- 特异性识别EGFRvⅢ的含CD70嵌合抗原受体修饰T细胞的制备方法