与抗原呈递蛋白有关的方法和组合物与流程
政府权益
本发明是在政府资助下根据美国国立卫生研究院授予的ar40312进行。政府享有本发明的某些权利。
相关申请
本专利申请要求2015年5月22日提交的美国临时专利申请号62/165349的优先权,所述专利申请据此以引用的方式整体并入。
背景技术:
人cd1蛋白是主要组织相容性复合物(mhc)相关蛋白,其将脂聚糖/糖脂抗原呈递给t细胞。人cd1家族由五种同种型(cd1a-e)组成,所述五种同种型已经进化出独特的结构和细胞内运输特征,使得它们能够呈递从各种内吞腔室(例如内体、吞噬体、溶酶体)收集的不同类别的疏水性抗原。迄今为止,关于cd1/抗原相互作用的大部分知识依赖于:1)在无细胞系统中人工加载纯化的可溶性重组蛋白,2)利用先前鉴定的单一抗原或相关结构组的细胞培养系统,或3)以上项的一些组合。这些方法因其固有的基于操作者的偏倚而严重限制cd1配体鉴定,所述偏倚诸如使用源自环境的个体抗原,其可能含有许多其他分子。
简述
在一些方面,本发明涉及包含可通过蛋白酶从跨膜结构域裂解的胞外结构域的跨膜蛋白。所述胞外结构域可以是抗原呈递蛋白(诸如cd1a)的胞外结构域。本发明的一些方面涉及编码本文所述蛋白质的核酸或包含所述核酸的细胞。本发明的其他方面涉及纯化和/或分离蛋白质和/或抗原的方法。
附图描述
图1示出了包含以下各项的蛋白质的设计和氨基酸序列(seqidno:25):β-2m胞外结构域(β2m)、甘氨酸-丝氨酸接头(gs)、cd1a胞外域(cd1aec)、链霉亲和素亲和标签(strep)、组氨酸亲和标签(8his)、3c蛋白酶裂解位点(cleave)、flag亲和标签(flag)、跨膜结构域(tm)和胞质结构域(ct)。
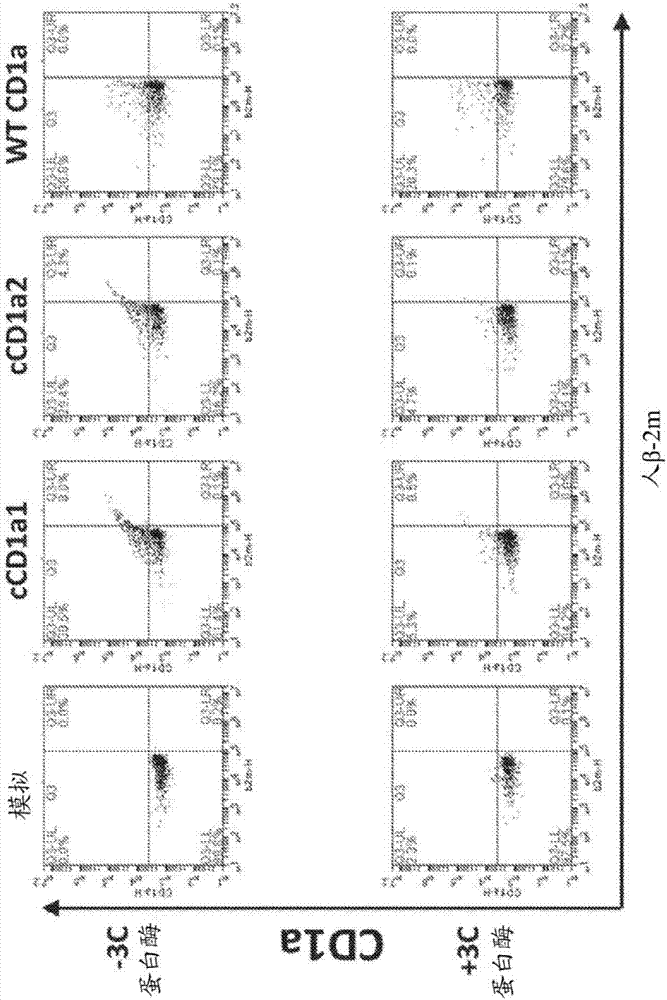
图2示出在用3c蛋白酶裂解之前和之后在小鼠b16细胞中表达的包含β-2m胞外结构域、cd1a胞外结构域和3c蛋白酶裂解位点的蛋白质的流式细胞术结果,使用了针对cd1a和β-2m的荧光标记。“模拟(mock)”绘示未转染的对照细胞,“ccd1a1”和“ccd1a2”绘示了用包含β-2m和cd1a胞外结构域的可裂解蛋白质转染的细胞,并且“wtcd1a”绘示用缺乏β-2m胞外结构域和3c蛋白酶裂解序列的野生型人cd1a转染的细胞。
图3由两个图组成,标记为图(a)和图(b)。图(a)示出在用3c蛋白酶裂解之前和之后(分别为cd1a和cd1a+3c)在真核细胞中表达的包含cd1a胞外结构域和3c蛋白酶裂解位点的蛋白质的流式细胞术结果。图(b)示出用3c蛋白酶从细胞裂解下来并且用结合组氨酸标签的ni-nta纯化的蛋白质的聚丙烯酰胺凝胶。“洗脱”泳道对应于使用ni-nta纯化的蛋白质,并且主要条带的分子量对应于裂解的胞外结构域的分子量。
图4由三个图组成,标记为(a)、(b)和(c)。使用正丙醇(a)、氯仿-甲醇-水(b;10∶10∶3)和氯仿-甲醇(c;2∶1)从ni-nta树脂中洗脱结合ccd1a的分子,并且使用质谱测量其分子量。白色菱形对应于在将ccd1a表达细胞与来自结核分枝杆菌(m.tuberculosis)的裂解物一起孵育后从ccd1a洗脱的分子。黑色菱形对应于针对未处理的ccd1a表达细胞的对照。
图5是示出由各种浓度的脂蛋白lppx(lppx;x轴)诱导的干扰素γ(inf-γ)浓度(y轴)的图。将用野生型cd1a(wtcd1a)、包含可裂解cd1a胞外结构域(ccda1)的工程化蛋白质转染的hela细胞和未转染的hela细胞与lppx和lcd4.gt细胞一起孵育,所述lcd4.gt细胞是识别lppx抗原的cd1a限制性t细胞克隆。通过elisa测量t细胞的inf-γ生成。ccd1a转染的细胞展示出与wtcd1a转染的细胞相似的诱导inf-γ产生的能力,表明ccd1a构建体保持其向t细胞呈递抗原的能力。
详述
在一些方面,本发明涉及包含来自cd1糖蛋白的胞外结构域的蛋白质。蛋白质可以包含来自cd1糖蛋白的胞质结构域。先前的研究已经描述了多种蛋白质结构域,其具有将基因融合蛋白配偶体有差别地分布到不同的细胞内和细胞外位置的能力,通常在所得功能上具有显著差异。更具体地,包含从人cd1蛋白借用的序列的表达盒可用于将基因融合异源蛋白运输至不同的细胞内位置(参见例如niazi,k.r.等,immunology122(4):522-31(2007))。像大多数1型膜蛋白一样,cd1基因编码具有独特亚结构域的多肽,每个亚结构域具有相关功能。在cd1的情况下,存在4个结构域,其中蛋白质的n端(即“结构域1”)编码前导肽,即是将cd1信使rna和相关核糖体靶向至内质网以将剩余蛋白质易位到其内腔的序列。在本质上,前导肽的合成是靶向1型膜蛋白用于分泌系统和细胞外空间而非细胞质的第一步。在前导肽序列之后,第二cd1亚结构域(“结构域2”)是与mhci具有序列和结构同源性的胞外结构域,其结合脂聚糖抗原以呈递给t淋巴细胞。为了将所述胞外结构域锚定到细胞膜,野生型cd1序列中的下一个模块(“结构域3”)是跨膜结构域,即跨越质膜宽度的15个或更多个疏水或非极性氨基酸残基段。cd1的最后结构域(“结构域4”)是胞质尾区序列,其充当细胞内衔接蛋白的捕获序列以便将cd1从膜运输到不同的胞内内体小泡。使用这些结构域中的每一个作为独立的功能单位,cd1蛋白的胞外结构域可以用融合蛋白诸如gfp、分枝杆菌groes等来替代来将其靶向至野生型cd1将运输至的腔室,从而将产生一组靶向盒(参见例如niazi,k.r.等,immunology122(4):522-31(2007))。
本发明的一些方面包括另外的新型特征,诸如胞外膜近侧的蛋白水解裂解位点,例如其包含小rna病毒3c蛋白酶的识别序列;和纯化结构域,例如其包含一个或多个“亲和标签”诸如6至8个的组氨酸(8his)段或strep-tag序列。可以选择3c识别位点,这部分地是由于3c蛋白酶在生理ph和盐浓度下裂解其底物的能力,从而防止细胞裂解和胞内蛋白对靶蛋白池的随后污染。亲和标签的位置可以在n-端、c-端或内部之间变化,这取决于蛋白质配偶体的功能耐受程度,并且对于1型膜蛋白,裂解序列理想地定位成更接近膜。这些模块也可以与2型整合膜蛋白结合使用。
i.重组蛋白
在一些方面,本发明涉及包含胞外结构域、跨膜结构域和位于胞外结构域与跨膜结构域之间的蛋白酶裂解位点的蛋白质。胞外结构域可以包括抗原呈递蛋白的胞外结构域。蛋白酶裂解位点可以位于跨膜结构域的附近。例如,蛋白酶裂解位点可位于离跨膜结构域50、40、30、29、28、27、26、25、24、23、22、21、20、19、18、17、16、15、14、13、12、11、10、9、8、7、6、5、4、3、2或1个氨基酸内。
蛋白酶裂解位点可由识别至少4个氨基酸的蛋白酶,例如识别至少5、6、7或8个氨基酸的蛋白酶识别。蛋白酶裂解位点可以是4、5、6、7、8、9或10个氨基酸,即蛋白酶裂解位点可以由识别4、5、6、7、8、9或10个氨基酸的序列的蛋白酶识别。蛋白酶裂解位点可以例如由凝血酶、因子xa、tev蛋白酶、肠肽酶或鼻病毒3c蛋白酶识别,即蛋白酶裂解位点可以是凝血酶、因子xa、tev蛋白酶、肠肽酶或鼻病毒3c蛋白酶裂解位点。在一些实施方案中,蛋白酶裂解位点由3c蛋白酶识别,即蛋白酶裂解位点可以是3c蛋白酶裂解位点。然而,只要蛋白酶是特异性的,则蛋白酶裂解位点的性质就没有特别限制。蛋白酶裂解位点可以是例如levlfqgp(seqidno:1;由鼻病毒3c蛋白酶裂解);ddddk(seqidno:2;由肠肽酶裂解);iegr(seqidno:3;由因子xa裂解);enlyfqg(seqidno:4;由tev蛋白酶裂解);或lvprgs(seqidno:5;由凝血酶蛋白酶裂解)。在一些实施方案中,蛋白酶裂解位点包含seqidno:1。
胞外结构域可以包括cd1蛋白的胞外结构域,诸如cd1a、cd1b、cd1c、cd1d或cd1e的胞外结构域。在一些实施方案中,胞外结构域包括cd1a的胞外结构域。cd1蛋白可以是人cd1。在一些实施方案中,胞外结构域包括来自β-2微球蛋白(β-2m)的胞外结构域。在一些实施方案中,胞外结构域包括来自mhci类α链的胞外结构域。
胞外结构域可以包括cd1蛋白的胞外结构域的一部分,诸如cd1a、cd1b、cd1c、cd1d或cd1e的胞外结构域的一部分。在一些实施方案中,胞外结构域包括cd1a的胞外结构域的一部分。cd1蛋白可以是人cd1。在一些实施方案中,胞外结构域包括来自β-2m的胞外结构域的一部分。在一些实施方案中,胞外结构域包括来自mhci类α链的胞外结构域的一部分。在一些实施方案中,胞外结构域包括蛋白质的抗原呈递结构域。
在一些实施方案中,跨膜结构域是单个α螺旋。蛋白质可以是1型膜蛋白,即,蛋白质可以被定向为使得胞外结构域是蛋白质的n端并且胞质结构域是c端。
在一些实施方案中,蛋白质还包含位于蛋白质n端与蛋白酶裂解位点之间的第一亲和标签。第一亲和标签可以被定位成在胞外结构域与蛋白酶裂解位点之间。
在一些实施方案中,蛋白质还包含位于蛋白质的c端与蛋白酶裂解位点之间的第二亲和标签。第二亲和标签可被定位成在跨膜结构域与蛋白酶裂解位点之间。
第一亲和标签和第二亲和标签的性质没有特别的限制。例如,第一亲和标签和第二亲和标签中的至少一个可以选自avi标签(seqidno:6glndifeaqkiewhe)、钙调蛋白-标签(seqidno:7krrwkknfiavsaanrfkkisssgal)、聚谷氨酸盐标签(seqidno:8eeeeee)、e-标签(seqidno:9gapvpypdplepr)、flag-标签(seqidno:10dykddddk)、ha-标签(seqidno:11ypydvpdya)、his-标签(seqidn0:12hhhhhh)、myc-标签(seqidno:13eqkliseedl)、s-标签(seqidno:14ketaaakferqhmds)、sbp-标签(seqidno:15mdekttgwrgghvveglageleqlrarlehhpqgqrep)、softag1(seqidno:16slaellnaglggs)、softag3(seqidno:17tqdpsrvg)、strep-标签(seqidno:18wshpqfek)、tc标签(seqidno:19ccpgcc)、v5标签(seqidno:20gkpipnpllgldst)、vsv-标签(seqidno:21ytdiemnrlgk)、xpress标签(seqidno:22dlyddddk)、isopep标签(seqidno:23tdkdmtitftnkkdae)和spytag(seqidno:24ahivmvdaykptk)。在一些实施方案中,第一亲和标签包括strep-标签(seqidno:18)和/或his-标签(seqidno:12)。在一些实施方案中,第二亲和标签包括flag-标签(seqidno:10)。
在一些实施方案中,蛋白质包含n端前导序列,例如用于使胞外结构域易位跨过膜。在一些实施方案中,蛋白质包含胞质结构域,例如用于在细胞内运输蛋白质。胞质结构域可以包括cd1蛋白诸如cd1a、cd1b、cd1c、cd1d或cd1e的胞质结构域。例如,胞质结构域可以包括人cd1a胞质结构域的一部分。
所述蛋白质可以包含与seqidno:25所示的氨基酸序列具有至少约95%、96%、97%、98%或99%同一性的序列。蛋白质可以具有seqidno:25所示的氨基酸序列。
ii.重组核酸
在一些方面,本发明涉及编码本文所述的任何一种蛋白质的核酸。编码蛋白质的核酸序列在本文中称之为“基因”。核酸还可包含可操作地连接至编码本文所述的任何一种蛋白质的核苷酸序列的启动子。核酸还可包含选择性标记,诸如抗生素抗性基因。核酸还可包含复制起点,诸如用于在细胞诸如大肠杆菌中克隆核酸。
iii.细胞
在一些方面,本发明涉及包含编码本文所述的任何一种蛋白质的基因(即,重组基因)的细胞。细胞可以是原核细胞,例如用于克隆基因。细胞可以是真核细胞,例如用于表达蛋白质。基因可以存在于质粒上。在一些实施方案中,基因例如在稳定转染表达细胞之后不存在于质粒上。基因可以整合到细胞的基因组中,即在用编码所述基因的核酸转化或转染细胞之后。细胞可以包含核酸,所述核酸包含编码蛋白质的基因和选择性标记,例如与基因相关联的选择性标记以用于选择包含所述基因的细胞。细胞可以是真核细胞,并且基因可以整合到细胞的基因组中。
在一些实施方案中,细胞是克隆细胞,例如,细胞可以选自大肠杆菌和酿酒酵母。
细胞可以选自c6/36、s2、sf21、sf9和highfive细胞。
在一些实施方案中,细胞是真核细胞并且细胞表达蛋白质。细胞可以是哺乳动物细胞,诸如小鼠细胞或人类细胞。在某些优选的实施方案中,细胞是人类细胞。细胞可以选自721、293t、a172、a253、a2780、a2780adr、a2780cis、a431、a-549、bcp-1、beas-2b、br293、bt-20、bxpc3、ca1-27、cmlt1、cor-l23、cor-l23/5010、cor-l23/cpr、cor-l23/r23、cov-434、du145、ducap、em2、em3、fm3、h1299、h69、hca2、hek-293、hela、hl-60、hmepc、ht-29、huvec、jurkat、jy、k562、kbm-7、kcl22、kg1、ku812、kyo1、lncap、ma-mel、mcf-10a、mcf-7、mda-mb-157、mda-mb-231、mda-mb-361、mg63、mono-mac6、mor/0.2r、mrc5、nci-h69/cpr、nci-h69/lx10、nci-h69/lx20、nci-h69/lx4、peer、raji、saos-2、siha、skbr3、skov-3、t2、t-47d、t84、u373、u87、u937、vcap、wm39、wt-49和yar细胞。细胞可以选自3t3、4t1、a20、alc、b16、bend.3、c2c12、c3h-10t1/2、cgr8、ct26、e14tg2a、el4、emt6/ar1、emt6/ar10.0、hepa1c1c7、j558l、mc-38、mtd-1a、myend、nih-3t3、renca、rin-5f、rma/rmas、x63和yac-1细胞。细胞可以选自9l、b35、bhk-21、c6、cho、cmt、cos-7、d17、dh82、mdckii、rbl和vero细胞。细胞可以是永生细胞系的细胞、外周血单核细胞或成纤维细胞。
在一些实施方案中,细胞来自不表达可在蛋白酶裂解位点裂解蛋白质的蛋白酶的生物体。在优选的实施方案中,细胞来自表达抗原呈递蛋白的生物体。在一些实施方案中,蛋白质包含用于使胞外结构域易位跨过细胞膜的n端前导序列;并且细胞来自表达天然蛋白上的n端前导序列的生物体。在一些实施方案中,蛋白质包含用于在细胞内运输蛋白质的胞质结构域;并且细胞来自表达胞质结构域的生物体。
细胞可以或可以不内源性地表达cd1蛋白。如本文所述的“内源性表达”是指不考虑用本文所述的基因转染的蛋白质的表达,即,其中蛋白质是由从细胞中的天然基因而不是通过转染引入的基因转录的mrna表达。细胞可以或可以不内源性地表达cd1a、cd1b、cd1c、cd1d和/或cd1e。在某些实施方案中,细胞不内源性地表达cd1(例如cd1a、cd1b、cd1c、cd1d和/或cd1e),并且细胞表达包含如本文所述的抗原呈递蛋白cd1a的胞外结构域的蛋白。
细胞可以或可以不内源性地表达i类主要组织相容性复合物(mhci类)。细胞可以或可以不内源性地表达ii类主要组织相容性复合物(mhcii类)。细胞可以是或可以不是抗原呈递细胞。
iv.用于分离抗原的方法
在一些方面,本发明涉及用于分离抗原的方法。所述方法可以包括使如本文上述的细胞与包含抗原的混合物接触;将细胞与识别由细胞表达的蛋白质(如本文所述)的蛋白酶裂解序列的蛋白酶一起孵育,,从而将蛋白质的胞外结构域从细胞裂解;并且从混合物中分离蛋白质的胞外结构域,从而分离出结合胞外结构域的抗原。在一些实施方案中,所述方法包括使如本文上述的细胞与包含抗原的混合物接触;从混合物中分离细胞;将细胞与识别由细胞表达的蛋白质(如本文所述)的蛋白酶裂解序列的蛋白酶一起孵育,从而将蛋白质的胞外结构域从细胞裂解;并且将胞外结构域与细胞分离,从而分离出抗原。在上述方法中,细胞优选为真核细胞,更优选为哺乳动物细胞,诸如小鼠细胞或人类细胞。蛋白质可以包含亲和标签。从混合物中分离细胞可以包括或可以不包括将混合物与特异性结合亲和标签的分子一起孵育。分离细胞可以包括使细胞沉淀并去除上清液、荧光激活细胞分选(facs)或磁性激活细胞分选(macs)。蛋白质可以包含在胞外结构域与蛋白酶裂解位点之间的亲和标签。因此,分离胞外结构域可以包括将包含胞外结构域的组合物(例如,混合物)与特异性结合亲和标签的分子一起孵育。分离胞外结构域可以包括亲和色谱法,例如使用特异性结合亲和标签的固定相。所述方法还可包括将抗原与胞外结构域分离。例如,所述方法可以包括在胞外结构域与特异性结合亲和标签的分子结合的同时,使包含抗原、胞外结构域和特异性结合亲和标签的分子的复合物与化学变性剂诸如尿素或胍接触,并且从复合物中分离抗原(例如通过亲和色谱法、离心、过滤或磁性分离)。另选地,将抗原与胞外结构域分离可以包括色谱法,诸如高效液相色谱法(hplc)。所述方法还可包括鉴定抗原。例如,所述方法可以包括质谱法(例如,hplc-ms、lc-ms、单四极杆、三重四极杆、离子阱、飞行时间、四极杆-飞行时间和/或串联ms)。
特异性结合亲和标签的分子可以连接到颗粒、珠粒、树脂或其他固体支持结构(例如共价连接)。颗粒、珠粒、树脂或其他固体支持结构可允许通过离心、过滤、亲和色谱法或磁性分离进行纯化。分子可以连接到荧光团(例如,共价连接)。
v.用于分离t细胞的方法
在一些方面,本发明涉及分离t细胞的方法,其包括使细胞(例如,表达本文所述的蛋白质)与抗原接触;将所述细胞与多种t细胞一起孵育;分离结合所述细胞的t细胞,从而分离出t细胞;并且将所述细胞与识别蛋白质的蛋白酶裂解位点的蛋白酶一起孵育,从而将t细胞从所述细胞裂解下来。多种t细胞中的至少一些t细胞优选能够特异性结合抗原/抗原呈递蛋白质复合物,使得如果胞外结构域呈递由t细胞识别的抗原,则多种t细胞中的一些t细胞可以特异性结合所述细胞上表达的蛋白质的胞外结构域。因此,优选地,所述细胞上表达的蛋白质的胞外结构域与多种t细胞中的t细胞是相同种类的。优选地,所述细胞与多种t细胞中的t细胞是相同种类的。
使所述细胞与抗原接触可以包括将抗原添加至包含所述细胞的组合物,从而产生包含所述细胞和抗原的组合物;或将所述细胞添加到包含抗原的混合物,从而产生包含所述细胞和抗原的组合物。包含抗原的混合物可以包含多种t细胞。另选地,包含所述细胞的组合物可以包含多种t细胞。另选地,所述方法可以包括将多种t细胞添加到包含所述细胞和抗原的组合物中。
例如,当蛋白质包含cd1家族成员诸如cd1a的胞外结构域时,多种t细胞可包括以下项(或基本上由以下项组成):cd1-限制性t细胞。例如,当蛋白质包含对应cd1家族成员的胞外结构域时,多种t细胞可以包括以下项(或基本由以下项组成):cd1a、cd1b、cd1c和/或cd1d-限制性t细胞。
所述方法还可包括将t细胞与所述细胞分离。
分离结合所述细胞的t细胞和/或将t细胞与所述细胞分离可以包括荧光激活细胞分选(facs)或磁性激活细胞分选(macs)。例如,所述方法可以包括使所述细胞与特异性结合由细胞表达的蛋白质的亲和标签的分子接触,例如其中所述分子连接至荧光团或磁性、顺磁性或超顺磁性颗粒,从而允许分离结合所述细胞的t细胞(即,在与蛋白酶一起孵育之前)或将t细胞与所述细胞分离(即在与蛋白酶一起孵育之后)。
在t细胞与多种t细胞中的其他t细胞和所述细胞分离之后,然后可以扩增和/或表征t细胞。例如,所述方法可以包括对t细胞的t细胞受体的互补决定区进行测序,例如以鉴定特异性结合抗原的氨基酸序列。所述方法可以包括对αβt细胞受体(αβtcr)和/或γδt细胞受体(γδtcr)的互补决定区进行测序,例如其中所述蛋白质包含cd1家族成员的胞外结构域。
此公开将根据以下实验细节得到更好的理解。然而,本领域的技术人员将易于理解,所讨论的具体方法和结果仅仅是说明性的,在随后的实施方案中将对本公开进行更充分的描述。
例证
实施例1:可裂解胞外结构域的设计
使用cd1a/β-2微球蛋白(β-2m)融合蛋白作为模型蛋白。由于β-2m具有自己的前导肽,所以所述结构域未被来自cd1a的功能等同序列替代,但可以使用任何前导肽或信号序列,只要其将蛋白质靶向至表达细胞的膜。构建体利用cd1a结合脂聚糖的能力,来为正在开发的表面表达、裂解和纯化系统的实用性提供功能性证据。因此,cd1a系统提供了在由活细胞摄取、加工和呈递之后对真正负载的cd1a结合抗原池进行采样从而消除了操作者偏倚的直接手段。为了产生能够实现细胞内运输、从细胞表面按需裂解和容易纯化的重组cd1a蛋白,设计了以下构建体。
利用重叠的基于寡核苷酸的聚合酶链式反应、使用基于盒的克隆方案克隆编码以下各项的嵌合蛋白:人β-2微球蛋白(β2m),甘氨酸-丝氨酸接头(gs)、成熟cd1a胞外结构域(cd1aec)、strep-标签序列(strep)、聚组氨酸亲和标签(8his)、人鼻病毒3c蛋白酶基序(cleave)、甘氨酸-丝氨酸接头和flag表位(flag)以及野生型cd1a跨膜和胞质结构域(分别为tm和ct)(参见图1)。所得的表达蛋白质不分泌,但以与野生型cd1a类似的方式进行运输,从而能够在细胞抗原加工和加载后进行裂解和纯化。
编码β-2m前导肽的序列充当结构域1;剩余的β-2m、甘氨酸-丝氨酸接头和cd1a的胞外结构域代表结构域2;纯化和裂解模块插入在结构域2与结构域3之间;flag-标记的cd1a跨膜结构域充当结构域3,并且cd1a的胞质结构域表示结构域4。cd1a胞质尾区虽然其能力不独特,但是因为它可以将融合蛋白配偶体主导地运输到细胞表面或循环内体而是理想的靶向序列。
实施例2:融合蛋白的表达和裂解
为了验证新工程化的可裂解cd1a(ccd1a)基因可以在细胞表面上表达,在进行或不进行3c蛋白酶处理的情况下将小鼠b16-f10黑素瘤细胞(其缺乏人cd1a和β-2m)用ccd1a构建体的两种不同制备物或野生型cd1a瞬时转染并且用对cd1a和人β-2m特异的抗体进行表面染色(图2)。仅在表达ccd1a而不表达wtcd1a的细胞中观察到细胞表面cd1a和人β-2微球蛋白表达的降低,这证明了ccd1a的基于蛋白酶的裂解的特异性质,而来自细胞表面的wtcd1a并没有所述特异性质。为了建立产生足够的ccd1α表达用于下游制备性生物化学纯化的系统,将ccd1a转基因亚克隆到允许哺乳动物药物选择的质粒中,以使得能够在人hela细胞系背景中产生稳定产生ccd1a的两个克隆,并且转基因的产物同样显示对3c蛋白酶裂解敏感(图3a)。对ccd1a蛋白的sds-page评价展示出对应于起始材料和最终洗脱液中预期大小的条带(图3b)。
实施例3:抗原分离
为了评价ccd1a蛋白的抗原结合能力,将来源于高表达稳定性克隆5的细胞与结核分枝杆菌裂解物一起孵育,并且将ccd1a蛋白裂解并纯化,其中从未处理的细胞中收集的ccd1a充当阴性对照。使用逐渐增加的非极性/疏水性溶剂对从由本实验产生的ni-nta结合的ccd1a蛋白收集的级分进行的质谱评价揭示存在抗原处理组独特的分枝杆菌脂质抗原谱,但在对照样品中未观察到(图4)。这些发现提供了“概念验证(proof-of-concept)”数据,证实了ccd1a系统作为查询比现有策略更广泛的抗原的手段的能力,并且突出了3c蛋白酶系统作为制备在哺乳动物细胞表面上展示的蛋白质的手段的灵活性。
实施例4:ccd1a功能保留
使用野生型cd1a(wtcd1a)或包含cd1a胞外结构域和在胞外结构域与跨膜结构域之间的工程化蛋白酶裂解位点的构建体(ccd1a)转染hela细胞。对于wtcd1a转染的细胞和ccd1a细胞中的每一者,将20,000个转染的hela细胞与10,000个lcd4.gt细胞和0.001-10μg/mllppx在96孔板中一起孵育。lcd4.g是能够识别脂蛋白lppx抗原的cd1a限制性t细胞克隆。将细胞在包含10%人血清的rpmi培养基中孵育。将用lcd4.g细胞和lppx孵育的未转染hela细胞作为阴性对照。通过elisa监测干扰素γ(inf-γ)的产生。用ccd1a转染的hela细胞能够诱导inf-γ产生至与wtcd1a转染的hela细胞相似的程度,并且增加浓度的脂蛋白lppx诱导增加浓度的inf-γ(图5)。阴性对照未诱导任何可测量的inf-γ。这些结果表明ccd1a能够将抗原呈递给t细胞。
以引用的方式并入
本文所引用的所有美国专利、美国公开的专利申请、外国专利、外国专利出版物以及其他出版物均以引用的方式并入本文。
等效方案
本领域技术人员仅仅使用常规实验将认识到或者能够确定本文所述的发明的具体实施方案的许多等效方案。此类等同物可以具有以下特征。
- 还没有人留言评论。精彩留言会获得点赞!