支化α葡聚糖的制作方法
本发明涉及多糖和低聚糖领域以及它们的饮食效果。具体地,本发明涉及生产支化α-葡聚糖的方法。本发明的其他方面是,包含交替的α(1→4)和α(1→6)糖苷键并具有α(1→4,6)支化点的支化α-葡聚糖,食品组合物,以及α-葡聚糖转移酶用于减少含淀粉食物材料的可消化碳水化合物的用途。
背景技术:
肥胖和超重的流行率正在全世界迅速增加。具有高饱腹能力和低能量密度的食物的发展可以有助于预防体重增加和促进体重减轻。与含糖的食物和饮料相比,食用含有非消化性碳水化合物而不是糖的食物和饮料导致更低的饭后血糖升高。
人类饮食中最常见的碳水化合物是淀粉。这种多糖是由大多数绿色植物作为能量贮存物产生的。淀粉大量包含在主食如马铃薯、小麦、玉米、稻米和木薯中。已经提出了各种方法来将淀粉和麦芽低聚糖化学改性成非消化性碳水化合物。
ep2427565描述了罗伊氏乳杆菌(lactobacillusreuteri)121gtfb的葡聚糖转移酶将淀粉转化成含有相对长的异麦芽低聚糖侧链的直链葡糖低聚糖的用途。这种材料部分抗消化,因此在食用时提供较少的葡萄糖产生,从而有助于预防肥胖和ii型糖尿病。
已经观察到,高度支化的α-葡聚糖可以将降低的消化性与由胃的低ph条件触发的稠化效应相结合。这种稠化导致饱腹感。已经描述了从蔗糖生产高度支化的α-葡聚糖,例如由罗伊氏乳杆菌121gtfa葡聚糖蔗糖酶合成罗伊糖(reuteran)(kralj等人,2002年)。
希望提供用于淀粉、淀粉衍生物和麦芽低聚糖的酶法改性的其他手段,以便改变它们的功能特性并提高它们的营养价值。具体地,有益的是提供酶以进行这种适合用于食品制造并显示良好的酶活性和热稳定性的改性。
不能将本说明书中对现有技术文献中的任何参考视为承认此类现有技术为众所周知的技术或形成本领域普遍常识的一部分。本说明书中使用的词语“包括”、“包含”和类似的词语,都不应被理解为具有排他性或穷举性的含义。换句话讲,这些词语用来指“包括但不限于”的意思。
技术实现要素:
本发明的目的是改进现有技术,并提供将淀粉和其他多糖或低聚糖酶法改性成具有降低的消化性的材料的改进解决方案,或至少提供有用的替代方案。本发明的目的通过独立权利要求的主题实现。从属权利要求进一步拓展本发明的构想。
因此,本发明在第一方面提供了生产支化比例为至少8%的α-葡聚糖的方法,该方法包括使在其非还原端包含至少两个α(1→4)连接的d-葡萄糖单元的多糖或低聚糖底物与能够切割α(1→4)糖苷键并与α(1→4,6)支化点形成新的交替α(1→4)和α(1→6)糖苷键的α-葡聚糖转移酶接触,其中所述α-葡聚糖转移酶选自gtfb、gtfc和gtfd型的酶,或它们的具有指定酶活性的功能同源物。
在第二方面,本发明涉及包含交替的α(1→4)和α(1→6)糖苷键并具有α(1→4,6)支化点的α-葡聚糖,其中α-葡聚糖具有至少15%的支化比例和在1×106da与40×106da之间的平均分子量。在第三方面,本发明涉及包含交替的α(1→4)和α(1→6)糖苷键并具有α(1→4,6)支化点的α-葡聚糖,其中α-葡聚糖具有至少15%的支化比例和在1×106da与40×106da之间的平均分子量。
本发明的另一方面是包含与seqidno:1具有至少80%同一性的氨基酸序列或具有seqidno:1的氨基酸序列的α-葡聚糖转移酶用于减少含淀粉食物材料的可消化碳水化合物的用途。
最近,发明人已经鉴定出了对蔗糖无活性但是对淀粉/麦芽糊精底物显示4,6-α-葡聚糖转移酶(4,6-α-gt酶)活性,并由罗伊氏乳杆菌121gtfb(s.kralj等人,2011年)和西伯利亚微小杆菌(exiguobacteriumsibiricum)255-15gtfc酶(gangoiti等人,2015年)表示的两种新型糖苷水解酶亚家族。gtfb酶和gtfc酶均能催化对α(1→4)的切割和直链α(1→6)-葡聚糖链的合成。如葡聚糖蔗糖酶一样,gtfb型酶仅存在于乳酸菌中并且具有相对于gh13α-淀粉酶环状变换(circularlypermuted)的催化性(α/β)8桶型域。相比之下,gtfc型酶存在于非乳酸革兰氏阳性菌中,并且具有与gh13酶类似的非变换的域布局。因此gtfc酶似乎代表在gh13α-淀粉酶与gh70葡聚糖蔗糖酶/gtfb样4,6-α-葡聚糖转移酶之间的进一步进化中间体。
发明人已经在固氮细菌褐球固氮菌(azotobacterchroococccum)ncimb8003的基因组中鉴定出了新型gh70家族蛋白。这种酶被命名为gtfd,并且与gtfc型酶最密切相关,共享相同的域架构,并且显示出对淀粉/麦芽糊精底物的水解酶/转糖基酶活性。然而,褐球固氮菌gtfd酶不能合成连续的α(1→6)糖苷键,而是替代地其从直链淀粉(amylose)和淀粉(starch)形成具有交替α(1→4)和α(1→6)糖苷键的更高分子量和相对高度支化的α-葡聚糖。因此,这种聚合物类似于由罗伊氏乳杆菌121gtfa葡聚糖蔗糖酶从蔗糖合成的罗伊糖,被认为是促进健康的食物成分。gtfd酶在ph6.5和60℃显示其最大活性,并且表现出比gtfa葡聚糖蔗糖酶以及gtfb4,6-α-葡聚糖转移酶和gtfc4,6-α-葡聚糖转移酶更高的热稳定性。先前尚未描述过将淀粉转化成罗伊糖样α-葡聚糖聚合物的酶。
对由褐球固氮菌gtfd酶形成的支化α-葡聚糖的1d1hnmr分析显示了α(1→4)和α(1→6)键的形成。对α-葡聚糖的甲基化分析显示了末端4-取代、6-取代和4,6-二取代的吡喃葡萄糖残基的存在。6-取代和4,6-二取代的吡喃葡萄糖残基的存在意味着gtfd酶在直链和支化取向上形成了α(1→6)连接。通过2dnmr波谱分析,没有观察到关于两个连续的α(1→6)连接的吡喃葡萄糖残基的证据。因此,所有支化的残基都是α(1→4,6)-α-d-glcp-α(1→4)-残基。此外,通过甲基化分析检测到的所有6-取代的吡喃葡萄糖残基必须是α(1→4)连接的并且连接α(1→4)葡聚糖链以在α-葡聚糖结构的直链部分中形成交替的α(1→6)/α(1→4)键。这与ep1943908中公开的具有e.c.2.4.1.18活性的支化酶的作用相反。这种支化酶只产生α(1→4,6)支化点,而不会在α-葡聚糖结构的直链部分中产生α(1→6)键,因此不会形成交替的α(1→4)和α(1→6)糖苷键。
发明人已经在细菌北京类芽孢杆菌(paenibacillusbeijingensis)dsm24997的基因组中鉴定出了表现出这种新型反应和产物特异性的gh70家族蛋白的第二示例。这种酶被命名为gtfd,并且与存在于芽孢杆菌(bacillus)、地芽孢杆菌(geobacillus)和微小杆菌(exiguobacterium)菌株中的gtfc酶亚家族密切相关。这种酶表现出对淀粉/麦芽糊精底物的4,6-α-葡聚糖转移酶活性,但是如褐球固氮菌gtfd一样,不能合成连续的α(1→6)糖苷键。北京类芽孢杆菌gtfd对直链淀粉的活性导致合成高分子量(hmm)和低分子量(lmm)多糖、具有交替的α(1→4)和α(1→6)糖苷键的高度支化α-葡聚糖。
对由北京类芽孢杆菌gtfd酶形成的支化α-葡聚糖的1d1hnmr分析显示了α(1→4)和α(1→6)键的形成。对α-葡聚糖的甲基化分析显示了末端4-取代、6-取代和4,6-二取代的吡喃葡萄糖残基的存在。6-取代和4,6-二取代的吡喃葡萄糖残基的存在意味着gtfd酶在直链和支化取向上形成了α(1→6)连接。通过2dnmr波谱分析,没有观察到关于两个连续的α(1→6)连接的吡喃葡萄糖残基的证据。因此,所有支化的残基都是α(1→4,6)-α-d-glcp-α(1→4)-残基。此外,通过甲基化分析检测到的所有6-取代的吡喃葡萄糖残基必须是α(1→4)连接的并且连接α(1→4)葡聚糖链以在α-葡聚糖结构的直链部分中形成交替的α(1→6)/α(1→4)键。这与ep1943908中公开的具有e.c.2.4.1.18活性的支化酶的作用相反。这种支化酶只产生α(1→4,6)支化点,而不会在α-葡聚糖结构的直链部分中产生α(1→6)键。
附图说明
图1示出了gh70家族蛋白的域布局的直链示意图。从左至右:罗伊氏乳杆菌121gtfa-δn葡聚糖蔗糖酶(pijning等人,2012年)、罗伊氏乳杆菌121gtfb-δn4,6-α-葡聚糖转移酶(bai等人,2015b)、西伯利亚微小杆菌255-15gtfc4,6-α-葡聚糖转移酶(gangoiti等人,2015年)、褐球固氮菌ncimb8003gtfd酶以及北京类芽孢杆菌dsm24997gtfd。包括gtfa-δn葡聚糖蔗糖酶(pijning等人,2012年)(左)和地衣芽孢杆菌(b.licheniformis)α-淀粉酶(machius等人,molbiol246:545-559(1995))(右)的晶体结构,从而显示出gh70葡聚糖蔗糖酶的不常见“u型”域结构,其中5个域中的4个由多肽链的两个不连续区段组成,即由n-末端半部和c-末端半部形成。通过使用clustalw2,与罗伊氏乳杆菌121gtfb和西伯利亚微小杆菌gtfc序列进行序列比较,在褐球固氮菌gtfd一级结构中鉴定出了域a、b、c和iv。gtfd酶缺乏在西伯利亚微小杆菌gtfc中鉴定出的ig2样域和仅存在于葡聚糖蔗糖酶和gtfb样4,6-α-葡聚糖转移酶中的域v。通过与罗伊氏乳杆菌121gtfb进行序列比较,将域a、b、c和iv分配到北京类芽孢杆菌中葡聚糖蔗糖酶和gtfb样4,6-α-葡聚糖转移酶中保守区域i至iv的顺序是ii-iii-iv-i,这反映了它们的环状变换的域布局。氨基酸残基编号表示每个域的开始。保守区域i至iv用深灰色矩形表示。
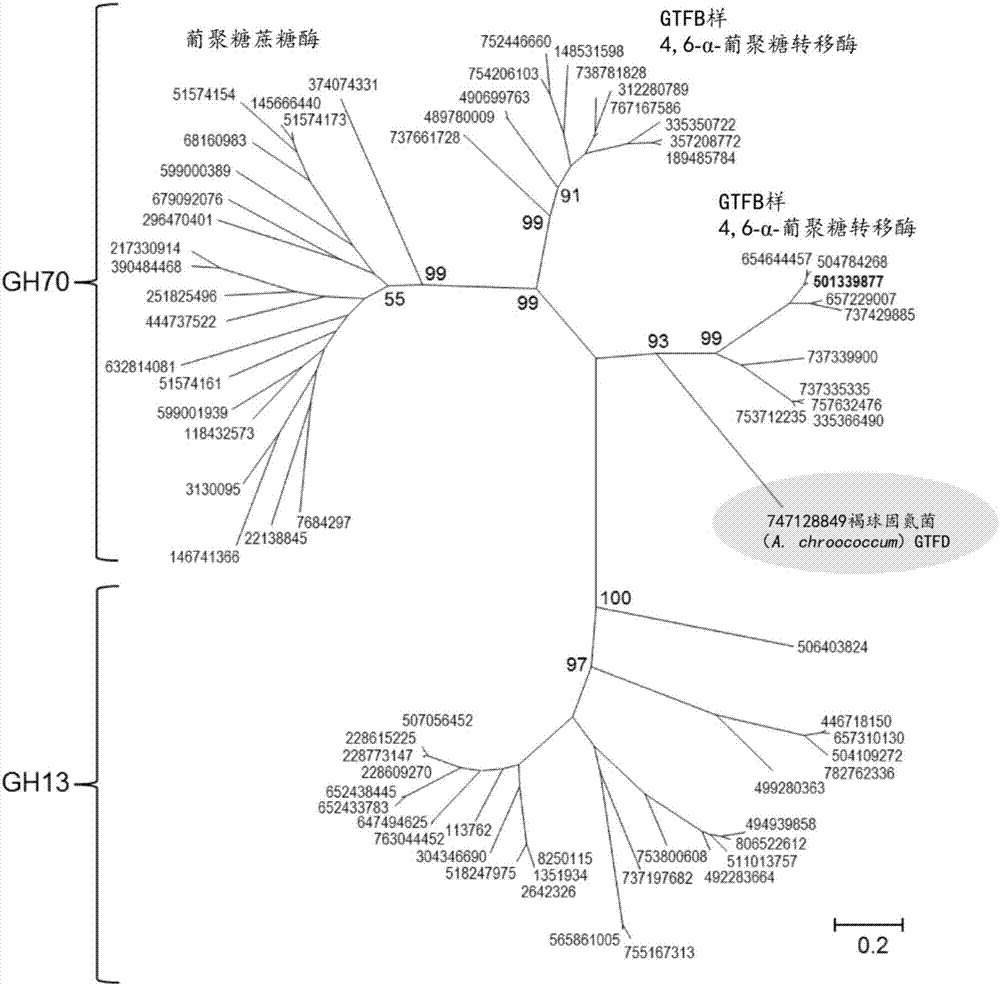
图2是使用西伯利亚微小杆菌255-15gtfc4,6-α-葡聚糖转移酶蛋白作为查询(粗体示出),通过blastp搜索鉴定的代表性家族gh70和gh13蛋白序列的系统进化树。通过根据基于jtt矩阵的模型使用最大似然法来推断进化历史。条对应于每个位置0.2个取代(20%的氨基酸序列差异)的遗传距离。与主节点相邻的自展值(bootstrapvalue)表示基于1000次重复的概率。蛋白质序列用genbankgi号注释。细菌物种的名称提供于表1中。新型的褐球固氮菌ncimb8003gtfd酶以灰色背景突出显示。
图3示出了褐球固氮菌ncimb8003gtfd酶(a)、(推定)gtfc样4,6-α-葡聚糖转移酶(b)、(推定)gtfc样4,6-α-葡聚糖转移酶(c),葡聚糖蔗糖酶(d)和gh13α-淀粉酶(e)的催化域中的保守基序i至iv的序列对比。gh70酶中的7个严格保守的氨基酸残基(由序列上方的编号1至7表示)在新型褐球固氮菌ncimb8003gtfd蛋白中也是保守的。构成催化三联体的氨基酸以三角形表示。在gtf180-δn(
图4示出了从大肠杆菌(e.coli)bl21star(de3)纯化的褐球固氮菌ncimb8003gtfd蛋白的sds-page分析。泳道m,分子量标准品;泳道1,无细胞提取物的样品;泳道2,裂解细胞离心后地不溶级分的样品;泳道3,ni-nta琼脂糖柱层析后合并的级分。对应于gtfd蛋白的谱带以箭头标记。
图5示出了纯化的褐球固氮菌ncimb8003gtfd酶的生物化学性质。(a)ph对gtfd活性的影响。在37℃进行测定,并将相对酶活性与ph6.5时的酶活性(100%值)进行比较。(b)温度对gtfd活性的影响。在ph6.5时进行实验,并将相对活性与60℃下的酶活性(100%值)进行比较。(c)温度对gtfd稳定性的影响。将gtfd酶(0.5mgml-1)在指定温度下在含有1mmcacl2的20mmtris-hclph8.0缓冲液中温育10分钟。在实验部分中描述的标准条件下,在50℃测定残余活性。
图6示出了通过用25mm麦芽低聚糖(dp2-dp7)、0.6%(w/v)直链淀粉v、0.6%的马铃薯可溶性淀粉和0.6%的支链淀粉进行的温育,用40μgml-1褐球固氮菌ncimb8003gtfd酶合成的产物混合物的tlc分析。将反应混合物在37℃和ph6.5下温育24小时。s,标准品;g1,葡萄糖;g2-g7,麦芽糖至麦芽七糖;amv,直链淀粉v;str,淀粉;amp,支链淀粉;pol,聚合物。
图7示出了通过用40μgml-1的褐球固氮菌ncimb8003gtfd酶温育0.6%(w/v)直链淀粉v(a)和马铃薯淀粉(b)(ph6.5,24小时)获得的反应混合物的500mhz1维1hnmr分析,在d2o中记录。化学位移以相对于内部丙酮信号的百万分率给出(δ2.225)。
图8示出了从用40μgml-1的褐球固氮菌ncimb8003gtfd酶(ph6.5)和罗伊氏乳杆菌121gtfb酶(ph4.7)在37℃下温育24小时的0.6%(w/v)直链淀粉v获得的反应产物的hpsec谱。虚线对应于直链淀粉v的洗脱曲线。实心黑色和灰色线分别对应于由gtfd酶和gtfb酶合成的产物的洗脱曲线。
图9示出了在用褐球固氮菌ncimb8003gtfd酶(40μgml-1)温育0.6%(w/v)直链淀粉v24小时后获得的空隙体积bio-gelp-2多糖级分在300k处在d2o中记录的500-mhz1d1hnmr谱、2d1h-1htocsy谱(混合时间150ms)和2d13c-1hhsqc谱。已经指出了α(1→4)和α(1→6)异头(anomeric)信号的峰。结构报告峰:a.关于6-取代的glc的h-4,b.关于末端glc的h-4,c.关于4-取代的glc的h-4,d.关于6-取代的glc的h-6a以及e.关于6-取代的glc的h-6b。
图10示出了在用(a)麦芽六糖和(b)直链淀粉v温育褐球固氮菌ncimb8003gtfd酶(20μgml-1)达t=10分钟、30分钟、3小时和24小时(ph6.5,37℃)后形成的低聚糖混合物的hpaec-pad谱。使用商售的低聚糖标准品来确定峰的种类。*未鉴定出的碳水化合物结构。g1,葡萄糖;g2-g6,麦芽糖至麦芽六糖;异-g2,异麦芽糖;pa,潘糖。
图11示出在用0.35%直链淀粉v(amv)(供体底物)或直链淀粉v与25mm麦芽糖或25mm异麦芽糖(受体底物)在37℃下温育褐球固氮菌ncimb8003gtfd酶(40μgml-1)(a)和罗伊氏乳杆菌121gtfb酶(40μgml-1)(b)24小时后形成的低聚糖混合物的hpaec-pad谱。使用商售的低聚糖标准品来确定峰的种类。g1,葡萄糖;g2-g4,麦芽糖至麦芽四糖;异-g2-异-g5,异麦芽糖至异麦芽五糖;pa,潘糖。
图12示出了用(a)米曲霉(aspergillusoryzae)α-淀粉酶、(b)无定毛壳菌(chaetomiumerraticum)葡聚糖酶和(c)植生克雷伯菌(klebsiellaplanticola)支链淀粉酶m1处理后,对褐球固氮菌ncimb8003gtfd聚合物、罗伊氏乳杆菌121gtfa罗伊糖聚合物和罗伊氏乳杆菌121gtfb异麦芽/麦芽多糖(immp)的tlc分析。泳道1-3:分别通过gtfd聚合物、罗伊糖和immp的酶促水解产生的产物混合物。泳道4,α-淀粉酶、葡聚糖酶和支链淀粉酶处理的阳性对照:淀粉(a)、葡聚糖(b)和支链淀粉(c)。泳道s,标准品:葡萄糖(g1)至麦芽七糖(g7);pol,聚合物。
图13示出了在用支链淀粉酶m1处理褐球固氮菌ncimb8003gtfd聚合物后形成的低聚糖的hpaec-pad谱。包括已确定的低聚糖结构。使用市售的低聚糖标准品并通过与罗伊糖的支链淀粉酶水解物的谱进行比较,来指定峰1至6和8的身份。峰7对应于具有至少一个α(1→6)键的dp5低聚糖(vanleeuwen等人,2008年)。
图14是来自蔗糖的罗伊氏乳杆菌121gtfa产物和来自直链淀粉的褐球固氮菌ncimb8003gtfd产物的复合结构的视觉表示。该复合结构包含针对各个产物确定的所有结构特征。每种结构元素的数量符合1d1hnmr积分和甲基化分析的组合数据。
图15示出了褐球固氮菌ncimb8003酶和北京类芽孢杆菌dsm24997gtfd酶的催化域中的保守基序i至iv的序列比对。gh70酶中的七个严格保守的氨基酸残基由序列上方的编号1至7指示。在gtf180-δn(
图16示出了对不同纯化阶段的北京类芽孢杆菌gtfd4,6-α-葡聚糖转移酶的sds-page分析。泳道m,分子量标准品;泳道1,无大肠杆菌细胞的提取物的样品;泳道2,裂解细胞离心后地不溶级分的样品;泳道3,ni-nta琼脂糖柱层析后纯化的gtfd酶。对应于北京类芽孢杆菌gtfd蛋白的谱带以箭头指示。
图17示出了来自北京类芽孢杆菌的经纯化的gtfd酶的生物化学性质。(a)ph对gtfd活性的影响。在40℃进行实验,并将相对酶活性与ph7.0时的酶活性(100%值)进行比较。(b)温度对gtfd活性的影响。在ph7.0时进行测定,并将相对活性与50℃下的酶活性(100%值)进行比较。结果是两次重复测定的平均值,并且条表示两次重复测定的标准误差。
图18示出对由40μgml-1的北京类芽孢杆菌gtfd(a)和褐球固氮菌gtfd(b)酶从25mm麦芽低聚糖(dp2-dp7)、0.6%(wv-1)直链淀粉v和0.6%(wv-1)支链淀粉产生的产物的tlc分析。将反应混合物在37℃和ph7.0(北京类芽孢杆菌gtfd)或ph6.5(褐球固氮菌gtfd)下温育24小时。s,标准品;g1,葡萄糖;g2,麦芽糖;g3,麦芽三糖;g4,麦芽四糖;g5,麦芽五糖;g6,麦芽六糖;g7,麦芽七糖;amv,直链淀粉v;amp,支链淀粉;pol,聚合物。
图19示出了将0.6%(wv-1)直链淀粉v用40μgml-1的北京类芽孢杆菌gtfd4,6-α-葡聚糖转移酶在37℃和ph7.0下温育24小时后产生的产物混合物的一维500-mhz1hnmr谱。谱是于25℃下在d2o中记录的。化学位移以相对于内部丙酮信号的百万分率示出(δ=2.225)。gα/β和rα/β分别表示对应于d-glcp单元和还原(1→4)-d-glcp单元的异头信号。
图20示出了通过将0.6%(wv-1)直链淀粉v用40μgml-1的褐球固氮菌gtfd酶(ph6.5)和北京类芽孢杆菌gtfd酶(ph7.0)在37℃下温育24小时而获得的产物混合物的hpsec色谱图。虚线对应于起始直链淀粉v的洗脱曲线。实心黑色和灰色线分别对应于由北京类芽孢杆菌和褐球固氮菌gtfd酶合成的产物的洗脱曲线。
图21示出了在sephadexs200柱上通过尺寸排阻色谱法分离的由北京类芽孢杆菌gtfd酶产生的高(hmm)(a)和低分子量(lmm)(b)多糖的500-mhz1hnmr谱。反应产物从用40μgml-1的北京类芽孢杆菌gtfd酶在37℃和ph7.0下温育24小时的0.6%(wv-1)直链淀粉v获得。谱是于25℃下在d2o中记录的。化学位移以相对于内部丙酮信号的百万分率示出(δ=2.225)。已经指出了α(1→4)和α(1→6)异头(anomeric)信号的峰。
图22示出了在298k下在d2o中记录的用直链淀粉v温育的北京类芽孢杆菌gtfd酶的hmm产物的500-mhz1d1hnmr谱、2d1h-1htocsy谱(混合时间150ms)和2d13c-1hhsqc谱。已经指出了α(1→4)和α(1→6)异头(anomeric)信号的峰。结构报告峰a:关于6-取代的glcp的h-4,b:关于末端glcp的h-4,c:关于4-取代的glcp的h-4,d:关于6-取代的glcp的h-6a,以及e:关于6-取代的glcp的h-6b。
图23示出了对北京类芽孢杆菌dsm24997gtfd的hmm和lmm聚合物、褐球固氮菌ncimb8003gtfd罗伊糖样聚合物和罗伊氏乳杆菌121gtfb异麦芽/麦芽多糖(immp)的酶处理。将含有5mgml-1的α葡聚糖的反应混合物单独用高剂量的(a)米曲霉α淀粉酶、(b)无定毛壳菌葡聚糖酶和(c)植生克雷伯菌支链淀粉酶m1在37℃下温育48小时,并进行tlc分析。泳道1-4:通过分别对北京类芽孢杆菌gtfdhmm聚合物、北京类芽孢杆菌gtfdlmm聚合物、罗伊糖样聚合物和immp进行酶处理产生的反应产物。泳道5,α-淀粉酶、葡聚糖酶和支链淀粉酶消化的阳性对照:直链淀粉(a)、葡聚糖(b)和支链淀粉(c)。泳道s,标准品:葡萄糖(g1)至麦芽七糖(g7);pol,聚合物。
图24示出了在用支链淀粉酶m1处理北京类芽孢杆菌gtfdhmm聚合物(a)、北京类芽孢杆菌gtfdlmm聚合物(b)和褐球固氮菌gtfd聚合物(c)之后形成的低聚糖的hpaec-pad谱。包括已确定的低聚糖结构。使用市售的低聚糖标准品并通过与罗伊糖的支链淀粉酶水解物的谱进行比较,来指定峰1至16的身份。
图25是由直链淀粉v形成的褐球固氮菌ncimb8003gtfd聚合物、hmm北京类芽孢杆菌gtfd聚合物和lmm北京类芽孢杆菌gtfd聚合物的复合结构的视觉表示。该复合结构包含针对各个产物确定的所有结构特征。每种结构元素的数量符合1d1hnmr积分和甲基化分析的组合数据,以及使用α-淀粉酶、葡聚糖酶和支链淀粉酶进行的酶促降解研究。
图26示出了在用北京类芽孢杆菌gtfd(a)和褐球固氮菌(b)gtfd酶(20μgml-1)分别在37℃和ph7.0和ph6.5下温育麦芽七糖达t=10分钟、30分钟、3小时和24小时后形成的低聚糖混合物的hpaec-pad谱。使用商售的低聚糖标准品来确定峰的种类。*未鉴定出的碳水化合物结构。g1,葡萄糖;g2-g6,麦芽糖至麦芽六糖;异-g2,异麦芽糖;pa,潘糖。
图27是与未处理的糊化小麦淀粉(a)相比,用褐球固氮菌gtfd(b)处理的糊化小麦淀粉的体外消化性曲线。该图绘制了水解样品%对照以分钟为单位的时间的曲线。
图28是与糊化小麦淀粉(a)相比,来自直链淀粉v的褐球固氮菌gtfd-高分子量(c)、北京类芽孢杆菌gtfd-高分子量(d)和北京类芽孢杆菌gtfd-低分子量(e)产物的体外消化性的曲线图。该图绘制了水解样品%对照以分钟为单位的时间的曲线。
具体实施方式
因此,本发明部分地涉及生产支化比例为至少8%(例如至少12%)的α-葡聚糖的方法,该方法包括使在其非还原端包含至少两个α(1→4)连接的d-葡萄糖单元的多糖或低聚糖底物与能够切割α(1→4)糖苷键并与α(1→4,6)支化点形成新的交替α(1→4)和α(1→6)糖苷键的α-葡聚糖转移酶接触,其中所述α-葡聚糖转移酶选自gtfb、gtfc和gtfd型的酶(例如gtfd型的酶),或它们的具有指定酶活性的功能同源物。例如,本发明方法中的α-葡聚糖转移酶可以能够切割α(1→4)糖苷键并将麦芽低聚糖转移至dp5,导致以交替和支化两种模式形成单个α(1→6)键。多糖为聚合的碳水化合物分子,由通过糖苷键结合在一起的单糖单元的长链组成。低聚糖是含有少量(通常三至九份)单糖的糖类聚合物。在其非还原端包含至少两个α(1→4)连接的d-葡萄糖单元的底物的示例是直链淀粉。
本发明的方法可以包括使在其非还原端包含至少两个α(1→4)连接的d-葡萄糖单元的多糖或低聚糖底物与能够切割α(1→4)糖苷键并与α(1→4,6)支化点(例如与α(1→4,6)支化点一起)形成新的交替α(1→4)和α(1→6)糖苷键而不形成连续的α(1→6)糖苷键的α-葡聚糖转移酶接触,其中所述α-葡聚糖转移酶选自gtfb、gtfc和gtfd型的酶,或它们的具有指定酶活性的功能同源物。在本说明书中,缩写gtf是指葡聚糖转移酶。
交替的α(1→4)和α(1→6)糖苷键可以夹杂有一些连续的α(1→4)糖苷键,这种结构也可以被描述为夹杂有α(1→6)糖苷键的α(1→4)连接的d-葡萄糖单元的链。在本发明的方法中可以在一个或多个α(1→4)糖苷键之间形成的单个α(1→6)糖苷键有时被称为“桥接”α(1→6)键。可以使用符号(α1→4)代替α(1→4)来表示1→4α键,但是这些符号是等同的,如同(α1→6)和α(1→6)一样。
本发明的方法可以包括使在其非还原端包含至少两个α(1→4)连接的d-葡萄糖单元的多糖或低聚糖底物与能够切割α(1→4)糖苷键并形成新的α(1→6)糖苷键以形成具有夹杂有α(1→6)糖苷键的α(1→4)连接的d-葡萄糖单元链并且具有α(1→4,6)支化点的结构,而不形成连续的α(1→6)糖苷键的α-葡聚糖转移酶接触,其中所述α-葡聚糖转移酶选自gtfb、gtfc和gtfd型的酶,或它们的具有指定酶活性的功能同源物。
在本发明的语境中,支化比例被定义为支化脱水葡糖酐单元(agu)的总数,即相对于分子的agu总数,与三个其他单元结合的agu。支化比例可以通过本领域已知的方法测定,诸如使用气相色谱法甲基化。通过本发明的方法产生的α-葡聚糖可以具有至少8%,例如至少10%,例如至少15%的支化比例。
通过本发明的方法产生的α-葡聚糖可以包含与α(1→6)糖苷键相邻的至少一个α(1→4)糖苷键和至少一个α(1→4,6)支化点。通过本发明的方法产生的α-葡聚糖可以包含交替的α(1→4)和α(1→6)糖苷键并具有α(1→4,6)支化点,例如通过本发明的方法产生的α-葡聚糖可以包含在40%与50%之间的连续α(1→4)糖苷键、在12%与21%之间的交替模式的单一α(1→6)糖苷键,以及在8%与25%之间的α(1→4,6)支化点,例如在12%与21%之间的α(1→4,6)支化点,例如在15%与20%的α(1→4,6)支化点。通过本发明的方法产生的α-葡聚糖可以具有少于1%的连续α(1→6)糖苷键,例如其可以具有少于0.5%的连续α(1→6)糖苷键,作为进一步示例其可以不具有连续的α(1→6)糖苷键。
本发明方法中的α-葡聚糖转移酶可以包含与seqidno:1具有至少80%同一性(例如与seqidno:1至少90%、95%、96%、97%、98%或99%的同一性)的氨基酸序列。本发明方法中的α-葡聚糖转移酶可以由与seqidno:1具有至少80%同一性(例如与seqidno:1至少90%、95%、96%、97%、98%或99%的同一性)的氨基酸序列组成。
mraspsqffaisllsiaisgllsgaavaapaptaleqvpdgkggvkwqevthdasaeeeqkgqdpkkflgiqaittepdgsvkvemgkpevrqpasgdvfvsnekldehvifqafalyqpndnatykaltenapqlaqwgitdvwspppyraasdskygegyaiadrydlgaydkgptkygtadelkaaigalhnndiriqvdvvpnqiiglnerhvlpvtgvdmygkpmnpfldhylystyskgsapgqaehgvikewdyfhfhgtttqyqglfrvlsdanstlyrylgpnhpenylpaflaesdaakygkintidgylladtwfavenaesenavyaplflyyeeprngvveqtfmdfarengytgsdediratmlaelrmtpnpigplmdeylaaqpgyskkseddakvtalrydgpendashigtnvldfeflvgndldtiredvqqeqlnwqkylldfgfdgfridaashintdmlrdevtqrlnhfagedvnehlsyiesyvtqqvdflqsnnygqmamdagpfsglmfsfgrdwaplryafeaslidrvnggpalpnwsfvnnhdqehnilvtvplteeeaggyepnsqpyelrqlekydadrnsvekqwaphnvpamyaillttkdtvptvfygdmfvsskpymstptpyrddivnilklrkqfakgeqviryensntgsngedlvsnirlgndrktgvavvagnnpaldttitvdmgaqhrnqwfvdamgyqperlktdkdgrltvqvkgtqnvdvkgylaawvpdlqaqe(seqidno:1)
本发明方法中的α-葡聚糖转移酶可以是褐球固氮菌gtfd酶,例如本发明方法中的α-葡聚糖转移酶可以是褐球固氮菌ncimb8003gtfd酶。本发明的用于生产支化比例为至少8%的α-葡聚糖的方法可以包括使在其非还原端包含至少两个α(1→4)连接的d-葡萄糖单元的多糖或低聚糖底物与褐球固氮菌gtfd酶接触。
本发明的另一方面提供了生产支化比例为至少8%的α-葡聚糖的方法,所述方法包括使在其非还原端包含至少两个α(1→4)连接的d-葡萄糖单元的多糖或低聚糖底物与包含与seqidno:92具有至少80%同一性(例如与seqidno:92至少90%、95%、96%、97%、98%或99%的同一性)的氨基酸序列(例如由其组成)的α-葡聚糖转移酶接触。seqidno:92是北京类芽孢杆菌dsm24997gftd酶的序列,genbank登录号wp_052702730.1。
本发明方法中的α-葡聚糖转移酶可以包含与seqidno:92具有至少80%同一性(例如与seqidno:92至少90%、95%、96%、97%、98%或99%的同一性)的氨基酸序列。本发明方法中的α-葡聚糖转移酶可以由与seqidno:92具有至少80%同一性(例如与seqidno:92至少90%、95%、96%、97%、98%或99%的同一性)的氨基酸序列组成。
本发明方法中的α-葡聚糖转移酶可以是北京类芽孢杆菌gtfd酶,例如本发明方法中的α-葡聚糖转移酶可以是北京类芽孢杆菌dsm24997gftd酶。北京类芽孢杆菌dsm24997是北京类芽孢杆菌d的模式菌株,也被称为accc03082,并且可以从leibniz-institutdsmz-deutschesammlungvonmikroorganismenundzellkulturengmbh获得。本发明的用于生产支化比例为至少8%的α-葡聚糖的方法可以包括使在其非还原端包含至少两个α(1→4)连接的d-葡萄糖单元的多糖或低聚糖底物与北京类芽孢杆菌gtfd酶接触。
本发明的一个方面提供了生产支化比例为至少8%的α-葡聚糖的方法,所述方法包括使在其非还原端包含至少两个α(1→4)连接的d-葡萄糖单元的多糖或低聚糖底物与包含与seqidno:92具有至少80%同一性的氨基酸序列的α-葡聚糖转移酶接触。
本发明方法中的底物可以具有至少为三的聚合度,例如其可以包含至少三个d-葡萄糖单元。聚合度是聚合物或低聚物分子中单体单元的数量。例如,本发明方法中的底物可以具有至少为四的聚合度,例如其可以包含至少四个d-葡萄糖单元。本发明方法中的底物可以选自淀粉(例如蜡质淀粉或高直链淀粉)、淀粉衍生物、麦芽低聚糖、直链淀粉、支链淀粉、麦芽糊精、α(1→4)葡聚糖和它们的组合。淀粉衍生物通过物理、酶促或化学地处理天然淀粉以改变其性质来制备。
本发明方法中的底物可以包含在另一种材料中,例如底物可以是以面粉形式提供的淀粉。有利的是能够将包含在食物成分内的多糖或低聚糖转化成具有较低消化性的α-葡聚糖,例如支化α-葡聚糖。这种转化可以增加成分的纤维含量和/或可以帮助降低成分的卡路里含量。本发明的方法可以作为食物加工操作的一部分进行,例如α-葡聚糖转移酶可以在生产食物产品的过程中施加至食物成分。底物可以包含在已经具有积极营养构成的材料内,例如底物可以包含在全麦面粉中。
本发明的方法中多糖或低聚糖底物可以由α-葡聚糖转移酶转化的程度可以通过限制反应时间来调节。部分转化的底物将提供不同的物理性质。本发明方法中的α-葡聚糖的产生可以在底物与α-葡聚糖转移酶之间的反应达到完全之前停止,例如其可以通过使酶变性(例如通过加热)或去除酶来停止。
本发明的方法中的α-葡聚糖转移酶可以被固定,例如在接触多糖或低聚糖底物之前被固定。这种固定技术是本领域众所周知的。酶的去除(上面讨论的)可以通过固定酶来促进。固定技术可以选自共价结合、截留、物理吸附、交联和这些技术的组合。在通过共价结合进行固定时,酶通过酶中对催化活性不是必要的官能团与载体共价连接。可以使用氧化物材料(诸如氧化铝、二氧化硅和硅酸盐化的氧化铝)来共价结合酶。在通过截留进行固定时,酶位于聚合物基质或膜的晶格内。截留方法分为五种主要类型:晶格、微胶囊、脂质体、膜和反胶束。酶被截留在各种合成或天然聚合物的基质中。藻酸盐是通过离子凝胶法形成凝胶的天然存在的多糖,是一种此类固定基质。通过物理吸附固定是将酶固定到载体上的最简单和最古老的方法。通过吸附固定是基于酶与载体之间的物理相互作用,诸如氢键、疏水相互作用、范德华力以及它们的组合。吸附对酶的破坏通常比对化学附着手段要少。交联固定利用双官能或多官能化合物,所述双官能或多官能化合物充当用于酶的分子间交联的试剂。交联可以与其他固定方法如吸附或截留组合使用。
在本发明的方法中多糖或低聚糖底物可以与α-葡聚糖转移酶在30℃与75℃之间(例如在40℃与75℃之间,例如在50℃与70℃之间,例如在35℃至45℃)的温度和在4.8与8.0之间(例如在5.5与7.5之间,例如在6.0与7.0之间)的ph下接触。
在另一个实施方案中,本发明涉及包含交替的α(1→4)和α(1→6)糖苷键并具有α(1→4,6)支化点的α-葡聚糖,其中α-葡聚糖具有至少12%(例如至少15%)的支化比例,具有超过1重量%的麦芽五糖单元,并且具有在1×106da与40×106da之间的平均分子量,例如在5×106da与30×106da之间的平均分子量,例如在10×106da与20×106da之间的平均分子量。根据本发明的α-葡聚糖可以包含在40%与50%之间的连续α(1→4)糖苷键、在12%与21%之间的交替模式的单一α(1→6)糖苷键,以及在12%与25%之间的α(1→4,6)支化点,例如在12%与21%之间的α(1→4,6)支化点,例如在15%与20%的α(1→4,6)支化点。根据本发明的α-葡聚糖可以具有少于1%的连续α(1→6)糖苷键,例如其可以具有少于0.5%的连续α(1→6)糖苷键,作为进一步示例其可以不具有连续的α(1→6)糖苷键。本发明的α-葡聚糖类似于由罗伊氏乳杆菌121gtfa葡聚糖蔗糖酶从蔗糖合成的罗伊糖,被认为是促进健康的食物成分,但是具有一些重要的差异。支化比例较高,例如在表3分析的样品中,可以看出褐球固氮菌ncimb8003gtfd酶产生18%的支化,而相较之下罗伊氏乳杆菌121gtfa酶产生11%的支化。α-葡聚糖中存在的支化越多,则提供给消化酶的接近性就越低,因此α-葡聚糖的消化性就越低。本发明的α-葡聚糖在其结构中还包含麦芽五糖单元(参见图14),麦芽五糖单元不存在于罗伊糖(例如由罗伊氏乳杆菌121gtfa酶产生的罗伊糖)中。较高量的连续α(1→4)键(例如麦芽五糖单元)可以提供特别的物理性质,诸如胶凝和粘度调节,这提供了例如在食品中的有用应用。
本发明的α-葡聚糖可以具有α(1→4,6)支化点,至少12%的支化比例,超过1重量%的麦芽五糖单元,少于1%的连续α(1→6)糖苷键(例如少于0.5%的连续α(1→6)糖苷键,作为进一步示例没有连续的α(1→6)糖苷键),平均分子量在1×106da与40×106da之间,并且可以包含具有夹杂有α(1→6)糖苷键的α(1→4)连接的d-葡萄糖单元链的结构(例如直链结构)。本发明的α-葡聚糖可以包含至少1%的具有夹杂有α(1→6)糖苷键的α(1→4)连接的d-葡萄糖单元链的结构,例如至少10%的具有夹杂有α(1→6)糖苷键的α(1→4)连接的d-葡萄糖单元链的结构,进一步例如至少20%的具有夹杂有α(1→6)糖苷键的α(1→4)连接的d-葡萄糖单元链的结构。本发明的α-葡聚糖可以具有至少5%的α(1→6)糖苷键。北京类芽孢杆菌gtfd酶从直链淀粉v合成高分子量聚合物和低分子量聚合物(参见图20)。两种聚合物级分都具有约17%至21%的高支化度。北京类芽孢杆菌gtfd酶可以合成具有长α(1→4)序列的聚合物,例如麦芽六糖和麦芽七糖单元(参见图24)。在所使用的实验条件下,高分子量聚合物的平均分子量为27×106da,并且低分子量聚合物的平均分子量为19×103da。这提供了产生具有不同大小的罗伊糖样聚合物的可能性。本发明的α-葡聚糖可以具有至少15%(例如至少17%,进一步例如至少20%)的支化比例以及在22×106da与35×106da之间的平均分子量。本发明的α-葡聚糖可以具有至少15%(例如至少17%,进一步例如至少20%)的支化比例以及在15×103da与25×103da之间的平均分子量。本发明的α-葡聚糖可具有超过1重量%的麦芽六糖单元。本发明的α-葡聚糖可具有超过1重量%的麦芽七糖单元。本发明的α-葡聚糖可以具有至少17%的支化比例、在15×103da和25×103da之间的平均分子量,超过1重量%的麦芽六糖单元和超过1重量%的麦芽七糖单元。
在另一方面,本发明提供了通过使在其非还原端包含至少两个α(1→4)连接的d-葡萄糖单元的多糖或低聚糖底物与包含与seqidno:1具有至少80%同一性或与seqidno:92具有至少80%同一性的氨基酸序列的α-葡聚糖转移酶接触而可获得(例如获得)的α-葡聚糖。
本发明的α-葡聚糖可以被认为是膳食纤维。由于α-葡聚糖的高度支化的结构,α-葡聚糖将抵抗上消化道中的酶降解并最终在大肠中被结肠菌群充分发酵。此外,这种膳食纤维增强了人类或动物的饱腹感。饭后血糖水平上升。由于本发明的α-葡聚糖显示出与诸如淀粉的材料相比降低的消化性,所以与含有淀粉的等同膳食相比,被制备为含有本发明的α-葡聚糖的膳食将导致降低的血糖反应,并且会引起较低的胰岛素反应。包含本发明的α-葡聚糖的组合物可以用于控制个体的饭后血糖和胰岛素水平。个体可以是人或宠物。包含本发明的α-葡聚糖的组合物可用于治疗或预防与个体的饭后血糖和胰岛素水平升高相关的病症。该病症可以选自:糖尿病,例如妊娠糖尿病;葡萄糖代谢受损;高胰岛素血症或胰岛素抗性。个体可以是患有糖尿病或前期糖尿病的人类或宠物。
通常,饭后高胰岛素血可促进胰岛素抗性、代谢综合征、葡萄糖不耐症和2型糖尿病的发展[koppw.,metabolism.2003年7月;52(7):840-844]。然而,降低餐后的胰岛素需求可一方面降低对2型糖尿病的血糖控制的恶化,另一方面降低易患病个体发展为2型糖尿病的风险。
“前期糖尿病患者”是显示胰岛素抗性或葡萄糖代谢受损的个体,并且例如由于家族史、生活方式或遗传学因素而易于在以后生活中发展为糖尿病。减少胰岛素分泌降低了胰腺长时间内耗尽的风险,并且因此有利于在前期糖尿病中管理胰腺或对代谢障碍患者有利。因此,使用包含本发明的α-葡聚糖的组合物将降低那些个体中糖尿病、葡萄糖代谢受损、高胰岛素血症或胰岛素抗性的风险和/或发展。
主要在成年人中观察到糖尿病、胰岛素抗性或葡萄糖不耐症的发病率。然而,越来越多的儿童在以后生活中受到这种疾病的影响,或易患这种疾病,或有发展为这种疾病的风险。因此,有利地,这些疾病的预防和/或治疗在幼年时就已开始。或者,类似于对人类所观察到的,糖尿病、高胰岛素血症或胰岛素抗性在动物中,特别是在作为宠物动物饲养的动物中越来越普遍。因此,本发明还涉及猫和狗。
包含本发明的α-葡聚糖的组合物可以非治疗地用以降低饭后血浆中的葡萄糖和胰岛素水平。有利的是,也可将包含本发明的α-葡聚糖的组合物施用给可能在之后的某一时间有发展为2型糖尿病、胰岛素抗性或葡萄糖不耐症的风险的个体,例如健康个体。如本文公开的包含本发明的α-葡聚糖的组合物在摄入后提供降低的胰岛素水平。许多健康的人希望减轻体重。食用含有膳食纤维的膳食可以增加饱腹感,从而帮助人们摄入更少的可消化卡路里。包含本发明的α-葡聚糖的组合物可以非治疗地用以减轻体重。
本发明的另一方面涉及包含本发明的α-葡聚糖的食品组合物。该食品组合物可以例如包含在1重量%与20重量%之间的本发明的α-葡聚糖。食品组合物可以是饮料,例如粉末饮料混合物或饮料奶精;早餐谷物;宠物食物产品;经烘焙的面团产品,例如面包、披萨或夹心的咸味卷饼(filledsavouryturnover);或甜食产品。甜食产品可以是冷冻甜食产品,诸如冰淇淋;烘焙甜食产品,诸如饼干,例如夹心饼干或薄饼;巧克力甜食产品;或者糖型甜食产品,诸如口香糖、胶冻软糖、硬熬制糖果或耐嚼糖。术语“糖型甜食产品”或“糖型糖果”是指传统上基于糖但是可以用替代甜味剂和/或糖替代物制造的甜食产品。
在另一个实施方案中,本发明提供了gtfdα-葡聚糖转移酶用于减少食物材料中可消化碳水化合物的用途。本发明提供了包含与seqidno:1具有至少80%同一性(例如与seqidno:1具有至少90%、95%、96%、97%、98%或99%同一性)的氨基酸序列,或具有seqidno:1的氨基酸序列的α-葡聚糖转移酶用于减少食物材料(例如含淀粉的食物材料)中的可消化碳水化合物的用途。在本发明的范围中,可消化的碳水化合物对应于总碳水化合物中可消化并可用于向身体细胞提供能量的分数。
本发明还提供了包含与seqidno:92具有至少80%同一性(例如与seqidno:92具有至少90%、95%、96%、97%、98%或99%同一性)的氨基酸序列,或具有seqidno:92的氨基酸序列的gtfdα-葡聚糖转移酶用于减少食物材料(例如含淀粉的食物材料)中的可消化碳水化合物的用途。
本发明提供gtfdα-葡聚糖转移酶用于降低食物材料的血糖指数的用途,该gtfdα-葡聚糖转移酶为例如包含具有与seqidno:1或seqidno:92至少80%的同一性(例如与seqidno:1或seqidno:92至少90%、95%、96%、97%、98%或99%的同一性)的氨基酸序列的α-葡聚糖转移酶。血糖指数是与特定类型食物相关的数字,表示食物对人血液葡萄糖(也称为血糖)水平的影响。值为100代表标准、等效量的纯葡萄糖。
本领域的技术人员将理解,他们可以自由地组合本文所公开的本发明的所有特征。具体地讲,可将针对本发明的方法描述的特征与本发明的产品组合,反之亦然。此外,可以组合针对本发明的不同实施方案所描述的特征。对于具体的特征如果存在已知的等同物,则这些等同物被纳入,如同在本说明书中明确提到这些等同物。参见附图和实验部分后,本发明的更多优点和特征是显而易见的。
实验部分
引言
糖苷水解酶(gh)家族70最初是针对葡聚糖蔗糖酶(gs)建立的(http://www.cazy.org/),gs酶仅在乳酸菌中存在(lombard等人,2014年)。gs使用蔗糖合成多种直链和支化的α-葡聚糖,不同之处在于糖苷键的类型、支化度和类型、葡聚糖链的长度、分子量和聚合物的构象。根据它们的葡聚糖产物中存在的主要糖苷键,它们可以分为葡聚糖[α(1→6)键]、变聚糖[α(1→3)键)、罗伊糖[α(1→4)和α(1→6)键]和交替糖[交替α(1→3)和α(1→6)键]。来自gh70的酶属于gh-h族(也称为α-淀粉酶超家族),连同来自家族gh13的酶(主要是淀粉修饰酶)和来自家族gh77的酶(例如4-α-葡聚糖转移酶)(stam等人,2006年)。所有gh-h成员都采用类似的催化机制,涉及共价葡糖基中间体和α-构型在它们的产物中的保持,但是它们的产物和反应特异性差别很大。
迄今为止,60种gs酶已经被在生物化学上表征,并且三维结构可用于具有不同产物特异性的四种蛋白质(vujicic-zagar等人,2010年;ito等人,2011年;brison等人,2012年;pijning等人,2012年)。这些晶体结构显示gs在结构上与密切相关的gh13和gh77淀粉修饰酶相似,从而证实了先前的二级结构预测(macgregor等人,1996年;2001年)。然而,gs也具有独特的结构特征。首先,与gh13和gh77酶相比,它们的催化性(α/β)8-桶型域是环状变换的。因此,在gs中,gh-h族的四种签名序列基序i至iv的顺序是ii-iii-iv-i(图1),并且不与gh13和gh77酶中存在的顺序(i-ii-iii-iv)对应。其次,这些晶体结构揭示,在gs蛋白质中,肽链含有5个域(a、b、c、iv和v),并且肽链遵循不寻常的“u”折叠域,其中5个域中的4个是由多肽链的两个不连续区段组成的(图1)。a、b和c域形成催化核心,并且也存在于gh13酶中。相反,域iv和v是gs所特有的。域iv的作用仍有待阐明,而域v看起来对于多糖合成是重要的。实际上,罗伊氏乳杆菌180gtf180葡聚糖蔗糖酶中的域v的截短产生了具有完全催化活性但具有严重受损的多糖合成能力的酶。这种截短的蛋白质相反会产生大量的低聚糖(meng等人,2015年)。
近年来,已经确认gh70酶亚家族对蔗糖无活性,但表现出对麦芽低聚糖(mos)和淀粉的明显水解酶/转糖基酶活性,这也反映了家族gh70与gh13之间的进化关系(kralj等人,2011年)。此亚族的成员与gs酶具有明显的序列相似性,并且仅在乳酸菌中存在。罗伊氏乳杆菌121gtfb酶为这个切割α(1→4)键并合成α(1→6)键的亚家族中的第一个表征成员,被命名为4,6-α-葡聚糖转移酶(4,6-α-gt酶)。作为gtfb酶活性的结果,产生了直链的异麦芽/麦芽多糖(immp),所述immp由附接到mos或淀粉片段的非还原端的直链α(1→6)-葡聚糖链组成。immp代表根据体外研究的新型淀粉衍生的可溶性膳食纤维,因此它们是潜在有价值的食物成分(bai等人,2015a;dobruchowska等人,2012年;dijkhuizen等人,2010年;leemhuis等人,2014年)。gtfb样酶的确切体内作用仍然未知。应该指出的是,gtfb基因被鉴定为在来自罗伊氏乳杆菌121的gtfa基因的上游,编码将蔗糖转化为罗伊糖的常规gh70葡聚糖蔗糖酶,罗伊糖是具有交替的α(1→4)和α(1→6)键的支化葡聚糖)(kralj等人,2002年;vanleeuwen等人,2008a,dobruchowska等人,2013年)。
最近在非乳酸菌细菌中已经鉴定出了具有4,6-α-葡聚糖转移酶活性的第二gh70亚家族,并且鉴定了西伯利亚微小杆菌255-15gtfc酶(gangoiti等人,2015年)。微小杆菌是杆菌属,并且数据显示这种gtfc酶在生物化学上与罗伊氏乳杆菌gtfb酶非常相似。观察到的主要区别在于,这种gtfc酶合成异麦芽/麦芽低聚糖(immo),而不是由麦芽低聚糖和直链淀粉v形成的(改性的)聚合物(immp)。关于它们的氨基酸序列,罗伊氏乳杆菌121gtfb和西伯利亚微小杆菌gtfc仅共享30%的同一性,但是它们在它们的签名基序i至iv中显示出高度的保守性。然而,gtfc酶中这些保守基序的顺序是i-ii-iii-iv,这反映了它们的非变换的域布局,与gh13蛋白质相似,但不同于葡聚糖蔗糖酶和gtfb样4,6-α-葡聚糖转移酶的经变换的顺序ii-iii-iv-i特征(图1)。gtfc酶与gh13酶共享a、b和c域。然而gtfc酶另外具有插入域b中的域iv,并且在若干种情况下具有可以允许细胞表面结合的ig样2域。鉴于活性和域布局,西伯利亚微小杆菌gtfc4,6-α-葡聚糖转移酶代表gh13α-淀粉酶与gh70葡聚糖蔗糖酶/gtfb样4,6-α-葡聚糖转移酶之间的进化中间体(gangoiti等人,2015年)。
本实验部分报道了具有独特产物特异性和不同微生物来源(褐球固氮菌ncimb8003)的新型gh70酶的生物化学表征。这种蛋白质被命名为gtfd,并且在使用麦芽糊精和淀粉作为底物方面类似于4,6-α-葡聚糖转移酶。然而,褐球固氮菌gtfd酶催化从直链淀粉合成具有交替的的α(1→4)和α(1→6)糖苷键的高分子量和相对高度支化的α-葡聚糖。这种产品不含有连续的α(1→6)键,与分别由罗伊氏乳杆菌121gtfb和西伯利亚微小杆菌gtfc合成的immp和immo明显不同。由褐球固氮菌gtfd酶形成的聚合物的结构更类似于由罗伊氏乳杆菌121gtfa葡聚糖蔗糖酶从蔗糖合成的罗伊糖的结构(kraj等人,2004年;vanleeuwen等人,2008a;dobruchowska等人,2013年)。随着这种新型固氮菌gtfd4,6-α-葡聚糖转移酶的发现,看起来gh70酶的分布不限于革兰氏阳性菌。褐球固氮菌ncimb8003是一种形成厚壁孢囊的土壤生n2固定革兰氏阴性细菌。基于对这种细菌的最近阐明的基因组的分析,预测这种细菌产生细胞外多糖,诸如藻酸盐、果聚糖和纤维素(robson等人,2015年)。我们的工作表明,褐球固氮菌也能够从淀粉/麦芽糊精合成罗伊糖样的α-葡聚糖。由褐球固氮菌gtfd4,6-α-葡聚糖转移酶产生的聚合物的体内作用仍有待研究。
褐球固氮菌gtfd表现出在氨基酸序列方面与由北京类芽孢杆菌dsm24997(genbank登录号wp_052702730.1)编码的假定gh70酶48%的同一性。为了进一步扩展淀粉转化gh70家族酶的全部功能,对植物促生根圈细菌北京类芽孢杆菌dsm24997的gtfd酶进行了表征。我们的数据显示,北京类芽孢杆菌gtfd还是形成罗伊糖样聚合物的4,6-α-gt酶,提供了革兰氏阳性菌中的这种新型反应和产物特异性的第一个示例。此外,通过褐球固氮菌gtfd和北京类芽孢杆菌gtfd的作用合成的产物之间存在差异,从而扩大了可以由直链淀粉合成的罗伊糖样聚合物的范围。最终,褐球固氮菌gtfd和北京类芽孢杆菌gtfd分离出了罗伊糖样聚合物,并且对从淀粉温育获得的反应混合物进行使用消化酶(猪胰酶和大鼠肠粉提取物)进行的体外消化性研究,以便评估这些酶产生更不易消化的含淀粉食物的潜在用途。
材料和方法
系统发育分析
从gh70数据库(http://www.cazy.org)检索西伯利亚微小杆菌255-15序列,并在blastp搜索(http://www.ncbi.nlm.nih.gov/blast/)中用作查询。使用mega版本6进行系统发育分析(tamura等人,2013年),其中总共71个氨基酸序列对应于通过blastp确定的代表性gh70和gh13序列。本部分中所用序列的genbank登录号列出于表1中。通过muscle,使用默认参数进行序列比对。基于mega6中使用的基于jtt矩阵的模型,通过最大似然法构建系统发育树。进行对包含比对缺口和缺失数据的位置的部分删除。通过执行1,000次自举重复进行对推断的系统发育关系的统计置信度的评估。
表1.在图2的系统发育树中使用的家族gh70和gh13蛋白序列的genbank登录号。
蛋白序列分析
使用signalp4.1服务器(http:/www.cbs.dtu.dk/services/signalp/)预测信号肽切割位点。使用pfam服务器(http://pfam.sanger.ac.uk/)进行保守域搜索。使用jalview进行在由pfam服务器确定的功能区域与罗伊氏乳杆菌121gtfb和西伯利亚微小杆菌255-15gtfc序列之间的成对序列比较(waterhouse等人,2009年)。或者,使用clustalw2程序(http://www.ebi.ac.uk/tools/msa/clustalw2)产生多个氨基酸序列比对,并通过使用jalview进行可视化(waterhouse等人,2009年)。
克隆来自褐球固氮菌的gtfd基因
使用phusiondna聚合酶(finnzyme)从褐球固氮菌ncimb8003染色体dna扩增编码全长gtfd蛋白的dna片段(genbank条目aje22990.1,氨基酸29-780),并使用不依赖连接的克隆(lic)将其克隆到经修饰的pet15b载体中。对于lic克隆,使用具有5’延伸(粗体)的以下引物对进行pcr扩增:前向cagggacccggtgcaccggcccccacggcgctcg和反向cgaggagaagcccggttactcctgggcctggaggtccggaaccc。基本上,从凝胶分离经kpni消化的载体和gtfdpcr产物,然后分别在dttp和datp存在下用t4dna聚合酶(newenglandbiolabs)处理。将两种反应产物以1:4的摩尔比混合在一起,并将混合物用于转化大肠杆菌dh5α细胞(phabagen)。这产生了含有可被3c蛋白酶切割的n-末端his6标签的gtfd构建体。将所构建的表达载体pet15b/gtfd转化到宿主大肠杆菌bl21star(de3)中。通过核苷酸测序验证基因序列(lgc基因组学,berlin,germany)。
蛋白质表达和纯化-褐球固氮菌
将具有褐球固氮菌ncimb8003的gtfd基因的大肠杆菌bl21star(de3)在补充有氨苄青霉素(100μgml-1)的luria肉汤培养基中在37℃和230rpm下培养。当培养物达到od600~0.6时,加入诱导剂异丙基-β-d-1-硫代半乳糖苷(iptg)至终浓度为0.1mm,并在16℃下继续培养24小时。通过离心(10,000g,20分钟)收获细胞,随后用b-per蛋白提取试剂(thermoscientific,pierce)裂解。在离心(15,000g,20分钟)后,对含有可溶性gtfd蛋白的无细胞提取物进行ni-imac色谱。在用20mmtris-hcl(ph8.0)和1mmcacl2洗涤后,将蛋白质用200mm咪唑在同一缓冲液中洗脱。将含有gtfd的级分浓缩并在搅拌的超滤单元(amicon,beverly,ma)中于30,000分子量截留膜上交换到20mmtris-hcl缓冲液1mmcacl2(ph8.0)中。通过sds-page检查纯度,并使用nanodrop2000分光光度计(isogenlifescience,demeern,thenetherlands)测定蛋白质浓度。
克隆北京类芽孢杆菌gtfd基因
使用phusiondna聚合酶(finnzyme,helsinki,finland)并使用北京类芽孢杆菌染色体dna(dsm24997)作为模板,通过pcr扩增编码全长gtfd酶、不具有该酶的推定信号肽编码序列(氨基酸31至776)的2241bp的dna片段。用于扩增gtfd基因的pcr引物包含5'端延伸(粗体)以促进不依赖连接的克隆(lic),并且是:pbf(5'cagggacccggtgcggaaagcaatgcgaaagg3')和pbr(5'cgaggagaagcccggttaattgctaaaccgtcttaatgctttattc3')。通过不依赖连接的克隆(lic)将gtfdpcr产物克隆到经修饰的pet15b载体中,从而产生含有可被3c蛋白酶切割的n-末端his6标签的gtfd构建体。将所构建的表达载体pet15/pbgtfd转化到宿主大肠杆菌bl21star(de3)中。通过测序(gatc,cologne,germany)来确认构建体。
重组北京类芽孢杆菌gtfd蛋白在大肠杆菌中的产生和纯化
使携带pet15/pbgtfd的大肠杆菌bl21star(de3)在旋转振荡器中于含有100μgml-1氨苄青霉素的500mllb培养基中生长(37℃,220转/分钟)至在600nm的光密度为0.4-0.6。通过加入终浓度为0.1mm的异丙基-β-d-硫代半乳糖苷(iptg)诱导重组gtfd的表达,并在16℃继续培养20小时。通过离心(10,000g×20分钟)收获细胞,然后用b-per裂解试剂(thermoscientific,pierce)破碎。在离心(15,000g×20分钟)后,使用ni2+-次氮基三乙酸酯(ni-nta)作为柱材料(sigma-aldrich),通过his标签亲和层析从无细胞提取物中纯化可溶性gtfd蛋白。在用25mmtris-hcl(ph8.0)、1mmcacl2洗柱后,用200mm咪唑在相同缓冲液中洗脱结合的蛋白质,并用具有30,000截留分子量的带搅拌超滤装置(amicon,beverly,ma)去除咪唑。通过sds-page分析纯化的蛋白质的纯度和均质性,并用(nanodrop2000分光光度计(isogenlifescience,demeern,thenetherlands)常规测定酶溶液中蛋白质的量。
酶分析
使用0.125%(w/v)直链淀粉v(avebe,foxhol,thenetherlands)或0.125%(w/v)马铃薯淀粉(sigma-aldrich)作为底物,通过直链淀粉-碘方法(bai等人,2015b)测定褐球固氮菌ncimb8003的gtfd酶的初始总活性。这种测定测量由转糖基和/或水解活性产生的α-葡聚糖-碘复合物的吸光度降低。在25mm磷酸钠缓冲液(ph6.5)中用28μg/ml酶在50℃下进行酶测定。一个单位的活性对应于每分钟转化1mg底物的酶量。使用直链淀粉v作为底物,在4.5-9.5的ph范围和30-75℃的温度范围内测定最佳的ph和温度。在ph4.5-6.0时使用乙酸钠缓冲液(25mm),在ph6.0-7.0时使用mops缓冲液(25mm),在ph7.0-8.0时使用tris-hcl缓冲液(25mm)并且在ph9.0-9.5时使用甘氨酸-naoh。对于热稳定性研究,将酶(0.5mg/ml)在不存在底物的情况下在50℃至95℃的不同温度下温育10分钟,然后立即冷却至4℃。如上所述测量残余活性。
使用0.125%(wv-1)直链淀粉v(avebe,foxhol,thenetherlands)作为底物,通过碘染色测定法来测定纯化的北京类芽孢杆菌gtfd(pbgtfd)酶的初始活性。这种方法监测由转糖基和/或水解活性产生的α-葡聚糖-碘复合物随着时间推移在660nm处吸光度的下降。在含有1mmcacl2的25mm磷酸钠缓冲液(ph7.0)中用12μgml-1酶在50℃下进行酶测定。一个单位的活性被定义为每分钟转化1mg底物的酶量。在4.5-10.0的ph范围和35-60℃的温度范围内测定最佳的ph和温度。柠檬酸钠缓冲液(25mm)用于在4.5与7.0之间的ph,磷酸钠缓冲液(25mm)用于在7.0与8.0之间的ph,tris-hcl缓冲液(25mm)用于在8.0与9.0之间的ph,并且碳酸氢钠缓冲液用于在8.0与9.0之间的ph。
使用gtfd进行的底物/产物分析
用25mm蔗糖(acros)、黑曲霉糖(sigma-aldrich)、潘糖(sigma-aldrich)、异麦芽糖(sigma-aldrich)、异麦芽三糖(sigma-aldrich)、异麦芽五糖(carbosynth)、β-环糊精(sigma-aldrich)、具有不同聚合度(g2-g7)的麦芽低聚糖(mos)和0.6%(w/v)直链淀粉v(avebe,foxhol,thenetherlands)、马铃薯淀粉(sigma-aldrich)和支链淀粉(sigma-aldrich)单独温育褐球固氮菌ncbi8003的纯化的gtfd酶(40μgml-1)。所有反应均在ph6.5的25mm磷酸钠缓冲液中用1mmcacl2在37℃下进行24小时。使用相同的条件分析用麦芽六糖和直链淀粉v随时间推移形成的低聚糖,但是在这种情况下使用20μgml-1的gtfd酶。对于受体底物研究,将gtfd(40μgml-1)在含有1mmcacl2以及受体底物麦芽糖或异麦芽糖(25mm)的ph6.5的25mm磷酸钠缓冲液中在0.35%(w/v)直链淀粉v(供体底物)的存在下温育。将反应混合物在37℃温育24小时。在所有情况下,反应的进展都遵循高性能阴离子交换色谱(hpaec)和/或薄层色谱(tlc)。
将重组北京类芽孢杆菌gtfd酶(40μgml-1)用25mm蔗糖(acros)、黑曲霉糖(sigma-aldrich)、潘糖(sigma-aldrich)、异麦芽糖(sigma-aldrich)、异麦芽三糖(sigma-aldrich)、异麦芽五糖(carbosynth)、聚合度(dp)为2-7的麦芽低聚糖(mos)和0.6%(w/v)直链淀粉v(avebe,foxhol,thenetherlands)和支链淀粉(sigma-aldrich)单独温育。所有的温育都在含有1mmcacl2的ph7.0的25mm磷酸钠缓冲液中于37℃下进行24小时。通过将样品加热至100℃达8分钟来终止反应。通过薄层色谱(tlc)和/或高效阴离子交换色谱(hpaec)评估反应的进展。
薄层色谱和高效阴离子交换色谱以及脉冲安培检测分析
样品在tlc薄片(merck硅胶60f254,20×20cm)上在1cm线上点样,并在干燥后将板在体积比为2:1:1的正丁醇:乙酸:水中跑样6小时。将条带用苔黑酚/硫酸染色可视化,并与葡萄糖和mos的混合物的同时跑样(dp2至dp7)进行比较。
通过hpaec在装备有ics-3000ed脉冲安培检测系统(pad)的ics-3000工作站(dionex,amsterdam,thenetherlands)上分析来自使用gtfd的温育的产物混合物。在carbopacpa-1柱(dionex;250×4mm)上通过使用在100mmnaoh中的10-240mm乙酸钠的线性梯度以1ml/min的流速分离低聚糖。使用商售的低聚糖标准品来确定峰的种类。
使用gtfd从直链淀粉温育产生的产物的产生和分析
在“使用gtfd进行的底物/产物分析”中描述的条件下,将纯化的褐球固氮菌和北京类芽孢杆菌gtfd酶(0.2mg)分别用直链淀粉v温育。在37℃温育24小时后,通过转移至95℃达6分钟来停止反应。通过在bio-gelp-2柱(2.5×50cm;bio-rad)上使用10mmnh4hco3作为洗脱液,以48ml/h的流率进行尺寸排阻色谱来分离由褐球固氮菌gtfd酶产生的hmm聚合物。通过在superdexs-200(10×300mm;ge-healthcare)上使用25mm碳酸氢铵作为洗脱液,以0.5mlmin-1的流率进行尺寸排阻色谱,来测定由北京类芽孢杆菌gtfd生成的hmm和lmm多糖级分对直链淀粉的活性。
(i)甲基化分析
如前所述(vanleeuwen等人,2008b),通过使用ch3i和固体naoh在dmso中对多糖进行全甲基化,接着用tfa进行酸水解,来进行对分离的多糖的甲基化分析。用nabd4还原部分甲基化的单糖。将所得到的部分甲基化糖醇在120℃使用吡啶:乙酸酐(体积比为1:1)进行全乙酰化。如所述(vanleeuwen等人,2008b),通过glc-ei-ms和glc-fid分析部分甲基化的糖醇乙酸酯(pmaa)。
(ii)hpsec分析
如前所述(bai等人,2015b),通过hpsec-mals-ri测定产物混合物的分子量分布。简言之,将样品以3.5mgml-1的浓度溶解在dmso-libr(0.05m)中,并通过与多角度激光光散射检测器(sld7000pss,mainz)、粘度计(eta-2010pss,mainz)和差示析光率检测器(g1362a1260ridagilenttechnologies)在线结合的高性能尺寸排阻色谱法分析。通过使用dmso-libr(0.05m)作为洗脱液,流率为0.5mlmin-1的三个孔隙度为100、300和
(iii)nmr光谱学
产物混合物和分离的多糖的一维1h核磁共振(nmr)谱是在varianinova500光谱仪(nmrcenter,universityofgroningen)上,在探针温度为298k时在d2o中记录的,并用mestrenova5.3(mestrelabsresearchsl,santiagodecompostella,spain)处理。将样品在d2o(99.9原子%d,cambridgeisotopelaboratories,inc.,andover,ma)中进行中间冻干交换两次,然后溶于0.6ml的d2o中。化学位移以ppm表示,并通过内标丙酮校准(δ2.225ppm)。通过整合各个信号峰区域来估计不同键的百分比。
gtfd产物的酶处理
使罗伊糖gtfa聚合物、immpgtfb聚合物、北京类芽孢杆菌gtfdhmm和lmm多糖和褐球固氮菌gtfd聚合物(5mg/ml)经受使用过量的α-淀粉酶(米曲霉α-淀粉酶;megazyme)、葡聚糖酶(无定毛壳菌;sigma-aldrich)或支链淀粉酶m1(植生克雷伯菌;megazyme)进行的酶促消化。每种聚合物的酶促水解在ph5.0的50mm乙酸钠缓冲液中于37℃进行48小时。通过tlc和/或hpaec分析来分析水解度。淀粉、葡聚糖和支链淀粉分别用作α-淀粉酶、葡聚糖酶和支链淀粉处理的阳性对照,导致在这些条件下的完全水解。
结果与讨论
实施例1:由褐球固氮菌编码的新型gh70蛋白的鉴定
近来已经报道了对由西伯利亚微小杆菌255-15gtfc4,6-α-gt(被命名为gtfc酶)表示的新型gh70亚家族的鉴定(gangoiti等人,2015年)。为寻找对麦芽糊精和/或淀粉具有活性,但表现出不同产物特异性的新酶,以西伯利亚微小杆菌gtfc蛋白作为查询序列进行blastp搜索。如先前所述(gangoiti等人,2015年),这允许在各种微小杆菌属和芽孢杆菌属菌株中鉴别gtfc同源物,从而共享分别与西伯利亚微小杆菌gtfc蛋白超过75%和54%的同一性(表2)。这种新的blastp搜索也导致鉴定了最近阐明的褐球固氮菌ncimb8003(atcc4412)的基因组中存在的附加gtfc同源物(与西伯利亚微小杆菌gtfc具有78%的覆盖率、39%的同一性),被注释为葡聚糖蔗糖酶(robson等人,2015年)。使用blastp获得的下一个命中是(推定的)gtfb样4,6-α-葡聚糖转移酶,之后是(推定的)家族gh70葡聚糖蔗糖酶和家族gh13蛋白。图2描绘了通过blastp鉴定的代表性gh70和gh13家族成员之间的进化关系。如先前所报道的,gtfc样蛋白质分别从葡聚糖蔗糖酶和gtfb型酶成簇,在家族gh13和gh70蛋白之间(gangoiti等人,2015年)。在系统发育上,由褐球固氮菌编码的假设葡聚糖蔗糖酶与gtfc型酶最相关。然而,它与其他gtfc型酶仅共享39%至42%的氨基酸序列同一性,这一事实反映在树中该酶自身的长链支链中。
表2:通过使用西伯利亚微小杆菌255-15gtfc蛋白作为查询的blastp搜索确定的gtfc样序列和gtfb样序列。指示了gtfc样序列。褐球固氮菌ncimb8003gtfd酶以粗体示出。
褐球固氮菌的这个推定的葡聚糖蔗糖酶序列被分类在碳水化合物活性酶(cazy)数据库中的家族gh70中。迄今为止,所有的gh70成员都是由专属于乳杆菌(gss和gtfb样4,6-α-gt)和芽孢杆菌(gtfc样4,6-α-gts)目的厚壁菌门革兰氏阳性菌的低gc门的成员编码的。褐球固氮菌ncimb8003是γ-变形菌的有氧独立生存成员,具有形成抗脱水孢囊的能力。这种革兰氏阴性细菌在氮固定和氢代谢研究中被认为是模式微生物(robson等人,1984年;robson,1986年)。褐球固氮菌已被认知为细胞外的胞外多糖的产生者(lawson和stacey,1954年;cote和krull,1988年)。鉴于褐球固氮菌的起源以及与其他家族gh70蛋白的低序列同一性,我们决定对这种新型酶进行详细的表征并将其命名为gtfd。
褐球固氮菌gtfd蛋白一级序列分析
来自褐球固氮菌的gtfd的完整氨基酸序列编码780个氨基酸的多肽。这种蛋白含有保守的革兰氏阴性信号肽,其中预测的信号肽酶切割位点在氨基酸28与29之间,与此酶的细胞外位置一致。使用pfam服务器对这个gtfd序列进行的分析揭示了该序列的两个区段(残基82-255和残基416-780)与家族gh70相关。与西伯利亚微小杆菌gtfc和罗伊氏乳杆菌gtfb的序列比较显示,褐球固氮菌gtfd具有针对西伯利亚微小杆菌的gtfc样酶观察到的(非变换的)域布局,并且与gtfb和葡聚糖蔗糖酶的区别在于保守区域i-iv的环状变换。因此,从n-末端到c-末端,褐球固氮菌gtfd多肽链连续地贡献域an、bn、iv、bc、ac和c,完全缺乏域v(图1)。褐球固氮菌gtfd缺乏在微小杆菌gtfc同源物的c-末端部分中鉴定的ig样2域(gangoiti等人,2015年)。葡聚糖蔗糖酶和gtfb样4,6-α-葡聚糖转移酶在n末端区域存在200至700个残基的长可变区,该长可变区已被认为在细胞壁附着中发挥作用(bath等人,2005年)。这种可变域也不存在于褐球固氮菌gtfd中。然而,成熟的褐球固氮菌gtfd蛋白(没有它的信号肽)在其n末端具有约50个未知功能的氨基酸残基,这些氨基酸残基西伯利亚微小杆菌gtfc酶中不存在(图1)。在褐球固氮菌gtfd酶(图3)中鉴定了四个同源区(i-iv),这四个同源区被认为是gh13和gh70家族中的签名基序。褐球固氮菌gtfd中也存在gh70家族中的完全保守的七个残基(vanhijum等人,2006年;gangoiti等人,2015年)。这包括三个(推定的)催化残基asp471、glu505和asp572(褐球固氮菌gtfd编号)。在gh13酶中这些残基中的六个也是高度保守的,gln208(gtfd,褐球固氮菌编号)除外,gln208在gh13酶中被his取代(his140,bsta嗜热脂肪芽孢杆菌α-淀粉酶编号)。褐球固氮菌gtfd的基序i-iv与在(推定的)gtfc和gtfb4,6-α-葡聚糖转移酶中存在的基序非常相似,如由这些蛋白质序列中保守的大量氨基酸所显示的。在先前的研究中,序列比对显示,已知对于葡聚糖蔗糖酶的活性和产物特异性重要的一些残基在gtfb样4,6-α-葡聚糖转移酶和gtfc样4,6-α-葡聚糖转移酶中是不同的(leemhuis等人,2013年;gangoiti等人,2015年)。最值得注意的是,用4,6-α-葡聚糖转移酶中的tyr残基取代葡聚糖蔗糖酶中的保守残基w1065,以及1137、1140和1141位(gtf180罗伊氏乳杆菌180编号)的保守区域iv的差异。在褐球固氮菌gtfd中,保守残基w1065被tyr残基取代,并且1137和1141位的氨基酸残基分别为gln和asn,与其他4,6-α-葡聚糖转移酶相似。相比之下,保守的q1140被褐球固氮菌gtfd中的his残基取代,而不是大多数4,6-α-葡聚糖转移酶中存在的lys残基。先前对gtf180葡聚糖蔗糖酶的突变研究表明,残基q1140影响糖苷键反应特异性(vanleeuwen等人,2009年)。此外,残基q1140与残基n1411和d1458一起“阻断”了亚位点-1以外的活性位点,从而阻止了较长的低聚糖的结合。由于此特征,葡聚糖蔗糖酶仅在每个反应循环中转移单个葡萄糖部分,而不是低聚糖(vujicic-zagar等人,2010年)。另一方面,褐球固氮菌gtfd中的保守区域的序列顺序是i-ii-iii-iv,反映了它的非变换的域布局,类似于西伯利亚微小杆菌gtfc4,6-α-葡聚糖转移酶并且与葡聚糖蔗糖酶和gtfb同源物的变换顺序ii-iii-iv-i特征不同(图1)。褐球固氮菌gtfd因此看起来是具有与gh13酶类似的域架构,但显示出新的酶促反应特异性的新型gh13-gh70进化中间体(参见下文)。
褐球固氮菌gtfd的纯化和生化特性
将没有推定的信号序列、编码褐球固氮菌gtfd酶的基因使用n-末端his标签符合读框地克隆,并在大肠杆菌(de3)bl21star中表达。大部分gtfd蛋白以可溶形式产生,并且可以通过金属螯合层析纯化至均质(图4)。对纯化的酶的sds-page分析显示了表观分子量为约90kda的单一蛋白条带,其符合从序列推导的理论值(86.4kda)。
使用直链淀粉v作为底物测定ph和温度对褐球固氮菌gtfd活性的影响。该酶在60℃和ph6.5下显示其最大活性,并且在5.5至7.0的ph范围内保持超过70%的此活性(图5ab)。此外,该酶在含有1mmcacl2的ph8.0的20mmtris-hcl缓冲液中在至多60℃下可稳定至少10分钟(图5c)。其热稳定性高于罗伊氏乳杆菌121α-4,6-gtgtfb和gsgtfa,罗伊氏乳杆菌121α-4,6-gtgtfb和gsgtfa分别在至多45℃和50℃的温度下稳定(kralj等人,2004年;bai等人,2015b)。在含有1mmcacl2的ph6.5的磷酸钠缓冲液中并且在50℃下,gtfd对0.125%(w/v)直链淀粉和淀粉的总比活性值分别为6.6±0.05和6.0±0.2u/mg蛋白质。这些值显著高于之前使用直链淀粉v作为底物(在它们的最佳条件下)针对罗伊氏乳杆菌121gtfb(2.8u/mg)和西伯利亚微小杆菌255-15gtfc(2.2u/mg)报道的值(bai等人,2015b;gangoiti等人,2015年)。
褐球固氮菌gtfd的底物和产物特异性
通过将酶与不同的低聚糖和多糖在37℃温育24小时来研究gtfd的底物特异性。该酶对蔗糖、潘糖、黑曲霉糖、β-环糊精和具有dp2、dp3和dp5的异麦芽低聚糖是无活性的。然而,gtfd表现出对dp3至dp7的麦芽低聚糖(mos)的明显水解酶/转糖基酶活性,并形成一系列较短和较长的低聚糖(图6)。在g4(四个葡萄糖单体的聚合物)和较大的mos的情况下也检测到了聚合物积聚。然而,gtfd不能使用麦芽糖作为葡萄糖供体底物。当用直链淀粉v、马铃薯淀粉和支链淀粉探索gtfd酶的活性时,tlc上出现一些较低分子量的产物,反映了gtfd酶对这些聚合物的水解酶/歧化活性。特别是从各种底物中积累的麦芽糖(图6)。
使用直链淀粉v和淀粉作为底物,用gtfd获得的产物混合物的1hnmr分析显示在异头区域中对应于α(1→4)和新合成的α(1→6)键的两个宽信号(δ=约5.40-5.35和约4.97)(图7)。光谱还显示存在对应于游离葡萄糖单元(gαh-1,δ5.225;gβh-1,δ4.637)和4-取代的还原端葡萄糖残基(rαh-1,δ5.225;rβh-1,δ4.652)的信号。直链淀粉和淀粉反应产物的α(1→4)连接的、α(1→6)连接的还原葡萄糖残基的摩尔比分别为70:28:2和80:18:2。这些1hnmr谱与由gtfb(leemhuis等人,2014年)从直链淀粉产生的immp的那些谱的比较显示,在gtfd反应混合物的情况下,存在在α(1→4)异头区中强烈重叠的额外信号。δ为约5.40-5.35的这种宽广信号的不同组合表明形成了不同的产物。
通过hpsec-mals-ri分析确定由gtfd从直链淀粉v产生的产物的分子量分布(图8)。起始直链淀粉v底物在22ml处洗脱作为单峰,平均mw为174×103da。在用gtfd酶温育直链淀粉v之后,对应于直链淀粉v底物的峰消失,而在19ml和33ml处产生两个另外的主峰。在19ml处洗脱的峰对应于平均mw为13×106da的高分子量聚合物,而在33ml处洗脱的第二峰对应于麦芽糖和其他低分子量低聚糖。由gtfd从直链淀粉v合成的产物的洗脱曲线不同于将该底物用罗伊氏乳杆菌121gtfb4,6-α-葡聚糖转移酶温育后获得的产物的洗脱曲线。在gtfb的情况下,对应于immp的峰(27.6ml)以比对应于起始直链淀粉v底物的峰(22ml)更高的洗脱体积洗脱,并且平均mw为15×103da。这些数据显示,gtfd产生了mw值为起始直链淀粉v底物的约80倍大的高分子量聚合物。这种聚合物也比分别由罗伊氏乳杆菌121gtfb和西伯利亚微小杆菌gtfc(gangoiti等人,2015年)从直链淀粉产生的immp和immo大得多。
由褐球固氮菌gtfd从直链淀粉v合成的聚合物的表征
为了进一步分析,通过在biogelp-2柱上进行尺寸排阻色谱法,通过收集空隙体积级分来分离直链淀粉v衍生的高分子量聚合物。这种聚合物的1d1hnmr分析显示,68%和32%的葡糖基单元分别形成α(1→4)和α(1→6)键,表明α(1→6)连接的葡萄糖残基相较于反应混合物中的那些具有轻微增长。这种gtfd聚合物的1hnmr谱(图9)显示出与由罗伊氏乳杆菌121和罗伊氏乳杆菌35-5gtfags从蔗糖合成的罗伊糖的谱的高相似性(kralj等人,2002;vanleeuwen等人,2008a)。在1d1hnmr谱中,6-取代的glc残基的结构报道基团信号a显示gtfd产物的相对强度低于gtfa产物。指示末端残基的峰b具有较高的相对强度。在2d1h-1htocsy谱中,仅在α(1→4)异头轨道中观察到了具有a的交叉峰,表明6-取代的glc残基仅存在于→6)-α-d-glcp-(1→4)-序列中。没有关于两个或更多连续的α(1→6)连接的glc残基的证据。此外,2d13c-1hhsqc谱中与6-取代残基的h-6a和h-6b相对应的信号d和e分别具有δ3.97和δ3.78的1h化学位移值。在2d1h-1htocsy光谱的α(1→6)-异头轨道中,在这些值处没有观察到交叉峰。2d13c-1hhqsc谱中的峰c指示4-取代的残基(vanleeuwen等人,2008a)。通过甲基化分析证实了两种α-葡聚糖的相似性(表3)。对gtfd高分子量产物的甲基化分析显示,存在摩尔百分比为19%、45%、18%和18%的末端的、4-取代的、6-取代的和4,6-二取代的吡喃葡萄糖残基。这显示了比gtfa罗伊糖产物更高的支化比例,即18%而不是11%,这符合1d1hnmr谱(图9)中的观察(vanleeuwen等人,2008a)。如上所述,测得褐球固氮菌gtfd产生的多糖的平均分子量为13×106da,而由gtfags从蔗糖产生的罗伊糖的平均分子量为45×106da(kralj等人,2005年)。因此,与由gtfa从蔗糖合成的罗伊糖相比,gtfd的高分子量产物显示出更高的分支量、更少量的交替α(1→4)和α(1→6)键,以及降低的分子量。
表3:由褐球固氮菌ncimb8003gtfd酶从直链淀粉v产生的聚合物的结构分析。
a该数据表示在多糖的1hnmr谱中4.97ppm处的α(1→6)键信号和5.36ppm处的α(1→4)键信号的表面积积分的比率(参见图4)。b多糖的平均分子量是一式两份测定的。c获取自kralj等人,2005年。
由褐球固氮菌gtfd酶从麦芽六糖和直链淀粉v随时间推移形成的低聚糖
为了获得关于随时间推移产物形成的信息,将麦芽六糖和直链淀粉v都用gtfd温育,并且在不同时间点采集用于hpaec分析的样品(图10)。除g2之外,gtfd还从麦芽六糖中产生了具有高dp(在约40分钟处洗脱的峰)的未知结构、作为第一主要反应产物的低聚糖(图10a)。与g4相比,过量的g2表明gtfd催化麦芽四糖基转移反应,从而产生未知结构的峰。对dp为2至30的mos的混合物的同时分析显示,这种峰的保留时间与麦芽十糖的保留时间不完全匹配,麦芽十糖略迟洗脱,指示具有dp10和至少一个α(1→6)键的结构。在稍后的时间,由于gtfd的主要歧化活性,检测到具有低于起始供体的dp的mos,而且还检测到对应于具有较高dp的低聚糖的小峰。反应后期最初形成的未知产物减少,表明gtfd可以使用这种低聚糖作为供体和/或受体底物。gtfd在反应10分钟后从直链淀粉v释放g2、g3、g4、g5和g6作为其水解酶/转移糖基酶活性的副产物(图10b)。最值得注意的是,当使用麦芽六糖和直链淀粉两者作为底物时,在反应开始时未检测到葡萄糖。总体而言,这些数据表明,褐球固氮菌gtfd酶呈现不止一个供体底物结合亚位点,类似于其他淀粉分解酶,诸如淀粉酶、环糊精糖基转移酶和淀粉麦芽糖酶(macgregor等人,2001年;uitdehaag等人,2000年;naessens等人,2005年)。因此,这种gtfd并非优先地逐个转移葡糖基单元,而是替代地转移具有低dp的mos。西伯利亚微小杆菌gtfc还显示出附加的内-α(1→4)-糖苷酶活性,该活性与单葡糖基单元的主α(1→6)转移活性形结合以成immo(gangoiti等人,2015年)。根据这种聚合机理,褐球固氮菌gtfd产生具有α(1→6)/α(1→4)交替结构和α(1→6)支化点的α-葡聚糖。
褐球固氮菌gtfd受体底物反应的研究
为了更好地理解褐球固氮菌gtfd的作用模式,研究了这种酶的受体底物特异性并与罗伊氏乳杆菌gtfb的受体底物特异性进行比较(图11ab)。当用gtfd和麦芽糖作为受体底物温育直链淀粉v时,检测到比单独用直链淀粉v温育更大量的麦芽三糖和麦芽四糖。还通过hpaec鉴定出了少量的潘糖,所述潘糖可能是通过具有α(1→6)键的葡萄糖到麦芽糖的非还原末端(次要活性)的偶联所形成的。在gtfb的情况下,在具有较高dp的其他低聚糖中,在潘糖和麦芽三糖的位置处检测到了峰。这些结果表明,gtfd和gtfb具有在存在具有低dp的受体底物如麦芽糖时合成α(1→4)键和α(1→6)键的能力。异麦芽糖对gtfd来说是一个不良的受体底物。hpaec分析表明,在异麦芽糖存在下,gtfd不形成大量的低聚糖,仅鉴定到少量的麦芽糖和未知产物(图11a)。相比之下,gtfb有效地利用异麦芽糖作为受体底物产生大量的低聚糖,对应于用一系列葡萄糖单元延伸的异麦芽糖(异麦芽三糖、异麦芽四糖和异麦芽五糖)(图11b)。这种结果与gtfb产物中存在连续的α(1→6)键而在gtfd产物中不存在连续的α(1→6)键一致。
褐球固氮菌gtfd聚合物的酶促水解
为了进一步研究褐球固氮菌gtfd聚合物的性质并将其与由罗伊氏乳杆菌121gtfags合成的聚合物(罗伊糖)和由gtfb4,6-α-gt合成的聚合物(immp)进行比较,用高剂量的α-淀粉酶、葡聚糖酶和支链淀粉酶处理这3种α-葡聚糖(图12)。后续的tlc分析显示,gtfd聚合物、罗伊糖和immp对α-淀粉酶的内-α(1→4)-水解酶作用具有抗性,而淀粉被完全水解。在gtfd聚合物和罗伊糖消化的情况下,通过tlc仅检测到痕量的麦芽糖(图12a)。gtfd聚合物和罗伊糖对葡聚糖酶的内-α(1→6)-水解酶活性具有抗性,这再次证实了两种聚合物中不存在连续的α(1→6)键。然而,immp和葡聚糖被通过葡聚糖酶的作用完全降解(图12b)。在支链淀粉酶切割支链淀粉和支化多糖中交替的α(1→6)键的情况下,包括支链淀粉作为阳性对照。immp对支链淀粉酶处理具有抗性,这反映了仅在immp结构中存在连续的α(1→6)糖苷键。相比之下,支链淀粉酶有效地水解罗伊糖和gtfd聚合物,这与这些聚合物中交替的α(1→6)/α(1→4)和α(1→4,6)支化点的存在一致(图12c)。因此可以看出,ep2248907中描述的由罗伊氏乳杆菌121gtfb4,6-α-gt(immp)合成的聚合物含有连续的α(1→6)糖苷键,而不包含交替的α(1→6)键。hpaec分析能够在支链淀粉酶消化后鉴定由gtfd聚合物形成的反应产物,并且清楚地表明gtfd聚合物由通过α(1→6)键连接的麦芽糖、麦芽三糖和麦芽四糖元件组成(图13)。支链淀粉酶m1水解罗伊糖得到相同的低聚糖(vanleeuwen等人,2008a)。然而,在gtfd聚合物的情况下,还检测到了对应于麦芽五糖的附加小峰。综合来自nmr光谱和甲基化分析以及支链淀粉酶消化的所有数据,配制了复合结构(图14),所述复合结构包含相较于gtfa产物,观察到的gtfd产物的所有结构元件(vanleeuwen等人,2008a)。gtfa产物与gtfd产物之间的最值得注意的差异是gtfd产物的支化量更高并且α(1→6)键的量更低。这导致了包含较少交替α(1→4)/α(1→6)序列和更多直链α(1→4)序列的复合结构。如图14中所示,褐球固氮菌gtfd产物包含具有夹杂有α(1→6)糖苷键的α(1→4)连接的d-葡萄糖单元链的结构。
实施例2:用褐球固氮菌gtfd处理的糊化小麦淀粉的体外消化性
从小麦淀粉中产生褐球固氮菌gtfdα-葡聚糖
用小麦淀粉(sigmas5127)在水中制备0.6%悬浮液。将该悬浮液加热至90℃达10分钟以使淀粉糊化,随后冷却至37℃。向该糊化淀粉悬浮液中加入333μl的50mmcacl2溶液,然后加入283μl的褐球固氮菌gtfd(acgtfd)酶溶液(667μg酶/100mg淀粉)。将淀粉悬浮液在37℃温育24小时。温育后,将经处理的悬浮液在95℃加热6分钟以使acgtfd酶失活。最后,将经处理的淀粉悬浮液冻干以获得acgtfd产生的材料的粉末。
制备用于测定的消化酶
在10mmpbs溶液(ph6.8)中以40mg酶粉末/ml浓度提取来自猪胰腺的胰酶(sigmap7545)和来自大鼠的肠道丙酮粉末(sigmai1630)。将酶悬浮液涡旋混合并在冰水中超声处理7分钟。然后将经超声处理的悬浮液在4℃以10,000×g离心30分钟。收集上清液,并测量蛋白质含量以及酶活性。
消化酶制剂中的蛋白质含量测量
使用用于蛋白质测定的bca(二喹啉甲酸)试剂盒(sigmabca1-1kt)在从酶提取获得的上清液中进行蛋白质定量。将上清液稀释10倍,并在与bca试剂在37℃下反应30分钟后在分光光度计中于562nm波长下测量蛋白质含量。用牛血清白蛋白标准物制备标准曲线以计算总蛋白质含量。
消化酶活性的测量
在10mmpbs溶液(ph6.8)中制备来自马铃薯的1%可溶性淀粉溶液(sigmas2004)。将100μl1%可溶性淀粉溶液加入到100μl胰酶上清液或大鼠肠道丙酮粉末上清液中。将淀粉和酶的混合物在37℃下连续搅拌10分钟。随后将混合物煮沸10分钟以终止酶促反应。使混合物冷却后,将样品管以10,000×g离心10分钟,并使用autokitglucose(439-90901,wakodiagnostics)通过比色测定法测量葡萄糖。一个单位的酶活性被定义为从可溶性淀粉水解1μg葡萄糖所需的蛋白质量。
体外消化性测量
在10mmpbs(ph6.8)中制备acgtfd产生的材料的1%溶液。将300μl等分试样的溶液与酶溶液一起预热至37℃达5分钟。将每种消化酶的100个单位/毫克的acgtfd产物加入到样品管、标准品管和空白管中,一式三份。将样品管涡旋混合并在37℃连续搅拌下温育20分钟、60分钟和120分钟。在每个时间点之后,将0.5ml等分试样的样品转移到含有1.5ml90%含水乙醇的管中。将乙醇中的样品等分试样贮存在4℃直到准备进行葡萄糖定量。将样品等分试样以10,000×g离心10分钟,并使用autokitglucose(439-90901,wakodiagnostics)通过比色测定法测量葡萄糖。
1.结果
用acgtfd处理糊化小麦淀粉产生具有显著较低的体外消化率和体外消化程度的材料。如从图27可以看出,acgtfd处理(b)使在用猪胰酶和大鼠肠粉末温育120分钟后,糊化小麦淀粉的总消化性降低了30%。此外,acgtfd处理显著降低了在20分钟温育后由水解样品%所表示的快速消化淀粉的含量。
实施例3:由北京类芽孢杆菌编码的新型gh70蛋白的鉴定
通过在ncbi和img-er平台内进行blastp搜索,在北京类芽孢杆菌dsm24997的基因组中鉴定出了与褐球固氮菌gtfd同源的蛋白质。褐球固氮菌gtfd表现出在氨基酸序列方面与由北京类芽孢杆菌dsm24997(genbank登录号wp_052702730.1)编码的假定gh70酶48%的同一性。
对北京类芽孢杆菌gtfd酶的一级序列分析
所鉴定的北京类芽孢杆菌gtfd蛋白质序列由776个氨基酸组成并且含有根据gh70酶的细胞外位置推定的在氨基酸30与31之间的分泌信号肽酶切割位点。北京类芽孢杆菌gtfd的域布局类似于西伯利亚微小杆菌gtfc和褐球固氮菌gtfd酶,被认为是gh13与gh70家族之间的结构进化中间体(图2)。因此,这种酶显示出具有非变换的催化(β/α)8桶的gh13样域布置,但具有插入在域b中的额外域iv。与西伯利亚微小杆菌gtfc和褐球固氮菌gtfd类似,这种酶缺乏通常存在于gh70gs和gtfb同源物中的可变n末端域和域v。此外,在一些gtfc样蛋白的c-末端部分中鉴定出的ig2样域看起来不存在于北京类芽孢杆菌gtfd中,如在褐球固氮菌gtfd的情况中所观察到的。
在序列比对的基础上,鉴定出了北京类芽孢杆菌gtfd中gh-h族的四个保守区域,并将这些保守区域与对应于其他gh70蛋白的那些保守区域进行比较。根据非变换的域布局,这四个保守区域在北京类芽孢杆菌gtfd和褐球固氮菌gtfd中的顺序是i-ii-iii-iv,而不是gh70葡聚糖蔗糖酶和gtfb样4,6-α-gt酶的变换的顺序ii-iii-iv-i特征。在所有gh70家族成员的基序i至iv中完全保守的七种氨基酸残基也存在于这两种gtfd样蛋白中(图15)。在这七种残基中,催化三联体的亲核试剂、一般酸/碱和过渡态稳定剂分别被鉴定为北京类芽孢杆菌gtfd中的asp409、glu442和asp512(使用北京类芽孢杆菌gtfd编号)。
北京类芽孢杆菌gtfd酶的纯化和生化特性
将不具有肽信号序列(氨基酸31-776)的重组北京类芽孢杆菌gtfd以可溶形式高水平表达,并通过his标签亲和层析从大肠杆菌bl21star(de3)纯化至均质,从而产生50mg纯蛋白质/每升培养物。对纯酶的sds-page分析显示出现了单个约80kda的蛋白质条带(图16),这与从纯酶的氨基酸序列推断的预测分子量(85kda)一致。通过直链淀粉-碘测定法测定ph和温度对酶活性的影响(图17)。北京类芽孢杆菌的gtfd酶在ph7.0和50℃时表现出其最大的活性。报道了褐球固氮菌gtfd酶的较高最佳温度值(65℃),而两种gtfd酶之间不存在最佳ph值方面的显著差异。相比之下,从乳杆菌菌株鉴定出的gtfb4,6-α-gt酶已经被报道表现出显著更偏酸性的最适ph值4.5和5,这反映了它们对胃肠道的适应性。在含有1mmcacl2的ph7.0的25mm磷酸钠缓冲液中和50℃下,北京类芽孢杆菌gtfd的总比活性值为6.3±0.17umg-1,并且与褐球固氮菌gtfd(在ph6.5和50℃下)的总比活性值(即6.6±0.05umg-1)类似。因此,两种gtfd酶都表现出比针对罗伊氏乳杆菌gtfb和西伯利亚微小杆菌gtfc4,6-α-gt酶所测定的那些总比活性值显著更高的总比活性值,罗伊氏乳杆菌gtfb和西伯利亚微小杆菌gtfc4,6-α-gt酶的比活性值分别为2.8umg-1和2.2umg-1(在40℃下并且分别在ph5和6下)[j.gangoiti,t.pijning,l.dijkhuizen(2015年)]。
底物和产物特异性
通过将酶与不同碳水化合物底物一起在37℃下温育24小时来研究北京类芽孢杆菌gtfd的底物特异性(图18),并将该底物特异性与褐球固氮菌gtfd酶的底物特异性(图6)进行比较。北京类芽孢杆菌gtfd酶对蔗糖、潘糖、黑曲霉糖和具有dp2、dp3和dp5的异麦芽低聚糖无活性(数据未示出),与褐球固氮菌gtfd和其他4,6-α-gt酶类似。替代地,北京类芽孢杆菌gtfd酶催化dp3的麦芽低聚糖(mos)转化成dp7的mos,显示出了水解和转糖基酶(歧化)活性两者(图18)。事实上,将北京类芽孢杆菌gtfd与dp3至dp7的mos一起温育显示形成了较低分子量和较高分子量的产物。此外,以g4和较大的mos作为底物,也清楚地检测到了在tlc板的原点处残留的聚合物材料。然而,北京类芽孢杆菌gtfd不能作用于麦芽糖。在使用褐球固氮菌gtfd时观察到了类似的底物特异性(图6)。当直链淀粉v和支链淀粉用作底物时,观察到了两种gtfd酶之间的主要差异。如先前所报道,褐球固氮菌gtfd酶从这些聚合物底物积累g2和的一些低分子量低聚糖,这反映了褐球固氮菌gtfd酶的水解酶/歧化活性。相比之下,当探索北京类芽孢杆菌gtfd对直链淀粉和支链淀粉的活性时,这些低分子量产物不能通过tlc明确检测到。
对从直链淀粉v产生的产物混合物的1hnmr分析显示存在对应于α(1→4)(δ为约5.40至5.35)和新形成的α(1→6)键(δ为约4.97)的两个宽异头信号。(图19)。此1hnmr谱类似于通过褐球固氮菌gtfd处理从直链淀粉v得到的产物(图7a),表明两种gtfd酶具有相同的产物特异性。光谱还显示存在对应于游离葡萄糖单元(gαh-1,δ5.225;gβh-1,δ4.637)和4-取代的还原端葡萄糖残基(rαh-1,δ5.225;rβh-1,δ4.652)的小信号。这些信号在北京类芽孢杆菌gtfd产物混合物的情况下要小得多,反映了这种产物中仅存在痕量的葡萄糖、麦芽糖和其他小低聚糖,如先前通过tlc分析所观察到的。两种反应中α(1→4)连接的、α(1→6)连接的和还原的葡萄糖残基的摩尔比几乎相同,对于褐球固氮菌gtfd为72:26:2,并且对于北京类芽孢杆菌gtfd为75:25:<1。对由北京类芽孢杆菌gtfd从直链淀粉v合成的产物混合物的甲基化分析揭示,根据通过1hnmr测定的键比例,末端的、4-取代的、6-取代的、和4,6-二取代的吡喃葡萄糖残基以18%、54%、8%和20%的摩尔百分比存在。这种结果证实,北京类芽孢杆菌gtfd充当切割α(1→4)键并合成由α(1→4)和α(1→6)键组成的支化α-葡聚糖的4,6-α-葡聚糖转移酶。
使用多重检测通过hpsec对由北京类芽孢杆菌和褐球固氮菌gtfd酶从直链淀粉产生的产物的比较显示了它们的分子量分布的差异(图20)。将直链淀粉v与褐球固氮菌gtfd一起温育后,对应于具有小分子量(约200×103da)的直链淀粉的单峰消失并形成了两个新的峰:一个峰在约19ml洗脱,对应于平均mw为13×106的高分子量(hmm)聚合物,第二个峰在约34ml洗脱,对应于麦芽糖和其他小低聚糖。相比之下,由北京类芽孢杆菌gtfd从直链淀粉v合成的产物的hpsec谱显示存在两个主要的聚合物群体,而麦芽糖和其他小低聚糖没有显著积聚。除了在约19ml处洗脱并对应于mw为27×106da的hmm聚合物的早期峰之外,检测到了在约29ml洗脱并对应于mw为19×103的低分子量(lmm)聚合物的第二宽峰。hmm和lmm产物的合成可能是北京类芽孢杆菌gtfd中两种不同的持续性和非持续性延伸机制的结果。基于折射率响应,北京类芽孢杆菌gtfdhmm聚合物仅占总产物的很小百分比(少于20%),lmm聚合物是反应的主要产物。
由北京类芽孢杆菌gtfd酶从直链淀粉v产生的高分子量聚合物和低分子量聚合物的表征
为了更详细地表征,通过在sephadexs-200上进行尺寸排阻色谱分析来分离由北京类芽孢杆菌gtfd从直链淀粉v产生的hmm和lmm聚合物,并对所述聚合物进行1d/2d(1)h/(13)cnmr光谱。图21显示针对这两种多糖获得的1hnmr谱非常相似,显示出针对hmm聚合物的键比例α(1→4):α(1→6)=70:30并且针对lmm聚合物的键比例α(1→4):α(1→6)=76:23,这表明hmm聚合物中α(1→6)连接的葡萄糖残基的百分比略微增加。北京类芽孢杆菌gtfdα-葡聚糖的2dnmr数据与由褐球固氮菌gtfd和罗伊氏乳杆菌121gtfa葡聚糖蔗糖酶分别从直链淀粉和蔗糖的产生的罗伊糖型聚合物的2dnmr数据匹配(图22)。最值得注意的是,在北京类芽孢杆菌gtfdhmm(图22)和lmm(未示出)产物的2dnmr谱中未鉴定出对应于连续α(1→6)键的典型化学位移值。通过甲基化分析进一步证实了北京类芽孢杆菌gtfd产物的罗伊糖样结构,从而揭示了末端、4-取代、6-取代和4,6-二取代的吡喃葡萄糖基单元的存在(表4)。hmm北京类芽孢杆菌gtfd产物含有与由褐球固氮菌gtfd合成的罗伊糖样聚合物(表3)大致相似量的α(1→6)键,但是在6-取代和4,6-二取代的吡喃葡萄糖基残基方面略有不同。这产生了具有略低量(即14%而不是18%)的交替α(1→4)/α(1→6)糖苷键和较高量(21%而不是18%)的分支的罗伊糖样聚合物。与hmm北京类芽孢杆菌产物相比,lmm北京类芽孢杆菌产物呈现较低量的直链取向α(1→6)键,这由减少量(8%而不是14%)的6-取代吡喃葡萄糖基单元反映。
表4:由北京类芽孢杆菌gtfd酶从直链淀粉v合成的hmm和lmm聚合物的结构表征
a该数据表示在多糖的1hnmr谱中4.97ppm处的α(1→6)键信号和5.36ppm处的α(1→4)键信号的表面积积分的比率(参见图4)。b多糖的平均分子量是一式两份测定的。
为了获得对hmm和lmm北京类芽孢杆菌gtfd产物的碳水化合物结构的更深入了解,并将它们与褐球固氮菌gtfd的罗伊糖样聚合物和罗伊氏乳杆菌121gtfbimmp进行比较,将这些α-葡聚糖与不同的水解酶:α-淀粉酶、葡聚糖酶和支链淀粉酶m1一起温育48小时(图23)。对水解产物的检查显示,hmm北京类芽孢杆菌gtfd和褐球固氮菌gtfd聚合物部分地抗α-淀粉酶的内-α-1,4-水解酶活性。在这两种情况下,在α-淀粉酶消化48小时后仅检测到痕量的hmm低聚糖。然而,如由对应于聚合物材料的斑点强度降低以及hmm低聚糖的积聚所显示,北京类芽孢杆菌lmm产物看起来更易于受α-淀粉酶消化影响。此结果与lmm北京类芽孢杆菌gtfd产物与其hmm对应物相比降低的分子量和更低量的α(1→6)键明显相关。如先前所报道的,immpgtfb产物也抗α-淀粉酶的作用,而直链淀粉底物在相同条件下完全降解。北京类芽孢杆菌gtfd产物和褐球固氮菌gtfd都对葡聚糖酶的内-α-1,6-水解酶活性具有抗性,反映了在这些聚合物中没有连续的α(1→6)键。相比之下,含有α(1→6)连接的d-吡喃葡萄糖基重复单元的直链主链的immp和葡聚糖通过葡聚糖酶的作用被有效地水解。支链淀粉酶特异性地水解支链淀粉(pullulan)、支链淀粉(amylopectin)和其他4,6-支化的多糖的α(1→6)键。在用支链淀粉酶处理后,北京类芽孢杆菌gtfd和褐球固氮菌gtfd产物降解为较小的低聚糖,反映了这些聚合物中交替α(1→6)/α(1→4)和α(1→4,6)支化点的存在。immp不会因支链淀粉酶的作用而水解,这与immp不结构中直链α(1→6)链的存在一致。通过用hpaec分析在将hma和lmm聚合物与支链淀粉酶m1一起温育后形成的低聚糖(图24),获得了北京类芽孢杆菌gtfd产物的精确结构的更多细节。将hmm北京类芽孢杆菌gtfd聚合物与支链淀粉酶一起温育产生了至多到dp11的mos的混合物(图24a),而在lmm北京类芽孢杆菌gtfd聚合物的情况下,还鉴定出了对应于至多到dp14的mos的附加峰(图24b)。褐球固氮菌gtfd聚合物的消化导致形成dp为2至5的mos(图24c),并且证实了此α-葡聚糖由通过单个α(1→6)以直链或支链取向连接的麦芽糖、麦芽三糖、麦芽四糖和麦芽五糖单元组成。在hmm和lmm北京类芽孢杆菌gtfd产物的情况下,具有较高dp的mos的鉴定导致包含较长直链α(1→4)序列的结构。在lmm北京类芽孢杆菌gtfd多糖中,dp为6至10的的mos的大量存在解释了观察到的α-淀粉酶的作用对此聚合物的部分消化(图23a),该α-淀粉酶以内型方式切割α(1→4)连接的葡聚糖。
复合模型。
使用通过甲基化分析、nmr谱和酶消化研究获得的数据,可以构建复合模型,从而反映从hmm和lmm北京类芽孢杆菌gtfd产物观察到的所有主要结构元件(图25)。与褐球固氮菌gtfd产物相比,hmm的直链α(1→4)连接序列更长(在模型中高达dp6)并且lmm的直链α(1→4)连接序列甚至更长(在模型中高达dp7)。尽管在支链淀粉酶消化分析中观察到连续α(1→4)的较长直链dp(hmm的为dp11,并且lmm的为dp14),但是其含量太低而不能在复合模型中反映。对于褐球固氮菌gtfd产物,支链淀粉酶消化仅显示至多dp5的直链α(1→4)连接的序列。
由北京类芽孢杆菌gtfd酶从麦芽七糖随着时间推移形成的低聚糖
为了获得对北京类芽孢杆菌和褐球固氮菌gtfd酶的反应机理的更好了解,将这两种酶与麦芽七糖(g7)一起温育,并通过hpaec分析随时间推移形成的低聚糖(图26)。将g7(被g6和g5轻度污染)与北京类芽孢杆菌gtfd酶一起温育产生了g1、g2和对应于具有较高dp的未知结构化合物的两个峰,这两个峰在反应早期在53.5分钟和55.5分钟处洗脱(图26a)。还鉴定出了对应于g3的小峰,而g5和g6的量保持低。对dp为2至30的mos标准品的hpaec分析显示,未鉴定结构的这两个峰比麦芽十二糖(g12)和麦芽十三糖(g13)略早洗脱,表明结构具有为12和13的dp以及至少一个α(1→6)键。在释放的g5和g6中观察到的缺陷以及g1和g2的形成表明,北京类芽孢杆菌gtfd酶催化麦芽五糖基和麦芽六糖基部分转移至g7受体底物,从而产生两个未知峰(在53.5分钟和55.5分钟处洗脱的峰)。24小时后,由北京类芽孢杆菌gtfd酶最初形成的未知低聚糖消失,表明这些化合物可以随后用作供体和/或受体底物。当探索褐球固氮菌gtfd的活性时,g2、g3和在51.4分钟和53.5分钟处洗脱的具有高dp的两种未知化合物被检测为从g7形成的第一明确产物(图26b)。g2和在53.5分钟洗脱的峰的出现(这在北京类芽孢杆菌gtfd的情况下也被观察到)表明,褐球固氮菌gtfd也具有催化从g7进行麦芽五糖基转移反应的能力。与g4相比过量的g3,与在51.4分钟洗脱的峰的鉴定一起表明,褐球固氮菌gtfd也能够切割麦芽四糖基单元并将其转移至mos受体分子。最值得注意的是,对于褐球固氮菌gtfd,在反应的早期没有看到作为麦芽六糖基单元转移反应的副产物的g1的释放。与这种作用模式一致,褐球固氮菌gtfd对直链淀粉的活性导致合成由通过α(1→6)键连接的具有至多为5的dp的mos构成的罗伊糖样聚合物。北京类芽孢杆菌gtfd酶的转移较长葡聚糖链的偏好也由在其罗伊糖样产物结构中较长的直链α(1→4)序列的存在反映。总体而言,这些结果表明,这些gtfd型酶的活性位点的架构可以呈现不止一个供体结合亚位点,类似于进化相关的gh13和gh77家族的其他淀粉转换酶(16-18)。因此,这些gtfd酶具有转移mos单元的能力,与gs的不同处在于在每个反应周期严格转移单个葡萄糖单元。供体底物结合亚位点数量的差异可以解释在由北京类芽孢杆菌和褐球固氮菌gtfd酶转移的链长度方面观察到的差异。
实施例4:用褐球固氮菌gtfd或北京类芽孢杆菌gtfd处理过的直链淀粉的体外消化性
如上所述产生gtfdα-葡聚糖(参见“使用gtfd从直链淀粉温育产生的产物的产生和分析”部分)。
制备用于测定的消化酶
在10mmpbs溶液(ph6.8)中以40mg酶粉末/ml浓度提取来自猪胰腺的胰酶(sigmap7545)和来自大鼠的肠道丙酮粉末(sigmai1630)。将酶悬浮液涡旋混合并在冰水中超声处理7分钟。然后将经超声处理的悬浮液在4℃以10,000×g离心30分钟并单独收集上清液。
消化酶制剂中的蛋白质含量测量
使用用于蛋白质测定的bca(二喹啉甲酸)试剂盒(sigmabca1-1kt)在从酶提取获得的上清液中进行蛋白质定量。将上清液稀释10倍,并在与bca试剂在37℃下反应30分钟后在分光光度计中于562nm波长下测量蛋白质含量。用牛血清白蛋白标准物制备标准曲线以计算总蛋白质含量。
消化酶活性的测量
在10mmpbs溶液(ph6.8)中制备来自马铃薯的1%可溶性淀粉溶液(sigmas2004)。将100μl1%可溶性淀粉溶液分别加入到100μl胰酶上清液或大鼠肠道丙酮粉末上清液中。将淀粉和酶的混合物在37℃下连续搅拌10分钟。随后将混合物在100℃加热10分钟以终止酶促反应。使混合物冷却后,将样品管以10,000×g离心10分钟,并使用autokitglucose(439-90901,wakodiagnostics)通过比色测定法测量葡萄糖。一个单位的酶活性被定义为从可溶性淀粉水解1μg葡萄糖所需的蛋白质量。
体外消化性测量
将pbgtfd-hmm、pbgtfd-lmm、acgtfd-hmm、直链淀粉v以及糊化小麦淀粉的1%(w/v)溶液与100单位猪胰酶和大鼠肠粉提取物一起在10mmpbs(ph6.8)中,在37℃持续搅拌下以1.15ml总体积温育20、60和120分钟。在每个时间点后,随后将样品在100℃加热10分钟以停止酶促反应。使混合物冷却后,将样品管以10,000×g离心10分钟,并使用autokitglucose(439-90901,wakodiagnostics)通过比色测定法测量葡萄糖。
结果
从将直链淀粉v与pbgtfd和acgtfd酶一起温育获得的α-葡聚糖产物的体外消化性与糊化小麦淀粉相比,在消化率和消化程度方面都大大降低。如从图28可以看出,来自直链淀粉v温育的酶产物在与猪胰酶和大鼠肠粉末提取物一起温育120分钟后分别对acgtfd-hmm、pbgtfd-hmm和pb-gtfd-lmm具有仅10%、22%和30%的总消化性。尽管3种酶产物的初始速率(在20分钟时间点)是相当的,但显然两种高分子量的α-葡聚糖的消化性均低于北京类芽孢杆菌gtfd低分子量产物。所有的α-葡聚糖产物的消化性都低于直链淀粉v(未标出)。
总体结论
在此项研究中,我们报道了褐球固氮菌ncimb8003的gtfd酶的表征,提供了革兰氏阴性细菌中家族gh70酶的第一个示例。关于氨基酸序列和域布局,这种酶与西伯利亚微小杆菌255-15gtfc密切相关,它是在非乳酸菌细菌中存在的最近鉴定的新型gh70亚家族的第一特征性成员(gangoiti等人,2015年)。gtfc型酶被认为是家族gh13与gh70之间的进化中间体,表现出对麦芽低聚糖和直链淀粉/淀粉的4,6-α-葡聚糖转移酶活性,如先前针对乳杆菌的gtfb型酶发现的。西伯利亚微小杆菌gtfc酶活性导致合成异麦芽/麦芽低聚糖,所述异麦芽/麦芽低聚糖由附接到mos或淀粉片段的非还原端的直链α(1→6)-葡聚糖链组成。相比之下,褐球固氮菌gtfd酶不能合成连续的α(1→6)键并且将直链淀粉v转化成具有交替α(1→4)与α(1→6)糖苷键以及具有α(1→4,6)支化点的α-葡聚糖。由直链淀粉v产生的gtfd聚合物因此与由罗伊氏乳杆菌gtfa葡聚糖蔗糖酶从蔗糖产生的罗伊糖更相似(kralj等人,2004年;vanleeuwen等人,2008a;dobruchowska等人,2013年)。
褐球固氮菌gtfd是迄今为止报道的首个能够从直链淀粉和/或淀粉合成罗伊糖样聚合物的酶。这种gtfd酶不同于其他淀粉转化酶,诸如仅引入α(1→6)支化点的家族gh13和gh57支化酶(grimaud等人,2014年;palomo等人,2011年)或合成连续的α(1→6)键的家族gh15糊精糊精酶(naessens等人,2005年)。在功能上,褐球固氮菌gtfd在其聚合机理上也不同于罗伊氏乳杆菌121gtfb和西伯利亚微小杆菌gtfc,因为其在每个反应循环中优先转移低聚糖(可见于图10中)而不是单个葡萄糖单元。鉴于此特征,预测褐球固氮菌gtfd中的活性位点布局呈现不止一个供体底物结合亚位点,与gh13α-淀粉酶类似。总体而言,褐球固氮菌gtfd酶为家族gh13与gh70酶之间的独特进化中间体(图2),其大大扩展了我们关于家族gh70成员的天然多样性的知识。
褐球固氮菌gtfd酶代表了将食物基质中存在的淀粉转化为促进健康的食物成分的有力工具。事实上,罗伊糖已经描述为有价值的食物成分,被认为是膳食纤维。由于罗伊糖的高度支化的结构,罗伊糖抗上消化道中的酶降解并最终在大肠中被结肠菌群充分发酵。此外,看起来罗伊糖增强人类或动物的饱腹感(ekhart等人,2006年),并且可以用作面包改良剂(plijter等人,2009年)。这种褐球固氮菌gtfd罗伊糖样聚合物的体内作用是未知的。已经提出,eps为细胞提供保护,防止因原生动物或噬菌体攻击导致的干燥和捕食(flemming和wingender,2010年)。早期研究报道,褐球固氮菌菌株ncimb8003和nrrlb-14341产生至少两种胞外多糖,一种类似藻酸酯,另一种类似杂多糖(lawson和stacey,1954年;cote等人,1988年)。褐球固氮菌nrrlb-14341在淀粉上生长后,分离出相同的胞外多糖(cote等人,1988年)。在棕色固氮菌(a.vinelandii)中的研究表明,藻酸酯是孢囊形成的必要条件(nunez等人,1999年),并且在保护负责固氮的o2敏感固氮酶方面起作用(sabra等人,2000年)。褐球固氮菌gtfd可能具有相关的生理功能。
我们还报道了北京类芽孢杆菌dsm24997的gtfd酶的表征,所述北京类芽孢杆菌dsm24997的gtfd酶为另一种能够从直链淀粉和/或淀粉合成罗伊糖样聚合物的酶。鉴于褐球固氮菌gtfd对直链淀粉的活性导致除了麦芽糖和其他小低聚糖之外还合成高分子量聚合物,所以由北京类芽孢杆菌gtfd产生了两种罗伊糖样聚合物分布:一种是平均mw为27mda的高分子量聚合物,另一种是平均mw为19000da的低分子量聚合物。此外,北京类芽孢杆菌gtfd能够比褐球固氮菌对应物转移更长的mos单元,从而产生含有更长的直链α(1→4)序列的罗伊糖样聚合物。从体外消化性研究来看,所有这些聚合物都表现出较低的消化酶消化性,从而为这些酶在降低淀粉类产品的血糖指数方面的应用提供了强有力的支持。
参考文献
y.bai,r.m.vanderkaaij,a.j.woortman,z.jin,l.dijkhuizen(2015a)“characterizationofthe4,6-α-glucanotransferasegtfbenzymeoflactobacillusreuteri121isolatedfrominclusionbodies。”bmcbiotechnol.15:49.doi10.1186/s12896-015-0163-7
y.bai,r.m.vanderkaaij,h.leemhuis,s.s.vanleeuwen,z.jin,l.dijkhuizen(2015b)-“biochemicalcharacterizationoflactobacillusreuteriglycosidehydrolasefamily70gtfbtypeof4,6-α-glucanotransferaseenzymesthatsynthesizesolubledietarystarchfibers。”applenvironmicrobiol.,出版。
k.bath,s.roos,t.wall,h.jonsson(2005)-“thecellsurfaceoflactobacillusreuteriatcc55730highlightedbyidentificationof126extracellularproteinsfromthegenomesequence。”femsmicrobiollett253:75-82。
y.brison,t.pijning,y.malbert,e.fabre,l.mourey,s.morel,g.potocki-véronèse,p.monsan,s.tranier,m.remaud-siméon,b.w.dijkstra(2012)-“functionalandstructuralcharacterizationofanα-(1-2)branchingsucrasederivedfromdsr-eglucansucrase。”jbiolchem.287:7915-7924。
g.l.cote,l.h.krull(1988)-“characterizationoftheexocellularpolysaccharidesfromazotobacterchroococcum。”carbohydrres.181:143-152。
j.m.dobruchowska,g.j.gerwig,s.kralj,p.grijpstra,h.leemhuis,l.dijkhuizen,j.p.kamerling.2012。“structuralcharacterizationoflinearisomalto-/malto-oligomerproductssynthesizedbythenovelgtfb4,6-alpha-glucanotransferaseenzymefromlactobacillusreuteri121。”glycobiology22:517-528。
j.m.dobruchowska,x.meng,h.leemhuis,g.j.gerwig,l.dijkhuizen,j.p.kamerling(2013)-“gluco-oligomersinitiallyformedbythereuteransucraseenzymeoflactobacillusreuteri121incubatedwithsucroseandmalto-oligosaccharides。”glycobiology23:1084-1096。
l.dijkhuizen,m.j.e.c.vandermaarel,j.p.kamerling,r.j.leemhuis,s.kralj,j.m.dobruchowska(2010)-“glucooligosaccharidescomprising(alpha1->4)and(alpha1->6)glycosidicbonds,usethereof,andmethodsforproducingthem。”ep2427565b1。
p.ekhart,g.h.vangeel-schutten,m.vanbinsbergen,e.timmerman(2006)-“branchedalpha-glucansforweightmanagement。”us20060100171a1。
h.c.flemming,j.wingender(2010)-“thebiofilmmatrixsource。”natrevmicrobiol.8:623-633。
j.gangoiti,t.pijning,l.dijkhuizen(2015)-“biochemicalcharacterizationoftheexiguobacteriumsibiricum255-15gtfcenzymerepresentinganovelglycosidehydrolase70subfamilyof4,6-α-glucanotransferaseenzymes。”applenvironmicrobiol.,提交。
f.grimaud,c.lancelon-pin,a.rolland-sabaté,x.roussel,s.laguerre,
a.
k.ito,s.ito,t.shimamura,s.weyand,y.kawarasaki,t.misaka,k.abe,t.kobayashi,a.d.cameron,s.iwata(2011)-“crystalstructureofglucansucrasefromthedentalcariespathogenstreptococcusmutans。”jbiolchem.408:177-186。
s.kralj,pgrijpstra,s.s.vanleeuwen,h.leemhuis,j.m.dobruchowska,r.m.vanderkaaij,a.malik,a.oetari,j.p.kamerling,l.dijkhuizen(2011)-“4,6-alpha-glucanotransferase,anovelenzymethatstructurallyandfunctionallyprovidesanevolutionarylinkbetweenglycosidehydrolaseenzymefamilies13and70.”applenvironmicrobiol.77:8154-8163。
s.kralj,g.h.vangeel-schutten,h.rahaoui,r.j.leer,e.j.faber,m.j.vandermaarel,dijkhuizenl.(2002)-“molecularcharacterizationofanovelglucosyltransferasefromlactobacillusreuteristrain121synthesizingaunique,highlybranchedglucanwithalpha-(1→4)andalpha-(1→6)glucosidicbonds”applenvironmicrobiol.68:4283-4291。
s.kralj,g.h.vangeel-schutten,m.j.e.c.vandermaarelandl.dijkhuizen(2004)-“biochemicalandmolecularcharacterizationoflactobacillusreuteri121reuteransucrase。”microbiology150:2099-2112。
s.kralj,e.stripling,p.sanders,g.h.vangeel-schutten,l.dijkhuizen(2005)-“highlyhydrolyticreuteransucrasefromprobioticlactobacillusreuteristrainatcc55730。”applenvironmicrobiol.71:3942-3950。
g.l.lawson,m.stacey(1954)“immunopolysaccharides.i.preliminarystudiesofapolysaccharidefromazotobacterchroococcumcontaininganuronicacid。”jchemsoc.1954:1925-1931。
h.leemhuis,w.p.dijkman,j.m.dobruchowska,t.pijning,p.grijpstra,s.kralj,j.p.kamerling,l.dijkhuizen(2013)-“4,6-α-glucanotransferaseactivityoccursmorewidespreadinlactobacillusstrainsandconstitutesaseparategh70subfamily。”applmicrobiolbiotechnol.97:181-193。
h.leemhuis,j.m.dobruchowska,m.ebbelaar,f.faber,p.l.buwalda,m.j.e.c.vandermaarel,j.p.kamerling,l.dijkhuizen(2014)-“isomalto/maltopolysaccharide,anovelsolubledietaryfibermadeviaenzymaticconversionofstarch。”jagricfoodchem.62:12034-12044。
v.lombard,h.golacondaramulu,e.drula,p.m.coutinho,b.henrissat(2014)-“thecarbohydrate-activeenzymesdatabase(cazy)in2013。”nucleicacidsres.42:d490-495。
e.a.macgregor,s.janecek,b.svensson.(2001)-“relationshipofsequenceandstructuretospecificityinthealpha-amylasefamilyofenzymes。”biochimbiophysacta1546:1-20。
e.a.macgregor,h.m.jespersen,b.svensson(1996)-“acircularlypermutedalpha-amylase-typealpha/beta-barrelstructureinglucan-synthesizingglucosyltransferases。”febslett.378:263-266。
x.meng,j.m.dobruchowska,t.pijning,c.a.lópez,j.p.kamerling,l.dijkhuizen(2014)“residueleu940hasacrucialroleinthelinkageandreactionspecificityoftheglucansucrasegtf180oftheprobioticbacteriumlactobacillusreuteri180。”jbiolchem.289:32773-32782。
x.meng,j.m.dobruchowska,t.pijning,g.j.gerwig,j.p.kamerlingandl.dijkhuizen(2015)-“truncationofdomainvofthemultidomainglucansucrasegtf180oflactobacillusreuteri180heavilyimpairsitspolysaccharide-synthesizingability。”applmicrobiolbiotechnol.99:5885-5894。
m.naessens,a.cerdobbel,w.soetaert,e.j.vandamme(2005)-“dextrandextrinaseanddextranofgluconobacteroxydans。”jindmicrobiolbiotechnol.32:323-334。
c.nunez,s.moreno,g.soberon-chavez,g.espin(1999)-“theazotobactervinelandiiresponseregulatoralgrisessentialforcystformation。”jbacteriol.181:141-148。
m.palomo,t.pijning,t.booiman,j.m.dobruchowska,j.vandervlist,s.kralj,a.planas,k.loos,j.p.kamerling,b.w.dijkstra,m.j.vandermaarel,l.dijkhuizen,h.leemhuis(2011)-“thermusthermophilusglycosidehydrolasefamily57branchingenzyme:crystalstructure,mechanismofaction,andproductsformed。”jbiolchem.286:3520-3530。
t.pijning,a.vujicic-zagar,s.kralj,l.dijkhuizen,b.w.dijkstra(2012)-“structureoftheα-1,6/α-1,4-specificglucansucrasegtfafromlactobacillusreuteri121。”actacrystf.68:1448-1454。
j.plijter,a.jurgens,m.p.kats,m.w.j.noort,c.e.a.heddes,g.h.vangeelschutten(2009)“breadimprover”us20090297663a1。
r.l.robson,r.jones,r.m.robson,a.schwartz,t.h.richardson(2015)-“azotobactergenomes:thegenomeofazotobacterchroococcumncimb8003(atcc4412)。”plosone;10:e0127997.doi:10.1371/journal.pone。
r.l.robson,j.a.chesshyre,c.wheeler,r.jones,p.r.woodley,j.r.postgate(1984)-“genomesizeandcomplexityinazotobacterchroococcum。”jgenmicrobiol.130:1603-1612。
r.l.robson(1986)-“nitrogenfixationinstrainsofazotobacterchroococcumbearingdeletionsofaclusterofgenescodingfornitrogenase。”archmicrobiol.146:74-79。
w.sabra,a.p.zeng,h.lünsdorf,w.d.deckwer(2000)-“effectofoxygenonformationofazotobactervinelandiialginateanditsroleinprotectingnitrogenase。”applenvironmicrobiol.66:4037-4044。
m.r.stam,e.g.danchin,c.rancurel,p.m.coutinho,b.henrissat,(2006)-“dividingthelargeglycosidehydrolasefamily13intosubfamilies:towardsimprovedfunctionalannotationsofalpha-amylase-relatedproteins。”proteinengdessel.19:555-562。
k.tamura,g.stecher,d.peterson,a.filipski,s.kumar(2013)-“mega6:molecularevolutionarygeneticsanalysisversion6.0。”molbiolevol.30:2725-2729。
s.a.f.t.vanhijum,s.kralj,l.k.ozimek,l.dijkhuizen,g.h.vangeel-schutten(2006)-“structure-functionrelationshipsofglucansucraseandfructansucraseenzymesfromlacticacidbacteria。”microbiolmolbiolrev.70:157-176。
s.s.vanleeuwen,s.kralj,w.eeuwema,g.j.gerwig,l.dijkhuizen,andj.p.kamerling(2009)-“structuralcharacterizationofbioengineeredalpha-d-glucansproducedbymutantglucansucrasegtf180enzymesoflactobacillusreuteristrain180。”biomacromol.10:580-588。
s.s.vanleeuwen,s.kralj,g.h.vangeel-schutten,g.gerwig,l.dijkhuizen,j.p.kamerling(2008a)-“structuralanalysisofthealpha-d-glucan(eps35-5)producedbythelactobacillusreuteristrain35-5glucansucrasegtfaenzyme。”carbohydrres.343:1251-1265。
s.s.vanleeuwen,s.kralj,i.h.vangeel-schutten,g.j.gerwig,l.dijkhuizen,j.p.kamerling(2008b)-“structuralanalysisoftheα-d-glucan(eps180)producedbythelactobacillusreuteristrain180glucansucrasegtf180enzyme。”carbohydrres.343:1237-1250。
.j.c.uitdehaag,g.j.vanalebeek,b.a.vanderveen,l.dijkhuizen,b.w.dijkstra.(2000)-“structuresofmaltohexaoseandmaltoheptaoseboundatthedonorsitesofcyclodextringlycosyltransferasegiveinsightintothemechanismsoftransglycosylationactivityandcyclodextrinsizespecificity。”biochemistry39:7772-7780。
s.a.f.t.vanhijum,s.kralj,l.k.ozimek,l.dijkhuizen,g.h.vangeel-schutten(2006)-“structure-functionrelationshipsofglucansucraseandfructansucraseenzymesfromlacticacidbacteria。”microbiolmolbiolrev.70:157-176。
a.
a.m.waterhouse,j.b.procter,d.m.a.martin,m.clamp,g.j.barton(2009)-jalview第2版-“amultiplesequencealignmenteditorandanalysisworkbench。”bioinformatics.25:1189-1191。
- 还没有人留言评论。精彩留言会获得点赞!