基于人RNA聚合酶I系统的肠道病毒68型微复制子体系及其构建方法与流程
本发明属于生物工程领域,更具体的,本发明公开了一种基于人RNA聚合酶I(hPolI)系统的肠道病毒68型微复制子的构建及应用。
背景技术:
肠道病毒68型(EV-D68)属于小RNA病毒科(Picornaradae)肠道病毒属(Enterovirus)的成员,归属于人类肠道病毒D组。EV-D68基因组为单股正链RNA,长度约为7.5Kb,由单一的开放读码框(ORF)及其两侧非翻译区(5’UTR和3’UTR)构成。EV-D68基因组编码一条多聚蛋白,该蛋白被病毒自身编码的蛋白酶水解为Pl、P2和P3三种前体蛋白,其中P1被进一步加工成病毒的结构蛋白VPl~VP4;P2和P3被加工成7个非结构蛋白。
自1962年首次发现后,该病毒的分离鉴定罕有报道。1970-2005年间,在美国只有26例临床分离株被报道,占所有报道的EV家族病例的0.1%,流行病学数据极其有限。然而近年来,日本(2005-2010),中国(2006-2012),泰国(2006-2011),意大利(2008-2009),英国(2008-2010),肯尼亚(2008-2011),法国(2009),菲律宾(2009-2011),美国(2009-2010),新西兰(2010),荷兰(2010)都有EV-D68爆发,而且出现严重的呼吸困难,四肢瘫痪为主要症状的重症患者,甚至发现死亡的病例。患者的主要年龄群集中在一岁到四岁的儿童,但有近四分之一的感染者为成年人。因此推断,随着检测数据的增加,EV-D68最终可能被认定为全年龄组的呼吸系统病原体。因此,EV-D68引起国际卫生组织的广泛关注。但是,目前仍缺乏特效的治疗手段。因此继续深入开展相关研究,如病毒的分子生物学特征、复制机制、致病机理,将有利于人类更加全面透彻的了解EV-D68,从而设计有效的药物、准确的诊断方法以及良好的疫苗提供理论依据。
随着分子生物学的不断发展,科学家可以通过反向遗传学的手段定向改造病毒,为深入开展相关病毒的研究提供了良好的工具。
病毒微复制子是将部分的病毒基因组替换为报告基因的病毒cDNA结构。由于微复制子结构简单且为DNA形式,可方便的用于对RNA病毒顺式作用元件和反式作用蛋白质的分析,也可用于抗病毒药物的筛选。微复制子本身安全无危害,不需要特殊的实验场所和设备,为不同实验室研究病毒复制相关机制提供了一个工具。
目前,单链正股RNA病毒反向遗传系统一般基于T7 RNA聚合酶来实现,将病毒cDNA克隆于T7启动子下游,通过体外转录的方法,获得病毒的RNA,再将病毒RNA转染细胞以获得重组病毒。这种方法费时费力,并且在操作过程中有对cDNA体外转录、RNA提纯的过程,易被RNA酶污染,造成实验失败。pHH21质粒上带有人RNA聚合酶I(hPolI)启动子,可以在细胞中直接诱导转录,省去了体外转录的过程,大大节省了操作步骤。
目前尚未有对EV-D68微复制子构建的报道。
技术实现要素:
为了解决现有技术中存在的问题,本发明提供一种基于Pol1系统的肠道病毒68型微复制子体系及其构建方法及其应用,克服现有技术中传统的病毒感染系统时间长,病毒滴度检测繁琐,精确度低的问题。
本发明的技术方案为:一种基于Pol1系统的肠道病毒68型微复制子体系的构建方法,包括以下步骤:
(1)合成EV-D68Fermon病毒株的5’UTR cDNA;所述Fermon的5’UTR核苷酸序列如SEQ ID NO:1所示;
(2)以步骤(1)得到的cDNA为模板,以SEQ ID NO:2和SEQ ID NO:3为引物,PCR扩增得到肠道病毒68型毒株Fermon的5’UTR片段;
(3)以实验室保存pGL3-basic质粒为模板,以SEQ ID NO:4和SEQ ID NO:5为引物,PCR扩增得到萤火虫荧光素酶(Firefly Luciferase,f-Luc)基因片段;
(4)以步骤(2)得到的PCR产物和步骤(3)得到的PCR产物为模板,以SEQ ID NO:6和SEQ ID NO:7为引物进行overlapping-PCR扩增;回收混合PCR产物;
(5)以步骤(4)得到的PCR产物为模板,以SEQ ID NO:6和SEQ ID NO:8为引物进行PCR扩增;回收PCR产物;
(6)Pst1和Not1双酶切经步骤(5)得到的PCR产物和载体,连接,转化,筛选阳性克隆;
(7)以步骤(6)得到的阳性克隆为模板,以SEQ ID NO:9和SEQ ID NO:10为引物,PCR扩增,PCR产物经DpnI酶37℃处理30分钟,转化感受态大肠杆菌DH5α,筛选获得无BsmB1酶切位点的f-Luc微复制子片段;
(8)以步骤(7)得到的无BsmB1酶切位点的f-Luc微复制子为模板,以SEQ ID NO:11和SEQ ID NO:12为引物,PCR扩增得到带有BsmB1酶切位点的f-Luc微复制子;
(9)BsmB1酶切步骤(8)得到的PCR产物和载体,连接,转化,筛选阳性克隆,即为RNA聚合酶I系统的肠道病毒68型f-Luc微复制子:pHH21-EV-D68-f-Luc;
(10)以步骤(9)得到的pHH21-EV-D68-f-Luc为模板,以SEQ ID NO:13和SEQ ID NO:14为引物,PCR扩增,PCR产物经DpnI酶37℃处理30分钟,转化感受态大肠杆菌DH5α,得到5’UTR 108-207碱基缺失的EV-D68微复制子突变体:pHH21-EV-D68Δ180-207-f-Luc。
在其中一个实例中,步骤(4)中所述overlapping-PCR的程序为95℃30s,53℃30s,72℃1.5min,五个循环,之后95℃30s,53℃30s,72℃1min,25个循环。
在其中一个实例中,步骤(6)所述载体为VR1012载体。
在其中一个实例中,步骤(9)所述载体为pHH21载体。
在其中一个实例中,步骤(7)和(10)中所述PCR的程序为95℃20s,55℃20s,72℃5min,18个循环。
一种基于RNA聚合酶I系统的肠道病毒68型微复制子体系的构建方法得到的肠道病毒68型微复制子体系。
本发明还提供了包含上述微复制子的宿主细胞,所述宿主细胞为大肠埃希氏菌(Escherichia coli)DH5α;
本发明的有益效果是:本发明合成肠道病毒68型毒株Fermon5,-UTR基因,采用重叠PCR技术,建立了带有萤火虫荧光素酶f-Luc报告基因的EV D68微复制子报告系统,可以定性和定量检测萤火虫荧光素酶表达情况以模拟EV D68复制和蛋白表达;获得的微复制子在转染细胞24小时就可以检测到明显的报告荧光,是一个稳定、安全的荧光报告体系;获得的微复制子不会产生完整的病毒,可以在普通实验室进行实验检测,为针对EV D68病毒的复制机制研究以及疫苗、药物的研发提供了一个简单、快速、安全、灵敏的检测平台。
本发明是基于人RNA聚合酶I(hPolI)系统来实现的,hPolI是人的RNA聚合酶I,通过这个系统可以在细胞中直接将DNA转录为RNA,从而使得病毒RNA在细胞内直接产生,无需体外转录先合成病毒RNA,再将病毒RNA转染细胞,节省实验步骤和试剂,避免RNA污染,极大简化实验流程。本发明使用的pHH21质粒带有hPolI序列以及mTer序列,hPolI为人的RNA聚合酶I启动子,用来启动微复制子的转录;mTer为鼠源终止子,是给予RNA聚合酶I转录终止信号的DNA序列。
附图说明
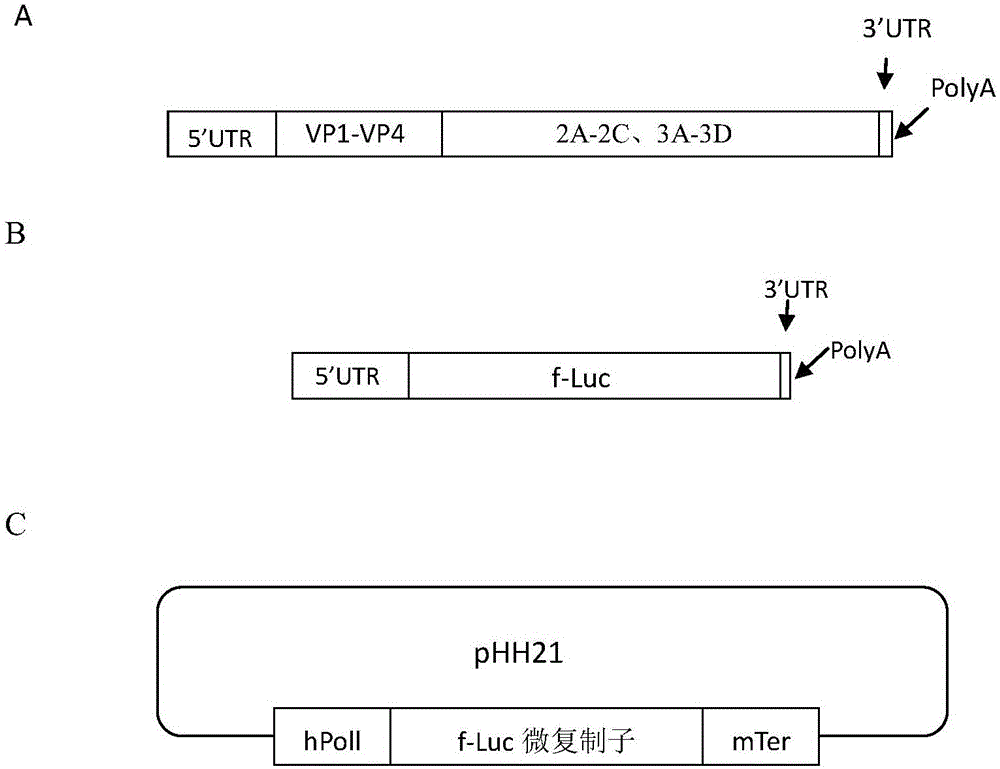
图1中A为EV-D68基因组结构示意图,B为微复制子结构示意图,C为微复制子在pHH21质粒中位置示意图(hPol1为人Pol1启动子,mTer为45S RNA终止子);
图2为微复制子全长PCR结果;
图3中A为转染293T细胞24h单报告检测结果,B为转染RD细胞24h单报告检测结果;
图4中A和B分别为微复制子和微复制子突变体的RNA结构预测图(mfold软件预测)。
具体实施方式
下面结合实施例对本发明进一步说明。
以下实施例仅用于说明本说明,但不用来限制本发明的包含范围,所属领域技术人员应该明白,在本发明的技术方案的基础上,本领域技术人员不需要付出创造性劳动即可做出的各种修改或变形人在本发明的保护范围内。若未特别指明,实施例中所用的技术手段为本领域技术人员所熟知的常规手段,所用原料均为市售商品。
1材料与方法
1.1实验材料
1.1.1细胞
所用细胞为人横纹肌肉瘤细胞(rhabdomyosarcoma cells,RD,ATCC No.CCL-136),人胚肾细胞(Human Embryonic Kidney 293T cells,293T,ATCC No.CRL-3216)。
1.1.2实验试剂
所用主要试剂为DNA胶回收试剂盒和质粒提取试剂盒(QIAGEN公司);高保真酶TransStart Fastpfu DNA Polymerase、Dpn1酶(Transgen公司);限制性内切酶、转染试剂、细胞培养基(Thermo公司);血清(Gbico公司);基因与引物合成以及测序由苏州GENEWIZ公司完成。
2实施例
实施例1 EV D68F-Luc微复制子的构建
1、扩增引物的设计与合成
从genebank中选取EV D68Fermon毒株的基因组序列,根据基因组5’UTR序列,设计EV D68Fermon的保守引物5’UTR F2、5’UTR R和5’UTR F1,根据f-Luc基因序列和Fermon基因组序列,设计f-Luc的引物f-Luc F和f-Luc R1、f-Luc R2、f-Luc R3,由GENEWIZ公司合成。具体引物序列如下:
5’UTR F1:5’-aaaactgcagttaatacgactcactataggttaaaacagctctg-3’(SEQ ID NO:6)
5’UTR F2:5’-gactcactataggttaaaacagctctggggttgttcccac tc-3’(SEQ ID NO:2)
5’UTR R::5’-gtttttggcgtcttccattgttataaataagtttaaac-3’(SEQ ID NO:3)
f-Luc F:5’-gtttaaacttatttataacaatggaagacgccaaaaac-3’(SEQ ID NO:4)
f-Luc R1:5’-gaaagtaactgtaacttgggtttcaattagagttatttacacggcgatctttccgcc-3’(SEQ ID NO:5)
f-Luc R2:5’-ggtccccaagtgaccaaaatttacctctaagtgaaagtaactgtaacttgggtttc-3’(SEQ ID NO:7)
f-Luc R3:5’-ttttccttttgcggccgctttttttttttttttttttttttttggtccccaagtgaccaaaatttac-3’(SEQ ID NO:8)
G394C F:5’-ctcatggtgaaaaccatcagacgctagacatgaac-3’(SEQ ID NO:9)
G394C R:5’-gttcatgtctagcgtctgatggttttcaccatgag-3’(SEQ ID NO:10)
pHH21F:5’-atcggtctcctattttaaaacagctctggggttg-3’(SEQ ID NO:11)
pHH21R:5’-atcgcgtctccgggatttttttttttttttttttttttttggtccccaagtgaccaaaatttacc-3’(SEQ ID NO:12)
5’UTR 180-207F:5’-gagcaagcacttctgtctacggttgaaaacaactta-3’(SEQ ID NO:13)
5’UTR 180-207R:5’-taagttgttttcaaccgtagacagaagtgcttgctc-3’(SEQ ID NO:14)
2、PCR扩增与克隆
得到公司合成的病毒基因组5’UTR cDNA后,PCR扩增的引物为正向引物5’UTR F2和反向引物5’UTR R,按照TransStart Fastpfu DNA Polymerase(Transgen公司)说明书构建50μL反应体系,扩增得到EV D68的5’UTR片段。
以实验室保存pcDNA3.1-f-Luc质粒为模板,f-Luc F和f-Luc R1为引物,扩增得到f-Luc片段,再用f-LUC F和f-Luc R2为引物,扩增得到PCR产物,最后以F-Luc F和f-Luc R3为引物,扩增得到f-Luc-3’UTR片段。
以得到的5’UTR片段和f-Luc-3’UTR片段,5’UTR F1和f-Luc R3为引物,overlapping-PCR扩增得到完整的f-Luc微复制子片段(5’UTR-f-Luc-3’UTR-polyA)(如图2所示)。
将f-Luc微复制子片段与VR1012质粒进行Pst1和Not1双酶切,酶切片段回收后,进行T4连接获得VR1012-f-Luc微复制子。
以VR1012-f-Luc微复制子为模板,利用G394C F和G394C R引物进行点突变,使5’UTR区的BsmB1酶切位点消失。
以突变后的VR1012-f-Luc微为模板,pHH21 F和pHH21 R为引物,扩增得到带有BsmB1酶切位点的f-Luc微复制子片段。
将带有BsmB1酶切位点的f-Luc微复制子片段与pHH21质粒进行BsmB1酶切,酶切片段回收,连接,转化,获得EV-D68微复制子:pHH21-EV-D68-f-Luc(如图1所示)。
实施例2 EV-D68微复制子突变体构建。
经mfold软件分析发现5UTR 180-207缺失会使RNA结构发生变化(如图4所示),因此突变5UTR 180-207区域可能会使5UTR功能发生变化。以pHH21-EV-D68-f-Luc为模板,5UTR 180-207 F(SEQ ID NO:13)和5UTR 180-207 R(SEQ ID NO:14)为引物,PCR反应,条件如下:95℃20s,55℃20s,72℃5min,18个循环。PCR产物经DpnI酶37℃处理30分钟,转化感受态大肠杆菌DH5α,获得5’UTR 108-207碱基缺失的EV-D68微复制子突变体:pHH21-EV-D68Δ180-207-f-Luc。
实施例3 EV-D68微复制子活性检测
使用PEI转染试剂将1μg pHH21、EV-D68微复制子和EV-D68微复制子突变体分别转染细胞。转染24或48小时后,收集转染细胞,用PBS轻轻漂洗两次,每孔加入500μLPBS吹起细胞并收集到离心管中。取100μL上清液加入96孔板。按照Luciferase Assay System(Promeg,Cat No:N1120)说明书操作步骤,使用LB960多功能检测仪检测荧光素酶数值,分析firefly luciferase数据,获得报告基因活化值(如图3所示)。
实施例4 EV-D68 5’UTR RNA二级结构预测
使用mfold软件(网址)对微复制子和微复制子突变体的RNA结构进行预测。
序列表
<110> 天津大学
<120> 基于RNA 聚合酶I系统的肠道病毒68型微复制子的构建及应用
<130>
<160> 14
<170> PatentIn version 3.3
<210> 1
<211> 732
<212> DNA
<213> 人工序列
<400> 1
ttaaaacagc tctggggttg ttcccactca agggcccacg tggcggctag tactctggta 60
tctcggtacc tttgtacgcc tgttttaatt ccctccccaa cgtaacttag aagcttttaa 120
accaaagctc aataggtgga gcgcaaacca gcgctcttat gagcaagcac ttctgtctcc 180
ccggtgtggt tgtatagact gtccccacgg ttgaaaacaa cttatccgtt aaccgctata 240
gtacttcgag aaacctagta ttgccttcgg agtgttgatg cgttgcgctc agcacactaa 300
cccgtgtgta gcttgggtcg atgagtctgg acgtacccca ctggcgacag tggtccaggc 360
tgcgttggcg gcctactcat ggtgaaaacc atgagacgct agacatgaac aaggtgtgaa 420
gagtctattg agctgctata gagtcctccg gcccctgaat gcggctaatc ctaaccatgg 480
agcaagtgct cacaaaccag tgagttactt gtcgtaacgc gcaagtccgt ggcggaaccg 540
actactttgg gtgtccgtgt ttcacttttt acttttatga ctgctaatgg tgacaattta 600
atattgttac catttggctt gtcgaattga tcacataaga tctatagttt tgttcactga 660
tttgctttga aataatctca cctcaaaacc tccagtacat aacatttaaa gagtttaaac 720
ttatttataa ca 732
<210> 2
<211> 42
<212> DNA
<213> 人工序列
<400> 2
gactcactat aggttaaaac agctctgggg ttgttcccac tc 42
<210> 3
<211> 38
<212> DNA
<213> 人工序列
<400> 3
gtttttggcg tcttccattg ttataaataa gtttaaac 38
<210> 4
<211> 38
<212> DNA
<213> 人工序列
<400> 4
gtttaaactt atttataaca atggaagacg ccaaaaac 38
<210> 5
<211> 57
<212> DNA
<213> 人工序列
<400> 5
gaaagtaact gtaacttggg tttcaattag agttatttac acggcgatct ttccgcc 57
<210> 6
<211> 44
<212> DNA
<213> 人工序列
<400> 6
aaaactgcag ttaatacgac tcactatagg ttaaaacagc tctg 44
<210> 7
<211> 56
<212> DNA
<213> 人工序列
<400> 7
ggtccccaag tgaccaaaat ttacctctaa gtgaaagtaa ctgtaacttg ggtttc 56
<210> 8
<211> 67
<212> DNA
<213> 人工序列
<400> 8
ttttcctttt gcggccgctt tttttttttt tttttttttt tttggtcccc aagtgaccaa 60
aatttac 67
<210> 9
<211> 35
<212> DNA
<213> 人工序列
<400> 9
ctcatggtga aaaccatcag acgctagaca tgaac 35
<210> 10
<211> 35
<212> DNA
<213> 人工序列
<400> 10
gttcatgtct agcgtctgat ggttttcacc atgag 35
<210> 11
<211> 34
<212> DNA
<213> 人工序列
<400> 11
atcggtctcc tattttaaaa cagctctggg gttg 34
<210> 12
<211> 65
<212> DNA
<213> 人工序列
<400> 12
atcgcgtctc cgggattttt tttttttttt tttttttttt ggtccccaag tgaccaaaat 60
ttacc 65
<210> 13
<211> 36
<212> DNA
<213> 人工序列
<400> 13
gagcaagcac ttctgtctac ggttgaaaac aactta 36
<210> 14
<211> 36
<212> DNA
<213> 人工序列
<400> 14
taagttgttt tcaaccgtag acagaagtgc ttgctc 36
- 还没有人留言评论。精彩留言会获得点赞!