本发明涉及氟化工技术领域,更具体地说,是涉及一种5-三氟甲基-5,6-二氢尿嘧啶的制备方法。
背景技术:
5-三氟甲基-5,6-二氢尿嘧啶是许多药物合成的起始原料,特别是很多尿嘧啶化合物的重要中间体,目前已发现其含有抗肿瘤活性,而国内未见报道此化合物的合成方法,国外也仅有少量文献报道其合成方法,因此开发一条5-三氟甲基-5,6-二氢尿嘧啶合成的工业路线具有很重要的意义。
目前,现有技术中合成5-三氟甲基-5,6-二氢脲嘧啶的路线较少,主要有:
(1)专利US3201387公开了以2-三氟甲基丙烯腈为原料,先与氢溴酸反应合成β-溴-α-三氟甲基丙酰胺,再与尿素反应得到单取代的氮-(α-三氟甲基丙酰胺)-尿素,最后经水解环化得到5-三氟甲基-5,6-二氢尿嘧啶,多步综合收率为14%;具体反应方程如下:
(2)文献Fuchikami T,Ojima I.Tetrahedron Letters,1982,23(40):4099-4100公开了以双三苯基膦氯化钯为催化剂,使用二甲基酰胺(DMF)作为溶剂,在三乙胺存在下,2-溴-1,1,1-三氟丙烯、尿素及CO在4.5MPa下反应18小时,合成5-三氟甲基-5,6-二氢尿嘧啶,产率为26%;具体反应方程如下:
(3)专利US4581452公开了以2-三氟甲基丙烯酸为原料,使用DMF作为溶剂,先与尿素进行加成反应,得到(2-羧基-3,3,3-三氟丙基)-尿素,再滴加二环己基碳二亚胺(DCC)的DMF溶液脱水环化,得到5-三氟甲基-5,6-二氢尿嘧啶,收率为35%;具体反应方程如下:
同时,在此专利中,还以醋酸酐作溶剂,采用2-三氟甲基丙烯酸和尿素反应,得到5-三氟甲基-5,6-二氢尿嘧啶,收率为40%;具体反应方程如下:
上述方法主要存在以下缺点:方法(1)路线反应收率较低,工业价值较小;方法(2)不仅收率较低,同时反应压力较高,对设备要求较高,并且CO在如此高压下使用、采购储运都存在一定的安全隐患;方法(3)虽然收率有所提高,但是需要在90℃以上进行反应,会造成2-三氟甲基丙烯酸聚合,造成损失,环化过程会产生难以分离的未知杂质,另外醋酸酐属于易制毒管制物品,商业获得途径较窄,不利于大规模生产使用。
因此,上述制备5-三氟甲基-5,6-二氢尿嘧啶的方法收率较低,工艺复杂,均存在较大的局限性,难以满足工业化生产的需要。
技术实现要素:
有鉴于此,本发明的目的在于提供一种5-三氟甲基-5,6-二氢尿嘧啶的制备方法,本发明提供的制备方法收率高、成本低,且合成路线简单,适合工业化生产。
本发明提供了一种5-三氟甲基-5,6-二氢尿嘧啶的制备方法,包括以下步骤:
a)将2-三氟甲基丙烯酸和溴化氢在溶剂中进行加成反应,得到3-溴-2-三氟甲基丙烯酸;
b)将步骤a)得到的3-溴-2-三氟甲基丙烯酸和氨水混合,进行氨化反应,得到3-氨基-2-三氟甲基丙酸;
c)将步骤b)得到的3-氨基-2-三氟甲基丙酸和氰酸盐在酸溶液中进行缩合反应,得到5-三氟甲基-5,6-二氢尿嘧啶。
优选的,步骤a)中所述2-三氟甲基丙酸和溴化氢的摩尔比为1:(1~3)。
优选的,步骤a)中所述溶剂为己烷、环己烷、二氯甲烷、三氯甲烷、醋酸和乙醇中的一种或多种。
优选的,步骤a)中所述加成反应的温度为-40℃~40℃,时间为3h~15h。
优选的,步骤b)中所述3-溴-2-三氟甲基丙烯酸和氨水的摩尔比为1:(1~8)。
优选的,步骤b)中所述氨化反应的温度为50℃~150℃,时间为1h~24h。
优选的,步骤c)中所述3-氨基-2-三氟甲基丙酸和氰酸盐的摩尔比为1:(1~5)。
优选的,步骤c)中所述氰酸盐为氰酸钠、氰酸钾、氰酸铵和氰酸银中的一种或多种。
优选的,步骤c)中所述缩合反应的温度为80℃~150℃,时间为0.5h~8h。
优选的,所述步骤c)还包括:
将缩合反应后得到的反应产物进行重结晶,得到5-三氟甲基-5,6-二氢尿嘧啶;
所述重结晶所用的重结晶溶剂为水、甲醇、乙醇、甲苯、正己烷、二氯甲烷和二甲基亚砜中的一种或多种。
本发明提供了一种5-三氟甲基-5,6-二氢尿嘧啶的制备方法,包括以下步骤:a)将2-三氟甲基丙烯酸和溴化氢在溶剂中进行加成反应,得到3-溴-2-三氟甲基丙烯酸;b)将步骤a)得到的3-溴-2-三氟甲基丙烯酸和氨水混合,进行氨化反应,得到3-氨基-2-三氟甲基丙酸;c)将步骤b)得到的3-氨基-2-三氟甲基丙酸和氰酸盐在酸溶液中进行缩合反应,得到5-三氟甲基-5,6-二氢尿嘧啶。与现有技术相比,本发明提供的制备方法以2-三氟甲基丙烯酸为起始原料,依次经过溴化氢加成、氨水氨化及氰酸盐缩合得到目标产物,技术路线简单、反应条件温和、原料常规成本低,适合工业化生产;并且,采用本发明提供的制备方法能够大大提高产品收率。实验结果表明,本发明提供的制备方法得到的5-三氟甲基-5,6-二氢尿嘧啶的总收率能够达到73%以上。
附图说明
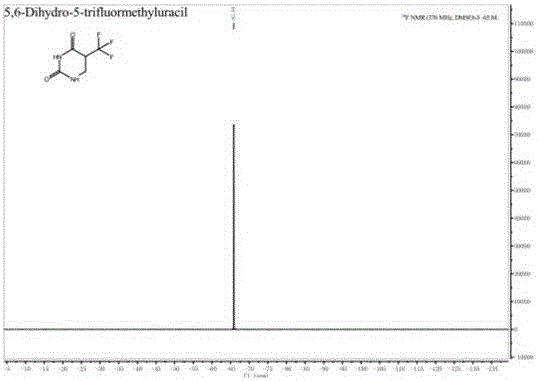
图1为本发明实施例1制备得到的5-三氟甲基-5,6-二氢尿嘧啶的氢谱谱图;
图2为本发明实施例1制备得到的5-三氟甲基-5,6-二氢尿嘧啶的氟谱谱图。
具体实施方式
下面将结合本发明实施例,对本发明的技术方案进行清楚、完整地描述,显然,所描述的实施例仅仅是本发明一部分实施例,而不是全部的实施例。基于本发明中的实施例,本领域普通技术人员在没有做出创造性劳动前提下所获得的所有其他实施例,都属于本发明保护的范围。
本发明提供了一种5-三氟甲基-5,6-二氢尿嘧啶的制备方法,包括以下步骤:
a)将2-三氟甲基丙烯酸和溴化氢在溶剂中进行加成反应,得到3-溴-2-三氟甲基丙烯酸;
b)将步骤a)得到的3-溴-2-三氟甲基丙烯酸和氨水混合,进行氨化反应,得到3-氨基-2-三氟甲基丙酸;
c)将步骤b)得到的3-氨基-2-三氟甲基丙酸和氰酸盐在酸溶液中进行缩合反应,得到5-三氟甲基-5,6-二氢尿嘧啶。
本发明首先将2-三氟甲基丙烯酸和溴化氢在溶剂中进行加成反应,得到3-溴-2-三氟甲基丙烯酸。在本发明中,所述2-三氟甲基丙烯酸具有式(I)所示结构:
本发明对所述2-三氟甲基丙烯酸和溴化氢的来源没有特殊限制,采用本领域技术人员熟知的市售商品即可。
在本发明中,所述溶剂优选为己烷、环己烷、二氯甲烷、三氯甲烷、醋酸和乙醇中的一种或多种,更优选为二氯甲烷和/或三氯甲烷。本发明对所述溶剂的来源没有特殊限制,采用本领域技术人员熟知的上述己烷、环己烷、二氯甲烷、三氯甲烷、醋酸和乙醇的市售商品即可。
在本发明中,首先将2-三氟甲基丙烯酸、溴化氢和溶剂进行混合,所述混合的过程优选具体为:
将2-三氟甲基丙烯酸和溶剂混合均匀,再将气态溴化氢缓慢通入上述反应体系;本发明采用上述混合方式,能够使反应原料在溶剂中更好的进行反应。在本发明中,所述2-三氟甲基丙酸和溴化氢的摩尔比优选为1:(1~3),更优选为1:(1.2~1.5)。
在本发明中,所述加成反应的温度优选为-40℃~40℃,更优选为0℃~25℃;所述加成反应的时间优选为3h~15h,更优选为12h~14h。在本发明一个优选的实施例中,首先将2-三氟甲基丙烯酸和溶剂混合均匀,然后控制温度为0℃,再将气态溴化氢缓慢通入上述反应体系,反应1h后,停止冷却,自然恢复室温继续反应12h,完成加成反应过程;在本发明另一个优选的实施例中,首先将2-三氟甲基丙烯酸和溶剂混合均匀,然后控制温度为40℃,再将气态溴化氢缓慢通入上述反应体系,反应1h后,停止升温,自然恢复室温继续反应12h,完成加成反应过程。
完成所述加成反应后,本发明采用本领域技术人员熟知的旋蒸过程回收溶剂,得到3-溴代-2-三氟甲基丙酸,本发明对此没有特殊限制。在本发明中,所述3-溴代-2-三氟甲基丙酸具有式(II)所示结构:
得到所述3-溴代-2-三氟甲基丙酸后,本发明将得到的3-溴-2-三氟甲基丙烯酸和氨水混合,进行氨化反应,得到3-氨基-2-三氟甲基丙酸。在本发明中,所述氨化反应优选在氮气保护条件下进行;所述氮气保护条件优选在上述混合过程时开始设置。在本发明中,所述3-溴-2-三氟甲基丙烯酸和氨水的摩尔比优选为1:(1~8),更优选为1:(5~6)。
在本发明中,所述氨化反应的过程优选在密闭反应系统中进行,本发明对此没有特殊限制,如可采用本领域技术人员熟知的反应釜。在本发明中,所述氨化反应的温度优选为50℃~150℃,更优选为80℃~150℃;所述氨化反应的时间优选为1h~24h,更优选为2h~8h。
完成所述氨化反应后,本发明将物料放出,采用本领域技术人员熟知的冷却结晶、过滤、干燥过程,得到3-氨基-2-三氟甲基丙酸,本发明对此没有特殊限制。在本发明中,所述3-氨基-2-三氟甲基丙酸具有式(III)所示结构:
得到所述3-氨基-2-三氟甲基丙酸后,本发明将得到的3-氨基-2-三氟甲基丙酸和氰酸盐在酸溶液中进行缩合反应,得到5-三氟甲基-5,6-二氢尿嘧啶。在本发明中,所述氰酸盐优选为氰酸钠、氰酸钾、氰酸铵和氰酸银中的一种或多种,更优选为氰酸钠和/氰酸钾。本发明对所述氰酸盐的来源没有特殊限制,采用本领域技术人员熟知的上述氰酸钠、氰酸钾、氰酸铵和氰酸银的市售溶液即可。
在本发明中,所述酸溶液优选为醋酸溶液、硫酸溶液、硝酸溶液和盐酸溶液中的一种或多种,更优选为硝酸溶液和/或盐酸溶液。在本发明一个优选的实施例中,所述酸溶液为质量浓度为20%的浓盐酸;在本发明另一个优选的实施例中,所述酸溶液为质量浓度为20%的浓硝酸。
在本发明中,首先将3-氨基-2-三氟甲基丙酸、氰酸盐和酸溶液进行混合,所述混合的过程优选具体为:
将3-氨基-2-三氟甲基丙酸和酸溶液混合均匀,再将氰酸盐溶液滴加入上述反应体系;本发明采用上述混合方式,能够使反应原料在酸溶液中更好的进行反应。本发明优选将滴加时间控制在1h以内。在本发明中,所述3-氨基-2-三氟甲基丙酸和氰酸盐的摩尔比优选为1:(1~5),更优选为1:(1.5~2)。
在本发明中,所述缩合反应的温度优选为80℃~150℃,更优选为100℃;所述缩合反应的时间优选为0.5h~8h,更优选为2h~4h。
完成所述缩合反应后,本发明采用本领域技术人员熟知的冷却结晶、过滤干燥过程,得到5-三氟甲基-5,6-二氢尿嘧啶粗品,本发明对此没有特殊限制。
得到所述5-三氟甲基-5,6-二氢尿嘧啶粗品后,本发明优选还包括:
将缩合反应后得到的反应产物进行重结晶,得到5-三氟甲基-5,6-二氢尿嘧啶。在本发明中,所述重结晶所用的重结晶溶剂优选为水、甲醇、乙醇、甲苯、正己烷、二氯甲烷和二甲基亚砜中的一种或多种,更优选为水和/或乙醇。在本发明中,所述3-氨基-2-三氟甲基丙酸和重结晶溶剂的摩尔比优选为1:(5~26),更优选为1:10。
在本发明中,所述5-三氟甲基-5,6-二氢尿嘧啶具有式(IV)所示结构:
本发明提供了一种5-三氟甲基-5,6-二氢尿嘧啶的制备方法,包括以下步骤:a)将2-三氟甲基丙烯酸和溴化氢在溶剂中进行加成反应,得到3-溴-2-三氟甲基丙烯酸;b)将步骤a)得到的3-溴-2-三氟甲基丙烯酸和氨水混合,进行氨化反应,得到3-氨基-2-三氟甲基丙酸;c)将步骤b)得到的3-氨基-2-三氟甲基丙酸和氰酸盐在酸溶液中进行缩合反应,得到5-三氟甲基-5,6-二氢尿嘧啶。与现有技术相比,本发明提供的制备方法以2-三氟甲基丙烯酸为起始原料,依次经过溴化氢加成、氨水氨化及氰酸盐缩合得到目标产物,技术路线简单、反应条件温和、原料常规成本低,适合工业化生产;并且,采用本发明提供的制备方法能够大大提高产品收率。实验结果表明,本发明提供的制备方法得到的5-三氟甲基-5,6-二氢尿嘧啶的总收率能够达到73%以上。
为了进一步说明本发明,下面通过以下实施例进行详细说明。以下实施例中所用的原料均为市售商品。
实施例1
(1)将56.0g(0.40mol)2-三氟甲基丙烯酸和120mL三氯甲烷加入250mL四口反应瓶中,在机械搅拌下混合均匀,然后将反应瓶降温至0℃,在流量计控制下缓慢通入溴化氢气体38.9g(0.48mol),气体通完后,继续反应1h,然后停止冷却,自然恢复室温继续反应12h,旋蒸回收溶剂后,得到3-溴代-2-三氟甲基丙酸84.0g;收率为95%,纯度为98.5%。
(2)氮气保护下,将88.4g(0.4mol)3-溴代-2-三氟甲基丙酸缓慢倒入反应釜,再加入300mL(2.16mol)氨水,密闭反应系统,将反应釜温度升至80℃,并在80℃保温反应4h,反应结束后将物料放出,冷却结晶、过滤、干燥,得到3-氨基-2-三氟甲基丙酸60.8g;收率为98%,纯度为99.2%。
(3)将62.0g(0.4mol)3-氨基-2-三氟甲基丙酸、80.3g(0.44mol)质量浓度为20%的浓盐酸加入500mL三口反应瓶,将反应瓶温度升至100℃,再将195g(0.6mol)质量浓度为20%的氰酸钠溶液在1h内滴加入反应瓶,滴加完毕后,保温反应3h,然后冷却结晶、过滤干燥,得到5-三氟甲基-5,6-二氢尿嘧啶粗品,最后经过184g(4.0mol)无水乙醇重结晶,得到白色5-三氟甲基-5,6-二氢尿嘧啶晶体56.8g;收率为78%,纯度为99.9%。
计算得到5-三氟甲基-5,6-二氢尿嘧啶的总收率为73%。
采用BRUKER AVANCE-500型核磁共振仪对本发明实施例1制备得到的5-三氟甲基-5,6-二氢尿嘧啶分别进行氢谱和氟谱的分析,结果如图1~2所示,其中,图1为本发明实施例1制备得到的5-三氟甲基-5,6-二氢尿嘧啶的氢谱谱图;图2为本发明实施例1制备得到的5-三氟甲基-5,6-二氢尿嘧啶的氟谱谱图。由图1~2可知,本发明实施例1制备得到的产品为5-三氟甲基-5,6-二氢尿嘧啶。
实施例2
(1)将56.0g(0.40mol)2-三氟甲基丙烯酸和120mL三氯甲烷加入250mL四口反应瓶中,在机械搅拌下混合均匀,然后将反应瓶降温至0℃,在流量计控制下缓慢通入溴化氢气体38.9g(0.48mol),气体通完后,继续反应1h,然后停止冷却,自然恢复室温继续反应12h,旋蒸回收溶剂后,得到3-溴代-2-三氟甲基丙酸84.0g;收率为95%,纯度为98.5%。
(2)氮气保护下,将88.4g(0.4mol)3-溴代-2-三氟甲基丙酸缓慢倒入反应釜,再加入300mL(2.16mol)氨水,密闭反应系统,将反应釜温度升至80℃,并在80℃保温反应2h,反应结束后将物料放出,冷却结晶、过滤、干燥,得到3-氨基-2-三氟甲基丙酸50.9g;收率为82%,纯度为98.5%。
(3)将62.0g(0.4mol)3-氨基-2-三氟甲基丙酸、80.3g(0.44mol)质量浓度为20%的浓盐酸加入500mL三口反应瓶,将反应瓶温度升至100℃,再将195g(0.6mol)质量浓度为20%的氰酸钠溶液在1h内滴加入反应瓶,滴加完毕后,保温反应3h,然后冷却结晶、过滤干燥,得到5-三氟甲基-5,6-二氢尿嘧啶粗品,最后经过184g(4.0mol)无水乙醇重结晶,得到白色5-三氟甲基-5,6-二氢尿嘧啶晶体56.8g;收率为78%,纯度为99.9%。
计算得到5-三氟甲基-5,6-二氢尿嘧啶的总收率为61%。
实施例3
(1)将56.0g(0.40mol)2-三氟甲基丙烯酸和120mL三氯甲烷加入250mL四口反应瓶中,在机械搅拌下混合均匀,然后将反应瓶降温至0℃,在流量计控制下缓慢通入溴化氢气体38.9g(0.48mol),气体通完后,继续反应1h,然后停止冷却,自然恢复室温继续反应12h,旋蒸回收溶剂后,得到3-溴代-2-三氟甲基丙酸84.0g;收率为95%,纯度为98.5%。
(2)氮气保护下,将88.4g(0.4mol)3-溴代-2-三氟甲基丙酸缓慢倒入反应釜,再加入300mL(2.16mol)氨水,密闭反应系统,将反应釜温度升至80℃,并在80℃保温反应8h,反应结束后将物料放出,冷却结晶、过滤、干燥,得到3-氨基-2-三氟甲基丙酸61.0g;收率为98%,纯度为99.0%。
(3)将62.0g(0.4mol)3-氨基-2-三氟甲基丙酸、80.3g(0.44mol)质量浓度为20%的浓盐酸加入500mL三口反应瓶,将反应瓶温度升至100℃,再将195g(0.6mol)质量浓度为20%的氰酸钠溶液在1h内滴加入反应瓶,滴加完毕后,保温反应3h,然后冷却结晶、过滤干燥,得到5-三氟甲基-5,6-二氢尿嘧啶粗品,最后经过184g(4.0mol)无水乙醇重结晶,得到白色5-三氟甲基-5,6-二氢尿嘧啶晶体56.8g;收率为78%,纯度为99.9%。
计算得到5-三氟甲基-5,6-二氢尿嘧啶的总收率为73%。
实施例4
(1)将56.0g(0.40mol)2-三氟甲基丙烯酸和120mL三氯甲烷加入250mL四口反应瓶中,在机械搅拌下混合均匀,然后将反应瓶降温至0℃,在流量计控制下缓慢通入溴化氢气体38.9g(0.48mol),气体通完后,继续反应1h,然后停止冷却,自然恢复室温继续反应12h,旋蒸回收溶剂后,得到3-溴代-2-三氟甲基丙酸84.0g;收率为95%,纯度为98.5%。
(2)氮气保护下,将88.4g(0.4mol)3-溴代-2-三氟甲基丙酸缓慢倒入反应釜,再加入300mL(2.16mol)氨水,密闭反应系统,将反应釜温度升至150℃,并在150℃保温反应4h,反应结束后将物料放出,冷却结晶、过滤、干燥,得到3-氨基-2-三氟甲基丙酸46.5g;收率为75%,纯度为98.1%。
(3)将62.0g(0.4mol)3-氨基-2-三氟甲基丙酸、80.3g(0.44mol)质量浓度为20%的浓盐酸加入500mL三口反应瓶,将反应瓶温度升至100℃,再将195g(0.6mol)质量浓度为20%的氰酸钠溶液在1h内滴加入反应瓶,滴加完毕后,保温反应3h,然后冷却结晶、过滤干燥,得到5-三氟甲基-5,6-二氢尿嘧啶粗品,最后经过184g(4.0mol)无水乙醇重结晶,得到白色5-三氟甲基-5,6-二氢尿嘧啶晶体56.8g;收率为78%,纯度为99.9%。
计算得到5-三氟甲基-5,6-二氢尿嘧啶的总收率为56%。
实施例5
(1)将56.0g(0.40mol)2-三氟甲基丙烯酸和120mL三氯甲烷加入250mL四口反应瓶中,在机械搅拌下混合均匀,然后将反应瓶升温至40℃,在流量计控制下缓慢通入溴化氢气体38.9g(0.48mol),气体通完后,继续反应1h,然后停止升温,自然恢复室温继续反应12h,旋蒸回收溶剂后,得到3-溴代-2-三氟甲基丙酸75.1g;收率为85%,纯度为98.6%。
(2)氮气保护下,将88.4g(0.4mol)3-溴代-2-三氟甲基丙酸缓慢倒入反应釜,再加入300mL(2.16mol)氨水,密闭反应系统,将反应釜温度升至80℃,并在80℃保温反应4h,反应结束后将物料放出,冷却结晶、过滤、干燥,得到3-氨基-2-三氟甲基丙酸60.8g;收率为98%,纯度为99.2%。
(3)将62.0g(0.4mol)3-氨基-2-三氟甲基丙酸、80.3g(0.44mol)质量浓度为20%的浓盐酸加入500mL三口反应瓶,将反应瓶温度升至100℃,再将195g(0.6mol)质量浓度为20%的氰酸钠溶液在1h内滴加入反应瓶,滴加完毕后,保温反应3h,然后冷却结晶、过滤干燥,得到5-三氟甲基-5,6-二氢尿嘧啶粗品,最后经过184g(4.0mol)无水乙醇重结晶,得到白色5-三氟甲基-5,6-二氢尿嘧啶晶体56.8g;收率为78%,纯度为99.9%。
计算得到5-三氟甲基-5,6-二氢尿嘧啶的总收率为65%。
实施例6
(1)将56.0g(0.40mol)2-三氟甲基丙烯酸和120mL二氯甲烷加入250mL四口反应瓶中,在机械搅拌下混合均匀,然后将反应瓶降温至0℃,在流量计控制下缓慢通入溴化氢气体38.9g(0.48mol),气体通完后,继续反应1h,然后停止冷却,自然恢复室温继续反应12h,旋蒸回收溶剂后,得到3-溴代-2-三氟甲基丙酸81.3g;收率为92%,纯度为98.0%。
(2)氮气保护下,将88.4g(0.4mol)3-溴代-2-三氟甲基丙酸缓慢倒入反应釜,再加入300mL(2.16mol)氨水,密闭反应系统,将反应釜温度升至80℃,并在80℃保温反应4h,反应结束后将物料放出,冷却结晶、过滤、干燥,得到3-氨基-2-三氟甲基丙酸60.8g;收率为98%,纯度为99.2%。
(3)将62.0g(0.4mol)3-氨基-2-三氟甲基丙酸、80.3g(0.44mol)质量浓度为20%的浓盐酸加入500mL三口反应瓶,将反应瓶温度升至100℃,再将195g(0.6mol)质量浓度为20%的氰酸钠溶液在1h内滴加入反应瓶,滴加完毕后,保温反应3h,然后冷却结晶、过滤干燥,得到5-三氟甲基-5,6-二氢尿嘧啶粗品,最后经过184g(4.0mol)无水乙醇重结晶,得到白色5-三氟甲基-5,6-二氢尿嘧啶晶体56.8g;收率为78%,纯度为99.9%。
计算得到5-三氟甲基-5,6-二氢尿嘧啶的总收率为70%。
实施例7
(1)将56.0g(0.40mol)2-三氟甲基丙烯酸和120mL三氯甲烷加入250mL四口反应瓶中,在机械搅拌下混合均匀,然后将反应瓶降温至0℃,在流量计控制下缓慢通入溴化氢气体48.5g(0.6mol),气体通完后,继续反应1h,然后停止冷却,自然恢复室温继续反应12h,旋蒸回收溶剂后,得到3-溴代-2-三氟甲基丙酸79.5g;收率为90%,纯度为98.2%。
(2)氮气保护下,将88.4g(0.4mol)3-溴代-2-三氟甲基丙酸缓慢倒入反应釜,再加入300mL(2.16mol)氨水,密闭反应系统,将反应釜温度升至80℃,并在80℃保温反应4h,反应结束后将物料放出,冷却结晶、过滤、干燥,得到3-氨基-2-三氟甲基丙酸60.8g;收率为98%,纯度为99.2%。
(3)将62.0g(0.4mol)3-氨基-2-三氟甲基丙酸、80.3g(0.44mol)质量浓度为20%的浓盐酸加入500mL三口反应瓶,将反应瓶温度升至100℃,再将195g(0.6mol)质量浓度为20%的氰酸钠溶液在1h内滴加入反应瓶,滴加完毕后,保温反应3h,然后冷却结晶、过滤干燥,得到5-三氟甲基-5,6-二氢尿嘧啶粗品,最后经过184g(4.0mol)无水乙醇重结晶,得到白色5-三氟甲基-5,6-二氢尿嘧啶晶体56.8g;收率为78%,纯度为99.9%。
计算得到5-三氟甲基-5,6-二氢尿嘧啶的总收率为69%。
实施例8
(1)将56.0g(0.40mol)2-三氟甲基丙烯酸和120mL三氯甲烷加入250mL四口反应瓶中,在机械搅拌下混合均匀,然后将反应瓶降温至0℃,在流量计控制下缓慢通入溴化氢气体38.9g(0.48mol),气体通完后,继续反应1h,然后停止冷却,自然恢复室温继续反应12h,旋蒸回收溶剂后,得到3-溴代-2-三氟甲基丙酸84.0g;收率为95%,纯度为98.5%。
(2)氮气保护下,将88.4g(0.4mol)3-溴代-2-三氟甲基丙酸缓慢倒入反应釜,再加入300mL(2.16mol)氨水,密闭反应系统,将反应釜温度升至80℃,并在80℃保温反应4h,反应结束后将物料放出,冷却结晶、过滤、干燥,得到3-氨基-2-三氟甲基丙酸60.8g;收率为98%,纯度为99.2%。
(3)将62.0g(0.4mol)3-氨基-2-三氟甲基丙酸、80.3g(0.44mol)质量浓度为20%的浓硝酸加入500mL三口反应瓶,将反应瓶温度升至100℃,再将195g(0.6mol)质量浓度为20%的氰酸钠溶液在1h内滴加入反应瓶,滴加完毕后,保温反应3h,然后冷却结晶、过滤干燥,得到5-三氟甲基-5,6-二氢尿嘧啶粗品,最后经过184g(4.0mol)无水乙醇重结晶,得到白色5-三氟甲基-5,6-二氢尿嘧啶晶体45.2g;收率为62%,纯度为99.9%。
计算得到5-三氟甲基-5,6-二氢尿嘧啶的总收率为58%。
实施例9
(1)将56.0g(0.40mol)2-三氟甲基丙烯酸和120mL三氯甲烷加入250mL四口反应瓶中,在机械搅拌下混合均匀,然后将反应瓶降温至0℃,在流量计控制下缓慢通入溴化氢气体38.9g(0.48mol),气体通完后,继续反应1h,然后停止冷却,自然恢复室温继续反应12h,旋蒸回收溶剂后,得到3-溴代-2-三氟甲基丙酸84.0g;收率为95%,纯度为98.5%。
(2)氮气保护下,将88.4g(0.4mol)3-溴代-2-三氟甲基丙酸缓慢倒入反应釜,再加入300mL(2.16mol)氨水,密闭反应系统,将反应釜温度升至80℃,并在80℃保温反应4h,反应结束后将物料放出,冷却结晶、过滤、干燥,得到3-氨基-2-三氟甲基丙酸60.8g;收率为98%,纯度为99.2%。
(3)将62.0g(0.4mol)3-氨基-2-三氟甲基丙酸、80.3g(0.44mol)质量浓度为20%的浓盐酸加入500mL三口反应瓶,将反应瓶温度升至100℃,再将195g(0.6mol)质量浓度为20%的氰酸钠溶液在1h内滴加入反应瓶,滴加完毕后,保温反应3h,然后冷却结晶、过滤干燥,得到5-三氟甲基-5,6-二氢尿嘧啶粗品,最后经过186g(10.3mol)水重结晶,得到白色5-三氟甲基-5,6-二氢尿嘧啶晶体45.2g;收率为62%,纯度为99.9%。
计算得到5-三氟甲基-5,6-二氢尿嘧啶的总收率为58%。
所公开的实施例的上述说明,使本领域专业技术人员能够实现或使用本发明。对这些实施例的多种修改对本领域的专业技术人员来说将是显而易见的,本文中所定义的一般原理可以在不脱离本发明的精神或范围的情况下,在其它实施例中实现。因此,本发明将不会被限制于本文所示的这些实施例,而是要符合与本文所公开的原理和新颖特点相一致的最宽的范围。