一株耐盐的木麻黄青枯病生防细菌B268及其应用的制作方法
本发明属于微生物菌株及其应用,涉及一株一株耐盐的木麻黄青枯病生防细菌B268,是一株新的耐盐芽孢杆菌Bacillus siamensis,菌株保藏号为CGMCC No.13225。本发明还涉及该菌株的生防活性,包括抑菌活性和促植物生长活性,及其在木麻黄青枯病防治中的应用。
背景技术:
青枯病又称细菌性枯萎病(bacterial wilt),是一种由茄科雷尔氏菌(Ralstonia solanacearum)引起的世界范围内的土传病害,广泛发生于热带、亚热带及温带部分地区,近年来由于温室效应的影响,已出现向高纬度地区蔓延的趋势。茄科雷尔氏菌种内包含6个生化型(biovar I-VI)和5个生理小种(race 1-5),复杂的种内多样性使其能够浸染50多个科、200余种植物,从单子叶到双子叶,从草本到木本,从灌木到乔木,是寄主范围最广的植物病原细菌之一,每年给全球多种经济作物(如番茄、马铃薯、花生、烟草、草莓、香蕉等)和多种林木(如木麻黄、桉树、桑、油橄榄、柚木、蝴蝶果等)带来巨大损失,因此被公认为世界第二大最具经济威胁,同时也最具研究价值的植物病原。
目前,青枯病的防治仍处于研究阶段,尚未形成有效手段,而生防微生物是其中最主流的研究方向之一,包括拮抗菌、内生菌和益生菌的使用。综合文献查新和专利检索的结果,迄今已报道的对茄科雷尔氏菌具有生防活性的微生物主要来源于寄主植物的根部土壤和内生环境,包括芽孢杆菌(Bacillus)、短芽孢杆菌(Brevibacillus)、类芽孢杆菌(Paenibacillus)、地芽孢杆菌(Geobacillus)、赖氨酸芽孢杆菌(Lysinibacillus)、假单胞菌(Pseudomonas)、寡养单胞菌(Stenotrophomonas)、不动杆菌属(Acinetobacter)、肠杆菌属(Enterobacter)、链霉菌(Streptomyces)、节杆菌(Arthrobacter)、弗兰克氏菌(Frankia)、曲霉(Aspergillus)、木霉(Trichoderma)、青霉(Penicillium)以及噬菌体等,有意思的是,一些分离自海洋环境的芽孢杆菌和链霉菌也表现出很高的拮抗活性。芽孢杆菌属是目前发现青枯病生防菌株最多的一类微生物,有报道的包括解淀粉芽孢杆菌(B.amyloliquefaciens),苏云金芽孢杆菌(B.thuringiensis),枯草芽孢杆菌(B.subtilis),甲基营养型芽孢杆菌(B.methylotrophicus),死谷芽孢杆菌(B.vallismortis)、蜡状芽孢杆菌(B.cereus)、巨大芽孢杆菌(‘B.magaterium’)等。而本专利所涉及的新菌株B268与暹罗芽孢杆菌(B.siamensis)的亲缘关系最近,虽然已有文献从基因组角度预测了该种芽孢杆菌的生防潜力,但目前尚未在任何病害的防治研究中有过报道。
另一方面,木麻黄(Casuarina equisetifolia)自引种至我国以来,由于其耐盐碱、耐潮湿、防风固沙以及速生等特点,已成为我国滨海沙地沿海基干林带不可替代的先锋树种,迄今造林面积已超过30万公顷。青枯病是木麻黄的主要病害之一,尤其在东南沿海地区,由于气候温暖潮湿,有利于茄科雷尔氏菌的生长繁殖,且夏季台风频繁,为病菌的侵染和传播创造了条件,因此,自1964年在广东省首次发现木麻黄青枯病以来,包括浙江、福建、广西以及海南等几乎每个省区均时有发生。茄科雷尔氏菌在野外环境中的潜伏时间长、隐蔽性高,且在木麻黄的苗期到成年期均可引发病害,造成植株大量死亡,严重时死亡率可达90%以上,同时还可能交叉浸染发病地区的其他高感病林木以及农作物,危害性大,因此,国家林业局于2013年的第4号公告中将木麻黄青枯病列入全国林业危险性有害生物名单。
迄今,木麻黄青枯病的防治研究以抗病育种技术报道得最多,但考虑到茄科雷尔氏菌的种内变异以及毒性分化,与生物防治技术相结合、‘内外兼修’的综合防治理念正在成为一种趋势。例如根据木麻黄的耐盐耐潮特性,在浙江、福建、广东一带有以海水浇淋对木麻黄青枯病进行防治的土法,其基本原理就是通过海水调节植物根部的微生态环境,诸如盐度、金属离子浓度、微生物群落结构等,使病原菌的生存和浸染环境恶化,同时有利于特定的生防微生物的生长,具有较好的防治效果。本专利所涉及的耐盐芽孢杆菌Bacillus siamensis B268即分离自海水浸渍后的木麻黄根部土壤,该菌株兼具病原菌拮抗活性以及促植物生长活性,且对海盐的耐受范围广,定殖能力强,在木麻黄青枯病的防治中具有一定的应用开发潜力,同时,在我国土地盐渍化情况日趋严峻的大背景下,该菌株的研究对于各种土质下的植物病害防治也具有一定的借鉴意义。
技术实现要素:
本发明的一个目的是提供一株耐盐的木麻黄青枯病生防细菌B268,是一株新的芽孢杆菌。本发明涉及的菌株B268来源于感病木麻黄植株,采集海水浸渍后的根部土壤,通过对峙板活性筛选获得。进一步的分析结果表明,该菌株归属于暹罗芽孢杆菌(Bacillus siamensis),且显示出较强的生防活性,包括:(1)对分离自同一木麻黄林区的茄科雷尔氏菌致病株Ralstonia solanacearum YQ以及购买自比利时微生物菌种保藏中心(Belgian Coordinated Collections of Microorganisms,BCCM)的茄科雷尔氏菌标准株Ralstonia solanacearum LMG 2299T均具有拮抗活性;(2)具有解磷、生成嗜铁素以及吲哚乙酸等促植物生长活性;(3)海盐的耐受范围广,而且能在不同的培养基以及多个盐度下形成生物被膜,显示出较强的定殖能力。目前,Bacillus siamensis菌株在青枯病防治的研究和应用中尚未见报道。所述的菌株B268已被中国微生物菌种保藏管理委员会普通微生物中心保藏(地址:北京市朝阳区北辰西路1号院3号,中国科学院微生物研究所,邮编100101),分类命名为Bacillus siamensis,保藏号为CGMCC No.13225,保藏日期为2016年11月1日。
本发明的另一个目的是提供所述菌株B268在木麻黄青枯病的生物防治中的用途。所述的菌株Bacillus siamensis B268可用于制备木麻黄青枯病的生物防治菌剂或农药,或者用于制备促木麻黄生长及提高其抗病性的微生物菌肥。所述的菌株Bacillus siamensis B268用于制备促木麻黄生长及提高其抗病性的微生物菌肥。实验证明所述的菌株Bacillus siamensis B268,其对于木麻黄及番茄青枯病的的致病菌株均具有拮抗活性。所述的菌株Bacillus siamensis B268,其具有促植物生长活性,包括解磷活性,合成并分泌嗜铁素的活性,以及合成植物生长激素——吲哚乙酸(IAA)的活性。所述的菌株Bacillus siamensis B268,其分离自海水浸渍的木麻黄根部土壤,具有宽的海盐耐受范围(0-12%),以及在有盐和无盐条件下(0-5%)生成稳定生物膜的能力。
目前,涉及青枯病防治的菌株以烟草青枯病居多,其他还包括番茄、花生、马铃薯、辣椒、生姜、茄子等作物青枯病,而木麻黄青枯病则尚未有报道。
为实现上述目的,本发明采取的技术方案为:
(1)菌株Bacillus siamensis B268的分离及拮抗活性筛选。据文献报道,海洋环境中存在着不少对茄科雷尔氏菌具有高拮抗活性的微生物,同时,海水浇淋法能够有效抑制发病初期的木麻黄青枯病,结合以上信息,专门联系了浙江省乐清市森林病虫防治检疫站开展合作,在其对海水浇淋法进行防治效果验证的木麻黄林区内采集根部土壤进行微生物的分离。同时采集林区中重病木麻黄植株的木质部样品,进行病原菌株的分离。最后通过对峙板法筛选获得多株拮抗微生物,其中即包括菌株B268。
(2)菌株Bacillus siamensis B268的拮抗活性验证。在已获得的木麻黄青枯病致病株Ralstonia solanacearum YQ的基础上,从比利时微生物菌种保藏中心(Belgian Coordinated Collections of Microorganisms,BCCM)购买青枯病原菌的标准株Ralstonia solanacearum LMG 2299T,两株菌分属于茄科雷尔氏菌的种内不同生化型,后者分离自番茄(Lycopersicon esculentum)青枯病病株,同时将两者作为靶标对菌株B268的拮抗活性进行验证(图3)。
(3)促植物生长活性分析。研究表明,解磷菌能够将土壤中植物难以吸收利用的不溶性磷转化为可吸收利用的可溶性磷,同时,一些微生物能够分泌小分子的铁螫合剂——嗜铁素(Siderophore),通过对三价铁的特异性结合帮助植物从土壤中富集这种限制性营养元素,这些生理特性有利于改善植物根部的营养环境,从而间接地促进植物生长。此外,根据文献报道,很多生防菌都能够合成植物内源性的生长激素——吲哚乙酸(indole-3-acetic acid,
IAA),通过直接调节植物生长来抵御病原菌的侵袭。基于上述信息,分别对菌株B268的解磷活性、吲哚乙酸生成以及嗜铁素生成进行了检测(图4-6)。
(4)盐的耐受性分析。鉴于菌株B268分离自海水浸渍后的根土,金属元素分析结果表明,土样中的钠镁离子浓度均明显高于普通土壤。同时,与B268亲缘关系最近的菌株Bacillus siamensis PD-A10T分离自盐渍螃蟹,能够耐受14%(w/v)的NaCl浓度。基于上述背景,对菌株B268的耐盐性进行了分析验证(图7)。
(5)生物被膜的形成能力分析。生物被膜(biofilm)是细菌适应环境的一种特殊生长状态,即面对环境胁迫时的一种自我调控方式,与细菌的定殖、浸染、毒力等多种特性密切相关,而定殖能力又是决定生防菌株能否在林间长期发挥防治效用,进而决定其是否具有实际应用价值的重要指标之一,基于上述原因,对菌株B268的生物被膜形成能力进行了考察(图8)。
(6)木麻黄青枯病的防治活性验证。以温室培养的盆栽木麻黄苗为寄主,Ralstonia solanacearum YQ为病原,对菌株B268的生防活性进行了比较和验证(图9)。
综上所述,本发明提供的菌株Bacillus siamensis B268丰富了生防芽孢杆菌的种类及其施用范畴,该菌株在不同培养基中均表现出强的生长能力及稳定的活性,具有进一步研发的价值。
本发明提供一株耐盐芽孢杆菌B268,该菌株分离自海水浸渍的木麻黄根部土壤,对木麻黄及番茄青枯病的致病菌株均具有拮抗活性,同时具有解磷、合成嗜铁素以及植物生长激素等促植物生长活性。此外,该菌株对海盐的耐受范围广,能在多个盐度下形成稳定的生物膜,生长及定殖能力强。鉴于上述生防活性,本发明提供的菌株B268可在制备木麻黄青枯病的生物防治中的应用,基于该菌株B268对病原菌的拮抗活性以及强的生物膜形成能力,能开发为病害防治菌剂或直接生产为生物农药,基于解磷、分泌嗜铁素以及IAA的活性,菌株B268能开发为菌肥。
附图说明
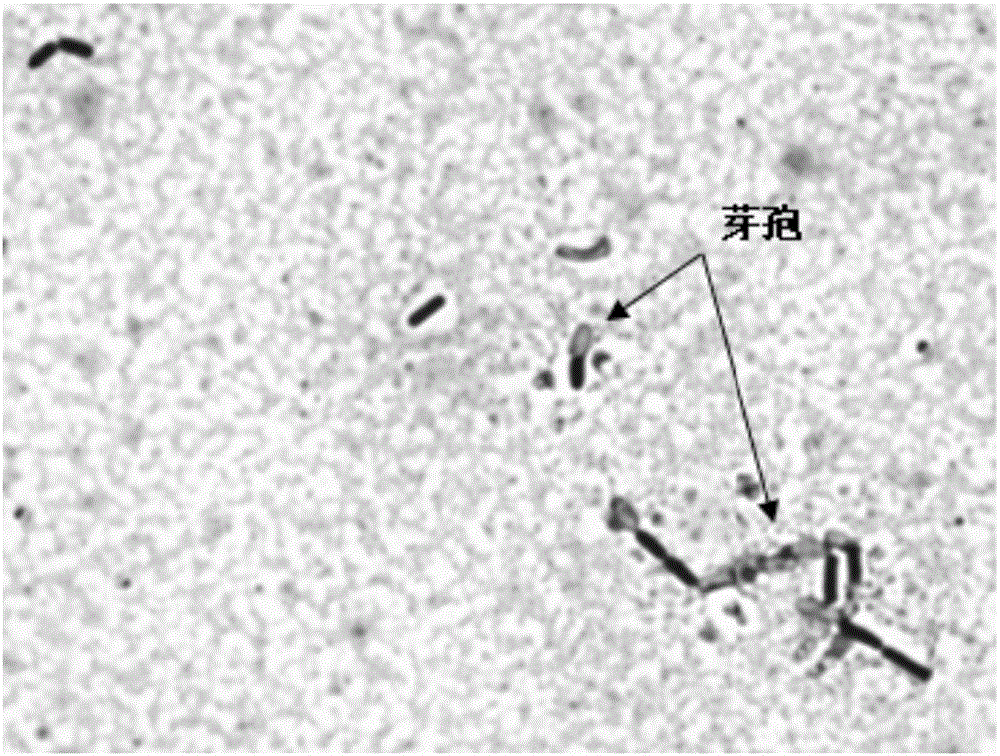
图1菌株Bacillus siamensis B268的细胞形态。
图2菌株Bacillus siamensis B268及其近缘菌株的Neighbor-Joining系统发育树。
图3菌株Bacillus siamensis B268对茄科雷尔氏菌的拮抗活性,其中A:富营养人工海水培养基+病原菌株Ralstonia solanacearum YQ+B268(活性筛选),B1:富营养人工海水培养基+病原菌株Ralstonia solanacearum YQ+B268(活性验证),B2:富营养人工海水培养基+病原菌株Ralstonia solanacearum LMG 2299T+B268,B3:Modified YPG无盐培养基+病原菌株Ralstonia solanacearum YQ+B268,B4:Modified YPG无盐培养基+病原菌株Ralstonia solanacearum LMG 2299T+B268。
图4菌株Bacillus siamensis B268的解磷活性,其中4-1:Pikovskaya Agar平板,4-2:NBRI-BPB平板。
图5菌株Bacillus siamensis B268的嗜铁素生成。
图6菌株Bacillus siamensis B268的IAA生成,其中A:Modified YPG无盐培养基检测结果,B:2%海盐+Modified YPG无盐培养基检测结果;对照1:补加色氨酸但不接种培养管,平行1-3:补加色氨酸并接种培养管,对照2:不补加色氨酸但接种培养管。
图7菌株Bacillus siamensis B268的耐盐性。
图8A菌株Bacillus siamensis B268在不同盐度下的生物被膜形成的结晶紫洗脱液的颜色对比。
图8B菌株Bacillus siamensis B268在不同盐度下的生物被膜形成的结晶紫洗脱液的OD570检测结果。
图9菌株Bacillus siamensis B268对木麻黄青枯病的防治效果,其中9-1:不同菌液灌根处理后的木麻黄苗的根部外观,9-2:不同菌液灌根处理后的木麻黄苗的茎基部横切面;图中A:无菌培养基+病原菌株Ralstonia solanacearum YQ培养液处理;B:Bacillus subtilis NH2-51-2培养液+病原菌株Ralstonia solanacearum YQ培养液处理;C:Bacillus siamensis B268培养液+病原菌株Ralstonia solanacearum YQ培养液处理。
具体实施方式
结合附图和实施例对本发明作进一步的说明。
实施例1:菌株Bacillus siamensis B268的分离及活性筛选
样品采集自浙江省乐清市滨海木麻黄人工林,该林区曾进行过海水浇淋对木麻黄青枯病防治效果的验证性实验,在海水浸渍过的林区中,根据目测的发病状况分别选取无病症和有病症植株,采集根围10cm以下的土壤。
在菌株分离前,对样品盐度进行验证,即采用电感耦合等离子体发射光谱法(Inductively Coupled Plasma Optical Emission Spectrometry,ICP-OES)对土样的金属元素组成及含量进行分析,结果表明,其中的钠镁离子浓度分别为0.5-0.7%和0.3-0.5%,明显高于作为对照的普通土样。
取10g土样以20ml无菌生理盐水悬浮,于28℃、140rpm条件下浸提2天。悬浮液以无菌生理盐水梯度稀释后涂布寡营养人工海水平板,于28℃培养至形成明显菌落。根据形态差异分别挑取单菌落,以相同平板进行菌株的纯化,并以20%(v/v)甘油管形式保藏。
分离菌株以富营养人工海水平板划线活化,28℃培养24小时,病原菌株Ralstonia solanacearum YQ以富营养人工海水液体摇管活化,28℃、140rpm培养48小时。取50μl菌株YQ的培养液(OD600=1.0)划线富营养人工海水平板,再挑取3个分离菌株的单菌落点种该平板,制成的对峙板于28℃培养3天,逐日观察抑菌圈的形成情况。菌株B268的活性筛选结果见图3A。
人工海水:NaCl 4.86g,MgCl2·6H2O 3.15g,MgSO4·7H2O 1.66g,CaCl2 0.45g,KCl 0.138g,NaHCO3 40mg,柠檬酸铁2.5mg,SrCl2·6H2O 14.25mg,KBr 20mg,H3BO3 5.5mg,Na2SiO3·9H2O 2.32mg,NaF 0.6mg,NH4NO3 0.6mg,Na2HPO4 2mg,去离子水1L。
寡营养人工海水培养基:Yeast Extract(BD 212750)0.5g,Trypticase Peptone(BD 211921)0.5g,人工海水1L,pH 7.0。
富营养人工海水培养基:Yeast Extract(BD 212750)1g,Trypticase Peptone(BD 211921)5g,人工海水1L,pH 7.0。
目前,菌株B268已在中国微生物菌种保藏管理委员会普通微生物中心保藏(地址:北京市朝阳区北辰西路1号院3号,中国科学院微生物研究所,邮编100101),分类命名为Bacillus siamensis,保藏号为CGMCC No.13225,保藏日期为2016年11月1日。
实施例2:菌株Bacillus siamensis B268的系统发育鉴定
挑取菌株B268的平板单菌落,转接富营养人工海水培养基,28℃、140rpm培养24小时后收集细胞,镜检的同时采用细菌基因组快速抽提试剂盒(东胜生物)抽提基因组模板。采用细菌通用引物27F(5'-AGAGTTTGATCCTGGCTCAG-3')以及1492R(5'-ACGGTTACCTTGTTACGACTT-3')扩增16S rRNA基因,获得的产物经AxyPrep PCR清洁试剂盒(Axygen)纯化后与pMD 19-T Vector连接(TaKaRa),并转化Trans1-T1感受态细胞(TransGen Biotech),挑取阳性重组子送交测序公司进行测序。
显微镜下菌株B268成杆状,可观察到芽孢的形成(图1)。
菌株B268的16S rRNA基因全长1513nt(详见序列表),序列已递交至GenBank数据库,序列登录号为KY129717。采用EzBioCloud(http://www.ezbiocloud.net/)比对工具进行两两序列间的相似性分析,结果表明,B268与Bacillus siamensis KCTC 13613T的序列相似性最高,为99.93%。采用Mega 6.0进行多序列比对和系统发育关系分析,结果表明,菌株B268在Neighbor-Joining系统发育树上与芽孢杆菌属的标准种B.subtilis,以及经典的青枯病生防菌B.amyloliquefaciens,B.methylotrophicus,潜在的生防菌B.siamensis处于同一个进化分支,且与Bacillus siamensis KCTC 13613T间的进化距离最短(图2)。
综合上述分析结果,将菌株B268划分至芽孢杆菌属中的Bacillus siamensis种。
菌株Bacillus siamensis B268保藏于中国微生物菌种保藏管理委员会普通微生物中心,保藏号为CGMCC No.13225。
实施例3:菌株Bacillus siamensis B268的拮抗活性验证
分别使用富营养人工海水培养基及Modified YPG无盐培养基制备对峙板,分别以本实验室分离自木麻黄病株的Ralstonia solanacearum YQ以及购买自BCCM的分离自番茄病株的Ralstonia solanacearum LMG 2299T为靶标进行拮抗活性的验证。菌株B268以平板划线活化,28℃培养24小时,两株病原菌株以液体摇管活化,使用富营养人工海水培养基时,于28℃、140rpm培养48小时,使用Modified YPG无盐培养基时,于28℃、140rpm培养24小时。对峙板的制备方法同实施例1,于28℃培养3天后观察抑菌圈的形成情况。
如图3B所示,病原菌株YQ及LMG 2299T在无盐培养基上生长更好,而菌株B268在两种培养基上均生长良好,且对两株侵染不同寄主的病原菌均表现出明显的拮抗活性。
Modified YPG无盐培养基:牛肉浸粉3g,蛋白胨5g,葡萄糖10g,酵母抽提物0.5g,蒸馏水1L,pH 7.0;
实施例4:菌株Bacillus siamensis B268的解磷试验
菌株B268划线富营养人工海水平板活化,28℃培养24小时后点种Pikovskaya Agar平板以及NBRI-BPB平板以鉴定其解磷活性,28℃培养至出现明显解磷圈。结果如图4-1及4-2所示,Pikovskaya Agar平板上出现透明圈而NBRI-BPB平板上出现黄色圈,表明菌株B268具有解磷活性。
Pikovskaya Agar培养基:Yeast Extract(BD 212750)0.5g,葡萄糖10g,Ca3(PO4)25g,(NH4)2SO4 0.5g,K2SO4 0.2g,MgSO4·7H2O 0.1g,MnSO4 2mg,FeSO4·7H2O 2mg,琼脂粉15g,蒸馏水1L,pH 7.0;
NBRI-BPB培养基:葡萄糖10g,Ca3(PO4)2 5g,MgCl2·6H2O 5g,MgSO4·7H2O 0.25g,KCl 0.2g,(NH4)2SO4 0.1g,溴酚蓝25mg,琼脂粉15g,蒸馏水1L,pH 7.0;
实施例5:菌株Bacillus siamensis B268的嗜铁素合成试验
菌株B268划线富营养人工海水平板活化,28℃培养24小时后点种LBA平板以鉴定其嗜铁素合成活性,28℃培养至出现明显反应圈。结果如图5所示,平板上出现黄色透明圈,表明菌株B268能够合成并分泌嗜铁素。
LBA培养基:60.5mg铬天青S溶于50ml去离子水中,以10mM HCl配制1mM的FeCl3·6H2O溶液,取该铁溶液10ml加入铬天青S水溶液中混匀,形成CAS溶液;72.9mg CTAB溶于40ml去离子水中,边搅拌边缓慢加入上述CAS溶液,混匀后灭菌备用;
Tryptone(BD 211705)10g,Yeast Extract(BD 212750)5g,NaCl 10g,PIPES 30.2g,去离子水900mL,以50%NaOH溶液调pH 6.8,加琼脂粉15g后灭菌备用;
上述两种基质混合后倒制LBA平板;
实施例6:菌株Bacillus siamensis B268的IAA合成试验
菌株B268以Modified YPG无盐培养基活化,转接相同培养基后补充终浓度为40mg/l的色氨酸,28℃、140rpm培养,以接菌但不补加色氨酸以及补加色氨酸但不接菌的平行培养管为对照。同时转接补加2%海盐(Sigma S9883)的Modified YPG无盐培养基,其余操作相同。
取7天培养液1ml,与等体积检测试剂混合后,室温避光放置24小时,期间观察颜色变化。结果如图6A所示,凡接种的培养管,无论是否补加色氨酸,加入检测试剂后均显红色,表明菌株B268能够合成IAA。而图6中B的结果与A相近,表明盐对于菌株B268的IAA合成无明显影响。
检测试剂:12g FeCl3·6H2O,7.9M硫酸1L;
实施例7:菌株Bacillus siamensis B268的耐盐性分析
在Modified YPG无盐培养基的基础之上添加0-12%海盐(Sigma S9883),配制盐梯度培养基,分别接种菌株B268以及病原菌株YQ和LMG 2299T,28℃、140rpm培养24小时后检测OD600值。结果如图7所示,菌株B268对海盐的耐受范围较广,培养24小时时,在1-7%的海盐浓度下均生长良好(OD600>1),而延长培养时间时,在0-12%的海盐浓度下均生长良好(OD600>1)。相反的,病原菌株YQ和LMG 2299T均不耐盐,明显喜好无盐或低盐环境(<1%),当海盐浓度大于3%时即不能生长。而根据文献报道,木麻黄的盐耐受范围为0.3-1.5%,与病原菌相当。基于上述数据可以认为:一,菌株B268的耐盐性与其分离自海水浸渍的土壤有关;二,宽的海盐耐受范围使得菌株B268易于在内陆、滨海甚至滩涂等不同含盐量的木麻黄种植带土壤中生存;三,耐盐性的差异预示了菌株B268可能协同含盐环境共同拮抗病原菌,而这可能是海水浇淋法抑制木麻黄青枯病的机制之一。
实施例8:菌株Bacillus siamensis B268的生物膜形成试验
在Modified YPG无盐培养基的基础之上添加不同浓度的海盐(Sigma S9883),制备盐梯度培养基,以195μl/孔的加量将上述海盐梯度培养基分别加入96孔培养板,每个梯度6个平行孔。以Modified YPG无盐培养基制备病原菌株YQ,LMG 2299T以及菌株B268的种子液,调OD600=0.3后,按5μl/孔的加量接种,同时以加入5μl无菌培养基的孔作为阴性对照。培养板的具体布局如表1所示,28℃静置培养20小时后进行生物膜的检测,具体方法如下:
以微量移液器小心吸走每孔中的菌液以及液体表面形成的菌膜,以无菌水轻柔洗涤每孔两次;吸干残余液体后按300μl/孔的加量加入1%(w/v)结晶紫水溶液,室温下静置染色30分钟;小心吸走染液,在合适的容器中以无菌水轻柔漂洗孔板至无明显浮色为止;吸干残余液体后按300μl/孔的加量加入33%(v/v)乙酸溶液,室温下静置,其目的是洗脱被生物膜固定的结晶紫,充分洗脱后检测OD570值。
表1
如图8A及图8B所示,菌株B268在0-5%的海盐浓度下均能形成稳定的生物膜,尤以1-3%的海盐浓度为最适(洗脱结晶紫的颜色最深或OD570值最高),这一趋势与其耐盐性基本一致,说明适当浓度的海盐能够促进菌株B268的定殖。而病原菌株YQ仅在0-1%海盐浓度下形成微弱的生物膜,LMG 2299T仅在0.5%海盐浓度下形成生物膜,表明在相同的营养条件下,菌株B268更具有生长优势,若在野外环境下,则意味着生态位的优先占据,从而达到抑制病原菌增殖的目的。
实施例9:菌株Bacillus siamensis B268对木麻黄青枯病的防治试验
菌株B268、Bacillus subtilis NH2-51-2及病原菌株YQ分别接种Modified YPG无盐培养基,28℃、140rpm培养24小时。菌液调OD600=1后,分别将NH2-51-2与YQ,B268与YQ,无菌培养基与YQ等体积混合。其中,菌株NH2-51-2分离自南海表层海水,对峙板筛选结果显示其对病原菌株YQ有微弱的拮抗活性,在本实验中作为阳性对比菌株。加入无菌培养基的YQ菌液作为阴性对照。以灌根法分别将上述3种混合菌液以5ml/株接种盆栽木麻黄苗,温室培养1个月后取根至茎基部分鉴定侵染情况。
如图9所示,在相同的培养时间下,仅接种病原菌株YQ的植株,根表呈黑色(图9-1A),茎基横切面干枯且维管组织有明显的腐烂现象(图9-2A),出现了青枯病侵染的症状;接种菌株B268及YQ混合液的植株,根表呈健康的亮褐色,且有光泽(图9-1C),茎基横切面新鲜湿润(图9-2C),未出现青枯病侵染的症状;而接种菌株NH2-51-2及YQ混合液的植株,根表呈暗褐色(图9-1B),茎基横切面略显干枯,维管组织有轻微腐烂痕迹(图9-2B)。上述结果表明,菌株NH2-51-2拮抗活性较弱,能延缓但不能抑制病害的发生,而菌株B268的存在能有效抑制病原菌对木麻黄根部的侵入,具有病害防治的效果。
<110> 浙江农林大学
<120> 一株耐盐的木麻黄青枯病生防细菌B268及其应用
<160> 3
<210> 1
<211> 1513
<212> DNA
<213> Bacillus siamensis
<400> 1
1 AGAGTTTGAT CCTGGCTCAG GACGAACGCT GGCGGCGTGC CTAATACATG CAAGTCGAGC
61 GGACAGATGG GAGCTTGCTC CCTGATGTTA GCGGCGGACG GGTGAGTAAC ACGTGGGTAA
121 CCTGCCTGTA AGACTGGGAT AACTCCGGGA AACCGGGGCT AATACCGGAT GGTTGTTTGA
181 ACCGCATGGT TCAGACATAA AAGGTGGCTT CGGCTACCAC TTACAGATGG ACCCGCGGCG
241 CATTAGCTAG TTGGTGAGGT AACGGCTCAC CAAGGCGACG ATGCGTAGCC GACCTGAGAG
301 GGTGATCGGC CACACTGGGA CTGAGACACG GCCCAGACTC CTACGGGAGG CAGCAGTAGG
361 GAATCTTCCG CAATGGACGA AAGTCTGACG GAGCAACGCC GCGTGAGTGA TGAAGGTTTT
421 CGGATCGTAA AGCTCTGTTG TTAGGGAAGA ACAAGTGCCG TTCAAATAGG GCGGCACCTT
481 GACGGTACCT AACCAGAAAG CCACGGCTAA CTACGTGCCA GCAGCCGCGG TAATACGTAG
541 GTGGCAAGCG TTGTCCGGAA TTATTGGGCG TAAAGGGCTC GCAGGCGGTT TCTTAAGTCT
601 GATGTGAAAG CCCCCGGCTC AACCGGGGAG GGTCATTGGA AACTGGGGAA CTTGAGTGCA
661 GAAGAGGAGA GTGGAATTCC ACGTGTAGCG GTGAAATGCG TAGAGATGTG GAGGAACACC
721 AGTGGCGAAG GCGACTCTCT GGTCTGTAAC TGACGCTGAG GAGCGAAAGC GTGGGGAGCG
781 AACAGGATTA GATACCCTGG TAGTCCACGC CGTAAACGAT GAGTGCTAAG TGTTAGGGGG
841 TTTCCGCCCC TTAGTGCTGC AGCTAACGCA TTAAGCACTC CGCCTGGGGA GTACGGTCGC
901 AAGACTGAAA CTCAAAGGAA TTGACGGGGG CCCGCACAAG CGGTGGAGCA TGTGGTTTAA
961 TTCGAAGCAA CGCGAAGAAC CTTACCAGGT CTTGACATCC TCTGACAATC CTAGAGATAG
1021 GACGTCCCCT TCGGGGGCAG AGTGACAGGT GGTGCATGGT TGTCGTCAGC TCGTGTCGTG
1081 AGATGTTGGG TTAAGTCCCG CAACGAGCGC AACCCTTGAT CTTAGTTGCC AGCATTCAGT
1141 TGGGCACTCT AAGGTGACTG CCGGTGACAA ACCGGAGGAA GGTGGGGATG ACGTCAAATC
1201 ATCATGCCCC TTATGACCTG GGCTACACAC GTGCTACAAT GGACAGAACA AAGGGCAGCG
1261 AAACCGCGAG GTTAAGCCAA TCCCACAAAT CTGTTCTCAG TTCGGATCGC AGTCTGCAAC
1321 TCGACTGCGT GAAGCTGGAA TCGCTAGTAA TCGCGGATCA GCATGCCGCG GTGAATACGT
1381 TCCCGGGCCT TGTACACACC GCCCGTCACA CCACGAGAGT TTGTAACACC CGAAGTCGGT
1441 GAGGTAACCT TTATGGAGCC AGCCGCCGAA GGTGGGACAG ATGATTGGGG TGAAGTCGTA
1501 ACAAGGTAGC CGT
<210> 2
<211> 20
<212> DNA
<213> 人工序列
<223> 16S rRNA基因上游引物
<400> 2
AGAGTTTGAT CCTGGCTCAG
<210> 3
<211> 21
<212> DNA
<213> 人工序列
<223> 16S rRNA基因下游引物
<400> 3
ACGGTTACCT TGTTACGACT T
- 还没有人留言评论。精彩留言会获得点赞!