一组用于头颈鳞状细胞癌淋巴结转移速检的LAMP引物组CK19‑115的制作方法
本发明属于生命科学与临床医学领域。更具体的,本发明涉及用于头颈鳞状细胞癌淋巴结转移速检的LAMP引物组,以及头颈鳞状细胞癌淋巴结转移的临床、尤其是术中快速检测方法。
背景技术:
头颈鳞状细胞癌(head and neck squamous cell carcinoma,HNSCC)在全球癌症发病率中排第六位,全世界每年有近65万新增病例,近年来恶性肿瘤诊治手段日新月异,然而HNSCC的5年生存率并没有明显提高。HNSCC治疗方案的选择及预后判断主要取决于TNM分期以及组织学分级,其中颈淋巴结转移情况对预后的影响较大。临床上约47%的HNSCC患者就诊时已经伴有颈淋巴结转移。因此颈淋巴结转移的准确检测对于HNSCC选择合理的治疗方案以及个体预后至关重要。
目前国内外颈淋巴结的转移状态主要依赖于局部触诊、影像学检查、病理检查等临床诊断手段。尽管随着超声、CT、MRI、PET、超声引导细针穿刺细胞学检查、术中冰冻切片病理检查等诊断技术的不断发展,颈淋巴结转移在术前术中诊断方面已有了一定进步,但迄今为止尚没有一种方法的诊断正确率能够完全满足临床需要,对于直径小于2mm的微转移灶更是无法准确检测。由于术前术中诊断手段较为局限,目前有10%~20%术前临床诊断为颈淋巴结转移阳性(clinical N+,cN+)的患者,术后病理检查未发现淋巴结转移,而同时约有25%术前临床诊断为颈淋巴结转移阴性(clinical N0,cN0)的患者术后病理却为淋巴结转移阳性。对于这1/4的cN0患者如果进行随访观察,患者将面临治疗不充分而带来的巨大风险;而对于另3/4的cN0患者和前述部分cN+患者,额外的治疗则完全没有必要,过度治疗带给患者的只有治疗风险和生活质量下降。
现已有研究开始探索分子生物学检测技术,即通过逆转录-多聚酶链反应(qRT-PCR)检测上皮来源特异mRNA的表达来判断淋巴结的转移状态。但常规的qRT-PCR分析一般需要3-4个小时的时间,不利于术中进行,因此临床特别需要一种能够准确、快速检测颈淋巴结状态的分子生物学方法。
技术实现要素:
为解决上述技术问题,填补现有技术空白,本发明在初步筛选出与HNSCC颈淋巴结转移相关的特异性分子标志物的基础上,建立了头颈部鳞状细胞癌颈淋巴结转移术中快速检测方法,即应用RT-LAMP检测方法进行检测,在手术过程之中即可判断淋巴结的转移状态,指导术中治疗,确立有效、快速、低廉的检测方法;不仅为肿瘤诊断的研究提供新的依据,而且能够有效减少患者的痛苦,提高患者的预后,也可以大幅节省患者和医院的开支,具有非常重要的临床和社会意义。
本发明具体技术方案如下:
1、收集手术切除的新鲜标本:组织标本切取后,向临床医师确定肿瘤部位、范围及肉眼可以判别的浸润情况,并进行描述和详细的临床记录。
2、筛选HNSCC淋巴结转移特异性标志物基因:通过文献报道和检索数据库确定检测HNSCC淋巴结转移的可能mRNA标志物。检索来源包括:PubMed、OMIM、UniGene、GeneCards、CGAP。共预选出39个候选基因。使用qRT-PCR实验对上述候选基因进行2轮筛选:
1)第一次基因筛选:选择原发HNSCC患者19例肿瘤组织和非癌患者的15例良性淋巴结组织,非癌患者的诊断分别为:11例诊断结节性甲状腺肿、2例诊断颈动脉体瘤、1例诊断先天性甲状舌管囊肿、1例诊断头颈部皮下囊肿。应用qRT-PCR法分析上述39个候选基因,选取明确差异表达的4个基因(CK7、CK19、EGFR、TACSTD1)用于后续研究;
2)第二次基因筛选:分别选择原发HNSCC患者的36例肿瘤组织、19例病理诊断为阳性的淋巴结和19例病理诊断为阴性的淋巴结,提取初步筛选出的4个基因的mRNA,进行qRT-PCR分析,确认能够区分HNSCC肿瘤组织、阳性淋巴结和阴性淋巴结的基因CK7、CK19并进行分析,并进一步得到最佳基因组合CK7+CK19。
3、LAMP检测流程的建立
在确定了CK7、CK19以及CK7+CK19基因组合的基础上,开始着手建立LAMP实验流程。整个流程建立包括实验试剂盒缓冲底液的制备、CK19及CK7引物设计及最佳反应温度测定三个方面。而其中的核心即引物设计,在对最佳引物的筛选实验中,同时得到了适当的缓冲底液及最佳反应温度。
本发明提供了一种CK7/CK19基因或蛋白在头颈鳞状细胞癌(HNSCC)淋巴结转移快速检测或诊断中的应用。
本发明提供了一组用于CK7基因RT-LAMP检测的引物组,其核苷酸序列如SEQ ID NO.8-12所示;本发明提供了三组用于CK19基因RT-LAMP检测的引物组,其核苷酸序列如SEQ ID NO.25-29、35-40、41-46所示;以及所述引物组在HNSCC淋巴结转移快速检测或诊断中的应用。
本发明提供了一种试剂盒,其特征在于,所述试剂盒包含扩增CK7和/或CK19基因的特异性引物,优选的,所述特异性引物为SEQ ID NO.8-12、25-29、35-40、41-46所示引物组;以及所述试剂盒在HNSCC淋巴结转移快速检测或诊断中的应用。
本发明提供了一种快速检测头颈鳞状细胞癌(HNSCC)淋巴结转移的方法,其特征在于,使用RT-LAMP方法检测淋巴结中CK7基因的表达水平。具体步骤如下:1)分离淋巴结组织,并提取总RNA;2)进行RT-LAMP扩增。所述LAMP扩增优选使用SEQ ID NO.8-12所示引物组;扩增温度为65℃,恒温反应时间为60min。
本发明提供了一种CK7基因/蛋白与CK19基因/蛋白在头颈鳞状细胞癌(HNSCC)淋巴结转移快速检测或诊断中的联合应用,即使用RT-LAMP方法检测淋巴结中CK7基因和CK19基因的表达水平。所述RT-LAMP检测优选使用下述引物组:1)SEQ ID NO.8-12所示引物;2)SEQ ID NO.25-29所示引物;3)SEQ ID NO.35-40所示引物;或/和4)SEQ ID NO.41-46所示引物。
本发明筛选出用于快速检测HNSCC淋巴结转移的特异性标志物基因及其基因组合,即CK7、CK19、CK7+CK19;建立了HNSCC患者淋巴结快速检测技术体系,即应用RT-LAMP法进行淋巴结状态检测,并将整个实验过程控制在四十分钟左右,适应于术中快速检测需求。
通过对HNSCC患者淋巴结RT-LAMP检测数据和石蜡病理结果的对比,充分验证该检测方法的准确性。最终证明了RT-LAMP技术的优越性,即:耗费时间短,实验温度低、结果准确性高且判读方式简便。以RT-LAMP技术为基础建立的HNSCC淋巴结快速诊断体系,使此类患者术中快速判定其淋巴结转移状态成为可能。
附图说明
图1:淋巴结取材示意图。
图2:a.肿瘤瘤体石蜡病理切片-箭头所示为喉癌瘤体细胞;b.肿瘤瘤体石蜡病理切片-高倍镜下可见明显癌栓。
图3:第一次筛选标本mRNA电泳图,M:DNA Marker:DM2000,从下往上依次为100,250,500,750,1000和2000bp,其中750bp为亮带,此处展示的标本为HNSCC 1-15,LN1-9。
图4:TACSTD1扩增曲线及溶解曲线。
图5:CK19扩增曲线及溶解曲线。
图6:CK7扩增曲线及溶解曲线。
图7:EGFR扩增曲线及溶解曲线。
图8:a.第二次筛选标本mRNA电泳图样本PN1-19;b.第二次筛选标本mRNA电泳图样本BN1-19。
图9:二次筛选TACSTD1扩增曲线及溶解曲线。
图10:二次筛选CK19扩增曲线及溶解曲线。
图11:二次筛选CK7扩增曲线及溶解曲线。
图12:二次筛选EGFR扩增曲线及溶解曲线。
图13a:4种明显差异性基因相关性分析:将目标基因进行分组统计,CK7和CK19基因组合能够更加准确的区分头颈部鳞状细胞癌患者颈部阳性和阴性淋巴结。
图13b:进一步等概率统计,CK7和CK19组合区分头颈部鳞状细胞癌患者颈部淋巴结良恶性的优势相较于其他基因组合就更加明显。
图14:CK7及CK19酶联免疫吸附实验结果。BN表示阴性淋巴结,PN表示阳性淋巴结。
图15:LAMP引物的设计位置与组成。
图16:CK7最佳引物筛选。
图17:CK19最佳引物筛选。
图18:RT-LAMP实验流程示意图。
图19:BN组CK7RT-LAMP结果。
图20:BN组CK19RT-LAMP结果。
图21a:PN1-PN32号样本CK-7RT-LAMP检测结果。
图21b:PN33-PN65号样本CK-7RT-LAMP检测结果。
图22a:PN1-PN32号样本CK-19RT-LAMP检测结果。
图22b:PN33-PN65号样本CK-19RT-LAMP检测结果。
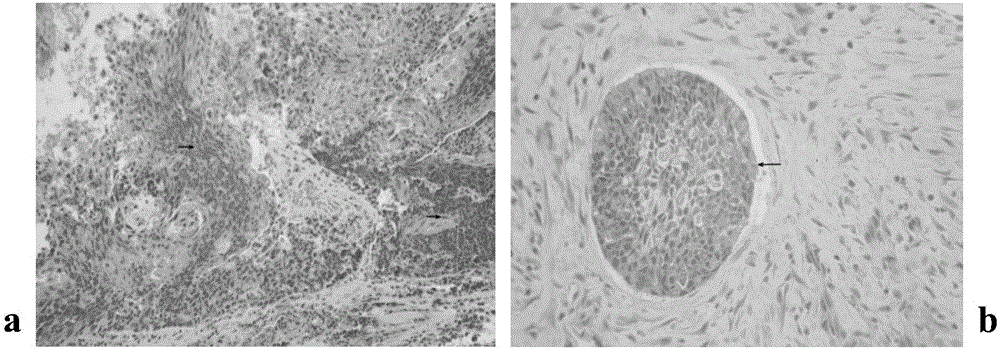
图23:a.BN34号标本石蜡切片;b.BN35号标本石蜡切片;c.BN36号标本石蜡切片;d.BN37号标本石蜡切片;e.BN38号标本石蜡切片;均为40倍放大。
具体实施方式
下面结合附图和具体的实施例对本发明的技术方案做进一步介绍。
实施例1:标本的收取及保存
收集手术切除的新鲜标本,包括头颈肿瘤组织、癌旁组织、癌周正常组织及颈部淋巴结组织。组织标本切取后,首先需向临床医师确定肿瘤部位、范围及肉眼可以判别的浸润情况,并进行描述和记录。
1、肿瘤、癌旁及癌周正常组织的收取:
标本取材遵循“癌周-癌旁-肿瘤组织”的原则。为保证标本mRNA活性和确定该组织的病理学特征,需要将留取的组织标本做如下处理:1)于肿瘤组织明显部位(并不一定是中心部位)取材,需避开坏死部分;2)取稍大的立方体或长方体组织块;3)将离体组织块沿长轴切开,镜像分割标本,并记录编号(A,B);4)将组织块A立即用中性福尔马林固定,并于近期进行病理切片;组织块B必须在标本离体30分钟内浸泡至RNA缓冲液中,以保证mRNA活性:每块组织长宽高均≤0.5cm,缓冲液量需是新鲜组织5-10倍;常温下放置一段时间(或置于4℃冰箱内过夜)以利于缓冲液渗透,后放于低温设备中保存。
2、淋巴结的取材及收取:
分理出整体淋巴结,尽量去除包膜和周围脂肪等残余组织,将其均匀分成4份(a’,b’,c’,d’),立即行快速冰冻病理切片,每个切面都留取一张冰冻切片且标号,及时阅片确定该淋巴结转移情况,后将a’、c’部分组织用于分子生物学实验,b’、d’部分组织用于石蜡切片,进一步判断淋巴结性质及肿瘤转移状态,留存完整病理信息。
3、标本编号及入库
本发明研究涉及新鲜组织标本、血标本以及基于以上标本的各类衍生信息,包括石蜡病理切片、冰冻病理切片、血浆、血细胞、RNA/DNA信息等,因此需将以上标本分类、编号并入库保存以利于取用。需要编号的标本媒介包括:冻存管、冻存盒、蜡块、切片、EP管。编号遵循以下原则:
·按照生物样本采集规范,头颈部癌标记“H/3”;
·每个标本媒介必须标注留取日期及患者病历号;
·留取部位标示:T—肿瘤P—瘤旁N—瘤周L—淋巴结;
·另需在媒介上明确冰箱/蜡块柜/切片柜、层架、位置等信息;
·纸质版及电子版信息的留存;
·及时加入取用标本的RNA/DNA信息。
对用于下一步分子生物学实验的标本进行严格的质量控制,是保证后续试验数据可靠性的关键原则。对留取的标本(尤其是肿瘤瘤体标本和淋巴结标本)进行常规病理切片,并经 由病理专家阅片,以确定标本组织学类型及肿瘤浸润情况并进行登记。对于肿瘤瘤体组织,只选取其瘤体面积≥60%的组织块进行下一步分子生物学实验(见图2、3)。
4、标本库样本量及实验样本量
本发明用于实验研究的标本份数为328例。依照标本质控原则,选择符合标准的标本组织投入到分子生物学实验中,包括头颈部癌瘤体组织109例、头颈部癌阳性淋巴结66例、头颈部癌阴性淋巴结107例,非癌患者良性淋巴结46例。
实施例2:HNSCC淋巴结转移特异性标志物基因的筛选
1、候选基因的确定
通过文献报道和检索数据库确定检测HNSCC淋巴结转移的可能mRNA标志物。检索来源包括:PubMed、OMIM、UniGene、GeneCards、CGAP。预选候选基因的原则是该基因在HNSCC中表达量较正常淋巴结组织表达异常,即高表达或低表达,或者该基因在HNSCC中上调或下调并且有独特的组织特异性,或者该基因具有肿瘤特异性。依据以上原则,共预选出39个候选基因(见表1)。
表1.初级筛选研究的候选基因
2、qRT-PCR实验对候选基因进行2次筛选
具体实验方法简述如下:
1)第一次基因筛选:选择原发HNSCC患者19例肿瘤组织和非癌患者的15例良性淋巴结组织,非癌患者的诊断分别为:11例诊断结节性甲状腺肿、2例诊断颈动脉体瘤、1例诊断先天性甲状舌管囊肿、1例诊断头颈部皮下囊肿。应用qRT-PCR法分析上述39个候选基因,选取明确差异表达的4个基因用于后续研究;
2)第二次基因筛选:分别选择原发HNSCC患者的36例肿瘤组织、19例病理诊断为阳性的淋巴结和19例病理诊断为阴性的淋巴结,提取初步筛选出的4个基因的mRNA,进行qRT-PCR分析,确认能够区分HNSCC肿瘤组织、阳性淋巴结和阴性淋巴结的基因并进行分析,进而得到最佳基因组合。
详细实验方法和结果如下:
1)第一次基因筛选:
各样品RealTimePCR检测:本次qRT-PCR共涉及34例标本组织,检测39个基因,根据目标基因设计特异性引物如下(见表2)。
表2. 39个候选基因的特异性引物
使用分子生物学常规方法提取样本总RNA,得到的RNA保存在-80℃,防止降解。取5μlRNA用1%琼脂糖凝胶进行电泳,检测RNA的完整性(见图4)。用DNase-Ⅰ试剂盒(CWbio.Co.Ltd,Cat#CW2090)对RNA中残留的DNA进行消化处理,实验操作按说明书进行。测定标本mRNA提取纯度、浓度及总量来验证标本的质量。从标本电泳和mRNA提取情况中得到对标本组织质量控制情况的验证,所有组织标本质量高,可以用于后期分子生物学实验。用HiFi-MMLV cDNA第一链合成试剂盒(CWbio.Co.Ltd,Cat#CW0744)进行反转录,实验操作按产品说明书进行。
RealTimePCR使用Bio-Rad CFX96荧光定量PCR仪,采用2-△△CT法进行数据的相对定量分析。RealTimePCR反应体系如下(见表3),扩增程序为:95℃10min,(95℃15sec,60℃60sec)×40个循环。
表3.RealTimePCR反应体系
将各样品cDNA 10倍稀释后取2ul作模板,分别用目的基因引物和内参基因引物进行扩增(表4)。同时在60-95℃进行溶解曲线分析。
表4.样品RealTimePCR检测设计
本次qRT-PCR试验中,发现了在原发HNSCC肿瘤组织和非癌的良性淋巴结组织中差异明显的4个基因,即:TACSTD1;CK19;CK7;EGFR。各样本实时扩增曲线图和样本扩增产物溶解曲线图请见图5-8。溶解曲线均为单峰,未见非特异性扩增,PCR定量准确。按照2-△△ct相对定量计算公式,即:
计算出各样品的目的基因相对定量结果,即其他各个样品相对于对照样品(以非癌良性淋巴结1号组织为对照样本),目的基因mRNA转录水平的差异,结果数据如下(见表5-8):
表5.TACSTD1相对荧光定量数据-第一次筛选
表6.CK19相对荧光定量数据-第一次筛选
表7.CK7相对荧光定量数据-第一次筛选
表8.EGFR相对荧光定量数据-第一次筛选
经由以上数据可以看出,TACSTD1、CK19、CK7、EGFR在HNSCC患者的肿瘤组织中表达量明显高于非癌患者的良性淋巴结组织表达量,具有显著的组织学差异性。因此,将这4个基因列为初步筛选出的目标基因,进入第二次基因筛选,进一步分析目标基因在肿瘤组织、颈部阳性淋巴结、阴性淋巴结中的表达差异性。
2)第二次基因筛选:
第二次基因筛选,采用“肿瘤组织:阳性淋巴结:阴性淋巴结”的分组方式,旨在分析该基因在HNSCC患者颈部转移淋巴结中的特异性表达情况。选择来自36例原发HNSCC患者的36例肿瘤组织(其中第1-19例为第一次基因筛选的样本,数据不重复展示,请参见表5-8HNSCC瘤体标本ct值)、来自7例患者的19例病理诊断为阳性的淋巴结组织和来自10例患者的19例病理诊断为阴性的淋巴结组织,就初筛出的4个在头颈部癌组织和非癌良性淋巴结组织中表达差异性明显的目标基因进行了第二次PCR筛选。
RealTimePCR检测方法与第一次基因筛选相同,此处不再赘述。74例样本的RNA质量 检测详见图8。结果显示组织标本质量高,可以用于后期分子生物学实验。各样本实时扩增曲线图和样本扩增产物溶解曲线图请见图9-12。溶解曲线均为单峰,未见非特异性扩增,PCR定量准确。计算出各样品的目的基因相对定量结果,即其他各个样品相对于对照样品(以HNSCC阴性淋巴结2号组织为对照样本),目的基因mRNA转录水平的差异,结果数据如下(见表9-12):
表9.TACSTD1相对荧光定量数据-第二次筛选
注:HNSCC表示头颈部癌瘤体组织,PN表示头颈部癌患者阳性淋巴结组织,BN表示头颈部癌患者阴性淋巴结组织
表10.CK19相对荧光定量数据-第二次筛选
注:HNSCC表示头颈部癌瘤体组织,PN表示头颈部癌患者阳性淋巴结组织,BN表示头颈部癌患者阴性淋巴结组织
表11.CK7相对荧光定量数据-第二次筛选
注:HNSCC表示头颈部癌瘤体组织,PN表示头颈部癌患者阳性淋巴结组织,BN表示头颈部癌患者阴性淋巴结组织
表12.EGFR相对荧光定量数据-第二次筛选
注:HNSCC表示头颈部癌瘤体组织,PN表示头颈部癌患者阳性淋巴结组织,BN表示头颈部癌患者阴性淋巴结组织
根据数据可以看出,目标基因基本上符合在肿瘤组织及阳性淋巴结中高表达,在阴性淋巴结中低表达的组织学差异性。
但是仍然可以看到某个标本在某个基因的相对荧光定量结果与上述结论相悖,即病理诊断阳性的淋巴结基因表达量低(例如PN19/TACSTD1/CK19/EGFR、PN2/CK7、PN3/CK7、PN13-19/CK7、PN4/EGFR),甚至低于阴性淋巴结基因表达量;而病理诊断阴性的淋巴结基因表达量高,甚至高于阳性淋巴结基因表达量。产生这种情况的可能性有:a.由于病理切片的局限性及人为主观诊断差异而造成的误诊或漏诊,进而造成病理结果和分子生物学实验结果不一致;b.由于qRT-PCR特异性强、敏感性高所致的某个标本在某个基因上出现假阳性或假阴性可能;c.由于个体差异性和对疾病的整体综合反应而造成的某个患者在某个基因的过表达或者低表达。
因此,使用多目标基因扩增结果判断患者颈部淋巴结状态的准确性显然高于单一基因判断。但同时,选择检测的目标基因越多,诊断过程中所涉及的和患者所要承担的医疗成本和时间成本也就越大,因此对目标基因第二次筛选结果进行了进一步分析。
在此基础上,将这4种目标基因的淋巴结数据进行相关性比较后发现,CK19和CK7组合在分析颈部淋巴结的转移状态上有着更好的组织学差异性(图13),即该基因组合可以更加准确的区分头颈部鳞状细胞癌患者颈部淋巴结的性质。
3)酶联免疫吸附实验结果(Elisa实验)
以来自24名HNSCC患者的9例阳性淋巴结及15例阴性淋巴结进行Elisa实验,得到的结果如图14。根据以上结果,同样证实了CK7+CK19在HNSCC患者淋巴结检测中的组织学差异性。
实施例3:LAMP检测流程的建立
在确定了CK7、CK19以及CK7+CK19基因组合的基础上,开始着手建立LAMP实验流程。整个流程建立包括实验试剂盒缓冲底液的制备、CK19及CK7引物设计及最佳反应温度测定三个方面。而其中的核心即引物设计,在对最佳引物的筛选实验中,同时得到了适当的缓冲底液及最佳反应温度。流程建立实验选取来自36名HNSCC患者的54例肿瘤组织及来自15名非癌患者的31例良性淋巴结组织,通过建立RT-LAMP反应体系筛选最佳引物及测试反应条件。患者的入组标准同前。
1)引物设计
使用软件Primer Explorer V4设计目的基因的LAMP引物,CK7基因全序列为SEQ ID NO.1,CK19基因全序列为SEQ ID NO.2。将待扩增的DNA分为六个独立的区域,根据这六个区域分别设计LAMP反应所需的引物(内引物FIP和BIP、外引物F3和B3、环引物LB、LF;内引物和外引物为LAMP发生的必须引物,环引物LB和LF为加速引物,为LAMP发生的非必须引物,由靶序列的Tm值和GC含量共同决定能否设计出环引物,它们的设计位置以及各个引物在靶序列上的位置详见图15。
据此原则,设计4套LAMP引物扩增靶基因CK7,引物核苷酸序列分别为:SEQ ID NO.3-24;设计4套LAMP引物扩增靶基因CK7,引物核苷酸序列分别为:SEQ ID NO.25-46。
2)RT-LAMP反应体系
提取样本总RNA、电泳、消化及反转录过程同前述实验过程,在此不做赘述。
25μl反应混合物(缓冲底液)各组分及浓度见表13,同时,实验得出的反应温度为65℃,恒温反应时间为60min。
表13.RT-LAMP反应各组分及浓度
3)最佳引物筛选结果
针对CK7的最佳引物筛选,由图16可知,CK7-18发生LAMP的反应时间最短(26分钟以内),扩增曲线最高(浊度在0.71),说明CK7-18的扩增效率最高,为扩增靶序列的最佳引物。
针对CK19的最佳引物筛选,由图17可知,CK19-33发生LAMP的反应时间最短(26分钟以内),扩增曲线最高(浊度在0.51),说明CK19-33的扩增效率最高,为扩增靶序列的最佳引物;同时,引物CK19-146、CK19-115发生LAMP的反应时间也控制在36分钟以内,浊度在0.25-0.4,也能够作为临床检测扩增靶序列CK19的有效引物。
4)实验流程的建立
根据前述实验,LAMP的实验流程已经基本建立,得到了验证实验所需的基因探针,并且得到了最佳的引物设计及缓冲底,除此之外,建立的标本库也按照质控原则收取了验证性实验的样本,因此,将整个实验流程进行了总结,并准备下一步验证实验(图18)。
在验证性实验中,共收取来自84名HNSCC患者的103例淋巴结,将其按图1所示取材,a、c部分留作RT-LAMP实验,b、d部分进行包埋,制作石蜡切片,并由专门的病理科副主任医师独立阅片,确定样本的转移状态。因此,按照病理结果,将这103例淋巴结分为BN组(38例)和PN组(65例),最后,将他们的病理结果和RT-LAMP结果(扩增曲线见图19-22)对比。
表14.BN组淋巴结RT-LAMP反应时间
注:单位(M)分钟,数据保留小数点后1位
表15.PN组淋巴结RT-LAMP反应时间
注:单位(M)分钟,数据保留小数点后1位
数据结果分析:经过RT-LAMP数据分析,不难发现BN组有5例标本出现了CK7以及CK19的高表达,这与石蜡病理结果并不一致。因此,将标号为BN34-38号蜡块进行了连续切片,并且由病理科副主任医师重新阅片,最终发现了肿瘤细胞的微转移病灶(图23a-e)。充分证实了RT-LAMP检测方法的准确性及可靠性。
除此之外,由于建立反应体系时,RT-LAMP根据HNSCC患者瘤体的扩增数据显示,其扩增时间均发生在60min之内,因此,在验证实验中,超过60min仍没有明显扩增的标本,即视为阴性淋巴结。
最后,根据RT-LAMP结果,HNSCC患者病理确诊为阳性的淋巴结的扩增反应时间值数 据总结如下(表16):
表16.HNSCC患者阳性淋巴结RT-LAMP扩增反应数据
注:单位(分钟),结果保留小数点后2位
由此,以RT-LAMP技术为基础建立的HNSCC淋巴结快速诊断体系,使此类患者术中快速判定其淋巴结转移状态成为可能。
SEQUENCE LISTING
<110> 首都医科大学附属北京儿童医院
<120> 一组用于头颈鳞状细胞癌淋巴结转移速检的LAMP 引物组CK19-115
<160> 46
<170> PatentIn version 3.3
<210> 1
<211> 2000
<212> DNA
<213> CK7基因全序列
<400> 1
aaaaggcgcg gagtgtcccc gaggtcagcg agtgcgcgct cctcctcgcc cgccgctagg 60
tccatcccgg cccagccacc atgtccatcc acttcagctc cccggtattc acctcgcgct 120
cagccgcctt ctcgggccgc ggcgcccagg tgcgcctgag ctccgctcgc cccggcggcc 180
ttggcagcag cagcctctac ggcctcggcg cctcacggcc gcgcgtggcc gtgcgctctg 240
cctatggggg cccggtgggc gccggcatcc gcgaggtcac cattaaccag agcctgctgg 300
ccccgctgcg gctggacgcc gacccctccc tccagcgggt gcgccaggag gagagcgagc 360
agatcaagac cctcaacaac aagtttgcct ccttcatcga caaggtgcgg tttctggagc 420
agcagaacaa gctgctggag accaagtgga cgctgctgca ggagcagaag tcggccaaga 480
gcagccgcct cccagacatc tttgaggccc agattgctgg ccttcggggt cagcttgagg 540
cactgcaggt ggatgggggc cgcctggagg cggagctgcg gagcatgcag gatgtggtgg 600
aggacttcaa gaataagtac gaagatgaaa ttaaccaccg cacagctgct gagaatgagt 660
ttgtggtgct gaagaaggat gtggatgctg cctacatgag caaggtggag ctggaggcca 720
aggtggatgc cctgaatgat gagatcaact tcctcaggac cctcaatgag acggagttga 780
cagagctgca gtcccagatc tccgacacat ctgtggtgct gtccatggac aacagtcgct 840
ccctggacct ggacggcatc atcgctgagg tcaaggcgca gtatgaggag atggccaaat 900
gcagccgggc tgaggctgaa gcctggtacc agaccaaggt gtgaggccac caggggcgta 960
tttcctcctg ccagggtcct tggtggcagc ttcccttact cctcaacttg tctcaagcct 1020
tcagggcctg ggtcccactg ttctggcagg caccagtggt ttaagtctgt ggtgctcagc 1080
cctggagaaa atcccaagat gggaggacag ggcagaggaa atagatatgg attaatcatt 1140
ataatagcta aaatatggca agtacttaca cagtactagg ctcatgtaat tattgactca 1200
tgtaatccac agaacagccc tattagatag gcatcattat tacccccatt ttgttttatt 1260
taatttaatt tattttattt ctattttttg agatggagtc ttgctctgtc acccaggctg 1320
aagtgcagtg gtgcgatctt ggctcactgc aacctttgcc tccctggttc atgtgatcct 1380
cgtgcctcag cctcctgagt agctgggact acaggtgtgc accaccatgc ctggctaatt 1440
ttttttgtat tttgagtaga gacgaggttt caccatgctg gccaggctgg tctcaaactc 1500
ctgacctcag gtgatccacc tgcctcggcc tcccaaagtg ctgggattat aggcgtgaga 1560
caccgcaccc agcctattac ccccatttaa agatgaggaa attgaggcac agagaggtta 1620
agtaatttgc ctaactgcat acagctagta gatggaagag cagggactaa atcctgaatg 1680
tgagggccct agacctggga ggcttaatca tcacatctac ttcatggtgg caggacagtt 1740
gatggtgcag gggctgaggg agcaggagtg ggtgctgggg tgaaccagtg ttcctgaaga 1800
agggatcccg aggcaaggat tgagaggtct gcccctgcag agatagagag tcattcatgg 1860
tgcctgggtg agaacacaag tatgccaaca agaagacctg ggttcaggcc ctcgttccat 1920
cactgattgg ctgtgtgatc cctgggtggt gctttctctt ctccaagact cactctcctc 1980
acctgtgaaa tgggtgttct 2000
<210> 2
<211> 1490
<212> DNA
<213> CK19基因全序列
<400> 2
agatatccgc ccctgacacc attcctccct tcccccctcc accggccgcg ggcataaaag 60
gcgccaggtg agggcctcgc cgctcctccc gcgaatcgca gcttctgaga ccagggttgc 120
tccgtccgtg ctccgcctcg ccatgacttc ctacagctat cgccagtcgt cggccacgtc 180
gtccttcgga ggcctgggcg gcggctccgt gcgttttggg ccgggggtcg cctttcgcgc 240
gcccagcatt cacgggggct ccggcggccg cggcgtatcc gtgtcctccg cccgctttgt 300
gtcctcgtcc tcctcggggg cctacggcgg cggctacggc ggcgtcctga ccgcgtccga 360
cgggctgctg gcgggcaacg agaagctaac catgcagaac ctcaacgacc gcctggcctc 420
ctacctggac aaggtgcgcg ccctggaggc ggccaacggc gagctagagg tgaagatccg 480
cgactggtac cagaagcagg ggcctgggcc ctcccgcgac tacagccact actacacgac 540
catccaggac ctgcgggaca agattcttgg tgccaccatt gagaactcca ggattgtcct 600
gcagatcgac aatgcccgtc tggctgcaga tgacttccga accaagtttg agacggaaca 660
ggctctgcgc atgagcgtgg aggccgacat caacggcctg cgcagggtgc tggatgagct 720
gaccctggcc aggaccgacc tggagatgca gatcgaaggc ctgaaggaag agctggccta 780
cctgaagaag aaccatgagg aggaaatcag tacgctgagg ggccaagtgg gaggccaggt 840
cagtgtggag gtggattccg ctccgggcac cgatctcgcc aagatcctga gtgacatgcg 900
aagccaatat gaggtcatgg ccgagcagaa ccggaaggat gctgaagcct ggttcaccag 960
ccggactgaa gaattgaacc gggaggtcgc tggccacacg gagcagctcc agatgagcag 1020
gtccgaggtt actgacctgc ggcgcaccct tcagggtctt gagattgagc tgcagtcaca 1080
gctgagcatg aaagctgcct tggaagacac actggcagaa acggaggcgc gctttggagc 1140
ccagctggcg catatccagg cgctgatcag cggtattgaa gcccagctgg gcgatgtgcg 1200
agctgatagt gagcggcaga atcaggagta ccagcggctc atggacatca agtcgcggct 1260
ggagcaggag attgccacct accgcagcct gctcgaggga caggaagatc actacaacaa 1320
tttgtctgcc tccaaggtcc tctgaggcag caggctctgg ggcttctgct gtcctttgga 1380
gggtgtcttc tgggtagagg gatgggaagg aagggaccct tacccccggc tcttctcctg 1440
acctgccaat aaaaatttat ggtccaaggg aaaaaaaaaa aaaaaaaaaa 1490
<210> 3
<211> 20
<212> DNA
<213> CK7-9F3
<400> 3
cccagatctc cgacacatct 20
<210> 4
<211> 20
<212> DNA
<213> CK7-9B3
<400> 4
cctgaaggct tgagacaagt 20
<210> 5
<211> 43
<212> DNA
<213> CK7-9FIP
<400> 5
ccttgacctc agcgatgatg ccttggtgct gtccatggac aac 43
<210> 6
<211> 42
<212> DNA
<213> CK7-9BIP
<400> 6
gaagcctggt accagaccaa ggttgaagct gccaccaagg ac 42
<210> 7
<211> 19
<212> DNA
<213> CK7-9LB
<400> 7
aggccaccag gggcgtatt 19
<210> 8
<211> 18
<212> DNA
<213> CK7-18F3
<400> 8
gtcacccagg ctgaagtg 18
<210> 9
<211> 20
<212> DNA
<213> CK7-18B3
<400> 9
acctgaggtc aggagtttga 20
<210> 10
<211> 42
<212> DNA
<213> CK7-18FIP
<400> 10
actcaggagg ctgaggcacg ttgatcttgg ctcactgcaa cc 42
<210> 11
<211> 42
<212> DNA
<213> CK7-18BIP
<400> 11
gactacaggt gtgcaccacc attgcatggt gaaacctcgt ct 42
<210> 12
<211> 21
<212> DNA
<213> CK7-18L
<400> 12
aggatcacat gaaccaggga g 21
<210> 13
<211> 20
<212> DNA
<213> CK7-2F3
<400> 13
gtggatgccc tgaatgatga 20
<210> 14
<211> 18
<212> DNA
<213> CK7-2B3
<400> 14
accaggcttc agcctcag 18
<210> 15
<211> 44
<212> DNA
<213> CK7-2FIP
<400> 15
acagcaccac agatgtgtcg gattcttcct caggaccctc aatg 44
<210> 16
<211> 41
<212> DNA
<213> CK7-2BIP
<400> 16
ggacaacagt cgctccctgg ttccatctcc tcatactgcg c 41
<210> 17
<211> 19
<212> DNA
<213> CK7-2LF
<400> 17
gcagctctgt caactccgt 19
<210> 18
<211> 18
<212> DNA
<213> CK7-2LB
<400> 18
acctggacgg catcatcg 18
<210> 19
<211> 20
<212> DNA
<213> CK7-6F3
<400> 19
gtggatgccc tgaatgatga 20
<210> 20
<211> 18
<212> DNA
<213> CK7-6B3
<400> 20
accaggcttc agcctcag 18
<210> 21
<211> 44
<212> DNA
<213> CK7-6FIP
<400> 21
acagcaccac agatgtgtcg gattccctca atgagacgga gttg 44
<210> 22
<211> 41
<212> DNA
<213> CK7-6BIP
<400> 22
ggacaacagt cgctccctgg ttccatctcc tcatactgcg c 41
<210> 23
<211> 18
<212> DNA
<213> CK7-6LF
<400> 23
ctgggactgc agctctgt 18
<210> 24
<211> 18
<212> DNA
<213> CK7-6LB
<400> 24
acctggacgg catcatcg 18
<210> 25
<211> 16
<212> DNA
<213> CK19-33F3
<400> 25
caggacctgc gggaca 16
<210> 26
<211> 17
<212> DNA
<213> CK19-33B3
<400> 26
tgcatctcca ggtcggt 17
<210> 27
<211> 43
<212> DNA
<213> CK19-33FIP
<400> 27
ccagacgggc attgtcgatc tttattcttg gtgccaccat tga 43
<210> 28
<211> 40
<212> DNA
<213> CK19-33BIP
<400> 28
gagacggaac aggctctgcg ttgccagggt cagctcatcc 40
<210> 29
<211> 17
<212> DNA
<213> CK19-33LB
<400> 29
cgacatcaac ggcctgc 17
<210> 30
<211> 16
<212> DNA
<213> CK19-84F3
<400> 30
cgctgagggg ccaagt 16
<210> 31
<211> 16
<212> DNA
<213> CK19-84B3
<400> 31
gcgacctccc ggttca 16
<210> 32
<211> 43
<212> DNA
<213> CK19-84FIP
<400> 32
tggcttcgca tgtcactcag gattggtcag tgtggaggtg gat 43
<210> 33
<211> 41
<212> DNA
<213> CK19-84BIP
<400> 33
atatgaggtc atggccgagc agttcagtcc ggctggtgaa c 41
<210> 34
<211> 21
<212> DNA
<213> CK19-84LB
<400> 34
ccggaaggat gctgaagcct g 21
<210> 35
<211> 16
<212> DNA
<213> CK19-146F3
<400> 35
tcgctggcca cacgga 16
<210> 36
<211> 18
<212> DNA
<213> CK19-146B3
<400> 36
gctgggcttc aataccgc 18
<210> 37
<211> 43
<212> DNA
<213> CK19-146FIP
<400> 37
gctcagctgt gactgcagct cattctccag atgagcaggt ccg 43
<210> 38
<211> 40
<212> DNA
<213> CK19-146BIP
<400> 38
tgccttggaa gacacactgg cttcagcgcc tggatatgcg 40
<210> 39
<211> 17
<212> DNA
<213> CK19-146LF
<400> 39
agaccctgaa gggtgcg 17
<210> 40
<211> 19
<212> DNA
<213> CK19-146LB
<400> 40
agaaacggag gcgcgcttt 19
<210> 41
<211> 19
<212> DNA
<213> CK19-115F3
<400> 41
agtgacatgc gaagccaat 19
<210> 42
<211> 20
<212> DNA
<213> CK19-115B3
<400> 42
gctttcatgc tcagctgtga 20
<210> 43
<211> 43
<212> DNA
<213> CK19-115FIP
<400> 43
agcgacctcc cggttcaatt ctttcgagca gaaccggaag gat 43
<210> 44
<211> 43
<212> DNA
<213> CK19-115BIP
<400> 44
cacacggagc agctccagat gtttgcagct caatctcaag acc 43
<210> 45
<211> 19
<212> DNA
<213> CK19-115LF
<400> 45
tggtgaacca ggcttcagc 19
<210> 46
<211> 19
<212> DNA
<213> CK19-115LB
<400> 46
agcaggtccg aggttactg 19
- 还没有人留言评论。精彩留言会获得点赞!