一种小鼠肠道固有层原代树突状细胞的分离方法与流程
本发明属于生物领域,涉及一种小鼠肠道固有层原代树突状细胞的分离方法。
背景技术:
肠道主要由上皮层、固有层及浆膜层构成,其中上皮层主要为一层扁平上皮细胞,而固有层内含有种类丰富、数目繁多的免疫细胞,是哺乳动物识别、捕获经消化道进入体内的外界病原微生物的重要场所,肠道固有层免疫紊乱与感染、肿瘤、炎症性肠病等多种疾病密切相关。树突状细胞是最重要的免疫细胞之一,针对树突状细胞的研究有助于提升抗感染、抗肿瘤等临床诊疗水平,改善广大患者的预后。对肠道固有层中的原代树突状细胞进行分离、纯化是开展此类研究的前提条件之一。
当前原代细胞分离的主要方法包括:机械解离法、酶学解离法与螯合剂解离法。机械解离法多采用剪刀剪切、吸管吹打、注射针头或纱网挤压过滤等方法分散组织细胞。此法虽然简便快速,但对细胞的机械损伤过大、分散效果差,因此极少用于原代细胞的分离。酶学解离法多使用胰蛋白酶或胶原酶,利用酶对细胞间质或细胞间连接的消化作用,达到使原代细胞分离的目的,但此方法具有消化时间长(对细胞的潜在毒性大)、酶浓度与活力欠稳定、对环境温度及PH要求高等不足,因此适用范围偏窄。螯合剂解离法常使用EDTA(Ethylene Diamine Tetraacetic Acid,乙二胺四乙酸),EDTA能够与细胞表面的钙、镁等二价离子结合形成螯合物,结合后的机械力能够使细胞变圆而分离。该法具有解离时间短、解离效应稳定、对环境要求低(不需要恒温、恒定PH等)等优势,尤其适用于上皮细胞的解离,但对原代细胞的损伤程度大于酶学解离法。另外,在原代细胞分离过程中,由于部分组织细胞被破坏,释放出核内的染色质,这些染色质具有很强的粘性,导致原代细胞间显著粘连,甚至形成胶冻状,严重阻碍细胞的进一步解离。
目前分离固有层细胞的主要方法是将小肠剪切为3-4cm片段,再加入消化酶(如胶原酶IV)或螯合剂(如EDTA)对细胞进一步分离。此方法的弊端包括:①对小肠多次剪切导致机械性损伤过大;②未将上皮层、固有层与浆膜层的细胞逐一消化,混合消化势必造成上皮层与浆膜层细胞对固有层细胞干扰过大、固有层细胞纯度显著降低;③树突状细胞具有敏感、脆弱、易死亡等特点,单纯酶学解离法消化时间过长、单纯螯合剂解离法细胞损伤过重,因此均难以达到满意效果。
技术实现要素:
本发明的目的是针对现有技术的上述不足,提供一种小鼠肠道固有层原代树突状细胞的分离方法。
本发明的目的可通过如下技术方案实现:
一种小鼠肠道固有层原代树突状细胞的分离方法,包括将肠管剪切为10-12cm的肠段,洗脱肠管表面杂质和肠管表面粘液后,以含EDTA和EGTA的消化液B洗脱肠上皮细胞层,再以含Liberase TL和DNase I的消化液C消化;最后以流式细胞仪进行分选得到小鼠肠道固有层原代树突状细胞。
一种小鼠肠道固有层原代树突状细胞的分离方法,优选包括如下步骤:
(1)将肠管剪切为每段长10-12cm的肠段,用聚乙烯细管将肠管翻转并用细线结扎固定,使肠管肠上皮细胞层暴露,并浸泡在装有平衡盐溶液B的试管中,并多次摇晃试管、更换平衡盐溶液B以洗脱肠管表面杂质;
(2)将平衡盐溶液B更换为消化液A,摇晃试管以洗脱肠管表面粘液;
(3)将消化液A更换为平衡盐溶液B,使用平衡盐溶液B再次清洗肠管多次,以中和消化液A;
(4)将平衡盐溶液B更换为消化液B,多次摇晃试管、更换新的消化液B,以洗脱肠上皮细胞层;所述的消化液B为含25-35mM EDTA及25-35mM EGTA的不含钙镁离子的PBS;
(5)将消化液B更换为平衡盐溶液B,使用平衡盐溶液B再次清洗肠管多次,以中和消化液B;
(6)将肠管自试管中取出,放入无菌平板培养皿中,加入消化液C,放入细胞培养箱,37℃、5%CO2消化80分钟后取出;消化液C为含10%FBS的DMEM培养基+Liberase TL+DNase I,其中Liberase TL终浓度:0.1-0.2mg/ml,DNase I终浓度:150-250U/ml;
(7)用移液枪轻柔吹打试管表面数次,将培养液经100um滤网过滤后,于4℃条件下离心1600rpm、5分钟,收集沉淀;
(8)用1ml稀释后抗体混悬步骤(7)所得细胞团,室温下离心3000rpm、3分钟,收集沉淀即得所述的固有层原代树突状细胞;所述的抗体选自DAPI、CD11c、MHC-II、CD103或CD11b中的一种或多种。
所述的平衡盐溶液B优选不含钙镁离子的PBS。
所述的消化液A优选含1mM DTT的不含钙镁离子的PBS。
所述的消化液B优选含30mM EDTA及30mM EGTA的不含钙镁离子的PBS。
所述的消化液C中Liberase TL终浓度优选为0.167mg/ml,DNase I终浓度优选为200U/ml。
步骤(8)中优选以流式缓冲液稀释抗体,抗体的稀释比为1:100。
所述的流式缓冲液为含钙镁离子的PBS+5%FBS。
所述的流式细胞仪分选时设置DAPI-CD11c+MHCII+即可得到固有层树突状细胞;或在此基础上,同时加做CD103或CD11b染色以行树突状细胞亚群分选或分析。
本发明中所述的含钙镁离子的PBS和不含钙镁离子的PBS的PH均为7.0-7.6,优选7.3;其他成分构成与普通PBS液一致。
有益效果:
针对现有技术的弊端,本发明提出将小肠平均剪切为4段,每段10-12cm,减少多次剪切造成的机械性损伤;然后将4段肠管分别翻转固定于聚乙烯细管表面(内径1.57mm,外径2.08mm)(Becton Dickinson,#427446),使上皮层暴露;进而利用螯合剂解离法解离效力强的优点,将上皮层解离、洗脱,使固有层暴露,再利用酶学解离法消化彻底、细胞损伤小的优点,对暴露的固有层进行特异性消化。因此,本发明减少了机械解离法的损伤,结合了螯合剂解离法与酶学解离法的各自优势,适用于固有层树突状细胞的分离。此外,本发明在在消化液方面也做出了较大改进。首先,本发明在EDTA中加入EGTA(Ethylene Glycol Tetraacetic Acid,乙二醇四乙酸)提高对肠上皮细胞层的解离、移除效能,缩短螯合剂对固有层细胞的潜在毒性作用时间;其次,本发明构建新型消化酶(Liberase TL)与脱氧核糖核酸酶I(DNase I,Deoxyribonuclease I)的混合物用于固有层原代细胞的消化解离。其中Liberase TL为高纯度胶原酶I/II搭载低浓度中性蛋白酶的混合型消化酶,并剔除了对细胞活性有负面效应的内毒素以及梭菌蛋白酶与胰蛋白酶等杂酶,有助于提升细胞产率、活性及功能性;DNase I为一种能够消化单链或双链DNA的核酸内切酶,在本发明中用于消化受损细胞释放出的染色质,抑制细胞间“胶冻结构”的形成,为进一步获取固有层树突状细胞提供有利条件。利用本发明所述方法分离得到的原代树突状细胞纯度高、表型特征完整。
附图说明
图1肠管翻转固定示意图
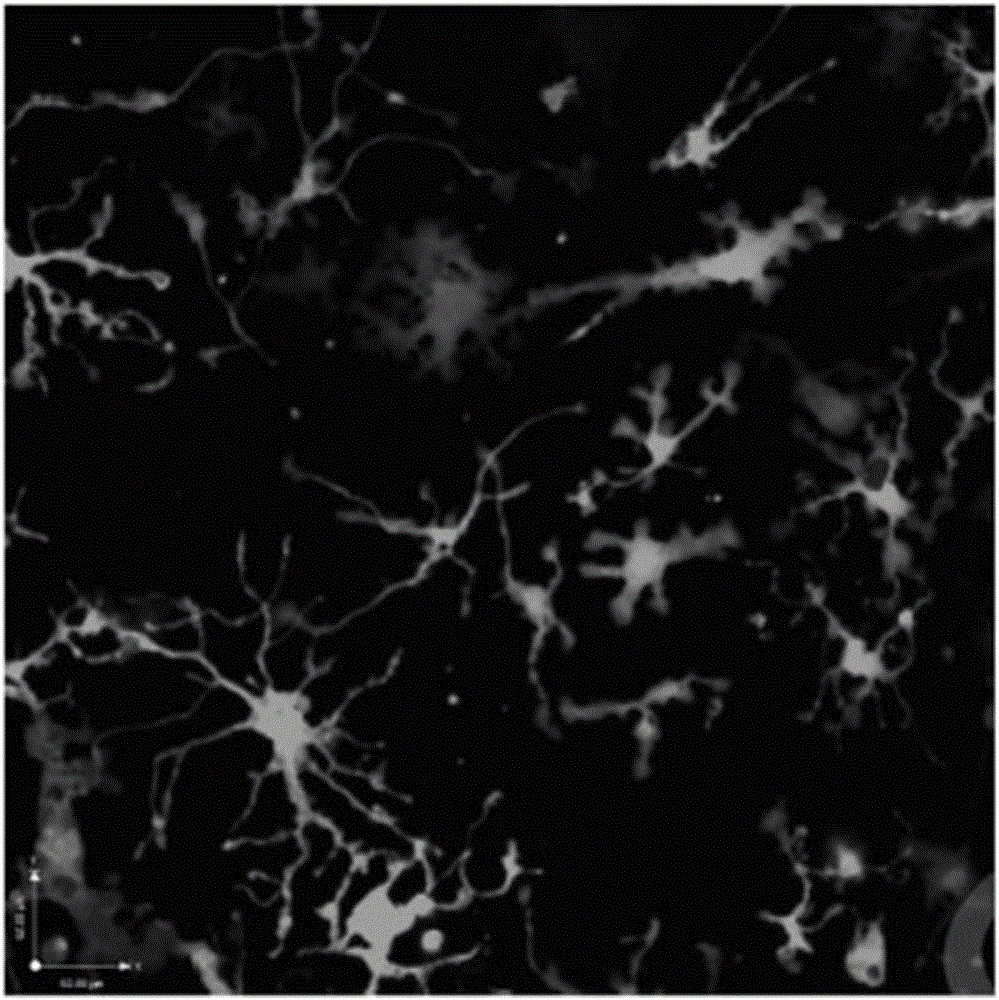
图2短期原代培养后的树突状细胞
图3原代树突状细胞的表型鉴定
(左图)表达CD11c与MHC-II的细胞(即图中方框圈出的CD11c+MHCII+)即为活的树突状细胞;(右图)对树突状细胞进一步进行亚群鉴定,可见三类树突状细胞亚群(即CD103-CD11b+、CD103+CD11b+、CD103+CD11b-)均清晰可见。
具体实施方式
实施例1
1.将小鼠常规CO2处死后,剪刀纵行剖开腹壁及腹膜,暴露腹腔脏器,剪刀截取自十二指肠至回盲部的全部小肠,放入平衡盐溶液A中暂存;
2.将小肠平均剪切为4段(每段长约10-12cm),丝线结扎肠段一端,用聚乙烯细管将肠段翻转至细管表面(使肠管内表面外露)并用丝线结扎固定(如图1),放入装有12ml平衡盐溶液B的15ml试管中;
3.手动摇晃试管2分钟后,更换新的12ml平衡盐溶液B,再摇晃2分钟,如此重复共3次,以洗脱肠管表面粪渣等杂质;
4.加入12ml消化液A,手动摇晃10分钟以洗脱肠管表面粘液;
5.如步骤3,使用平衡盐溶液B再次清洗2次,以中和消化液A;
6.加入10ml消化液B,手动摇晃试管6分钟,更换新的10ml消化液B,再摇晃6分钟,以洗脱肠上皮细胞层;
7.如步骤3,使用平衡盐溶液B再次清洗3次,以中和消化液B;
8.将肠管自试管中取出,放入直径10cm无菌平板培养皿中,加入20ml消化液C,放入细胞培养箱(37℃、5%CO2)消化80分钟后取出;
9.用移液枪轻柔吹打试管表面数次,将培养液经100um滤网过滤后,于4℃条件下离心1600rpm、5分钟,收集沉淀(即固有层细胞团)后用流式细胞仪进行细胞分选;
10.树突状细胞流式分选常用抗体包括DAPI、CD11c、MHC-II、CD103、CD11b等,用1ml稀释后抗体(含990ul流式缓冲液与10ul抗体原液、稀释比1:100)混悬第9步所得细胞团,室温下离心3000rpm、3分钟,收集沉淀;
用流式缓冲液重悬沉淀,上机流式细胞仪,设置DAPI-CD11c+MHCII+即可得到固有层树突状细胞,结果如图2,由图可见激光共聚焦显微镜下可见原代树突状细胞的树突充分伸展,表明细胞活性良好。同时加做CD103或CD11b染色以行树突状细胞亚群分选或分析,结果如图3,由图可见利用本发明所述方法分离得到的原代树突状细胞纯度较高、表型特征完整。
其中,使用的主要试剂的配方及来源:
平衡盐溶液A:含钙镁离子的PBS(Lonza#17-513F)
平衡盐溶液B:不含钙镁离子的PBS(Lonza#17-517Q)
消化液A:DTT+不含钙镁离子的PBS(终浓度:1mM)
消化液B:EDTA+EGTA+不含钙镁离子的PBS(EDTA终浓度:30mM、EGTA终浓度:30mM)
消化液C:DMEM(含10%FBS)+Liberase TL+DNase I(Liberase TL终浓度:0.167mg/ml、DNase I终浓度:200U/ml)
流式缓冲液:含钙镁离子的PBS+FBS(FBS终浓度:5%)
试剂原液:
DTT:Sigma#000000010197777001
EDTA:Boston BioProducts,#BM-150
EGTA:Boston BioProducts,#BM-151
Liberase TL Research Grade:Sigma#000000005401020001
DNase I:Roche#104159
DMEM:Gibco#11965-092
FBS:Hyclone#SH30396
不含钙镁离子的PBS:Lonza#17-517Q
含钙镁离子的PBS:Lonza#17-513F
对比例1
将小鼠常规处死、剪取全部小肠后,将小肠平均剪切为3-4cm片段,放入PBS液中稍加清洗,加入用DMEM(含10%FBS)稀释的胶原酶IV(0.5mg/ml),放入细胞培养箱(37℃、5%CO2)消化80分钟后取出,将细胞悬液经100um滤网过滤后,于4℃条件下离心1600rpm、5分钟,收集沉淀(即固有层细胞团)后用流式细胞仪进行细胞分选。
对比例2
将小鼠常规处死、剪取全部小肠后,将小肠平均剪切为3-4cm片段,放入PBS液中稍加清洗,加入用DMEM(含10%FBS)稀释的EDTA(30mM),放入细胞培养箱(37℃、5%CO2)消化80分钟后取出,将细胞悬液经100um滤网过滤后,于4℃条件下离心1600rpm、5分钟,收集沉淀(即固有层细胞团)后用流式细胞仪进行细胞分选。
对比例3
将小鼠常规处死、剪取全部小肠后,将小肠平均剪切为4段(每段长约10-12cm),用聚乙烯细管将肠段翻转至细管表面,放入PBS液中手动摇晃试管2分钟并重复共3次,以洗脱肠管表面粪渣等杂质;加入用PBS稀释的DTT(1mM)手动摇晃10分钟以洗脱肠管表面粘液;使用PBS液再次清洗2次,以中和DTT;加入用PBS稀释的EDTA(30mM),手动摇晃试管6分钟,重复2次以洗脱肠上皮细胞层;使用PBS液再次清洗3次,以中和EDTA;将肠管自试管中取出,放入直径10cm无菌平板培养皿中,加入用DMEM(含10%FBS)稀释的胶原酶IV(0.5mg/ml),放入细胞培养箱(37℃、5%CO2)消化80分钟后取出,将细胞悬液经100um滤网过滤后,于4℃条件下离心1600rpm、5分钟,收集沉淀(即固有层细胞团)后用流式细胞仪进行细胞分选。
表1
由表1可看出,本发明方法较之传统的单一酶法\螯合剂法分离得到的原代树突状细胞纯度更高、表型特征更完整,得到的树突状细胞量也更多。而且对比例3的数据也反映出消化液配方的改进给分离效果的提高带来了相当积极的影响。
- 还没有人留言评论。精彩留言会获得点赞!