一种耐干扰素的HBV细胞系模型的建立方法及其在制备抗HBV药物中的应用与流程
本发明涉及一种乙肝病毒的细胞诱导方法,尤其涉及的是一种耐干扰素的HBV细胞系模型的建立方法及其在制备抗HBV药物中的应用。
背景技术:
干扰素IFNα具有抗病毒和免疫调节的双重作用,是目前用于慢性乙型肝炎(CHB)治疗的主要药物之一。近年来开发的长效干扰素,如PEG-IFNα、rHSA-IFNα,克服了普通干扰素半衰期短的缺点,提高了患者的依从性。但不管是普通干扰素还是长效干扰素,长期应用后其抗乙肝病毒HBV、丙肝病毒HCV作用会出现明显下降,肝炎病毒容易对之产生耐药性,如普通IFNα治疗半年后,只有26%的CHB患者获得稳定的疗效,而PEG-IFNα的稳定疗效率也只有29%。rHSA-IFNα对CHB的长期疗效还不确切,但有HCV对rHSA-IFNα产生耐药性的报道。HBV对IFN产生耐药已严重限制了干扰素类药物的使用,对人类战胜HBV带来新的挑战。探索HBV耐干扰素的机制,并寻找相应的干预措施来延缓耐药性的产生,将是恢复干扰素抗HBV作用的关键,而建立耐干扰素的HBV细胞模型又是探索机制和寻找干预措施的关键。
HBV耐药是限制IFNα-2b使用的主要因素,建立体外耐药细胞模型是研究耐药机制的重要手段之一。目前建立耐药细胞系的方法主要有体外药物诱导法和耐药基因转染法,其中药物诱导法包括低浓度长期维持法和间歇大剂量冲击逐步增加剂量法。前者是最常见的方法,此法循序渐进,筛选成功的把握较大,建立的耐药株耐药性较稳定,需要时间短。目前国内外还没有建立耐IFN的HBV细胞模型的报道。
技术实现要素:
本发明的目的在于克服现有技术的不足,提供了一种耐干扰素的HBV细胞系模型的建立方法及其在制备抗HBV药物中的应用,建立HBV耐药细胞系模型。
本发明是通过以下技术方案实现的,本发明包括以下步骤:
(1)培养HBV体外转染细胞株HepG2.2.15;
(2)将低浓度10~70IU·mL-1的干扰素IFNα-2b加入到细胞株HepG2.2.15中,同时加入遗传霉素G418进行长期诱导12~48wk获得HepG2.2.15/IFNα-2b细胞系模型。
所述步骤(1)中,在培养基DMEM中加入80mg·L-1G418、10%胎牛血清,2mmol/L谷氨酰胺,100IU/mL青、链霉素;pH7.2~7.4,所用培养条件为37℃,5%CO2,待细胞长成单层后,0.25%胰蛋白酶消化,每3~4d传代一次,获得HepG2.2.15。
所述步骤(2)中,HepG2.2.15细胞计数后分组,培养液中分别加入终浓度为0、10、30、50、70IU·mL-1的IFNα-2b,同时加380mg·L-1G418诱导,培养3~4d,待细胞长满后消化计数再培养,持续诱导培养12~48wk获得HepG2.2.15/IFNα-2b细胞系模型。
本发明还包括以下步骤:在HepG2.2.15/IFNα-2b细胞系模型中加入最佳药效浓度的干扰素IFNα-2b,确定最佳刺激浓度和刺激时间。
所述最佳药效浓度的确定方法如下:
取HepG2.2.15细胞消化后计数,配制成3×104个mL-1接种于96孔培养板,2h后待细胞完全贴壁,分别给予不同浓度的IFNα-2b,阴性对照组不给药。继续培养96h,收集细胞上清液,HepG2.2.15细胞分泌标志物HBsAg、HBeAg、HBV DNA的受抑制程度最高的浓度为最佳药效浓度。
所述最佳刺激浓度的确定方法如下:
取刺激12wk的各组细胞,调整细胞浓度为3×104个mL-1,接种于96孔培养板,每孔100μL,2h后待细胞完全贴壁,移除培养液,加入含有最佳药效浓度的IFNα-2b培养液,96h后收集细胞上清液,比较不同刺激浓度的各组细胞上清液中HBsAg、HBeAg、HBV DNA的变化,从而确定最佳刺激浓度。
所述最佳刺激时间的确定方法如下:
选取上述最佳刺激浓度分别刺激不同刺激时间的细胞,调整细胞浓度为3×104个mL-1,接种于96孔培养板,每孔100μL,2h后待细胞完全贴壁,移除培养液,加入含有最佳药效浓度的IFNα-2b培养液,96h后收集细胞上清液,比较不同刺激时间的各组细胞上清液中HBsAg、HBeAg、HBV DNA的变化,从而确定最佳刺激时间。
一种所述耐干扰素的HBV细胞系模型的建立方法在制备抗HBV药物中的应用。
本发明相比现有技术具有以下优点:本发明工艺路线简单,建立耐干扰素的HBV细胞模型,为进一步探索HBV对干扰素产生耐药的机制提供实验基础,为新型抗HBV药物的筛选和开发提供思路。
附图说明
图1是IFNα-2b对HepG2.2.15细胞分泌标志物的影响;
图2是最佳药效浓度的IFNα-2b对不同刺激浓度的细胞分泌标志物的影响;
图3是最佳药效浓度的IFNα-2b对不同刺激时间的细胞分泌标志物的影响。
具体实施方式
下面对本发明的实施例作详细说明,本实施例在以本发明技术方案为前提下进行实施,给出了详细的实施方式和具体的操作过程,但本发明的保护范围不限于下述的实施例。
本发明的药物和试剂为:
干扰素IFNα-2b为安科生物工程股份有限公司产品(安达芬,600万IU·mL-1),DMEM高糖培养基、胎牛血清为美国Gibicol公司产品,胰蛋白酶为美国Hyclone公司产品,遗传霉素G418为美国Amresco公司产品,ELISA酶联免疫试剂盒、HBV核酸定量检测试剂盒均为上海科华生物技术有限公司产品,其余试剂均为国产分析纯。
本发明使用的检测仪器为:
实时定量PCR(qRT-PCR)仪(美国Applied Biosystems公司),Emax Plus酶标仪,IX51型倒置显微镜(日本OLYMPUS公司),3110型水套式CO2培养箱(美国Thermo)公司)。
实施例1
细胞培养:
HBV体外转染细胞株HepG2.2.15细胞系购自上海博冬生物科技有限公司。本实施例所用细胞均为此细胞,所用培养液均为DMEM中加入380mg·L-1G418,10%胎牛血清,2mmol/L谷氨酰胺,100IU/mL青、链霉素,pH7.2~7.4,所用培养条件均为37℃,5%CO2,待细胞长成单层后,0.25%胰蛋白酶消化,每3~4d传代一次。
耐药细胞株的诱导:
HepG2.2.15细胞计数后分为五组,培养液中分别加入IFNα-2b(终浓度分别为0、10、30、50、70IU·mL-1),同时加G418(380mg·L-1)诱导,培养3~4d,待细胞长满后消化计数再培养,按此方法持续诱导培养12个月,每个月收集细胞上清液并留取培养细胞冻存。
HepG2.2.15细胞是将ayw亚型HBV-DNA导入体外培养的人肝癌细胞系HepG2细胞而获得的转染细胞系,可稳定表达HBV的全部病毒标志,包括乙肝病毒的脱氧核糖核酸HBV-DNA(即乙肝病毒基因)、乙肝表面抗原HBsAg、乙型肝炎病毒e抗原HBeAg、乙型肝炎核心抗原HBcAg等。HepG2.2.15细胞是较成熟的抗HBV研究体外细胞模型,广泛用于HBV感染及药物抗HBV作用及机制等方面的研究。
实施例2
本实施例用于确定IFNα-2b对HepG2.2.15细胞分泌标志物的影响,比较不同浓度的IFNα-2b对HBsAg、HBeAg、HBV DNA表达的影响,从而确定最佳药效浓度。
取HepG2.2.15细胞消化后计数,配制成3×104个mL-1接种于96孔培养板(分7组,每组6个复孔),2h后待细胞完全贴壁,分别给予不同浓度的IFNα-2b(250、500、750、1000、1250、1500IU·mL-1),阴性对照组不给药。继续培养96h,收集细胞上清液。
细胞培养上清HBsAg和HBeAg检测按ELISA试剂盒说明书分别检测HBsAg、HBeAg在450nm处的OD值。根据标准品浓度和相应的OD值作出标准曲线,计算样品OD值对应的浓度,单位为ng·mL-1。按下式计算抗原抑制率。
抗原抑制率(%)=[对照孔HBsAg(或HBeAg)浓度—实验孔HBsAg(或HBeAg)浓度]/对照孔HBsAg(或HBeAg)浓度×100%
细胞培养上清HBV DNA定量测定:按照HBV DNA荧光定量检测试剂盒说明书操作,分别取上述不同浓度的IFNα-2b(250、500、750、1000、1250、1500IU·mL-1)刺激后收集的细胞培养上清100μL,沸水浴10min,13000rpm离心10min,取2μL作为PCR模板,与标准品一起进行实时定量PCR,反应体系为30μL,反应条件:50℃2min;94℃2min;(94℃10s,60℃30s)×40个循环。根据标准品HBV DNA浓度和相应的Ct值作出标准曲线,计算样品Ct值对应的HBV DNA浓度,单位为IU·mL-1
HBV DNA抑制率(%)=[对照孔HBV DNA浓度—实验孔HBV DNA)浓度]/对照孔HBV DNA浓度×100%。
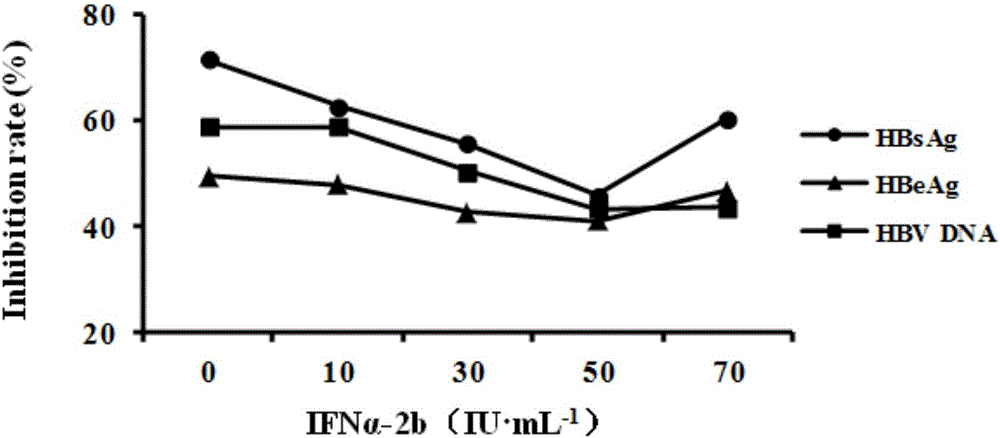
如图1所示,HepG2.2.15细胞经不同浓度的IFNα-2b处理96h后,HBsAg、HBeAg和HBV DNA的分泌均受到不同程度的抑制,且呈剂量依赖关系。当IFNα-2b的剂量为500IU·mL-1时,对上述三项标志物的分泌已有明显的抑制,随着剂量增加,抑制进一步增强。当剂量为1250IU·mL-1,HBsAg、HBeAg、HBV DNA复制抑制率接近顶峰(抑制率分别为72.2%、49.3%、58.8%),当剂量加至1500IU·mL-1时,HBsAg、HBeAg和HBV DNA抑制率增加较缓慢。因此可认为1250IU·mL-1为最佳药效浓度。
其他实施方式和实施例1相同。
实施例3
本实施例用于确定最佳的刺激浓度。
选取刺激12wk的各组细胞,调整细胞浓度为3×104个mL-1,接种于96孔培养板,每孔100μL,2h后待细胞完全贴壁,移除培养液,加入实施例2确定的含有最佳药效浓度的IFNα-2b培养液,阴性对照组不加任何药物,每组设6个复孔,96h后收集细胞上清液,比较不同刺激浓度的各组细胞上清液中HBsAg、HBeAg、HBV DNA的变化,从而确定最佳刺激浓度。
采用SPSS 17.0统计软件,计量资料以表示,多组间比较采用单因素方差分析,以P<0.05为差异有统计学意义。
1、IFNα-2b对各组细胞HBsAg表达的抑制作用
结果显示,共有六组,其中第1组为未给药组,给药组分泌的HBsAg显著低于未给药组(第1组)(p<0.01),表明IFNα-2b(1250IU·mL-1)可显著抑制HBsAg的表达。刺激组(第3、4、5、6组)分泌的HBsAg明显高于未刺激组(第2组)(p<0.01),表明经低浓度IFNα-2b(分别为10、30、50、70IU·mL-1)刺激后,HBsAg对IFNα-2b(1250IU·mL-1)的敏感性降低。各组间比较,30IU·mL-1组和50IU·mL-1组抑制率明显低于10IU·mL-1组和70IU·mL-1组(p<0.05),其中50IU·mL-1组抑制率明显低于30IU·mL-1组(P<0.01)。见表1。
表1 IFNα-2b对各组细胞HBsAg表达的抑制作用(n=6)
注:与第1组比较:1)1)P<0.01;与2组比较:2)2)P<0.01;与4组比较:3)3)P<0.01,3)P<0.05;与5组比较:4)4)P<0.01
2、IFNα-2b对各组细胞HBeAg表达的抑制作用
结果显示,给药组分泌的HBeAg显著低于未给药组(第1组)(p<0.01),表明IFNα-2b(1250IU·mL-1)可显著抑制HBeAg的表达,刺激组(第4、第5组)分泌的HBeAg明显高于未刺激组(第2组)(p<0.05),表明经低浓度IFNα-2b(分别为30、50IU·mL-1)刺激后,HBeAg对IFNα-2b(1250IU·mL-1)的敏感性降低。各组间比较,30IU·mL-1组与50IU·mL-1组抑制率相当,差异无统计学意义(P>0.05)。见表2。
表2 IFNα-2b对各组细胞HBeAg表达的抑制作用(n=6)
注:与1组比较:1)1)P<0.01;与2组比较:2)2)P<0.01,2)P<0.05;与4组比较:3)P<0.05;与5组比较:4)4)P<0.01
3、IFNα-2b对各组细胞HBV DNA表达的抑制作用
结果显示,给药组分泌的HBV DNA显著低于未给药组(第1组)(p<0.01),表明IFNα-2b(1250IU·mL-1)可显著抑制HBV DNA的表达。刺激组(第4、5、6组)分泌的HBV DNA明显高于未刺激组(第2组)(p<0.01),表明经低浓度IFNα-2b(分别为30、50、70IU·mL-1)刺激后,HBV DNA对IFNα-2b(1250IU·mL-1)的敏感性降低。各组间比较,50IU·mL-1组和70IU·mL-1组抑制率明显低于30IU·mL-1组(p<0.01),其中50IU·mL-1组与70IU·mL-1组抑制率相当,差异无统计学意义(P>0.05)。见表3。
表3 IFNα-2b对各组细胞HBV DNA表达的抑制作用(n=6)
注:与1组比较:1)1)P<0.01;与2组比较:2)2)P<0.01;与4组比较:3)3)P<0.01;与5组比较:4)4)P<0.01
如图2所示,经50IU·mL-1IFNα-2b刺激后,HBsAg、HBeAg、HBV DNA抑制率下降最明显,与对照细胞比较分别降低了25.48%、8.40%、15.43%。故可认为50IU·mL-1为最佳刺激浓度。
其他实施方式和实施例2相同。
实施例4
本实施例用于确定最佳的刺激时间,选取实施例3得到最佳刺激浓度分别刺激12wk、18wk、24wk、30wk、36wk、42wk、48wk的细胞,按上述实施例3的方法,比较不同刺激时间的各组细胞上清液中HBsAg、HBeAg、HBV DNA的变化,从而确定最佳刺激时间。
1、IFNα-2b对各组细胞HBsAg表达的抑制作用
结果显示,给药组分泌的HBsAg显著低于未给药组(第1组)(p<0.01),表明IFNα-2b(1250IU·mL-1)可显著抑制HBsAg的表达。18wk~48wk的各组细胞分泌的HBsAg明显高于12wk(第2组)(p<0.05),表明经50IU·mL-1IFNα-2b刺激18wk~48wk,HBsAg对IFNα-2b(1250IU·mL-1)的敏感性降低。各组间比较,经50IU·mL-1IFNα-2b刺激12wk~36wk,HBsAg抑制率下降明显,差异均有统计学意义(p<0.05),继续刺激至48wk,6组与7、8组比较,差异无统计学意义(p>0.05),表明经50IU·mL-1IFNα-2b刺激36wk,HBsAg抑制率已降至最低。见表4。
表4 IFNα-2b对各组细胞HBsAg表达的抑制作用(n=6)
注:与1组比较:1)1)P<0.01;与2组比较:2)2)P<0.01,2)P<0.05;与5组比较:3)3)P<0.01,3)P<0.05;与6组比较:4)4)P<0.01
2、IFNα-2b对各组细胞HBeAg表达的抑制作用
结果显示,给药组分泌的HBeAg显著低于未给药组(第1组)(p<0.01),表明IFNα-2b(1250IU·mL-1)可显著抑制HBsAg的表达。24wk~48wk各组细胞分泌的HBeAg明显高于12wk(第2组)(p<0.05),表明经50IU·mL-1IFNα-2b刺激24wk~48wk,HBeAg对IFNα-2b(1250IU·mL-1)的敏感性降低。各组间比较,经50IU·mL-1IFNα-2b刺激24wk~30wk,HBsAg抑制率下降明显,差异均有统计学意义(p<0.05),继续刺激至48wk,5组与6、7、8组比较,差异无统计学意义(p>0.05),表明经50IU·mL-1的IFNα-2b刺激30wk后,HBeAg抑制率不再降低。见表5。
表5 IFNα-2b对各组细胞HBeAg表达的抑制作用(n=6)
注:与1组比较:1)1)P<0.01;与2组比较:2)2)P<0.01,2)P<0.05;与5组比较:3)3)P<0.01,3)P<0.05;与6组比较:4)4)P<0.01,4)P<0.05
3、IFNα-2b对各组细胞HBV DNA表达的抑制作用
结果显示,给药组分泌的HBV DNA显著低于未给药组(第1组)(p<0.01),表明IFNα-2b(1250IU·mL-1)可显著抑制HBV DNA的表达。18wk~48wk各组细胞分泌的HBV DNA明显高于12wk(第2组)(p<0.05),表明经50IU·mL-1IFNα-2b刺激18wk~48wk,HBV DNA对IFNα-2b(1250IU·mL-1)的敏感性降低。各组间比较,经50IU·mL-1IFNα-2b刺激12wk~36wk,HBsAg抑制率下降明显,差异均有统计学意义(p<0.01),继续刺激至48wk,6组与7组比较,差异无统计学意义(p>0.05),6组与8组比较,36wk HBV DNA抑制率低于48wk,差异有统计学意义(p<0.05)。表明经50IU·mL-1的IFNα-2b刺激36wk后,HBV DNA抑制率达到最低。见表6。
表6 IFNα-2b对各组细胞HBV DNA表达的抑制作用(n=6)
注:与1组比较:1)1)P<0.01;与2组比较:2)2)P<0.01;与5组比较:3)3)P<0.01;与6组比较:4)4)P<0.01
如图3所示,经50IU·mL-1的IFNα-2b刺激36wk后,HBsAg、HBeAg、HBV DNA抑制率下降最明显,与对照细胞比较,抑制率分别降低了38.64%、15.71%、30.17%,故可认为36wk为最佳刺激时间。
其他实施方式和实施例3相同。
本发明将HepG2.2.15细胞系用低浓度IFNα-2b(10~70IU·mL-1)连续刺激,同时加入G418(380mg·L-1)诱导,结果显示,在刺激12周后,50IU·mL-1组细胞对最佳药效浓度的IFNα-2b的敏感性显著降低,HBsAg、HBeAg、HBV DNA抑制率出现不同程度下降,有产生耐药性的趋势;继续刺激至36周后抑制率将至最低,表明此状态下的细胞耐药程度最高。
本发明与HCV耐药细胞模型的建立方法有差异,诱导的时间更长一些,这可能与不同细胞株以及病毒本身结构有关。HBV属嗜肝DNA病毒科,为部分单链的环状双链DNA,而丙型肝炎病毒是单股正链RNA病毒,由一个开放阅读框及两侧的非编码区组成。
RNA病毒较DNA更易出现突变,因此推测,HBV较HCV更保守一些,基因序列出现突变的可能性更低一些。
可以在本发明的HepG2.2.15/IFNα-2b耐药细胞模型基础上,制备新型抗HBV药物。
以上所述仅为本发明的较佳实施例而已,并不用以限制本发明,凡在本发明的精神和原则之内所作的任何修改、等同替换和改进等,均应包含在本发明的保护范围之内。
- 还没有人留言评论。精彩留言会获得点赞!