一种手性氨基酸衍生物配合物、制备方法及其应用与流程
本发明涉及一种手性氨基酸衍生物配合物,具体涉及一种以d-(-)-4-羟基苯甘氨酸为主配体的锌配位聚合物,属于材料化学技术领域。
背景技术:
众所周知,cu2+离子和fe3+离子均是生命体必需的微量元素,二者在促进生物体的生长,dna和rna的形成以及生物的新陈代谢过程中扮演着不可或缺的角色。然而,在人体中二者的含量一旦出现过低或过高时,就会出现不良症状。比如,人体内铜含量过高会引发高血压、动脉硬化和冠心病等病症。而人体中三价铁含量异常时,也会引起人体功能紊乱现象,导致皮肤病、缺铁性贫血、失眠以及免疫力下降等不良现象。除此之外,过量的cu2+离子和fe3+离子同样会对环境造成污染,尤其是生命体赖以生存的水生态系统。因此,制备一种能够检测水相中cu2+离子和fe3+离子的识别材料是十分必要的。近些年来,发光金属有机配合物在对金属离子、小分子、芳香类爆炸物以及挥发性气体的荧光识别方面有着重要的应用。在这些应用当中,对一些金属离子的检测是与人类健康息息相关的,因此受到了更为广泛的关注。金属有机配合物的发光性质可以来源于有机配体、金属离子中心、天线效应、激态原子和激态络合物的形成以及客体分子。目前,用于检测cu2+离子和fe3+离子的发光金属有机配合物多为稀土有机配合物,并且大多数是在非水溶剂中进行的。对于不含镧系元素的金属有机配合物,它们具有较强的发光性质通常要求配位中心离子拥有d10电子构型以及有机配体拥有π-共轭的骨架结构。然而,已报道的能够用于检测水相中cu2+离子和fe3+离子的d10过渡金属有机配合物并不多。兰亚乾课题组报道了一种d10过渡金属锌有机配合物检测水相中的fe3+离子(bing-leihou,dantian,jiangliu,long-zhangdong,shun-lili,dong-shengli,ya-qianlan.inorg.chem.2016,55,10580-10586);但是该配合物的制备方法需要水热条件,且对fe3+离子的浓度检测范围较窄,为1×10-5—5×10-3mol·l-1。郑和根课题组报道了两例d10过渡金属镉有机配合物检测水相中的fe3+离子(shuguangchen,zhenzhenshi,lingqin,hailangjia,andhegenzheng.cryst.growthdes.2017,17,67-72);但是该配合物的制备方法也是溶剂热合成法。
现有用于检测cu2+离子和fe3+离子的d10过渡金属有机配合物为数不多,并且大多数都是在有机溶剂中进行的。然而,随着工业生产的发展,cu2+离子和fe3+离子在水中的污染日益加重,所以在水相中检测cu2+离子和fe3+离子就显得尤为重要。因此制备一种合成方法简单,反应条件温和,成本低廉,灵敏度高,且可用于检测水相中cu2+离子和fe3+离子的d10过渡金属有机配合物很有意义。氨基酸作为蛋白质的基本单元,赋予了蛋白质特定的分子结构形态。它具有重要的生化活性,是生命体内合成酶、激素、蛋白质及抗体的原料且参与多种生化过程。由于氨基酸在生命体中的重要作用,使得氨基酸衍生物及其金属配合物有着重要的研究意义和价值。除此之外,d-(-)-4-羟基苯甘氨酸同时拥有氨基和羧基官能团,丰富的氮、氧原子可作为配位原子,具有良好的配位性能,且本身便宜易得,无毒无害,是合成配合物的优良配体。
技术实现要素:
本发明的第一目的在于提供一种手性氨基酸衍生物配合物。
本发明的第二目的在于提供一种手性氨基酸衍生物配合物的制备方法。
本发明的第三目的在于提供该配合物在荧光识别方面的应用。
为了实现本发明的目的,本发明采用如下技术方案:一种手性氨基酸衍生物配合物,其化学式为{[zn(d-hpg)(bpe)]·(no3)·(c2h6o)}n,d-hpg—代表d-(-)-4-羟基苯甘氨酸脱去了一个羧基氢原子,带一个单位的负电荷;bpe代表1,2-双(4-吡啶基)乙烷,d-hpg—的结构式如下:
进一步地,本发明的手性氨基酸衍生物配合物是基于不同方向上的锌—羧酸氧链和锌—bpe吡啶基氮链构筑的二维网状结构化合物,含有一维孔道结构,一维孔道表面含有未参与配位的酚羟基和游离的硝酸根阴离子,一维孔道被游离的乙醇分子占据。
本发明的手性氨基酸衍生物配合物的制备方法,包括以下步骤:
(1)准确称取0.1mmolzn(no3)2·6h2o和0.1mmold-hhpg于50ml小烧杯中,加入8ml蒸馏水,搅拌至其完全溶解,然后将含有0.1mmolbpe的8ml乙醇溶液滴加到上述溶液中,继续搅拌20分钟后,用1mol·l-1naoh溶液调节混合溶液至ph=5.1;
(2)将步骤中(1)的混合溶液过滤,滤液在室温下静置,经过缓慢蒸发,两周后长出无色块状晶体,即得到手性氨基酸衍生物配合物,或称为具有荧光识别功能的手性氨基酸衍生物金属锌有机配合物。
本发明的手性氨基酸衍生物配合物具有荧光识别功能,可用于检测水相中的cu2+离子和fe3+离子。
具体地,检测cu2+离子和fe3+离子方法包括以下步骤:
(1)将一定量的具有荧光识别功能的手性氨基酸衍生物金属锌有机配合物(c=3.2×10-5mol/l)分别加入到浓度为0.01mol/l的不同金属的硫酸盐水溶液中,以未加入金属硫酸盐的等浓度配合物的水溶液作为参比,测试其荧光发射光谱,根据荧光强度变化得到该具有荧光识别功能的手性氨基酸衍生物金属锌有机配合物对cu2+离子和fe3+离子的识别性能;
(2)在具有荧光识别功能的手性氨基酸衍生物金属锌有机配合物的cu2+(或fe3+)硫酸盐水溶液中,引入其他金属离子(c=0.01mol/l),测试其荧光发射光谱,检测具有荧光识别功能的手性氨基酸衍生物金属锌有机配合物对cu2+,fe3+离子的识别抗干扰能力;
(3)将具有荧光识别功能的手性氨基酸衍生物金属锌有机配合物(c=0.1mg/ml)加入到浓度范围为1×10-6~1×10-3mol/l的cu2+(或fe3+)硫酸盐水溶液中,测试其荧光发射光谱,对荧光强度数据进行拟合处理,得到具有荧光识别功能的手性氨基酸衍生物金属锌有机配合物对cu2+离子和fe3+离子的检测定量关系式。
所述不同金属的硫酸盐是硫酸钠、硫酸钾、硫酸钙、硫酸镁、硫酸镉、硫酸锰、硫酸锌、硫酸亚铁、硫酸镍、硫酸铜和硫酸铁中的一种。
本发明具有以下有益效果:
1、该配合物制备方法简单、反应条件温和、原料便宜易得且无毒无害;
2、产物是纯相的,发光性好,并且在氮气氛围下加热到177℃配合物主体框架仍稳定存在;
3、该配合物能够快速而简单的检测水相中的cu2+离子和fe3+离子。
附图说明
图1为本发明公开的一种具有荧光识别功能的手性氨基酸衍生物金属锌有机配合物的配位环境。
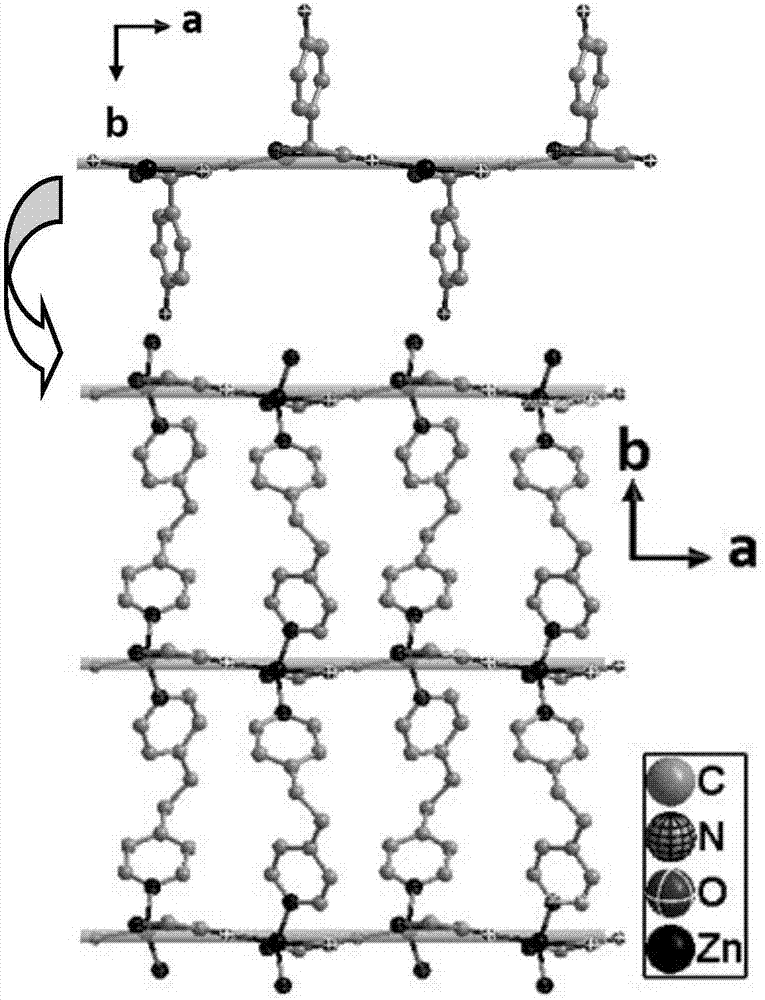
图2为本发明公开的一种具有荧光识别功能的手性氨基酸衍生物金属锌有机配合物的右手螺旋链及二维网状结构。
图3为本发明公开的一种具有荧光识别功能的手性氨基酸衍生物金属锌有机配合物的一维孔道结构。
图4为本发明公开的一种具有荧光识别功能的手性氨基酸衍生物金属锌有机配合物的单晶数据模拟和样品的x射线粉末(pxrd)衍射谱图。
图5为本发明公开的一种具有荧光识别功能的手性氨基酸衍生物金属锌有机配合物的热重(tg)曲线谱图。
图6为本发明公开的一种具有荧光识别功能的手性氨基酸衍生物金属锌有机配合物的红外(ir)谱图。
图7为本发明公开的一种具有荧光识别功能的手性氨基酸衍生物金属锌有机配合物在不同金属的硫酸盐水溶液中的荧光强度对比图。
图8为本发明公开的一种具有荧光识别功能的手性氨基酸衍生物金属锌有机配合物中引入不同于cu2+离子的其他金属离子的荧光对比图。
图9为本发明公开的一种具有荧光识别功能的手性氨基酸衍生物金属锌有机配合物对不同浓度的cu2+离子溶液的荧光响应图。
图10为本发明公开的一种具有荧光识别功能的手性氨基酸衍生物金属锌有机配合物荧光强度与cu2+离子浓度的拟合曲线图。
图11为本发明公开的一种具有荧光识别功能的手性氨基酸衍生物金属锌有机配合物中引入不同于fe3+离子的其他金属离子的荧光对比图。
图12为本发明公开的一种具有荧光识别功能的手性氨基酸衍生物金属锌有机配合物对不同浓度的fe3+离子溶液的荧光响应图。
图13为本发明公开的一种具有荧光识别功能的手性氨基酸衍生物金属锌有机配合物荧光强度与fe3+离子浓度的拟合曲线图。
具体实施方式
以下实施例用于说明本发明。
实施例1
一种具有荧光识别功能的手性氨基酸衍生物金属锌有机配合物,其化学式为{[zn(d-hpg)(bpe)]·(no3)·(c2h6o)}n,d-hpg—代表d-(-)-4-羟基苯甘氨酸脱去了一个羧基氢原子,带一个单位的负电荷;bpe代表1,2-双(4-吡啶基)乙烷。d-hpg—的结构式如下:
进一步地,具有荧光识别功能的手性氨基酸衍生物金属锌有机配合物是基于不同方向上的锌—羧酸氧链和锌—bpe吡啶基氮链构筑的二维网状结构化合物,含有一维孔道结构,一维孔道表面含有未参与配位的酚羟基和游离的硝酸根阴离子,提供了很好的识别位点。
结构描述:一种具有荧光识别功能的手性氨基酸衍生物金属锌有机配合物,其化学式为{[zn(d-hpg)(bpe)]·(no3)·(c2h6o)}n,d-hpg—代表d-(-)-4-羟基苯甘氨酸脱去了一个羧基氢原子,带一个单位的负电荷;bpe代表1,2-双(4-吡啶基)乙烷。
对该具有荧光识别功能的手性氨基酸衍生物金属锌有机配合物的单晶进行结构解析和表征,确定其晶胞和空间结构。该晶体属于正交晶系,p212121手性空间群,为2d层状结构。配合物中每个不对称单元包括一个zn(ii)阳离子,两个d-hpg—阴离子,两个bpe配体,一个no3—抗衡阴离子和一个游离的乙醇分子,如附图1所示。每个zn(ii)离子均采取五配位模式,分别与两个d-hpg—中的羧基氧原子(o1,o2)和氨基氮原子(n1),两个不同的bpe分子中的氮原子(n2,n3)配位,形成三角双锥构型。d-hpg—配体通过羧基氧原子和氨基氮原子以螯合-桥联三齿模式连接两个金属zn,沿a轴方向形成1d右手螺旋链,这些1d链进一步通过bpe分子以gauche构型桥联相邻的zn2+离子,在ab平面形成2d网状结构,如附图2所示。值得注意的是,在配合物中形成了沿a方向的一维孔道结构,一维孔道表面含有未参与配位的酚羟基和游离的硝酸根阴离子,其孔道被游离的乙醇分子填充(如附图3所示,为表清晰,游离的乙醇分子已省去)。
如附图4所示,x射线粉末衍射图表明该具有荧光识别功能的手性氨基酸衍生物金属锌有机配合物是纯相的。如附图5所示,热重分析表明具有荧光识别功能的手性氨基酸衍生物金属锌有机配合物具有较好的热稳定性。
一种具有荧光识别功能的手性氨基酸衍生物金属锌有机配合物的制备方法,包括以下步骤:
(1)准确称取0.1mmolzn(no3)2·6h2o和0.1mmold-hhpg于50ml小烧杯中,加入8ml蒸馏水,搅拌至其完全溶解,然后将含有0.1mmolbpe的8ml乙醇溶液滴加到上述溶液中,继续搅拌20分钟后,用1mol·l-1naoh溶液调节混合溶液至ph=5.1;
(2)将步骤中(1)的混合溶液过滤,滤液在室温下静置,经过缓慢蒸发,两周后长出无色块状晶体,即为具有荧光识别功能的手性氨基酸衍生物金属锌有机配合物。产率为66%(以zn计)。元素分析(%):c22h26n4o7zn(mr=523.84)理论值(%):c,50.43;h,5.00;n,10.69。实验值(%):c,50.37;h,5.04;n,10.54。红外谱图主要峰值(kbr,cm-1)ν:3441(w),3309(w),3217(s),3140(s),1620(s),1512(m),1381(s),1319(s),1265(m),1226(m),1103(w),1072(w),1033(m),825(s),756(w),678(w),632(w),601(w),555(w),如附图6所示。
一种具有荧光识别功能的手性氨基酸衍生物金属锌有机配合物的应用,用于检测水相中的cu2+离子和fe3+离子。
首先称取一定量的具有荧光识别功能的手性氨基酸衍生物金属锌有机配合物,将其分散于一定量的水溶液中(c=3.2×10-5mol/l),测定其荧光发射光谱,发现其最强发射波长为300nm。然后将具有荧光识别功能的手性氨基酸衍生物金属锌有机配合物分别加入到浓度为0.01mol/l的不同金属的硫酸盐水溶液中,测试其荧光发射光谱。
不同金属的硫酸盐为硫酸钠、硫酸钾、硫酸钙、硫酸镁、硫酸镉、硫酸锰、硫酸锌、硫酸亚铁、硫酸镍、硫酸铜和硫酸铁中的一种。根据荧光强度变化,发现cu2+离子和fe3+离子对该具有荧光识别功能的手性氨基酸衍生物金属锌有机配合物具有非常明显的荧光猝灭效应,因此具有荧光识别功能的手性氨基酸衍生物金属锌有机配合物对cu2+离子和fe3+离子具有识别性能,如附图7所示。
在具有荧光识别功能的手性氨基酸衍生物金属锌有机配合物的cu2+硫酸盐水溶液中,引入其他金属离子(c=0.01mol/l),测试其荧光发射光谱,检测具有荧光识别功能的手性氨基酸衍生物金属锌有机配合物对cu2+离子的识别抗干扰能力,如附图8所示,其它金属离子的引入,对于该配合物对cu2+离子的荧光识别效应没有产生影响。
将具有荧光识别功能的手性氨基酸衍生物金属锌有机配合物(c=0.1mg/ml)加入到浓度范围为1×10-6~1×10-3mol/l的cu2+硫酸盐水溶液中,测试其荧光发射光谱。随着cu2+离子浓度的的不断增加,荧光强度逐渐减弱,如附图9所示。并且在1×10-6~9×10-6mol/l浓度范围内,具有荧光识别功能的手性氨基酸衍生物金属锌有机配合物的荧光猝灭率与cu2+离子浓度存在以下线性关系:(i0-i)/i0=0.19546+0.06697c,其中,i0为不存在cu2+离子时,该配合物的荧光强度;i为存在cu2+离子时,该配合物的荧光强度;c为cu2+离子的浓度,单位为mol/l;如附图10所示。
在具有荧光识别功能的手性氨基酸衍生物金属锌有机配合物的fe3+硫酸盐水溶液中,引入其他金属离子(c=0.01mol/l),测试其荧光发射光谱,检测具有荧光识别功能的手性氨基酸衍生物金属锌有机配合物对fe3+离子的识别抗干扰能力,如附图11所示,其它金属离子的引入,对于该配合物对fe3+离子的荧光识别效应没有产生影响。
将具有荧光识别功能的手性氨基酸衍生物金属锌有机配合物(c=0.1mg/ml)加入到浓度范围为1×10-6~1×10-3mol/l的fe3+硫酸盐水溶液中,测试其荧光发射光谱。在3×10-5~1×10-3mol/l浓度范围内,随着fe3+离子浓度的的不断增加,荧光强度逐渐减弱,如附图12所示。并且在3×10-5~7×10-5mol/l浓度范围内,具有荧光识别功能的手性氨基酸衍生物金属锌有机配合物的荧光猝灭率与fe3+离子浓度存在以下线性关系:(i0-i)/i0=0.38001+0.00425c;在1×10-4~1×10-3mol/l浓度范围内,存在以下线性关系:(i0-i)/i0=0.67025+2.1292×10-4c;其中,i0为不存在fe3+离子时,该配合物的荧光强度;i为存在fe3+离子时,该配合物的荧光强度;c为fe3+离子的浓度,单位为mol/l;如附图13所示。
以上结果证实,本发明的手性氨基酸衍生物配合物,具有荧光识别功能,可以有效的识别水相中的cu2+离子和fe3+离子,并且检测范围较广泛。
- 还没有人留言评论。精彩留言会获得点赞!
- 用于生产化学品及其衍生物的组合物和方法与制造工艺
- 7‑OH‑8‑[(1‑胺基‑1‑苯基衍生物)‑次甲基]‑黄酮化合物及其制备方法及其应用与制造工艺
- 联苯胺衍生物、其制造方法和电子照相感光体与制造工艺
- 包含环糊精衍生物的可注射美法仑组合物及其制备和使用方法与制造工艺
- 含D型非天然氨基酸的抗菌肽类似物及其合成与应用的制造方法与工艺
- 一种黄芪甲苷衍生物及其制备方法和应用与制造工艺
- (Z,E)5‑OH‑3‑(苯基衍生物‑次甲基)‑二氢黄酮‑7‑O‑糖苷及其制备及其应用的制造方法与工艺
- 喹唑啉衍生物的制造方法与工艺
- 一种白杨素氨基酸衍生物的制备方法与制造工艺
- Harrisotone A衍生物的组合物在防治肝脏损伤药物中的应用的制造方法与工艺