一种毒素蛋白的纯化方法与流程
本发明属于蛋白质提取纯化领域,更具体地说,涉及一种高效且可维持蛋白活性的毒素蛋白的纯化方法。
背景技术:
毒素-抗毒素系统广泛存在于环境微生物和病原微生物的基因组中,在肠道益生菌中也有发现,且毒素-抗毒素系统在可移动遗传元件中出现的频率高于基因组的其它位置,这引起了国际微生物学界的高度关注。毒素-抗毒素系统是由一个稳定的毒素蛋白和一个不稳定的抗毒素组成。毒素-抗毒素系统最早发现存在于低拷贝的质粒上,并在维持质粒稳定性中起着关键作用,目前已有实验结果证实成对存在可以有效调控质粒的稳定性。此外,近年的研究还发现毒素-抗毒素系统还具有重要的生理学功能如基因组的稳定,细菌生物被膜的形成,细菌持续性感染(persistedcellformation),控制生长以及细胞的程序性死亡等相关联,因此毒素-抗毒素的研究越来越被重视,越来越被关注。特别是在不同的抗生素、高温和营养匮乏等压力条件刺激下,毒素-抗毒素系统会被激活,而毒素-抗毒素系统被激活的机制是抗毒素蛋白很不稳定并且很容易在压力条件被激活的各种蛋白酶所降解,从而释放出毒素蛋白,游离的毒素蛋白再行使它的功能。毒素蛋白在体内的作用靶点是多样的,包括dna复制,mrna的稳定性,蛋白的合成,细胞壁的合成及atp的合成,然而毒素蛋白的生化功能研究一直滞后其他蛋白的研究进展,归因于毒素蛋白的纯化的确存在很大的困难,这些毒素都是小分子蛋白(<100个氨基酸),且在大量表达时可导致宿主菌死亡,难以得到一定数量的毒素蛋白。
目前文献中毒素蛋白的纯化可以通过以下这些方法得到:1.可直接通过构建诱导型质粒异源表达毒素蛋白,然后通过亲和层析柱直接纯化毒素蛋白。但这种纯化方法局限性很大,只能用于小部分的毒性较低的毒素蛋白的纯化;2.通过构建诱导型质粒可以同时表达毒素蛋白与抗毒素蛋白,毒素与抗毒素蛋白形成复合物,再用强的变性剂处理蛋白复合物,使抗毒素-毒素蛋白复合物失活从而游离出毒素蛋白,再通过复性的方法使毒素蛋白的活性恢复,但是这种蛋白纯化方法的缺点很明显,复性后蛋白活性大部分很难得到恢复,有活性的毒素蛋白纯度低;3.通过筛选减毒宿主菌,再在宿主体内诱导型质粒异源表达毒素蛋白、进行纯化,但是这种蛋白纯化的方法很难实现,筛选减毒宿主菌的困难很大,耗时太长,成功率低,经济价值不高。
有鉴于此,确有必要提供一种高效且可维持蛋白活性的毒素蛋白的纯化方法。
技术实现要素:
本发明的目的在于:克服现有毒素蛋白分离纯化时容易出现的蛋白纯度低、活性差、耗时长等问题,提供一种高效且可维持蛋白活性的毒素蛋白的纯化方法。
为了实现上述发明目的,首先要解决的问题是毒素蛋白在宿主体内的积累,因为毒素蛋白的纯化首先需要蛋白的积累达到一定的数量,但是毒素蛋白的积累对宿主又是致死的,因此是很矛盾的技术问题;毒素蛋白之所以能在体内表达并存在是因为抗毒素蛋白的存在可以中和毒素蛋白的毒性,因此,我们通过将毒素蛋白和抗毒素蛋白在同一宿主体内进行共同表达,这样就既可以积累毒素蛋白又可以中和毒素蛋白的毒性。在得到毒素蛋白和抗毒素蛋白的复合物之后,怎么得到有活性的毒素蛋白才是最关键的技术问题,通过强化学试剂去破坏毒素蛋白与抗毒素蛋白的相互作用,虽然可以将毒素蛋白与抗毒素蛋白分离开,但是毒素蛋白的活性得不到保证,复性后的毒素蛋白的活性也不高,因此,我们希望能找到一种方法可以在温和的实验条件既能将毒素蛋白与抗毒素蛋白之间的相互作用消除,又能不破坏毒素蛋白的活性。通过大量的菌株筛选发现假交替单胞菌scsio6842的全细胞裂解液可以特异性水解毒素-抗毒素复合物中的抗毒素组分,而不降解毒素蛋白,再通过亲和层析柱纯化出毒素蛋白。
因此,本发明提供一种假交替单胞菌scsio6842,保藏于中国微生物菌种保藏管理委员会普通微生物中心,保藏地址为中国.北京,保藏号为cgmcc1.15540,保藏日为2016年2月23日。
一种毒素蛋白的纯化方法,其是利用上述假交替单胞菌scsio6842完成的,包括如下步骤:
(1)将含有能特异性降解抗毒素蛋白的蛋白酶的假交替单胞菌scsio6842的菌体破碎得到全细胞裂解液;
(2)将毒素基因和抗毒素基因扩增并克隆到表达载体中,诱导表达载体同时表达毒素蛋白和抗毒素蛋白,得到毒素蛋白和抗毒素蛋白的复合物;
(3)对毒素蛋白和抗毒素蛋白复合物进行纯化;
(4)将步骤(1)所得全细胞裂解液与步骤(3)所得复合物混合静置反应,使毒素蛋白分离出来并进行纯化、脱盐,得到毒素蛋白。
作为本发明毒素蛋白的纯化方法的一种改进,步骤(1)中,所述菌体破碎是采用高压细胞破碎法。
作为本发明毒素蛋白的纯化方法的一种改进,步骤(3)中,所述纯化是蛋白亲和层析纯化。
作为本发明毒素蛋白的纯化方法的一种改进,步骤(4)中,所述细胞裂解液与复合物的体积比为5:3。
作为本发明毒素蛋白的纯化方法的一种改进,步骤(4)中,所述静置反应的时间为1~2h。
作为本发明毒素蛋白的纯化方法的一种改进,步骤(4)中,所述混合静置反应的温度为25℃。
作为本发明毒素蛋白的纯化方法的一种改进,步骤(4)中,所述纯化是蛋白亲和层析纯化。
与现有技术相比,本发明筛选出能特异性降解抗毒素蛋白的蛋白酶的菌株假交替单胞菌scsio6842,还建立了基于蛋白酶能特异性降解抗毒素蛋白而纯化出高活性毒素蛋白的新方法,并具有如下特点:
1)本发明纯化方法周期短,不需要花费大量时间去筛选减毒菌株(即使筛选到减毒菌株也不一定适用于毒素蛋白的纯化,成功率低);
2)本发明纯化方法步骤简单容易操作,只需利用全细胞裂解液中的蛋白酶直接降解抗毒素蛋白即可达到去除抗毒素蛋白的目的,不需要进行变性再复性等繁杂步骤以去除抗毒素蛋白;
3)本发明纯化方法避免使用强化学试剂以消除毒素蛋白与抗毒素蛋白之间的相互作用,因此本发明方法具有高效性,所得的毒素蛋白纯度高,活性好;
4)本发明纯化方法属于经济型技术,只需收集菌体进行裂解即可得到全细胞裂解液,无需使用昂贵的化学试剂,也不需要对蛋白进行提纯处理,成本较低。
附图说明
下面结合附图和具体实施方式,对本发明毒素蛋白的纯化方法及其有益效果进行详细说明。
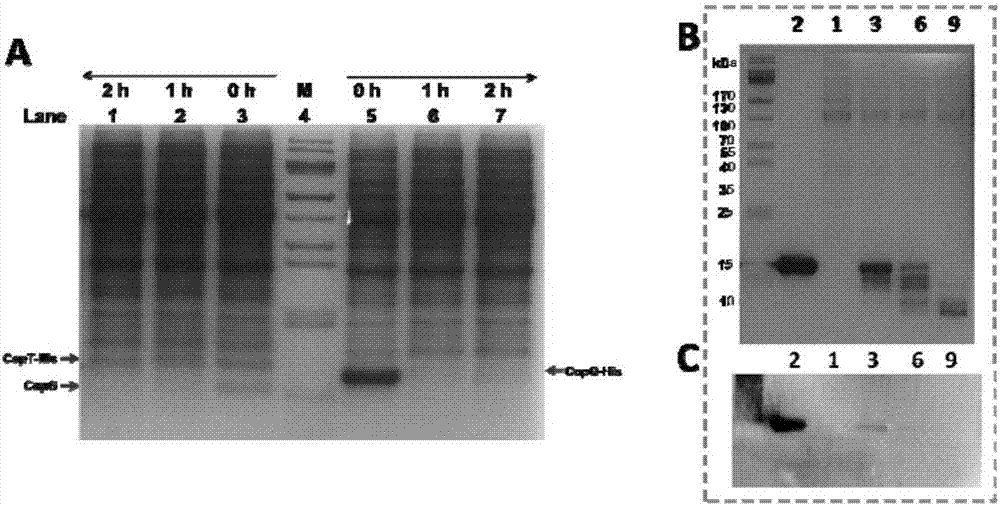
图1为体内的毒素蛋白(copt)与抗毒素蛋白(copg)之间的相互作用的检测结果图。
图2为抗毒素蛋白降解的检测结果图,其中,a表示抗毒素蛋白以单一成分或与毒素蛋白的复合物形式存在,抗毒素蛋白极易被scsio6842的全细胞裂解液降解;b表示抗毒素蛋白的降解;c标识抗毒素蛋白的降解是从c端开始。
图3为scsio6842全细胞裂解液中的蛋白类降解抗毒素蛋白,其中,泳道1~4分别表示scsio6842全细胞裂解液处理抗毒素蛋白的时间为0、20、30和60min,泳道5为沸水浴10min后的scsio6842全细胞裂解液处理抗毒素蛋白的结果。
图4为毒素蛋白的纯度及活性检测结果示意图,其中,a表示通过tricine-sds-page检测纯化后的毒素蛋白copgt,b表示dna促旋酶抑制实验结果。
具体实施方式
假交替单胞菌scsio6842全细胞裂解液的准备
(1)-80℃保存的菌株scsio6842,划线2216e平板,25℃培养箱静置过夜;
(2)挑取单菌落于含25ml新鲜2216e培养基的250ml三角瓶中,25℃培养箱,220rpm震荡培养12小时;
(3)以1:100转接于含300ml新鲜的2216e培养基的1000ml三角瓶中,220rpm震荡培养5-6小时(至对数期)。这么做是因为对数期菌体的酶活力最高。
(4)12,000rpm低温离心10min,收集菌体,去除上清。低温收集的目的是尽量维持酶的活性;
(5)加入10ml细胞裂解液(50mmkh2po4buffer(ph8.0),300mmnacl,5mm咪唑),小型涡旋器中充分重悬菌体;
(6)超声波破碎或高压细胞破碎细胞,高压细胞破碎的时间短,优选考虑;
(7)将破碎完的全细胞裂解液离心,10,000rpm低温离心60min,取上清,置于冰上或4℃冰箱备用。长时间离心可充分去除菌体,防止菌株影响后续的蛋白纯化。
毒素蛋白与抗毒素蛋白复合物的纯化
(1)pcr将毒素基因和抗毒素基因一起扩增,一起克隆到同一个蛋白诱导表达载体pet28b,再转化宿主细胞e.colibl21(de3)。毒素表达基因与抗毒素表达基因一般是共转录的,只需一轮pcr就可以将其克隆到,为了毒素蛋白的纯化,将组氨酸标签与毒素蛋白的c端进行了融合。
(2)挑取转化子置于25ml新鲜lb培养基的250ml三角瓶(含25μg/ml卡那霉素,维持质粒的存在)中,37℃培养箱,220rpm震荡培养12小时;
(3)以1:100转接于含300ml新鲜的lb培养基的1000ml三角瓶中(含25μg/ml卡那霉素),220rpm震荡培养od600=0.8时,加入300μliptg(终浓度为1mm)进行诱导,继续培养5-6小时。
(4)12,000rpm低温离心10min,收集菌体,去除上清。
(5)加入10ml细胞裂解液(50mmkh2po4buffer(ph8.0),300mmnacl,5mm咪唑),小型涡旋器中充分重悬菌体,并加入蛋白酶抑制剂pmsf,防止蛋白被外来的蛋白酶降解。
(6)高压细胞破碎仪破碎细胞,10,000rpm低温离心60min,收集上清;
(7)利用蛋白亲和层析柱ni-ntaresin(qiagen)对上述的毒素蛋白和抗毒素蛋白的复合物进行蛋白纯化。因为ii型的毒素蛋白可以与抗毒素蛋白直接相互作用,而且相互作用比较强(请参见图1);其相互作用的原理是抗毒素的c端与毒素蛋白直接进行相互作用,而抗毒素蛋白的c端又是scsio6842细胞裂解液降解的靶标位置(请参见图2);在只有毒素蛋白融合了组氨酸标签的复合物中,亲和层析柱会特异地将毒素蛋白截留,而毒素蛋白又可以通过蛋白-蛋白相互作用将抗毒素蛋白进行截留,因此,纯化后的蛋白是毒素蛋白和抗毒素蛋白的混合物;
(8)tricine-sds-page蛋白胶检测蛋白纯化。
毒素蛋白的纯化及检测
(1)将scsio6842全细胞裂解液与纯化后的毒素蛋白与抗毒素蛋白复合物以5:3比例混合均匀,置于25℃培养箱静置1-2小时。我们通过实验已经验证全细胞裂解中降解蛋白的主要成分是蛋白酶类(请参见图3);scsio6842细胞裂解液会特异性从抗毒素的c端进行逐级降解,而c端又是与毒素的结合位点,从而解除了毒素蛋白与抗毒素蛋白的相互作用,毒素蛋白被游离出来;又因为scsio6842的最适生长温度是在25℃,为了保证反应中酶活的存在,所以反应温度选择在25℃;同时因为毒素-抗毒素系统的差异会导致蛋白的差异,可以适当的调整反应时间。
(2)后续的蛋白纯化步骤同上毒素蛋白与抗毒素蛋白复合物的纯化;
(3)tricine-sds-page蛋白胶检测纯化后的毒素蛋白。因为毒素蛋白和抗毒素蛋白都是小分子蛋白,因此用小分子蛋白分离胶检测更为合适。
(4)纯化后的蛋白利用脱盐柱(sephadex-g-25-pre-packedpd-10columns)进行脱盐处理;脱盐后的蛋白用tricine-sds-page检测。
(5)利用蛋白定量试剂盒(biyuntianbcaassaykit(haimen,china))对脱盐的蛋白进行定量。
(6)利用蛋白活性检测试剂盒进行活性检测,得到活性好,纯度高的毒素蛋白。
实施例1
以假交替单胞菌中的copga-copgt毒素-抗毒素系统为例:
copga-copgt毒素-抗毒素系统中的毒素蛋白copgt通过ncbi及多序列比对发现,其属于pare家族蛋白,活性为dna促旋酶抑制剂。
1.假交替单胞菌scsio6842全细胞裂解液的准备:
(1)-80℃保存的菌株scsio6842,划线2216e平板,25℃培养箱静置过夜;
(2)挑取单菌落于含25ml新鲜2216e培养基的250ml三角瓶中,25℃培养箱,220rpm震荡培养12小时;
(3)以1:100转接于含300ml新鲜的2216e培养基的1000ml三角瓶中,220rpm震荡培养6小时(至对数期);
(4)12,000rpm低温离心10min,收集菌体,去除上清;
(5)加入10ml细胞裂解液(50mmkh2po4buffer(ph8.0),300mmnacl,5mm咪唑),小型涡旋器中充分重悬菌体;
(6)高压破碎仪破碎细胞。
(7)10,000rpm,4℃离心60min,取上清,置于冰上或4℃冰箱备用。
2.毒素蛋白copgt与抗毒素蛋白copga复合物的纯化:
(1)利用设计基因两侧的引物,pcr将毒素表达基因copgt和抗毒素表达基因copga一起扩增,通过酶切、连接,将其克隆到同一个蛋白诱导表达载体pet28b,再转化宿主细胞e.colibl21(de3)。。
(2)挑取转化子置于25ml新鲜lb培养基的250ml三角瓶(含25μg/ml卡那霉素,维持质粒的存在)中,37℃培养箱,220rpm震荡培养12小时;
(3)以1:100转接于含300ml新鲜的lb培养基的1000ml三角瓶中(含25μg/ml卡那霉素),220rpm震荡培养od600=0.8时,加入300μliptg(终浓度为1mm)进行诱导,继续培养5-6小时;
(4)12,000rpm低温离心10min,收集菌体,去除上清;
(5)加入10ml细胞裂解液(50mmkh2po4buffer(ph8.0),300mmnacl,5mm咪唑),小型涡旋器中充分重悬菌体,并加入蛋白酶抑制剂pmsf;
(6)高压细胞破碎仪破碎细胞,10,000rpm低温离心60min,收集上清;
(7)利用蛋白亲和层析柱ni-ntaresin(qiagen)对上述的毒素蛋白和抗毒素蛋白的复合物进行蛋白纯化;
(8)tricine-sds-page蛋白胶检测蛋白纯化(请参见图1)。
3.毒素蛋白copgt的纯化及检测
(1)将scsio6842全细胞裂解液与纯化后的毒素蛋白与抗毒素蛋白复合物以5:3比例混合均匀,置于25℃培养箱静置1小时。
(2)后续的蛋白纯化步骤同上毒素蛋白与抗毒素蛋白复合物的纯化;
(3)tricine-sds-page蛋白胶检测纯化后的毒素蛋白(请参见图4a);
(4)纯化后的蛋白利用脱盐柱(sephadex-g-25-pre-packedpd-10columns)进行脱盐处理;脱盐后的蛋白用tricine-sds-page检测。
(5)利用蛋白定量试剂盒(biyuntianbcaassaykit(haimen,china))对脱盐的蛋白进行定量。
(6)利用蛋白活性检测试剂盒对毒素蛋白copgt进行活性检测(体系:1.02nm超螺旋dnapuc19,35mmtris-hcl,24mmkcl,4mmmgcl2,2mmdtt,1.8mmspermidine,1mmatp,6.5%glycerol,and0.1mg/mlbsa,0.5mmciprofloxacin(简称cip),30nmdnagyrase(简称gry)(newenglandbiolabs),其中copt为毒素蛋白copgt的简称、inactivedcopgt为沸水处理后的毒素蛋白copgt、copgt为copga-copgt的蛋白复合物。30℃反应3.5小时,加入50μg/mlproteinasekand1%sds终止反应。),最终的得到有活性,纯度高的毒素蛋白(请参见图4b)。
本发明筛选出能特异性降解抗毒素蛋白的蛋白酶的菌株假交替单胞菌scsio6842,还建立了基于蛋白酶能特异性降解抗毒素蛋白而纯化出高活性毒素蛋白的新方法,具有蛋白活性高、操作简单、成本低等优点,具有良好的应用前景。
为了使本发明的发明目的、技术方案和有益技术效果更加清晰,以下结合实施例,对本发明进行进一步详细说明。应当理解的是,本说明书中描述的实施例仅仅是为了解释本发明,并非为了限定本发明,实施例的配方、比例等可因地制宜做出选择而对结果并无实质性影响。
根据上述说明书的揭示和教导,本发明所属领域的技术人员还可以对上述实施方式进行适当的变更和修改。因此,本发明并不局限于上面揭示和描述的具体实施方式,对本发明的一些修改和变更也应当落入本发明的权利要求的保护范围内。此外,尽管本说明书中使用了一些特定的术语,但这些术语只是为了方便说明,并不对本发明构成任何限制。
- 还没有人留言评论。精彩留言会获得点赞!