一株蜡样芽孢杆菌及其复合菌制剂和制备方法与流程
本发明专利属于微生物及其应用领域,具体涉及一株高效抑制弧菌病的蜡样芽孢杆菌(Bacillus cereus)BCXE-01;还涉及一种以上述蜡样芽孢杆菌(Bacillus cereus)BCXE-01为主要成分的复合菌制剂;还涉及一种以上述蜡样芽孢杆菌(Bacillus cereus)BCXE-01为主要成分的复合菌制剂的制备方法。
背景技术:
自1988年凡纳滨对虾引进中国后,因其具有抗逆性强、生长速度快、耐高密度等特点,迅速成为我国对虾养殖业中养殖范围最广的品种。但随着对虾集约化养殖模式的迅猛发展,残饵粪便等有机污染物的大量积存致使大量有害菌群滋生繁殖,养殖水体的生态环境持续恶化;严重降低了对虾的抗病力,使得对虾疾病频发。
目前,病害问题已是严重抑制对虾养殖业发展的重要因素之一。其中弧菌病就是对虾养殖过程中常发病之一,并且在世界各地均有对虾因弧菌病而导致高死亡率的报道。例如,由副溶血弧菌引起厄瓜多瓦、马来西亚、中国台湾、菲律宾和日本等地区爆发弧菌病而导致养殖对虾大量死亡的报道;在中国各地区也报道过因溶藻弧菌引起的弧菌病而导致对虾严重减产。故自2009年研究确定对虾“早期死亡综合症”的主要致病菌是副溶血弧菌以来,近些年弧菌便成为对虾细菌性疾病的主要致病菌之一,而且其致病性和危害性越来越大。针对对虾弧菌病的防治主要还是以抗生素类药物为主,但大量抗生素用于病害防治,会导致细菌耐药性增强及对虾体内药物残留等问题,并严重制约着对虾养殖业的健康可持续发展。
益生菌具有改善水质、降低养殖水体的氨氮浓度、提高养殖对象的抗病性和抗逆性、提高养殖对象的产量等众多优点,现已成为目前抗生素类药物替代品的研究热点。故寻找一株益生菌来防治对虾养殖过程中弧菌病的发生,对对虾养殖具有重要意义。
技术实现要素:
本发明的目的之一是提供一株蜡样芽孢杆菌(Bacillus cereus)BCXE-01,可以对对虾养殖过程中的致病菌弧菌属细菌产生有效的抑制作用,可用于对虾养殖过程中由弧菌属细菌引起的弧菌病的有效防治。
本发明的蜡样芽孢杆菌(Bacillus cereus)BCXE-01保藏于中国微生物菌种保藏管理委员会普通微生物中心(CGMCC),菌种保藏号为CGMCC NO.6940,保藏日期为2012年12月7日。
本发明的蜡样芽孢杆菌(Bacillus cereus)BCXE-01的主要特征如下:
1、生理生化特征(见表1):
表1蜡样芽孢杆菌(Bacillus cereus)BCXE-01的生理生化特征
2、菌株16SrDNA鉴定
蜡样芽孢杆菌(Bacillus cereus)BCXE-01,经16SrDNA鉴定,其与Bacillus cereus ATCC14579的同源性高达99%,经系统发育树分析得到其属于蜡样芽孢杆菌属细菌。
本发明的蜡样芽孢杆菌(Bacillus cereus)BCXE-01上清液中的活性物质分子量小于10kDa,并且能够耐高温和耐低pH,对对虾养殖过程中的常见致病菌副溶血弧菌、溶藻弧菌和灿烂弧菌等有较强的抑制作用。
本发明的蜡样芽孢杆菌(Bacillus cereus)BCXE-01可以有效的抑制对虾养殖池塘中弧菌的数量。
本发明的蜡样芽孢杆菌(Bacillus cereus)BCXE-01是从对虾养殖区域采集的对虾肠道粪便样品中分离得到。
本发明的蜡样芽孢杆菌(Bacillus cereus)BCXE-01属于安全无公害的益生菌种类。在对虾养殖过程中泼洒蜡样芽孢杆菌(Bacillus cereus)BCXE-01或是包含蜡样芽孢杆菌(Bacillus cereus)BCXE-01的复合菌制剂,能够有效抑制对虾养殖池塘中病原菌弧菌的数量,提高对虾养殖的产量,有效避免了抗生素的使用。
本发明还提供了一种以蜡样芽孢杆菌(Bacillus cereus)BCXE-01为主要成分的复合菌制剂,其可以提高生长状态不佳、食欲不振对虾的生长活力,促进对虾摄食和健康生长。所述复合菌制剂是由蜡样芽孢杆菌(Bacillus cereus)BCXE-01、地衣芽孢杆菌和枯草芽孢杆菌以5~7:1:1的细菌数量比例复合而成。
所述的地衣芽孢杆菌和枯草芽孢杆菌均购自青岛根源生物技术集团公司。所述复合菌制剂能够有效地降低对虾养殖水体中病原菌弧菌的数量,改善养殖水体,提高对虾产量。
所述以复合菌制剂蜡样芽孢杆菌(Bacillus cereus)BCXE-01为主要成分的复合菌制剂通过以下步骤制备:
(1)种子液培养
将蜡样芽孢杆菌(Bacillus cereus)BCXE-01、地衣芽孢杆菌和枯草芽孢杆菌通过平板划线,分别接种到2216E固体培养基平板上,置于37℃培养24h,然后挑取单菌落分别接种于液体发酵培养基A中,于37℃、180~200rpm培养20~24h,得到3种菌的摇瓶种子液。
所述发液体酵培养基A的配方如下:胰蛋白胨10g,酵母粉5g,KH2PO4 1.5g,MgSO4·7H2O 0.5g,陈海水1000mL,将pH调至6.0~7.5。将配制好的液体酵培养基A于121℃灭菌30min后使用。
所述2216E固体培养基的配方如下:胰蛋白胨10g,酵母粉5g,琼脂20g,陈海水1000mL,将pH调至7.6-7.8。将配制好的2216E固体培养基于121℃灭菌30min后使用。
(2)扩大培养
3种菌的摇瓶种子液按蜡样芽孢杆菌(Bacillus cereus)BCXE-01:地衣芽孢杆菌:枯草芽孢杆菌=5~7:1:1的细菌数量比例接种(例如以10%的接种量,体积比)到装有液体发酵培养基B的发酵罐中,于30~37℃,搅拌速度180~200rpm,通气量为2~4V/V·min,培养24~36h。
所述液体发酵培养基B:胰蛋白胨10g,玉米浆10g,葡萄糖10g,KH2PO4 1.5g,MgSO4·7H2O 0.5g,陈海水1000mL,pH6.0~7.5,121℃灭菌30min。
(3)复合菌制剂的制备
液体发酵制备复合菌制剂的方法:
将扩大培养后的3种菌株的混合液接种(例如按10%的接种量,体积比)到装有液体发酵培养基B的发酵罐中,于30~37℃,搅拌速度180~200rpm,通气量为2~4V/V·min,培养48~72h;然后采用高速离心的方法收集上述发酵菌体。
所述液体发酵培养基B的配方如下:胰蛋白胨10g,玉米浆10g,葡萄糖10g,KH2PO41.5g,MgSO4·7H2O 0.5g,陈海水1000mL,pH调至6.0~7.5。121℃灭菌30min后使用。将麦麸、沸石粉和玉米粉粉碎,然后按照1:1:1的重量比例混合均匀,所得的混合物作为辅料载体;
将离心分离得到的菌体载入辅料载体,然后烘干、粉碎、混合均匀,即得复合菌制剂。
所述以复合菌制剂蜡样芽孢杆菌(Bacillus cereus)BCXE-01为主要成分的复合菌制剂还可以通过以下步骤制备:
(1)种子液培养
将蜡样芽孢杆菌(Bacillus cereus)BCXE-01、地衣芽孢杆菌和枯草芽孢杆菌通过平板划线,分别接种到2216E固体培养基平板上,置于37℃培养24h,然后挑取单菌落分别接种于液体发酵培养基A中,于37℃、180~200rpm培养20~24h,得到3种菌的摇瓶种子液。
所述发液体酵培养基A的配方如下:胰蛋白胨10g,酵母粉5g,KH2PO4 1.5g,MgSO4·7H2O 0.5g,陈海水1000mL,pH6.0~7.5。使用前,将配制好的液体酵培养基A121℃灭菌30min。
所述2216E固体培养基的配方如下:胰蛋白胨10g,酵母粉5g,琼脂20g,陈海水1000mL,pH7.6-7.8。使用前,将配制好的2216E固体培养基121℃灭菌30min。
(2)扩大培养
3种菌的摇瓶种子液按蜡样芽孢杆菌(Bacillus cereus)BCXE-01:地衣芽孢杆菌:枯草芽孢杆菌=5~7:1:1的细菌数量比例接种(例如以10%的接种量,体积比)到装有液体发酵培养基B的发酵罐中,于30~37℃,搅拌速度180~200rpm,通气量为2~4V/V·min,培养24~36h。
(3)复合菌制剂的制备:
固体发酵制备复合菌制剂的方法:
首先将胰蛋白胨、酵母粉、麦麸、花生麸粉碎,然后将胰蛋白胨、酵母粉、麦麸、花生麸和水以2:1:12:4:1的重量比例混匀,制成发酵固体培养基。
采用加压法将将扩大培养后的3种菌株的混合液(例如按10%的接种量,体积比)喷入固体培养基上,边喷洒边混匀。然后于30~37℃,发酵培养48~72h。然后,采用流化床烘干机进行烘干,烘干后,粉碎,再混合均匀,即得复合菌制剂。
本发明为控制养殖水体中致病弧菌的数量、改善养殖水体环境、促进对虾健康生长以及降低对虾在养殖过程中的发病率和死亡率提供了有效的方法。
具体来说本发明与现有技术相比可产生如下积极效果:
1.本发明的蜡样芽孢杆菌(Bacillus cereus)BCXE-01可以改善对虾养殖环境,对对虾养殖池塘中病原菌弧菌的抑制率高达65.89%,可以作为抗生素类药物的替代品。
2.促进对虾摄食和生长;本发明的蜡样芽孢杆菌(Bacillus cereus)BCXE-01还可以重复使用,且不会产生药物残留和耐药性问题。
3.本发明蜡样芽孢杆菌(Bacillus cereus)BCXE-01产生的抑菌活性物质可以耐高温和耐低pH,这有利于其在应用中的运输和保存。
4.蜡样芽孢杆菌(Bacillus cereus)BCXE-01、地衣芽孢杆菌和枯草芽孢杆菌以5~7:1:1的细菌数比例混合制成的复合菌制剂,使其在对虾养殖过程中弧菌抑制率高于单菌,其抑制率高达72.4%~76.9%。
附图说明
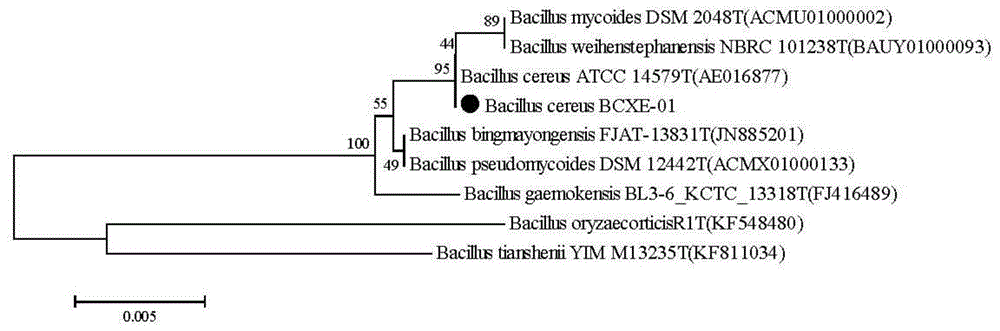
图1为蜡样芽孢杆菌(Bacillus cereus)BCXE-01的系统发育树分析;
图2为不同加热时间对蜡样芽孢杆菌(Bacillus cereus)BCXE-01发酵上清液抑菌效果的影响;
图3为10kDa Millipore超滤管过滤对蜡样芽孢杆菌(Bacillus cereus)BCXE-01发酵液抑菌效果的影响;
具体实施方式
试剂和仪器
培养基:
2216E液体培养基:胰蛋白胨10g,酵母粉5g,陈海水1000mL,pH7.6-7.8,121℃灭菌30min。
2216E固体培养基:胰蛋白胨10g,酵母粉5g,琼脂20g,陈海水1000mL,pH7.6-7.8,121℃灭菌30min。
TCBS琼脂:称取本品89.1g,煮沸溶解于1000ml蒸馏水中,冷至45-50℃时,倾入无菌平皿。
液体发酵培养基A:胰蛋白胨10g,酵母粉5g,KH2PO4 1.5g,MgSO4·7H2O 0.5g,陈海水1000mL,pH6.0~7.5,121℃灭菌30min。
液体发酵培养基B:胰蛋白胨10g,玉米浆10g,葡萄糖10g,KH2PO4 1.5g,MgSO4·7H2O 0.5g,陈海水1000mL,pH6.0~7.5,121℃灭菌30min。
仪器:光学显微镜、恒温摇床、无菌超净台、高压灭菌锅、pH计、高速离心机、恒温培养箱等。
实施例1菌种的分离纯化
从对虾养殖区域采集对虾肠道粪便样品。将采集的对虾肠道粪便置于装有无菌生理盐水的研钵中充分研磨,然后取上清加入2216E液体培养基中于37℃富集培养48h,然后稀释到适宜浓度后涂布于2216E固体培养基,置于37℃培养,然后挑选形态大小不同单菌落在相同的固体培养基上进行划线纯化培养,得到的单菌落于4℃保存备用。
将分离得到的单菌株先用Schaeffer-Fulton氏染色法进行芽孢染色(芽孢呈绿色,菌体呈红色),镜检出有芽孢的单菌落,然后接种到2216E固体培养基试管斜面,37℃培养24h,4℃保存备用。
实施例2拮抗菌的筛选
将实施例1中分离得到的单菌株在2216E固体培养基上进行划线活化培养12h,采用点种法,用接种环挑取单菌落点种于涂布有指示菌(副溶血弧菌)的2216E固体培养基上,37℃培养24~48h,观察有无抑菌圈,将出现抑菌圈的菌株进行再次点种,确认其抑菌性,最终获得一株抑菌效果较好的拮抗菌,命名为BCXE-01.
弧菌指示平板的制备:首先将指示菌于2216E液体培养基中活化培养24h,然后将指示菌稀释到105~106cfu/ml,取0.1ml均匀涂布于2216E固体培养基上(现用现制)。
实施例3拮抗菌BCXE-01的鉴定
所述菌株BCXE-01经革兰氏染色,可知该菌为革兰氏阳性杆菌;该菌在2216E固体培养基上的单菌落呈乳白色圆形、表面呈蜡烛状;菌体呈杆状,(0.8~1.2)μm×(2.0~4.2)μm,有鞭毛,能运动。按照《常见细菌系统鉴定手册》(东秀珠等,2001)进行生理生化特性检测,其测定结果详情见表1。
PCR模板的制备:在超净台中,用灭菌牙签挑取BCXE-01单菌落于50μL超纯水中混匀,然后置于PCR仪上,99℃20min,取上清液作为PCR模板。
用通用引物(正向:27F,反向:1492R)扩增16S rDNA序列,正向引物27F:5′-AGAGTTTGATCCTGGCTCAG-3′,反向引物1492R:5′-TACGGYTACCTTGTTACGACTT-3′。PCR反应体积50μL:模板1μL,2×Taqmix 25μL,10ng/μL正向引物和反向引物各2μL,无菌双蒸水水补至50μL。PCR反应条件:95℃5min;94℃45s;55℃30s;72℃1.5min,30个循环;72℃10min。
PCR产测序得到的16S rDNA基因序列在EzBioCloud数据库中与已知序列进行比对,结合菌株的生理生化鉴定结果,判断该菌属于蜡样芽孢杆菌(Bacilluscereus)细菌(见图1),故重新命名为蜡样芽孢杆菌(Bacillus cereus)BCXE-01。
实施例4蜡样芽孢杆菌(Bacillus cereus)BCXE-01对3种弧菌的拮抗试验
1、将蜡样芽孢杆菌(Bacillus cereus)BCXE-01接种于装有500ml液体2216E培养基的1000ml三角瓶中,37℃,180rpm培养24h。然后12000rpm离心10min,在无菌超净台中取上清液于1ml无菌离心管中。
2、将3中病原菌(副溶血弧菌、溶藻弧菌和灿烂弧菌)按照实施例2中指示菌平板制备方法制成供试平板。用牛津杯法,取200μl发酵上清液加入到涂好指示菌平板上的牛津杯中,然后37℃培养24h,测定其抑菌圈的大小。试验重复三次。
3、结果分析
蜡样芽孢杆菌(Bacillus cereus)BCXE-01的发酵上清液对副溶血弧菌、溶藻弧菌和灿烂弧菌均有明显的抑制作用;其对副溶血弧菌、溶藻弧菌和灿烂弧菌的抑菌圈大小分别为(2.40±0.15)cm、(2.25±0.11)cm和(1.55±0.15)。
实施例5发酵液中活性物质的耐高温试验
取实施例4蜡样芽孢杆菌(Bacillus cereus)BCXE-01的部分发酵液上清液在100℃中分别处理0(作为对照)、2、5、10、20、30、60、120min,然后用牛津杯法,以弧菌作为指示菌(制备方法见实施例2),取各个时间处理的发酵液200μl加入到涂好指示菌平板上的牛津杯中,然后37℃培养24h,测定其抑菌圈的大小。
结果分析:由图2可知,100℃的高温处理对蜡样芽孢杆菌(Bacillus cereus)BCXE-01发酵液中活性物质没有明显影响,其抑菌圈大小与对照没有差异。表明蜡样芽孢杆菌(Bacillus cereus)BCXE-01发酵液中抑菌活性物质具有良好的耐高温能力。其结果为三次重复试验的平均值。
实施例6发酵液中活性物质大小的初步检测
取实施例4蜡样芽孢杆菌(Bacillus cereus)BCXE-01的部分发酵液上清液用10kDa Millipore超滤管400rpm离心,取出超滤液于1ml无菌离心管中。
将未过滤的蜡样芽孢杆菌(Bacillus cereus)BCXE-01发酵上清液作为对照,用牛津杯法,以副溶血弧菌作为指示菌,取对照和超滤后(做a、b、c三个重复)的发酵液各200μl加入到涂好指示菌平板(指示菌平板制备方法见实施例2)上的牛津杯中,然后37℃培养24h,测定其抑菌圈的大小。
结果分析:由图3可知,用10kDa Millipore超滤管超滤后的发酵液抑菌圈大小与对照组的抑菌圈大小没有明显差异,表明蜡样芽孢杆菌(Bacillus cereus)BCXE-01经发酵产生的抑菌物质分子量小于10kDa。
实施例7蜡样芽孢杆菌(Bacillus cereus)BCXE-01发酵物质的耐pH检测
取实施例4蜡样芽孢杆菌(Bacillus cereus)BCXE-01的部分发酵液上清液,先进行发酵液原本pH值得测定,作为初始值。
然后将发酵上清液分成a、b、c、d4个组,然后用氢氧化钠溶液或盐酸溶液将pH分别调节至7.0±0.2、4.0±0.2、3.0±0.2、2.0±0.2,保持6h后,用牛津杯法,以副溶血弧菌作为指示菌,各个处理组均取出200μl加入到涂好指示菌平板(制备方法见实施例2)上的牛津杯中,然后37℃培养24h,测定其抑菌效果。
将剩余的a、b、c、d4个组pH再用氢氧化钠溶液或盐酸溶液将pH调至初始值,再用牛津杯法,以弧菌作为指示菌,各个处理组均取出200μl加入到涂好指示菌平板上的牛津杯中,然后37℃培养24h,测定其抑菌效果。其结果均为三次重复试验的平均值。
结果分析:
表2蜡样芽孢杆菌(Bacillus cereus)BCXE-01发酵上清液中活性物质耐pH试验结果
注:表中“+”表示有抑菌圈;“—”表示没有抑菌圈。
从表2可以看出,蜡样芽孢杆菌(Bacillus cereus)BCXE-01的发酵上清液抑菌活性物质具有耐酸性而且可以耐强酸,但当pH调至中性时上清液中抑菌活性物质失去抑菌性。表明蜡样芽孢杆菌(Bacillus cereus)BCXE-01的发酵上清液抑菌活性物质可以在酸性条件下发挥其抑菌性。
实施例8蜡样芽孢杆菌(Bacillus cereus)BCXE-01在对虾养殖池塘中的应用
试验地点选在胶州的南美白对虾养殖池塘,选取预先测定含有大量弧菌的池塘。
试验设定为3个池塘作为对照组,3个池塘泼洒发酵蜡样芽孢杆菌(Bacillus cereus)BCXE-01作为处理组。
试验开始0h时,取水样对试验池塘进行弧菌数量的检测。检测方法:采用TCBS培养基,取水样然后进行平板涂布计数的方法。
按照试验设计对处理组泼洒发酵蜡样芽孢杆菌(Bacillus cereus)BCXE-01,对照组什么也不添加,试验期间饲养条件不变。24h后,再对试验全部池塘的弧菌数量进行检测。
试验结果分析:
表3泼洒蜡样芽孢杆菌(Bacillus cereus)BCXE-01对池塘中弧菌数量的影响
由表3可知,用发酵蜡样芽孢杆菌(Bacillus cereus)BCXE-01处理池塘24h后,池塘中弧菌的数量显著低于对对照组。从试验结果来看,池塘中添加蜡样芽孢杆菌(Bacillus cereus)BCXE-01可以有效的降低池塘中弧菌的数量。
实施例9复合菌制剂的制备方法
本实施例的复合菌制剂的制备方法如下步骤:
1、种子液培养
将蜡样芽孢杆菌(Bacillus cereus)BCXE-01、地衣芽孢杆菌和枯草芽孢杆菌通过平板划线,分别接种到2216E固体培养基平板上,置于37℃培养24h,然后挑取单菌落分别接种于液体发酵培养基A中,于37℃,180~200rpm培养20~24h,得到三种菌的摇瓶种子液。
所述液体发酵培养基A包含:胰蛋白胨10g,酵母粉5g,KH2PO4 1.5g,MgSO4·7H2O 0.5g,陈海水1000mL,pH6.0~7.5,121℃灭菌30min。2216E固体培养基包括:胰蛋白胨10g,酵母粉5g,琼脂20g,陈海水1000mL,pH7.6-7.8,121℃灭菌30min。
2、扩大培养
三种菌的摇瓶种子液按蜡样芽孢杆菌(Bacillus cereus)BCXE-01:地衣芽孢杆菌:枯草芽孢杆菌=5:1:1的细菌数量比例接种到装有液体发酵培养基B的50L发酵罐中,于30~37℃,搅拌速度180~200rpm,通气量为2~4V/V·min,培养24~36h。
所述液体发酵培养基B:胰蛋白胨10g,玉米浆10g,葡萄糖10g,KH2PO4 1.5g,MgSO4·7H2O 0.5g,陈海水1000mL,pH6.0~7.5,121℃灭菌30min。
3、复合菌制剂的固体发酵
首先将胰蛋白胨、酵母粉、麦麸、花生麸采用网目0.9mm的锤片式粉碎机进行物料粉碎,然后将胰蛋白胨、酵母粉、麦麸、花生麸和水以2:1:12:4:1的重量比例混匀,制成发酵固体培养基。
将扩大培养后的3种菌株的混合液采用加压法将混合液(例如按10%的接种量,体积比)喷入固体培养基上,边喷洒边混匀。然后于30~37℃,发酵培养48~72h。然后,采用流化床烘干机进行烘干,烘干后,采用网目0.9mm的锤片式粉碎机进行粉碎,然后再用双螺旋混合机混合均匀,即得复合菌制剂。
实施例10复合菌制剂的制备方法
本实施例的复合菌制剂的制备方法如下步骤:
1、种子液培养
将蜡样芽孢杆菌(Bacillus cereus)BCXE-01、地衣芽孢杆菌和枯草芽孢杆菌通过平板划线,分别接种到2216E固体培养基平板上,置于37℃培养24h,然后挑取单菌落分别接种于液体发酵培养基A中,于37℃,180~200rpm培养20~24h,得到三种菌的摇瓶种子液。
所述液体发酵培养基A包含:胰蛋白胨10g,酵母粉5g,KH2PO4 1.5g,MgSO4·7H2O 0.5g,陈海水1000mL,pH6.0~7.5,121℃灭菌30min。2216E固体培养基包括:胰蛋白胨10g,酵母粉5g,琼脂20g,陈海水1000mL,pH7.6-7.8,121℃灭菌30min。
2、扩大培养
三种菌的摇瓶种子液按蜡样芽孢杆菌(Bacillus cereus)BCXE-01:地衣芽孢杆菌:枯草芽孢杆菌=6:1:1的细菌数量比例接种到装有液体发酵培养基B的50L发酵罐中,于30~37℃,搅拌速度180~200rpm,通气量为2~4V/V·min,培养24~36h。
所述液体发酵培养基B:胰蛋白胨10g,玉米浆10g,葡萄糖10g,KH2PO4 1.5g,MgSO4·7H2O 0.5g,陈海水1000mL,pH6.0~7.5,121℃灭菌30min。
3、复合菌制剂的固体发酵
首先将胰蛋白胨、酵母粉、麦麸、花生麸采用网目0.9mm的锤片式粉碎机进行物料粉碎,然后将胰蛋白胨、酵母粉、麦麸、花生麸和水以2:1:12:4:1的重量比例混匀,制成发酵固体培养基。
将扩大培养后的3种菌株的混合液采用加压法将混合液(例如按10%的接种量,体积比)喷入固体培养基上,边喷洒边混匀。然后于30~37℃,发酵培养48~72h。然后,采用流化床烘干机进行烘干,烘干后,采用网目0.9mm的锤片式粉碎机进行粉碎,然后再用双螺旋混合机混合均匀,即得复合菌制剂。
实施例11复合菌制剂的制备方法
本实施例的复合菌制剂的制备方法如下步骤:
1、种子液培养
将蜡样芽孢杆菌(Bacillus cereus)BCXE-01、地衣芽孢杆菌和枯草蜡样芽孢杆菌通过平板划线,分别接种到2216E固体培养基平板上,置于37℃培养24h,然后挑取单菌落分别接种于液体发酵培养基A中,于37℃,180~200rpm培养20~24h,得到三种菌的摇瓶种子液。
所述液体发酵培养基A包含:胰蛋白胨10g,酵母粉5g,KH2PO4 1.5g,MgSO4·7H2O 0.5g,陈海水1000mL,pH6.0~7.5,121℃灭菌30min。2216E固体培养基包括:胰蛋白胨10g,酵母粉5g,琼脂20g,陈海水1000mL,pH7.6-7.8,121℃灭菌30min。
2、扩大培养
三种菌的摇瓶种子液按蜡样芽孢杆菌(Bacillus cereus)BCXE-01:地衣芽孢杆菌:枯草芽孢杆菌=7:1:1的细菌数量比例接种到装有液体发酵培养基B的50L发酵罐中,于30~37℃,搅拌速度180~200rpm,通气量为2~4V/V·min,培养24~36h。
所述液体发酵培养基B:胰蛋白胨10g,玉米浆10g,葡萄糖10g,KH2PO4 1.5g,MgSO4·7H2O 0.5g,陈海水1000mL,pH6.0~7.5,121℃灭菌30min。
3、复合菌制剂的固体发酵
首先将胰蛋白胨、酵母粉、麦麸、花生麸采用网目0.9mm的锤片式粉碎机进行物料粉碎,然后将胰蛋白胨、酵母粉、麦麸、花生麸和水以2:1:12:4:1的重量比例混匀,制成发酵固体培养基。
将扩大培养后的3种菌株的混合液采用加压法将混合液(例如按10%的接种量,体积比)喷入固体培养基上,边喷洒边混匀。然后于30~37℃,发酵培养48~72h。然后,采用流化床烘干机进行烘干,烘干后,采用网目0.9mm的锤片式粉碎机进行粉碎,然后再用双螺旋混合机混合均匀,即得复合菌制剂。
实施例12实施例9~实施例11所得的复合菌制剂在对虾养殖过程中的应用
试验地点选在胶南的南美白对虾养殖场。
试验设计:选取20个水质相近,虾苗来源相同且死亡情况一致的池塘,每个池塘约1.5亩;20个池塘随机分为4组,其中1个组为对照组(泼洒4ppm的氟苯尼考),另外3个组作为处理组,分别泼洒实施例9~实施例11所得的液体复合菌制剂,分别标记为处理组1、处理组2和处理组3,喂养方法不变。处理组分别在第0、1、6天向池塘内泼洒液体复合菌制剂,在第0、1、2、7、15天进行处水样检测池塘中病原菌弧菌的数量,同时观察对虾摄食、生长及死亡情况。试验预期15天。
液体复合菌制剂的制备及使用方法:称取200g复合菌制剂溶于相对应的池塘水中,充分溶解后,均匀泼洒到池塘中。
弧菌的检测方法:采用TCBS平板计数法。
试验结果分析
表4养殖池中弧菌数量变化
由表4可知,对照泼洒氟苯尼考后,在第7d出现了严重的弧菌数量的反弹,并且在第15d检测的弧菌抑制率仅为42.7%;泼洒复合菌制剂的处理组3在泼洒后第2天弧菌的抑制率就达到了73.6%,虽然在第7d弧菌数量有轻微的反弹,但是在第15d测定的弧菌抑制率为76.9%。整体来看,处理组的弧菌抑制率明显高于对照组。
与实施例8对比可知,复合菌制剂的抑制弧菌的效果明显优于单菌菌株。各理组在泼洒复合菌制剂后,对虾的活力增强,投喂量增加,粪便成型且不拖尾,死亡量由每天死亡16~17斤先降至5~6斤左右,最后处理组对虾死亡量均维持在每天0.8~1.5斤左右,并且对虾生长状态逐渐恢复正常;对照组的对虾活力和投喂量也有所改善,但是每天的死亡量仍维持在6~8斤。
以上所述仅是本发明的优选实施方式,应当指出:对于本技术领域的普通技术人员来说,在不脱离本发明原理的前提下,还可以做出若干改进,这些改进应视为本发明的保护范围。
- 还没有人留言评论。精彩留言会获得点赞!