一种可直接对微小核糖核酸(microRNA)进行半定量的探针的制作方法
本发明涉及医学和分子生物学技术领域中的一种可直接对微小核糖核酸(microRNA)进行半定量的探针。
背景技术:
微小核糖核酸(microRNA,miRNA)是一类内生的、长度约为20-24个核苷酸的核糖核酸(RNA),在细胞发育、凋亡、分化、增殖等重要的生理病理过程中发挥重要作用。研究发现,人的体液中如血液、尿液、唾液、羊水、胸腹水等广泛存在microRNA,这些microRNA的表达谱与在组织细胞中一样,在肿瘤等病理状态下会发生特征性的改变,这些特定的microRNA表达谱是肿瘤细胞特异性生物标志物之一,是一种新的无创伤性诊断标志物以助于疾病的预测、诊断和预后。传统的microRNA检测方法包括印迹杂交技术(Northern Blotting),以及反转录与实时定量聚合酶链式反应(realtime PCR)联合应用,这些方法比较成熟且广为使用,但是存在着过程繁琐、价格昂贵、耗时较长、灵敏度低、易出现假阳性结果等缺陷,日益无法满足当前的检测需要。因此,研究开发一种可直接对微小核糖核酸(microRNA)进行半定量的探针一直是急待解决的新课题。
技术实现要素:
本发明的目的在于提供一种可直接对微小核糖核酸(microRNA)进行半定量的探针,该发明用于对体外细胞培养、离体组织、血液等样本提取的总microRNA中的某一种microRNA的进行半定量检测,利用探针进行microRNA的半定量检测,无需反转录及任何扩增技术,只需将少量样本直接加入反应体系中,50-65 ℃恒温5-30分钟,检测荧光强度即可,荧光强度累积速率与目的基因浓度成正比。
本发明的目的是这样实现的:一种可直接对微小核糖核酸(microRNA)进行半定量的探针,用于对总RNA中的某一种微小核糖核酸(microRNA)进行半定量检测,所述的可直接对微小核糖核酸(microRNA)进行半定量的探针具有一种由人工创造的非天然空间结构,命名为“由多功能茎环结构维持的单侧3’悬端双螺旋结构”,这是一种新型的核苷酸空间结构,由两个核苷酸相邻的二级结构组成,这种空间结构在特定条件下通过与靶序列的特异性结合,引起探针自身的两个二级结构依次变形,变形为一种“单链-双链-单链-双链”不完整双螺旋结构,且变形过程不可逆,探针初始的“由多功能茎环结构维持的单侧3’悬端双螺旋结构”不是DNA链置换酶能够催化的空间结构,而变形后的一种“单链-双链-单链-双链”不完整双螺旋结构是DNA链置换酶能够催化的空间结构;
所述的“由多功能茎环结构维持的单侧3’悬端双螺旋结构”,由两个相邻的核苷酸二级结构组成,分别是“多功能茎环结构”和“单侧3’悬端双螺旋结构”,由A、B链两条长度不同的寡核苷酸单链组装而成,A链较长,B链较短;
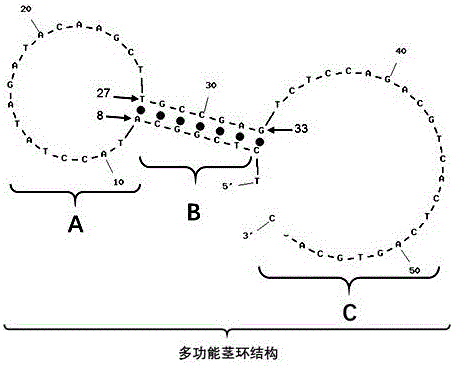
所述的“多功能茎环结构”是一种由普通茎环结构衍生出来的新型茎环结构,由A链按照碱基互补原则单独组装而成,含有三个结构域,分别是外环结构、“占位茎杆结构”和线状单链结构;外环结构是由A链中间区域的与靶序列完全互补核苷酸序列组成,空间结构是一条环状闭合单链,它的功能是与靶序列特异性结合,结合后将导致“占位茎杆结构”被破坏,茎环结构消失;“占位茎杆结构”是由A链近5’端的核苷酸序列和与外环结构3’端方向最后一个核苷酸相邻的核苷酸序列为起点,按照碱基互补原则形成的双螺旋结构,“占位茎杆结构”的近5’端的核苷酸占领了下游待结合B链的近3’端的结合位点,导致B链与A链结合后,B链的3’端无位点结合,成为3’悬端,它的功能不仅是维持茎环结构,增强外环结构对靶序列的识别能力,还是形成“单侧3’悬端双螺旋结构”的必需结构;线状单链结构由A链近3’端核苷酸序列形成,是按照碱基互补原则设计成的B链互补序列,空间构象是线状单链,它的功能是固定B链在探针中的位置;
所述的“单侧3’悬端双螺旋结构”是一种受“多功能茎环结构”调控的单侧3’端核苷酸游离的双螺旋结构,由A链的“占位茎杆结构”、线状单链结构和B链共同组成,B链一级结构的3’端核苷酸结合位点与A链一级结构近5’端核苷酸的结合位点重合,结合在A链的线状单链结构区,若“多功能茎环结构”完整,则“单侧3’悬端双螺旋结构”存在,若“多功能茎环结构”被破坏,则“单侧3’悬端双螺旋结构”将变形为普通双螺旋结构;
所述的这种空间结构在特定条件下通过与靶序列的特异性结合,是指在常规核酸杂交缓冲液中,杂交温度在50-65 ℃之间,能够触发核苷酸二级结构发生变形,使探针从初始“由多功能茎环结构维持的单侧3’悬端双螺旋结构”变形为一种“单链-双链-单链-双链”不完整双螺旋结构的唯一条件,这个唯一条件是探针的“多功能茎环结构”中的外环结构与靶序列发生特异性结合;
所述的引起探针自身的两个二级结构依次变形,探针自身的两个二级结构依次变形的顺序,核苷酸二级结构变形起始于“多功能茎环结构”的外环结构与靶序列的特异性结合,二者结合形成的双螺旋导致“占位茎杆结构”这个双螺旋被打开,在“多功能茎环结构”消失的同时暴露了原本由“占位茎杆结构”占领的B链3’端核苷酸结合位点,引起“单侧3’悬端双螺旋结构”的3’悬端与结合位点结合,变为普通的双螺旋结构,整个变形过程不可逆;
所述的一种“单链-双链-单链-双链”不完整双螺旋结构,特指在满足特定条件的杂交体系中,“由多功能茎环结构维持的单侧3’悬端双螺旋结构”与靶序列结合变形的产物,在特定条件下变形的最终产物的空间结构,由A链、靶序列、B链组成;A链的外环结构序列在靠近自身的5’端区域与靶序列形成双螺旋,A链的线状单链结构在自身的3’端与B链形成双螺旋,这两个双螺旋之间的区域和A链的5’端是原“占位茎杆结构”被打开后的单链;故从A链的5’端起,描述该变形产物的空间构象为一种“单链-双链-单链-双链”不完整双螺旋结构;
所述的探针初始的“由多功能茎环结构维持的单侧3’悬端双螺旋结构”不是DNA链置换酶能够催化的空间结构,而变形后的一种“单链-双链-单链-双链”不完整双螺旋结构是DNA链置换酶能够催化的空间结构,所述的DNA链置酶是一种具有5´→3´ 的聚合酶活性,可在互补链存在的情况下,沿着5’→3’方向延伸单链DNA或RNA,生成双链,但没有 5´→3´ 核酸外切酶活性的酶,当延伸方向遇到已结合序列时,在与互补链形成新双链的同事使原结合序列完整的游离,而不会将其剪切成单个核苷酸,这种特性被称为链置换活性;由于“由多功能茎环结构维持的单侧3’悬端双螺旋结构”的3’端是游离的悬端,无互补链,故DNA链置换酶不能催化这种核苷酸空间结构;而对结合了靶序列的一种“单链-双链-单链-双链”不完整双螺旋结构的3’端是与互补链结合的3’端,DNA链置换酶能够催化这种核苷酸空间结构,发生链延伸及链置换反应,生成以A链为模板的完整双螺旋结构,使已结合的靶序列重新游离,能够周而复始的与初始形态的探针结合,不断引发探针变形,直至全部探针变成以A链为模板的完整双螺旋结构;
所述的荧光基团与淬灭基团的修饰位置,荧光基团修饰在探针A链的5’端核苷酸上,淬灭基团修饰在5’端的互补位核苷酸或相邻的核苷酸上,也可以将荧光基团与淬灭基团位置互换;
所述的所述的一种可直接对微小核糖核酸(microRNA)进行半定量的探针的工作原理是,“靶序列启动的自身信号循环放大反应”:初始结构的探针(无荧光信号)→靶序列的出现→与探针结合后引发探针变形(变形后发出荧光信号,非靶序列不引起探针变形)→链延伸→链置换(初始结构探针不会发生链延伸及链置换反应)→靶序列重新游离→再次引起其它初始形态的探针变形(自身信号循环放大)。
本发明的要点在于它的“由多功能茎环结构维持的单侧3’悬端双螺旋结构”结构及“靶序列启动的自身信号循环放大反应”工作原理。
一种可直接对微小核糖核酸(microRNA)进行半定量的探针与现有技术相比,具有以下优点:适用范围广,可用于对体外细胞培养、离体组织、血液等任何已知来源的总microRNA提取液中的某一种microRNA进行半定量检测;直接加入原始样本,无需对靶序列进行反转录及扩增;检测限极低,可检出1.0*10-18mol的靶序列,特异性高,100倍单碱基错配序列无干扰,亦不受样本中DNA杂质的干扰,操作极其简便,只需一步加样操作即可送检;检测时间短,只需5-30分钟,可广泛地应用于医学和分子生物学技术领域中。
下面结合附图及实施例对本发明进行详细说明。
附图说明
图1是探针的工作原理图。
图2是以microRNA100-3p(以下简称microRNA100)作为靶序列的的探针A链的二级结构预测图。
图3 是以microRNA100作为靶序列的探针初始结构图。
图4 是以microRNA100作为靶序列的探针灵敏度考察——对不同含量的microRNA100标准品进行半定量分析。
图5 是microRNA100探针特异性考察——加入含量高于靶序列100倍的单碱基错配序列及双链DNA作为干扰物质的检测结果。
图6 是应用本探针检测不同细胞株中microRNA100表达差异的结果图。
图7 是应用realtime PCR法验证不同细胞株中microRNA100表达差异的结果图。
具体实施方式
参照附图,一种可直接对微小核糖核酸(microRNA)进行半定量的探针,用于对总RNA中的某一种微小核糖核酸(microRNA)进行半定量检测,所述的可直接对微小核糖核酸(microRNA)进行半定量的探针具有一种由人工创造的非天然空间结构,命名为“由多功能茎环结构维持的单侧3’悬端双螺旋结构”,这是一种新型的核苷酸空间结构,由两个核苷酸相邻的二级结构组成,这种空间结构在特定条件下通过与靶序列的特异性结合,引起探针自身的两个二级结构依次变形,变形为一种“单链-双链-单链-双链”不完整双螺旋结构,且变形过程不可逆,探针初始的“由多功能茎环结构维持的单侧3’悬端双螺旋结构”不是DNA链置换酶能够催化的空间结构,而变形后的一种“单链-双链-单链-双链”不完整双螺旋结构是DNA链置换酶能够催化的空间结构。
所述的“由多功能茎环结构维持的单侧3’悬端双螺旋结构”,由两个相邻的核苷酸二级结构组成,分别是“多功能茎环结构”和“单侧3’悬端双螺旋结构”,由A、B链两条长度不同的寡核苷酸单链组装而成,A链较长,B链较短。
所述的“多功能茎环结构”是一种由普通茎环结构衍生出来的新型茎环结构,由A链按照碱基互补原则单独组装而成,含有三个结构域,分别是外环结构、“占位茎杆结构”和线状单链结构;外环结构是由A链中间区域的与靶序列完全互补核苷酸序列组成,空间结构是一条环状闭合单链,它的功能是与靶序列特异性结合,结合后将导致“占位茎杆结构”被破坏,茎环结构消失;“占位茎杆结构”是由A链近5’端的核苷酸序列和与外环结构3’端方向最后一个核苷酸相邻的核苷酸序列为起点,按照碱基互补原则形成的双螺旋结构,“占位茎杆结构”的近5’端的核苷酸占领了下游待结合B链的近3’端的结合位点,导致B链与A链结合后,B链的3’端无位点结合,成为3’悬端,它的功能不仅是维持茎环结构,增强外环结构对靶序列的识别能力,还是形成“单侧3’悬端双螺旋结构”的必需结构;线状单链结构由A链近3’端核苷酸序列形成,是按照碱基互补原则设计成的B链互补序列,空间构象是线状单链,它的功能是固定B链在探针中的位置。
所述的“单侧3’悬端双螺旋结构”是一种受“多功能茎环结构”调控的单侧3’端核苷酸游离的双螺旋结构,由A链的“占位茎杆结构”、线状单链结构和B链共同组成,B链一级结构的3’端核苷酸结合位点与A链一级结构近5’端核苷酸的结合位点重合,结合在A链的线状单链结构区,若“多功能茎环结构”完整,则“单侧3’悬端双螺旋结构”存在,若“多功能茎环结构”被破坏,则“单侧3’悬端双螺旋结构”将变形为普通双螺旋结构。
所述的这种空间结构在特定条件下通过与靶序列的特异性结合,是指在常规核酸杂交缓冲液中,杂交温度在50-65 ℃之间,能够触发核苷酸二级结构发生变形,使探针从初始“由多功能茎环结构维持的单侧3’悬端双螺旋结构”变形为一种“单链-双链-单链-双链”不完整双螺旋结构的唯一条件,这个唯一条件是探针的“多功能茎环结构”中的外环结构与靶序列发生特异性结合。
所述的引起探针自身的两个二级结构依次变形,探针自身的两个二级结构依次变形的顺序,核苷酸二级结构变形起始于“多功能茎环结构”的外环结构与靶序列的特异性结合,二者结合形成的双螺旋导致“占位茎杆结构”这个双螺旋被打开,在“多功能茎环结构”消失的同时暴露了原本由“占位茎杆结构”占领的B链3’端核苷酸结合位点,引起“单侧3’悬端双螺旋结构”的3’悬端与结合位点结合,变为普通的双螺旋结构,整个变形过程不可逆。
所述的一种“单链-双链-单链-双链”不完整双螺旋结构,特指在满足特定条件的杂交体系中,“由多功能茎环结构维持的单侧3’悬端双螺旋结构”与靶序列结合变形的产物,在特定条件下变形的最终产物的空间结构,由A链、靶序列、B链组成;A链的外环结构序列在靠近自身的5’端区域与靶序列形成双螺旋,A链的线状单链结构在自身的3’端与B链形成双螺旋,这两个双螺旋之间的区域和A链的5’端是原“占位茎杆结构”被打开后的单链;故从A链的5’端起,描述该变形产物的空间构象为一种“单链-双链-单链-双链”不完整双螺旋结构。
所述的探针初始的“由多功能茎环结构维持的单侧3’悬端双螺旋结构”不是DNA链置换酶能够催化的空间结构,而变形后的一种“单链-双链-单链-双链”不完整双螺旋结构是DNA链置换酶能够催化的空间结构,所述的DNA链置酶是一种具有5´→3´ 的聚合酶活性,可在互补链存在的情况下,沿着5’→3’方向延伸单链DNA或RNA,生成双链,但没有 5´→3´ 核酸外切酶活性的酶,当延伸方向遇到已结合序列时,在与互补链形成新双链的同事使原结合序列完整的游离,而不会将其剪切成单个核苷酸,这种特性被称为链置换活性;由于“由多功能茎环结构维持的单侧3’悬端双螺旋结构”的3’端是游离的悬端,无互补链,故DNA链置换酶不能催化这种核苷酸空间结构;而对结合了靶序列的一种“单链-双链-单链-双链”不完整双螺旋结构的3’端是与互补链结合的3’端,DNA链置换酶能够催化这种核苷酸空间结构,发生链延伸及链置换反应,生成以A链为模板的完整双螺旋结构,使已结合的靶序列重新游离,能够周而复始的与初始形态的探针结合,不断引发探针变形,直至全部探针变成以A链为模板的完整双螺旋结构。
所述的荧光基团与淬灭基团的修饰位置,荧光基团修饰在探针A链的5’端核苷酸上,淬灭基团修饰在5’端的互补位核苷酸或相邻的核苷酸上,也可以将荧光基团与淬灭基团位置互换。
所述的所述的一种可直接对微小核糖核酸(microRNA)进行半定量的探针的工作原理是,“靶序列启动的自身信号循环放大反应”:初始结构的探针(无荧光信号)→靶序列的出现→与探针结合后引发探针变形(变形后发出荧光信号,非靶序列不引起探针变形)→链延伸→链置换(初始结构探针不会发生链延伸及链置换反应)→靶序列重新游离→再次引起其它初始形态的探针变形(自身信号循环放大)。
实施例一
以microRNA100-3p(以下简称microRNA100)作为靶序列,对不同含量的microRNA100标准品进行半定量分析。
步骤一:探针的设计及二级结构预测,microRNA100核苷酸序列为5’CAAGCTTGTATCTATAGGTATG 3’,A链的核苷酸序列及修饰基团为5’ROX TCL TCLGGCATACCTATAGATACAAGCTTGCCGAGT(-BHQ2)CTCCAGACGTCACTCAGTGCACC 3’。带有右上角标L的核苷酸为锁核酸,单下划线的序列互补,5’ 端修饰ROX(红色荧光基团),双下划线的T修饰BHQ2(荧光淬灭基团)。由http://sg.idtdna.com/UNAFold 提供的A链二级结构预测结果以及ΔG= -3.06,表明该二级结构可自发形成。如图2所示,从5’端第2个碱基C到第33个碱基G为预期的“多功能茎环结构”。从第34个碱基T到3’端是无二级结构的线性单链,作为B链的结合域,无二级结构的线性单链有利于B链的快速结合。A链二级结构预测结果与设计预期完全一致。参见图2是本发明的软件预测的A链二级结构图。B链核苷酸序列:5’GGTGCACTGAGTGACGTCTGGAGAC 3’,经相同软件预测,ΔG最小值为1.15,表明B链为无二级结构的线性单链。其3’端C的结合位点为A链5’端第33个碱基G,已经被“多功能茎环结构” 5’端第2个碱基C优先占据,因此B链与A链结合后形成了B链3’端C为游离态的双螺旋结构,即“单侧3’悬端双螺旋结构”,参见图3 是本发明的microRNA100探针设计图。
步骤二:探针的合成,取浓度为100 μmol /L的A链冻干粉10 μL,加入到80 μL的PBS中95 ℃金属浴1分钟,取出后缓慢冷却至室温,静置10分钟,加入浓度为100 μmol /L的B链冻干粉10 μL,混匀后室温下静置10分钟,即得。
步骤三:取含有不同浓度的人工合成microRNA100模板的标准液1 μL,分别加入到200 μL乳白色八联管中,样本中microRNA100的含量分别为1.0*10-12mol 、1.0*10-13mol,1.0*10-14mol,1.0*10-15mol,1.0*10-16mol,1.0*10-17mol,1.0*10-18mol,并用超纯水代替microRNA100做空白对照,所得结果即背景荧光值。
步骤四:向上述液体中加入浓度为10 μmol /L的探针1 μL以及杂交缓冲液18 μL,合计20 μL,混匀后送qPCR仪检测。
步骤五:检测条件为在60 ℃恒温30 分钟。
步骤六:结果分析。检测结果如图4所示,所有样本中,无靶序列的空白对照样本,荧光值强度最低,证明如我们预期,在无靶序列的情况下探针处于初始的“由多功能茎环结构维持的单侧3’悬端双螺旋结构”,发生了荧光共振能量转移,因此原始荧光强度很低(大约500000),并且这个空间结构也不是DNA链置换酶能够催化的空间结构,因此荧光强度的累积速率(上升幅度)极低,导致空白样本的最终荧光强度也最低(大约3000000)。所有含有microRNA100的样本荧光值均显著高于空白对照,其中microRNA100含量为1.0*10-18mol(1 amol)的荧光强度值(大约6000000)高出空白对照约2倍;并且microRNA100含量越高的样本,荧光强度越强,反应时间越短,microRNA100含量为1.0*10-12mol(1 pmol)的样本在10分钟时就已经达到反应终点,其荧光强度高出空白对照一个数量级。证明如我们预期,结合了靶序列而变形的一种“单链-双链-单链-双链”不完整双螺旋结构,不发生荧光共振能量转移,荧光可被检出,并且这个变形后的结构是DNA链置换酶能够催化的空间结构,即使在靶序列的量极低的样本中(1.0*10-14mol-1.0*10-18mol),在初始荧光强度很低的情况下(大约500000),由于链置换反应的不断发生,荧光强度的累积速率(上升幅度)远高于空白对照,于检测开始5分钟后已显示出差异,并且荧光强度差异随时间的增加而不断增加,充分显示了本专利技术具有极高的灵敏度。参见图4 对不同含量的microRNA100标准品进行半定量分析。
从a到g依次代表样本中microRNA100的含量为:1.0*10-12mol、1.0*10-13mol 1.0*10-14mol、1.0*10-15mol、1.0*10-16mol、1.0*10-17mol、1.0*10-18mol,最下面的曲线是空白对照。
实施例二
利用高浓度单碱基错配序列及与microRNA100序列一致但长度使其二倍的双链DNA混合做为干扰物质,考察探针的特异性。
步骤一: microRNA100探针设计与合成,见实施例1的步骤一和步骤二,单碱基错配核苷酸序列为5’CAAGCTTGTATTTATAGGTATG 3’,与microRNA100序列相比,仅一个碱基T有差异。干扰用双链DNA 的序列为5’CAAGCTTGTATCTATAG
GTATGCAAGCTTGTATCTATAGGTATG 3’及其互补序列形成的DNA双螺旋结构。
步骤二:分别取浓度为10 μmol /L的探针1 μL以及杂交缓冲液18 μL,合计19 μL,混匀后加入到200 μL乳白色八联管中。
步骤三:向A样本孔中加入microRNA100标准品1 μL,使样本中microRNA100的含量为1 pmol;向B样本孔中加入microRNA100标准品1 μL,使样本中microRNA100的含量为1 pmol,再加入单碱基错配模板1 μL,使样本中单碱基错配模板的含量为100 pmol,再加入双链DNA 1μL,使样本中双链DNA含量为1 pmol两个样本总体积均为20 μL,即B样本中有高于A孔100倍的单碱基错配模板及等量双链DNA,;向C样本孔中加入microRNA100标准品1 μL,使样本中microRNA100的含量为1 pmol,再加入单碱基错配模板1 μL,使样本中单碱基错配模板的含量为100 pmol,再加入双链DNA 1μL,使样本中双链DNA含量为1 pmol两个样本总体积均为20 μL,但是不加入靶序列,D孔中用超纯水代替标准品做空白对照,混匀后送qPCR仪检测。
步骤四:检测条件为在60 ℃恒温30 分钟。
步骤五:结果分析。检测结果如图5所示,AB两个样本检测结果基本一致,虽然B孔中加入100倍于microRNA100的单碱基错配序列和等量的双链DNA,但是探针并未因为单碱基错配和双链DNA的加入发生非特异性结合;同时CD两个样本检测结果也基本一致,同样表明探针在高浓度单碱基错配模板及双链DNA混合的干扰下,显示出了很高的特异性。因此,可以认为探针具有很强的单碱基错配的识别能力,以及抗DNA干扰的能力。参见图5 加入含量高于靶序列100倍的单碱基错配序列及双链DNA作为干扰物质的检测结果。
实施例三
检测Hosepic细胞和HIEC细胞中microRNA100的表达差异。
步骤一: microRNA100探针设计与合成,见实施例1的步骤一和步骤二。
步骤二: Trizol法提取Hosepic细胞和HIEC细胞的总RNA。
步骤三:取上述两个样本的总RNA提取液各5 μL,分别加入到200 μL乳白色八联管中。
步骤四:加入浓度为10 μM的探针1 μL,以及杂交缓冲液14 μL,合计20 μL,混匀后送qPCR仪检测。
步骤五:检测条件为在60 ℃恒温30 分钟。
步骤六:结果分析。检测结果如图6所示,30分钟时,含有Hosepic细胞总RNA的样本荧光强度约为8.0*106,含有HIEC细胞总RNA的样本荧光强度约为7.0*106,因此判定Hosepic细胞中microRNA100的含量高于HIEC细胞,即HIEC细胞表达microRNA100的量略高于Hosepic细胞。参见图6 是本发明的分别含有Hosepic细胞总RNA和HIEC细胞总RNA的样本的实时荧光曲线图。
步骤七:利用经典的反转录联合realtimePCR法验证本方法结果的正确性。验证结果如图7所示,Hosepic细胞达到CT值的循环数为27.91 ,HIEC细胞达到CT值的循环数为28.84,前者先于后者达到CT值,因此判定Hosepic细胞表达microRNA100的量略高于HIEC细胞。经过验证,本专利与经典的反转录联合realtimePCR法的检测结果一致。参见图6和图7 是利用本发明的进行不同细胞的microRNA100表达实例检测结果图及利用经典的反转录联合realtimePCR法验证结果图。
下面结合实施例进一步叙述本发明:
所述的荧光基团与淬灭基团修饰位置的理论依据是荧光共振能量转移原理。荧光共振能量转移(fluorescence resonance energy transfer, FRET),是距离很近的两个荧光分子间产生的 一种能量转移现象。当供体荧光分子的发射光谱与受体荧光分子的吸收光谱重叠,并且两个分子的距离在10纳米范围以内时,就会发生一种非放射性的能量转移,使得供体的荧光强度比它单独存在时要低的多(荧光猝灭),而受体发射的荧光却大大增强(敏化荧光)。如权利要求9所述的位置进行修饰后,探针在初始的“由多功能茎环结构维持的单侧3’悬端双螺旋结构”时,荧光基团与淬灭基团空间距离小于10纳米,将会发生荧光共振能量转移,导致荧光被淬灭,故检测不到荧光。当探针变形为一种“单链-双链-单链-双链”不完整双螺旋结构时,荧光基团与淬灭基团之间空间距离远大于10 纳米,不能发生荧光共振能量转移,荧光基团不能被淬灭,故可检测到荧光。每当“靶序列的出现→与探针结合→探针变形→链延伸→链置换→靶序列重新游离”循环反应一次,被打开探针的量就增加一个靶序列原始量,靶序列的原始量越大,单位时间内发出荧光的探针量就越大,即荧光强度的累积速率与靶序列浓度成正比。因此,探针具有自身信号放大功能,不需要对靶序列进行扩增,极微量靶序列的也能够被检测到。
所述的DNA链置酶的特性之一是当引物的3’端与模板上的互补碱基结合后,这种酶可以催化引物的3’端向前延伸,并具有链置换活性,可在互补链存在的情况下,沿着5’→3’方向延伸单链DNA或RNA,当延伸方向遇到已结合序列时,在与互补链形成新双链的同事使原结合序列完整的游离,而不会将其剪切成单个核苷酸,这种特性被称为链置换活性。
所述的一种可直接对微小核糖核酸(microRNA)进行半定量的探针是通过如下步骤来实现的:
步骤一:取浓度为10 μM的探针1 μL,加入到12 μL含DNA链置换酶2μL,Mg2+浓度20 mM的杂交缓冲液中,混匀;
步骤二:向上述液体其中加入5 μL样本,混匀后送qPCR仪检测;
步骤三:检测条件通常为60 ℃恒温30分钟,检测温度及检测时间和可根据具体情况在50-65 ℃、5-30分钟之间调整;
步骤四:结果分析。
所述的一种可直接对微小核糖核酸(microRNA)进行半定量的探针的检测结果判定的方法,使用一种可直接对microRNA进行半定量的探针对未知样本中microRNA进行半定量检测,荧光强度累积速率与样本中目的microRNA含量成正比,检测结果判定的方法有两种,当待测样本中目的microRNA含量较低时,相同时间内荧光强度值越高的样本,其目的microRNA的含量越高;当待测样本中目的microRNA含量较高时,达到相同荧光强度值所用时间越短的样本,其microRNA的含量越高;反应体系中目的microRNA含量低于1 pmol时,探针具有良好区分度,如反应体系中目的microRNA过高导致比较结果无差异时,如样本中目的microRNA含量过高导致比较结果无差异时,稀释样本后再进行检测。
附图1是探针的工作原理图,A: “由多功能茎环结构维持的单侧3’悬端双螺旋结构”(探针初始结构);B:“单链-双链-单链-双链”不完整双螺旋结构(探针变形结构);C:以A链为模板的完整双螺旋(反应最终结构)。
其工作原理为“靶序列启动的自身信号循环放大反应”:初始结构的探针(无荧光信号)→靶序列的出现→与探针结合后引发探针变形(变形后发出荧光信号,非靶序列不引起探针变形)→链延伸→链置换(初始结构探针不会发生链延伸及链置换反应)→靶序列重新游离→再次引起其它初始形态的探针变形(自身信号循环放大)。
如图1, A中的荧光基团与荧光淬灭基团的空间距离小于10纳米,会发生荧光共振能量转移,导致荧光被淬灭,因此,检测不到荧光信号;而靶序列的出现能够使A变形成B,荧光基团与荧光淬灭基团的空间距离远大于10纳米,荧光共振能量转移停止,荧光信号可被检测;DNA链置换酶可以催化B生成C,并且置换下已经结合的靶序列,使其重新游离,这样靶序列可以再次与其它初始形态的探针结合,实现自身信号循环放大。
附图2是以microRNA100作为靶序列的探针A链的二级结构预测图,A:外环结构;B:“占位茎杆结构”;C:线状单链结构。从5’端第2个核苷酸C到第8个核苷酸A,与第33个核苷酸G到第27个核苷酸T形成的7个碱基对的双螺旋为“占位茎杆结构”,其中第33个核苷酸G是B链3’悬端的互补位点;第8个核苷酸A到第27个核苷酸T的环状单链为外环结构;第34个核苷酸T到3’端为线状结构,是B链结合的域。“占位茎杆结构”、外环结构及线状单链结构三个结构域共同组成“多功能茎环结构”。
附图3是以microRNA100作为靶序列的探针初始结构图,A:外环结构(环状闭合单链);B:占位茎杆结构(双螺旋);C:线状单链结构;D:单侧3’悬末端双螺旋结构(占位茎杆结构5’端+B链+线状单链结构);E:该位置的C碱基为被占位茎杆结构5’端占领的3’悬端的结合位点;F:3’悬端。 A链形成的“多功能茎环结构”和B链形成的“单侧3’悬末端双螺旋结构”共同组成了探针的“由多功能茎环结构维持的单侧3’悬端双螺旋结构”。A链的5’端修饰红色荧光染料ROX,互补位置的相邻T碱基修饰荧光淬灭基团BHQ2。
附图4是以microRNA100作为靶序列的探针灵敏度考察——对不同含量的microRNA100标准品进行半定量分析,从a到g依次代表样本中microRNA100的含量为:1.0*10-12mol、1.0*10-13mol 1.0*10-14mol、1.0*10-15mol、1.0*10-16mol、1.0*10-17mol、1.0*10-18mol,最下面的曲线是空白对照。纵坐标为荧光强度值,横坐标为时间,单位是分钟。空白对照样本用超纯水代替靶序列,所得结果即背景荧光值。
附图5中的 microRNA100探针特异性考察——加入含量高于靶序列100倍的单碱基错配序列及双链DNA作为干扰物质的检测结果。A:对样本中只含有1 pmol 的microRNA100标准品的检测结果;B:对样本中含有1 pmol 的microRNA100标准品、100 pmol的单碱基错配序列及1 pmol双链DNA的检测结果;C:对样本中不含有microRNA100,但含有100 pmol的单碱基错配序列及双链DNA的检测结果;D:对空白对照样本的检测结果。纵坐标为荧光强度值,横坐标为时间,单位是分钟。空白对照样本用超纯水代替靶序列,所得结果即背景荧光值。
附图6中的应用本探针检测不同细胞株中microRNA100表达差异的结果图,A:对含有1 pmol 的microRNA100标准品样本的检测结果;B:对Hosepic的总RNA提取液的检测结果;C:对HIEC细胞的总RNA提取液的检测结果;D:对空白对照样本的检测结果。纵坐标为Fluorescence(荧光值),横坐标为Time(时间,单位是分钟)。检测结束时Hosepic细胞荧光值高于HIEC细胞,所以检测结果为Hosepic细胞microRNA100的表达高于Hosepic细胞。
附图7中的应用realtime PCR法验证不同细胞株中microRNA100表达差异的结果图,A为Hosepic细胞的检测结果,B为 HIEC细胞的检测结果。纵坐标为ΔRn,ΔRn 的值用于反映PCR过程中产物的量,值越大表明反应的产物量越大;横坐标为循环数,循环数小的样本microRNA100表达量高,Hosepic细胞的循环数(循环数=27.91)小于HIEC细胞的循环数(循环数=28.84),因此,检测结果为Hosepic细胞中microRNA100的含量略高于HIEC细胞,与本探针接测结果一致。
序列表
<110> 魏敏杰、张晶
<120> 一种可直接对微小核糖核酸(microRNA)进行半定量的探针
<160> 7
<170> PatentIn version 3.5
<210> 1
<211> 22
<212> DNA
<213> 人工序列
<400> 1
caagcttgta tctataggta tg 22
<210> 2
<211> 57
<212> DNA
<213> 人工序列
<400> 2
tctcggcata cctatagata caagcttgcc gagtctccag acgtcactca gtgcacc 57
<210> 3
<211> 25
<212> DNA
<213> 人工序列
<400> 3
ggtgcactga gtgacgtctg gagac 25
<210> 4
<211> 22
<212> DNA
<213> 人工序列
<400> 4
caagcttgta tttataggta tg 22
<210> 5
<211> 44
<212> DNA
<213> 人工序列
<400> 5
caagcttgta tctataggta tgcaagcttg tatctatagg tatg 44
<210> 6
<211> 23
<212> DNA
<213> 人工序列
<400> 6
atcattaaac ccgtagatcc gaa 23
<210> 7
<211> 24
<212> DNA
<213> 人工序列
<400> 7
aatggttgtt ctccacactc tctc 24
- 还没有人留言评论。精彩留言会获得点赞!
- 抑制人pard6a基因表达的小干扰核糖核酸序列及其抗卵巢癌增殖和转移的用图
- 光交联的形成抑制方法、及自交联体形成抑制型光响应性核酸的制作方法
- 糖修饰的核酸分子的制作方法
- 一种用于信息存储和加密的单链脱氧核糖核酸的制作方法
- Rnase4作为药物靶点在脑胶质瘤抑制药物中的应用
- (2S,3R,4R)-3,5-二取代-2-脱氧-2-羟基-2-甲基-D-核糖-γ-内酯的制备方法及其中间体的制作方法
- Rnase4作为药物靶点在脑胶质瘤抑制药物中的应用
- (2S,3R,4R)-3,5-二取代-2-脱氧-2-羟基-2-甲基-D-核糖-γ-内酯的制备方法及其中间体的制作方法
- 脱氧核糖核酸酶在制备用于治疗男性低生育力的药物中的应用
- 基于适体的靶向激活循环放大spr检测蛋白质的方法