血管内皮生长因子融合蛋白的制作方法
本发明涉及血管内皮生长因子受体(vegfr)融合蛋白,其用于制备治疗癌症或眼病的药剂(agent)。本发明的融合蛋白是多价双特异性抗体,其中vegfr胞外结构域与免疫球蛋白样结构域的fc区域融合。
背景技术:
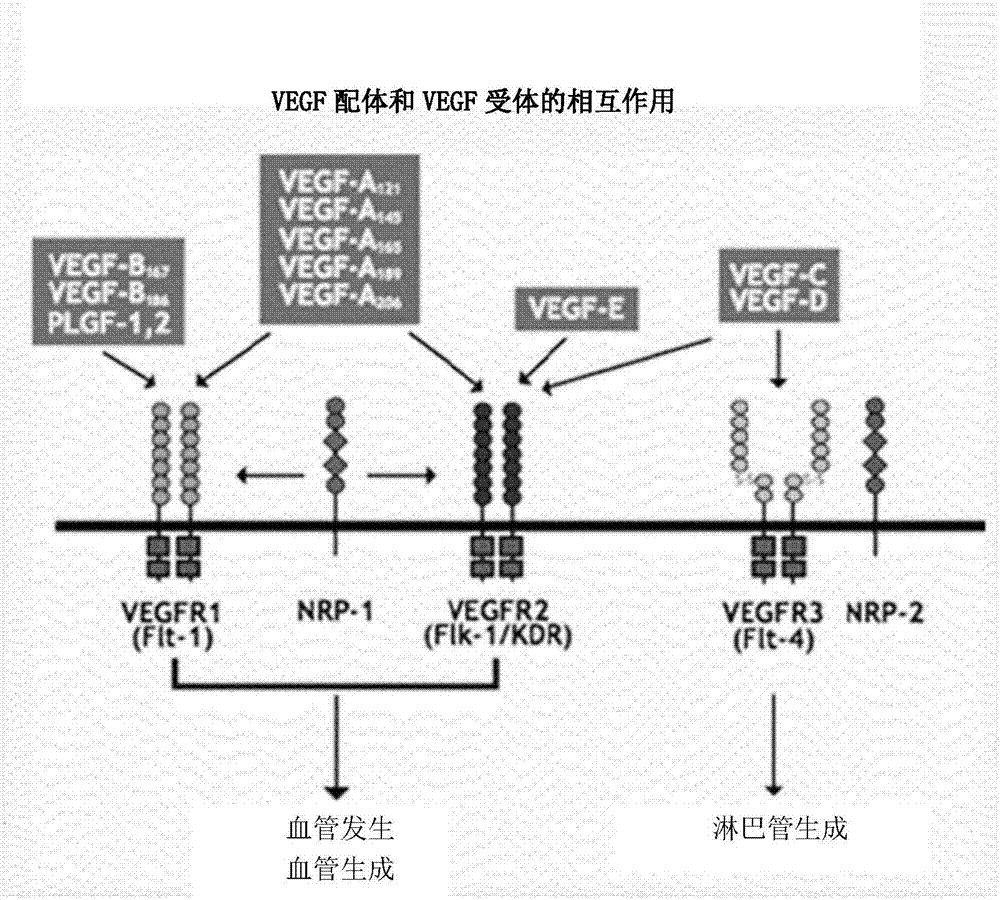
:血管内皮生长因子(vegf)是在促进血管发生和血管生成两者中起重要作用的信号蛋白。当血液循环不当时,vegf起到恢复和向组织供氧的系统的一部分的作用。vegf的众所周知的功能是在胚胎发育期间、在受伤部位、在运动后的肌肉中以及在脉管(vessel)形成中产生新的血管以绕过阻塞的血管。然而,增加的vegf的量可能引起异常的血管生成。尤其地,血管生成与肿瘤发展相关,使得其参与原发性或转移性肿瘤生成。此外,当原发性癌细胞通过血管生成引入血管时,发生癌症转移。据报道,血管生成引起例如哮喘、呼吸困难、子宫内膜异位;急性和慢性炎症,例如动脉粥样硬化和组织水肿;传染病,例如肝炎和卡波西肉瘤;自身免疫性疾病,例如糖尿病、牛皮癣、风湿性关节炎和甲状腺炎;和其他包括糖尿病视网膜病变、脉络膜新生血管形成(cnv)、年龄相关性黄斑变性(amd)、血管纤维瘤等的疾病(carmeliet,p.yjain,rk.2000.nature407:249-257;kuwanom,等2001.internmed40:565-572)。在血管生成中起重要作用的vegf主要影响血管内皮细胞。根据体外试验,vegf刺激内皮细胞的分裂(division)和漂移(wandering),并且也增加毛细血管通透性。在哺乳动物中,vegf被分为5种类型,例如vegf-a、vegf-b、vegf-c、vegf-d和plgf(胎盘生长因子)。vegf-a刺激血管生成、内皮细胞漂移、分裂、血管管腔形成、巨噬细胞和粒细胞的趋化性和血管扩张。vegf-b促进胚胎血管生成,尤其是心肌组织的发育。vegf-c加速淋巴管生成,并且vegf-d对于包围肺细支气管的淋巴管的生长是必需的。此外,plgf对于血管发生、缺血、炎症、损伤恢复和癌症中的血管生成是重要的。vegf受体(vegfr)——一种其配体为vegf的受体,由3种亚型(vegfr1(flt-1)、vegfr2(kdr/flk-1)和vegfr3(flt-4))组成,并且通过基因的可变剪接以膜-结合vegfr(mbvegfr)或可溶性vegfr(svegfr)的形式存在。vegfr在神经细胞,卡波西氏肉瘤和造血干细胞中表达,而其通常在内皮细胞中被发现。一旦vegf结合至vegfr,信号通过受体的二聚化和受体酪氨酸残基的磷酸化被传递。vegf以高亲和力结合至其受体vegfr1和vegfr2,并且主要通过vegfr2传递信号,并诱导包括内皮细胞的生长和迁移的血管生成机制。因此,作为用于抑制或压制由vegf诱导的血管生成的靶标,已经研究了vegf和vegfr2(ellis和hicklin,naturerev.cancer,8:579,2008;youssoufian等,clin.cancerres.,13:5544s,2007)。在先前研究中报道的双特异性抗体或多特异性抗体包括i)由vegfr1结构域2、vegfr2结构域3、结构域4和igg1fc组成的康柏西普,ii)由vegfr1结构域2、vegfr2结构域3和igg1fc组成的vegf-trap(阿柏西普)和iii)由vegfr1结构域2、结构域3和igg1fc组成的vegf-grab。我们发明人已经急切地研究开发用于通过压制或抑制血管生成来治疗癌症和眼病的多特异性抗体,并且已令人惊奇地发现本发明的免疫球蛋白样结构域的融合蛋白构建体以高灵敏度和特异性结合至vegf-a和plgf,并且具有显著优异的抑制各种肿瘤的增殖、生长和/或血管生成的效果。本文引用的所有专利、公开的申请和参考文献的教导通过引用以其整体并入。技术实现要素:技术问题因此,本发明的目的是提供用于治疗由血管生成引起的癌症和/或眼病的重组融合蛋白。本发明的另一个目的是提供核酸、包含所述核酸的重组载体和用于表达所述重组载体的宿主细胞。本发明的另一个目的是提供包含由宿主细胞表达的重组融合蛋白以预防或治疗癌症和/或眼病的药物组合物。技术方案为了解决技术问题,本发明提供了一种4价多特异性抗体的vegfr融合蛋白。本发明的融合蛋白是免疫球蛋白样结构域的重组融合蛋白,其包括(a)igg1的fc结构域,其中两条重链通过二硫键连接,和(b)vegfr1的四个免疫球蛋白结构域2,其中两个免疫球蛋白结构域2顺序地与(a)的fc结构域的每条重链融合。此外,本发明提供了编码所述重组融合蛋白的分离的核酸分子。此外,本发明提供了包括所述核酸分子的重组表达载体。在本发明的一个实施方案中,提供了用所述重组表达载体转化的宿主细胞。将重组表达载体插入宿主细胞以产生转化的细胞。用于重组表达载体的合适的宿主细胞可以是原核生物,例如大肠杆菌、枯草芽孢杆菌、链霉菌属、假单胞菌属、变形杆菌属或葡萄球菌属。另外,合适的宿主细胞可以是真核细胞,包括例如真菌,例如曲霉属;酵母,例如巴斯德毕赤酵母属、酿酒酵母、裂殖酵母属和粗糙脉孢菌;其他低等真核细胞;和高等真核细胞,例如昆虫细胞。另外,真核细胞可以是植物细胞或哺乳动物细胞,优选地,cos7细胞(猴肾细胞)、nso细胞、sp2/0细胞、cho细胞(中国仓鼠卵巢)、w138细胞、bhk细胞(幼地鼠肾细胞)、mdck细胞、多发性骨髓瘤细胞系、hut78细胞和hek293细胞可用于表达。在本发明中,用于宿主细胞转化的方法包括将核酸引入生物体、细胞、组织或器官中,同时可以根据宿主细胞选择最合适的方法。可用的转化方法包括例如电穿孔、原生质体融合、capo4沉淀、cacl2沉淀、碳化硅纤维搅拌、农杆菌介导的转化和peg、葡聚糖硫酸酯、脂质体转化(lipofectamine)和干燥/抑制介导的转化。为了表达本发明的融合蛋白,可以使用重组表达载体和宿主细胞的各种组合。用于真核细胞的优选表达载体包括来源于但不限于sv40、牛乳头瘤病毒、腺病毒、腺相关病毒、巨细胞病毒和逆转录病毒的基因表达调控序列。可用于细菌宿主的表达载体包括细菌质粒,例如从大肠杆菌获得的pet、prset、pbluescript、pgex2t、puc载体、cole1、pcr1、pbr322、pmb9及其衍生物;具有宽宿主范围的质粒,例如rp4;由各种噬菌体λ衍生物例如λgt10、λgt11和nm989示例的噬菌体dna;其它dna噬菌体,例如m13和丝状单链dna噬菌体。可用于酵母细胞的表达载体可以是质粒及其衍生物。用于昆虫细胞的表达载体包括pvl941。因此,在本发明中,重组表达载体可以是质粒、yac(酵母人工染色体)、yep(酵母附加型质粒)、yip(酵母整合型质粒)或重组病毒。在本发明的一个实施方案中,提供了用于产生vegfr融合蛋白的方法。该方法包括,(a)在产生融合多肽的条件下孵育宿主细胞,(b)回收产生的融合多肽。宿主细胞具有重组表达载体,其中编码融合多肽的核酸序列可操作地连接到表达调控序列。在原核或真核表达系统中,融合多肽可以通过使用包括编码下述的核酸序列的重组表达载体来表达:(a)第一vegfr1免疫球蛋白样结构域2;(b)第二vegfr1免疫球蛋白样结构域2;和(c)人igg的fc区域多肽。获得的融合多肽可以通过用于产生生物学上稳定的蛋白质的常规方法纯化。例如,透析、离子交换色谱、亲和色谱、hplc(高压液相色谱)和page(聚丙烯酰胺凝胶电泳)可用于此目的,但不限于此。此外,本发明提供通过上述方法制备的vegfr融合蛋白。根据本说明书的实施例2至4,与阿柏西普和贝伐单抗相比,本发明的融合蛋白与靶配体vegf-a和plgf具有显著增加的结合亲和力。此外,根据实施例5,本发明的融合蛋白(kp-vr2)可以用作抗-vegf,因为当施用于需要治疗与vegf有关的疾病的受试者时,其以高灵敏度和选择性结合至vegf。此外,根据实施例6,融合蛋白(kp-vr2)具有与阿柏西普类似的药代动力学特征,因此其可以替代市售的抗-vegf或与其组合使用。因此,本发明的融合蛋白提供了用于治疗肿瘤的药物组合物和用于治疗由眼中血管生成引起的眼病的药物组合物。在本发明中,与血管生成有关的眼病包括例如年龄相关性黄斑变性(armd)、湿性年龄相关性黄斑变性、脉络膜新生血管形成(cnv)、脉络膜血管病变、病理性近视、糖尿病性视网膜病变、糖尿病性黄斑水肿、视网膜血管阻塞、早产儿视网膜病变(rop)和新生血管性青光眼(nvg)。此外,脉络膜新生血管形成可以是近视cnv、创伤性cnv、由葡萄膜炎引起的cnv、眼组织胞浆菌病或特发性脉络膜新生血管形成。此外,根据实施例7,本发明的融合蛋白在较低浓度下更有效地抑制或压制人脐静脉内皮细胞(huvec)和ea-hy926(人内皮细胞杂交细胞系)的迁移和侵袭。这表明本发明的融合蛋白可用作有效的血管生长抑制剂用于治疗包括癌症和血管生成性眼病的疾病,因为细胞迁移和侵袭在内皮细胞的血管发生的进程中是重要的。此外,实施例8至10支持本发明的融合蛋白(kp-vr2)对来自人的各种癌和成纤维细胞系具有抑制活性,并且对裸鼠的异种移植物具有抑制活性。在一个实施方案中,可以通过本发明的融合蛋白治疗的肿瘤包括例如表皮样肿瘤,头颈部鳞状肿瘤、结肠直肠肿瘤、前列腺癌、乳腺癌、肺癌(包括小细胞肺癌和非小细胞肺癌)、胰腺癌、甲状腺癌、卵巢癌、肝癌、卡波西肉瘤、中枢神经系统(cns)增殖异常(神经母细胞瘤、毛细血管癌、脑膜瘤和脑转移)、黑素瘤、肾肿瘤、胃肠道肿瘤、横纹肌肉瘤(rms)、成神经细胞瘤、平滑肌肉瘤等。根据待治疗的疾病,本发明的药物组合物可以单独或与其它治疗同时或顺序地被施用。本发明的药物组合物可以包括药学上可接受的赋形剂、缓冲溶液、稳定剂或药学上可接受的载体或本领域技术人员公知的其它材料。这些材料是无毒的,并且不干扰或不与活性成分的药理作用相互作用,并且它们的精确性质可以取决于施用途径,例如口服、粘膜和胃肠外(例如静脉内)。本发明的融合蛋白可以以0.001至5㎎/一个眼睛或1~10㎎/kg的量注射。有益效果本发明的vegfr是4价抗体,是免疫球蛋白样结构域的融合蛋白,并且包括(a)igg1的fc结构域,其中两条重链通过二硫键连接,和(b)vegfr1的四个免疫球蛋白结构域2,其中两个免疫球蛋白结构域2顺序地与(a)的fc结构域的每条重链融合。本发明的vegfr对vegf和plgf具有显著增强的的结合亲和力,并且对内皮细胞的迁移和侵袭具有优异的抑制活性,并抑制各种癌症和成纤维细胞的生长和增殖。因此,本发明的融合蛋白可用于开发用于治疗由血管生成引起的癌症和眼病的药剂。附图说明图1示出了包括本发明的融合蛋白和现有技术的其他融合蛋白的融合蛋白构建体。图2a、2b和3示出了本发明的阿柏西普和kp-vr2(vegfr融合蛋白)的结构。图4显示通过sds-page和蛋白质印迹确认的kp-vr2融合蛋白的分子量。图5显示本发明的融合蛋白、阿柏西普和贝伐单抗对vegf-a165或vegf-a121的结合亲和力。图6显示了本发明的融合蛋白、阿柏西普和贝伐单抗对plgf的结合亲和力。图7显示了本发明的融合蛋白或阿柏西普和vegf-a165之间的最大结合相互作用。图8a和8b显示与阿柏西普相比本发明融合蛋白的施用途径上的药代动力学特征。图9a和9b显示了本发明的融合蛋白、阿柏西普和贝伐单抗对huvec侵袭的影响。图10a和10b显示了本发明的融合蛋白、阿柏西普和贝伐单抗对ea-hy926迁移的影响。图11a和11b显示了与阿柏西普相比,本发明的融合蛋白抑制9(九)种癌的增殖的能力图12和13显示了与阿柏西普相比,本发明的融合蛋白对抗-vegf抗性癌和成纤维细胞的细胞活力的抑制能力。图14至17表示人癌症模型(ht-29、lovo和skut1b)中肿瘤生长和肿瘤重量的比较。图18显示kp-vr2的重组表达载体。图19显示kp-vr3的重组表达载体。最佳实施方式本发明一般涉及4价fc-融合蛋白,并且更具体地,涉及fc-融合蛋白。fc-融合蛋白通常通过免疫球蛋白(ig)的fc片段与受体的配体结合区域的融合形成,并具有与抗体类似的结构。文献中提出了多种免疫粘附分子。然而,根据本发明的免疫粘附分子与常规免疫粘附分子具有不同的结构,并且也没有现有技术预测或描述根据本发明的免疫粘附分子的制剂。本发明的实施方式在下文中,将参考实施例更详细地描述本发明。应当理解,这些实施例不以任何方式被解释为限制本发明。实施例实施例1:vegfr融合蛋白kp-vr2的生产将与人igg1fc结构域融合的人vegfr2结构域3(kp-vr1);与人igg1fc结构域(seqidno:2)融合的人vegfr1结构域2(seqidno:1)(kp-vr2);与人igg1fc结构域融合的人vegfr2结构域3(seqidno:3)和vegfr1结构域2(kp-vr3);与人igg1fc结构域融合的人vegfr1结构域2和vegfr2结构域3(kp-vr4,阿柏西普)分别克隆到pcho1.0载体(invitrogen)中。分别用kp-vr1、kp-vr2、kp-vr3和kp-vr4构建体转染cho-s细胞(invitrogen),并通过使用甲氨蝶呤和嘌呤霉素选择转染的细胞。用蛋白a-琼脂糖亲和色谱纯化kp-vr2和kp-vr4(vegf-trap;阿柏西普;eylea)。纯化的蛋白质通过hplc分析进行定量,然后顺序地进行sds-page和蛋白质印迹。图1显示了每个构建体。图3表示蛋白质印迹的结果。如图3所示,与人igg1fc结构域融合的人vegfr1结构域2(kp-vr2)具有约120kda条带大小。实施例2:确定本发明的kp-vr2、阿柏西普和贝伐单抗对vegf-a的结合亲和力在本实验中比较了本发明的kp-vr2、阿柏西普和贝伐单抗对vegf-a的结合亲和力。elisa测定根据贝伐单抗概述验证报告(bevacizumabsummaryvalidationreport)(2014年2月28日)进行。用50ng/mlvegfa165(i)或vegfa121(iii)(r&d系统)涂覆96孔板(培养皿),然后将kp-vr2、kp-vr4(阿柏西普)或阿瓦斯丁(贝伐单抗)以从0.0122到1,000ng/ml逐渐增加的量添加到孔中。接下来,洗涤板并与过氧化物酶共轭的抗人fc抗体反应。然后,加入3,3,5,5-四甲基联苯胺(tmb)溶液(roche),然后使用elisa读数器(分光光度计,biorad)在450nm下检测吸光度。图5(i和iii)显示结果。此外,用2nm的kp-vr2或kp-vr4(阿柏西普)涂覆96孔板,然后以从0.03125至64nm逐渐增加的量向其中加入vegf165(ii)或vegf121(iv)(r&d系统),以比较kp-vr2或kp-vr4(阿柏西普)与vegf-a的结合量。接下来,洗涤该板,并与抗人vegf抗体反应1小时。然后,再次洗涤该板并与过氧化物酶共轭的抗山羊ig抗体反应。接着,加入3,3,5,5-四甲基联苯胺溶液,然后通过使用elisa读数器(分光光度计,biorad)在450nm下检测吸光度。图5(ⅱ和ⅳ)显示结果。实施例3:本发明的kp-vr2、阿柏西普或贝伐单抗的plgf(胎盘生长因子)的中和活性的比较进行elisa以检测本发明的kp-vr2、阿柏西普或贝伐单抗对plgf(胎盘生长因子)的结合亲和力。用50ng/ml的plgf(i)涂覆96孔板,然后将kp-vr2(0.0122~1,000ng/ml)、kp-vr4(阿柏西普)(0.390625~16,000ng/ml)或阿瓦斯丁(贝伐单抗)(0.0122~1,000ng/ml)以逐渐增加的量添加至孔中。然后,洗涤板并与过氧化物酶共轭的抗人fc抗体反应。接着,加入3,3,5,5-四甲基联苯胺溶液,并且通过使用elisa读数器(分光光度计,biorad)在450nm下检测吸光度。此外,用400ng/ml的kp-vr2或kp-vr4(阿柏西普)涂覆96孔板,然后以0.8至12,500ng/ml的递增量向其中加入plgf,以比较kp-vr2或kp-vr4(阿柏西普)与plgf的结合量。接着,使板与生物素化-plgf抗体反应1小时,然后洗涤。此后,使板与过氧化物酶共轭的抗山羊ig抗体(r&d系统)进一步反应。接下来,加入3,3,5,5-四甲基联苯胺(tmb)溶液,然后通过使用elisa读数器在450nm下检测吸光度。此外,用50ng/ml的plgf涂覆96孔板,然后以从2至31,250ng/ml逐渐增加的量加入kp-vr2或阿柏西普,以比较kp-vr2和kp-vr4(阿柏西普)与plgf的结合量。接下来,洗涤该板并与抗人fc抗体反应。然后,加入3,3,5,5-四甲基联苯胺(tmb)溶液(roche),并通过使用elisa读数器在450nm检测吸光度。图6(ⅰ、ⅱ和ⅲ)显示结果。如图6(i)所示,与kp-vr4(阿柏西普)相比,kp-vr2对plgf的滴度(titer)提高约42倍,并且与kp-vr4(阿柏西普)相比,kp-vr2对plgf的最大结合量提高约54.3%(图6(ⅱ))。这些结果支持kp-vr2对plgf具有显著更高的结合亲和力。同时,本发明的kp-vr2显示与kip-vr4(阿柏西普)类似的对plgf的结合亲和力。实施例4:本发明的kp-vr2融合蛋白对其配体(vegfa165、vegfa121或plgf)的总亲合力(avidity)的比较通过elisa测定kp-vr2和kp-vr4(阿柏西普)对vegfa165、vegfa121或plgf的亲合力,并且结果示于下表1中(kp-vr2和阿柏西普对vegf和plgf的亲合力的比较)。【表1】如表1所示,kp-vr2对于vegfa具有比阿柏西普高约的结合亲和力,并且对于plgf具有比阿柏西普高约55%的结合亲和力。实施例5:本发明的kp-vr2的融合蛋白和阿柏西普与vegf-a165的结合亲和力的比较使用spr(表面等离子体共振)的结合亲和力比较实验遵循参考文献(bindingandneutralizationofvascularendothelialgrowthfactor(vegf)andrelatedligandsbyvegftrap,ranibizumabandbevacizumab.angiogenesis.2012,15(2):171-185)进行。首先,用hbst缓冲液(50nmhepes,150nmnacl,0.1%tween20)稳定spr芯片,然后以1,000ru(共振单位)的密度将蛋白a结合到其上。通过使用10mm甘氨酸缓冲液洗涤芯片,并从中除去剩余的未结合的蛋白a。接下来,分别加入kp-vr2、kp-vr4(阿柏西普)和贝伐单抗(2nm)并结合到芯片上。将vegfa165(0.5~8nm)流过芯片上。结果显示于图7和表2(kp-vr2、kp-vr4和kp-vr3对vegf的结合亲和力)。【表2】如图7所示,kp-vr2的量以与vegfa165的浓度成比例提高,而kp-vr4(阿柏西普)和贝伐单抗在4nm达到最大结合值。此外,如表2所示,kp-vr2对vegf-a的最大结合值为约120ru,而kp-vr4(阿柏西普)和贝伐单抗(阿瓦斯丁)的最大结合值分别为87ru和75ru。因此,确认了与kp-vr4(阿柏西普)和贝伐单抗相比,本发明的kp-vr2具有显着增加的对vegf-a的总亲合力。实施例6:本发明kp-vr2在大鼠中的药代动力学特征将大鼠分为两组,以评估vr-2和kp-vr4(阿柏西普)的药代动力学特征。将1㎎/㎏的kp-vr2和1㎎/㎏的kp-vr4(阿柏西普)i.v.(静脉内)注射到一组大鼠中,并且s.c.(皮下注射)到另一组大鼠中。关于i.v.注射组,在对重180~200g的6周大的雌性sd(斯普拉格-杜勒)大鼠各尾静脉注射kp-vr2和kp-vr4(阿柏西普)后的0分钟、5分钟、15分钟、45分钟、3小时、5小时、24小时、48小时、72小时、96小时和168小时,从大鼠颈静脉收集血液(vegf-trap:avegfbiockerwithpotentantitumoreffects.pnas.2002,99(17):139311398),然后评价注射材料的变化量。接下来,对于s.c.注射组,在对重180~200g的6周大的雌性sd(斯普拉格-杜勒)大鼠的大鼠颈部的背部区域上各注射kp-vr2和kp-vr4(阿柏西普)后的0小时、1小时、2小时、4小时、6小时、20小时、22小时、24小时、26小时、28小时、48小时、96小时、168小时、240小时和336小时,从大鼠颈静脉收集血液,然后评价注射材料的变化量,结果显示于图8。如图8a和8b所示,kp-vr2显示与kp-vr4(阿柏西普)类似的体内半衰期和药代动力学特征。实施例7:分析kp-vr2在内皮细胞中的细胞迁移和侵袭抑制实施例7-1.检测用kp-vr2和kp-vr4(阿柏西普)处理huvec(人脐静脉内皮细胞)后由vegf-a诱导的细胞侵袭抑制通过在transwell系统中使用趋化性运动性检测(chemotacticmotilityassay)来评估细胞迁移,以通过kp-vr2检测细胞迁移和内皮细胞的侵袭。将生长因子减少的matrigel(millipore)涂覆在transwell系统上,然后通过使用侵袭检测测定细胞侵袭。细胞迁移和细胞侵袭检测的定量分析如下进行。transwell的底部涂覆有10μl0.1%明胶,并干燥24小时。将qcm24-孔细胞侵袭检测试剂盒(corning)用于该实验。用细胞侵袭检测培养基(内皮细胞基础培养基,ebm,0.1%fbs)收集分离的细胞。将细胞数调节至5×104个细胞/300μl细胞侵袭培养基,并将细胞接种在每个插入物上。用0~200nmkp-vr2、kp-vr4(阿柏西普)(eylea,商标)或贝伐单抗(avastin,商标)处理6孔。处理6孔中的vegf(350ng/ml),然后在37℃孵育48小时。孵育后,除去剩余的细胞和培养基,并将插入物移至新孔。接下来,将插入物置于225μl细胞分离溶液中,并在37℃下在培养器中进一步孵育30分钟。搅拌插入物以分离剩余的细胞。然后,向细胞分离溶液和细胞的混合溶液中进一步加入75μl裂解缓冲液/染料溶液,并将所得溶液在室温下放置15分钟。接下来,将200μl的溶液移入96孔中,并获得595μl荧光图像。结果显示于图9a、9b和表3(kp-vr2对内皮细胞迁移和侵袭的抑制的分析)。【表3】如图9a和9b所示,当vegf诱导huvec(lonza)中的细胞迁移和侵袭时,kp-vr2、kp-vr4(阿柏西普)和贝伐单抗抑制诱导的细胞迁移和侵袭。本发明的kp-vr2在相同浓度(13nm)下显示出比kp-vr4(阿柏西普)和贝伐单抗更高的抑制活性。此外,如表3所示,kp-vr2、kp-vr4(阿柏西普)和贝伐单抗的ic50分别为约11nm、20nm和21nm,这解释了kp-vr2对细胞侵袭具有突出的抑制活性。实施例7-2.在用kp-vr2,kp-vr4(阿柏西普)或贝伐单抗处理ea-hy926细胞系后检测由vegf-a诱导的细胞侵袭抑制将ea-hy926细胞系(atcccrl-2922tm)(3.5×105个细胞/ml)接种在具有0.1%fbs的dmem(达尔伯克氏改良的伊格尔氏培养基(dulbecco'smodifiedeagle'smedium),sigma)中的96孔板上。接着,在37℃、5%co2条件下,分别用kp-vr2(1500μg/ml)、kp-vr4(阿柏西普)(3000μg/ml)和贝伐单抗(3000μg/ml)处理该板24小时。作为阴性对照,使用未用融合蛋白处理的培养基。结果显示于图10a和10b。如图10a和10b所示,本发明的kp-vr2以比kp-vr4(阿柏西普)和贝伐单抗更低的浓度,更有效地抑制由vegf诱导的ea-hy926细胞的生长和增殖。实施例8:比较kp-vr2和kp-vr4之间的癌细胞增殖抑制能力对9(九)种癌细胞系进行mts细胞增殖比色检测,以确定kp-vr2对癌细胞分裂的抑制能力。表4显示了本实验中使用的9种癌细胞系。【表4】将9种癌细胞系ht-29(atcchtb-38tm)、lovo(atccccl-229tm)、hct116(atccccl-247tm)、skut1b(atcchtb-115tm)、caki-1(atcchtb-46tm)、ags(atcccrl-1739tm)、panc0203(atcccrl-2553tm)、sw480(atccccl-228tm)和pc-3(atcccrl-1435tm)在37℃、5%co2条件下孵育至达到完全融合(confluency)。接下来,除去癌细胞系,并在包括10%fbs的rpmi1640培养基(sigma)上接种(3×103个细胞/孔)。然后,将细胞系在37℃下孵育24小时。接着,用具有0.5%fbs的rpmi1640培养基(sigma)取代培养基。随后,用2、4或6nm的kp-vr2或kp-vr4(阿柏西普)处理细胞系,并进一步孵育72小时。将mts试剂(qiagen)加入板中,在490nm测定吸光度。结果显示于图11a、11b和表5。如图11a和11b所示,本发明的kp-vr2对本实验中使用的所有癌细胞显示出显著优异的细胞分裂抑制活性。【表5】此外,如表5(细胞生长抑制活性)中所公开的,本发明的kp-vr2对靶向vegf和plgf的9种癌显示出高度增强的细胞生长抑制作用。实施例9:在抗vegf抗性癌和成纤维细胞系中kp-vr2和阿柏西普的细胞分裂抑制活性的比较对于抗vegfa或抗vegfr抗性的癌细胞和成纤维细胞系进行mts细胞生长检测,以评估kp-vr2对癌细胞分裂的抑制活性。表6显示了本实验中使用的4种癌细胞系和2种成纤维细胞系。【表6】将4种癌细胞系el-4(atcctib-39tm)、llc1(atcctib-39tm)、b16f10(atcccrl-6475tm)、ct-26(atcccrl-2638tm)和pc-3(atcccrl-1435tm)以及成纤维细胞系nih3t3(kclbno.21658)和hs27(atcccrl-1634tm)在37℃、5%co2条件下孵育至达到完全融合。然后除去癌和成纤维细胞系,并在含有10%fbs的rpmi1640培养基(sigma)上接种(3×103细胞/孔)。其后,将细胞系在37℃下孵育24小时。然后用含有0.5%fbs的rpmi1640培养基(sigma)取代该培养基,并用2、4或6nm的kp-vr2或kp-vr4(阿柏西普)分别处理细胞系,然后将处理的细胞系进一步孵育72小时。接下来,将mts试剂(qiagen)加入至板,并在490nm检测吸光度。结果示于图12、13和表7(癌和成纤维细胞系)。【表7】类型检测方法kp-vr4kp-vr2ct26体外效果-~56%生长抑制b16-f10体外效果-~30%生长抑制el4体外效果~49%生长抑制~67%生长抑制llc1体外效果~12%生长抑制~70%生长抑制nih3t3体外效果~41%生长抑制~52%生长抑制hs27体外效果~15%生长抑制~25%生长抑制如图12、13和表7中所示,本发明的kp-vr2不仅对于癌细胞(参见实施例8)而且对于抗-vegf/vegfr抗性的癌细胞系(el-4、llc1、b16f10和ct-26)和成纤维细胞系(hs27和nih3t3)显示显著增强的细胞生长抑制活性。实施例10:比较kp-vr2和阿柏西普在裸鼠中的肿瘤生长抑制在balb/c裸鼠中使用各种肿瘤异种移植模型(ht-29、lovo&skut1b)进行体内实验以评估kp-vr2的肿瘤生长抑制活性。实施例10-1.ht-29体内异种移植将ht-29细胞(atcchtb-38tm)(5×106个细胞/0.2ml)皮下注射到裸鼠(东方生物、雌性、4周龄)的背部区域。当肿瘤体积变得大于200mm3时,分别将kp-vr2(1㎎/㎏或2㎎/㎏)和kp-vr4(阿柏西普)(2㎎/㎏或3㎎/㎏)以每周两次注射到小鼠的腹腔内,并且在相同的时间和周期将相同量的pbs(磷酸盐缓冲盐水)注射到阴性对照小鼠的腹腔中。每3至4天测量肿瘤的体积,并且结果公开于图14。如图14所示,与相同量的阿柏西普(kp-vr4)相比,本发明的kp-vr2在2㎎/㎏的剂量对于ht-29结肠癌细胞系显示约40%提高的生长抑制活性。此外,在kp-vr2(1㎎/㎏)和阿柏西普(kp-vr4)(3㎎/㎏)之间观察到类似的效果。实施例10-2.lovo体内异种移植使用lovo(atccccl-229tm)细胞系代替ht-29细胞系进行与实施例10-1相同的实验。将lovo细胞系(5×106个细胞/0.2ml)皮下注射到裸鼠(orientbio、雌性、4周龄)的背部区域。当肿瘤体积变得大于200mm3时,将kp-vr2(1mg/kg)和kp-vr4(阿柏西普)(1mg/kg)每周两次分别注射到裸鼠的腹腔中,并且在相同的时间和周期将相同量的pbs(磷酸盐缓冲盐水)注射到阴性对照小鼠的腹腔中。每3至4天测量肿瘤的体积,并在最后第42天提取肿瘤以比较重量。结果公开于图15a和15b。如图15a和15b所示,与相同量的阿柏西普(kp-vr4)相比,本发明的kp-vr2在1mg/kg的剂量对直肠癌细胞系(lovo)具有50%~60%提高的生长抑制活性(p<0.05)。从注射开始时观察本发明的kp-vr2的肿瘤生长抑制活性,并且自注射起kp-vr2与阿柏西普(kp-vr4)之间的抑制活性的差异增加。此外,与在相同注射剂量下的阿柏西普相比,注射本发明的kp-vr2引起约50%减少的肿瘤重量。实施例10-3.skut1b体内异种移植将为vegfr1阳性细胞系的子宫癌skut1b细胞系(atcchtb-115tm)注射到裸鼠中。将skut1b细胞系(1×107个细胞/0.2ml)皮下注射到裸鼠的背部区域,并且注射后从第1天至第32天每周两次将kp-vr2(2㎎/㎏)和kp-vr4(阿柏西普)(2㎎/㎏)分别注射到裸鼠的腹腔中。在相同的时间和周期将相同量的pbs(磷酸盐缓冲盐水)注射到阴性对照小鼠的腹腔中。每3至4天观察肿瘤的体积,并在最后第37天提取肿瘤以比较肿瘤的重量。结果公开于图16。如图16a和16b所示,与相同量的阿柏西普(kp-vr4)相比,本发明的kp-vr2在2㎎/㎏的剂量对本实验中使用的细胞系具有60%~70%提高的生长抑制活性(p<0.05)。此外,与在相同注射剂量下的阿柏西普相比,注射本发明的kp-vr2引起约70%减少的肿瘤重量。7.工业应用如上所述,本发明的(vegfr)融合蛋白包括(a)igg1的fc结构域,其中两条重链通过二硫键连接,和(b)vegfr1的四个免疫球蛋白结构域2,其中两个免疫球蛋白结构域2被顺序地融合到(a)的fc结构域的每条重链。因此,本发明能够提供用于治疗由血管生成引起的癌症和/或眼病的药物组合物。<110>韩国普瑞姆药物股份有限公司<120>血管内皮生长因子融合蛋白<130>ckr0416p-0001-kr<160>3<170>kopatentin3.0<210>1<211>102<212>prt<213>人工序列<220><223>vegfr1结构域2<400>1seraspthrglyargprophevalglumettyrsergluileproglu151015ileilehismetthrgluglyarggluleuvalileprocysargval202530thrserproasnilethrvalthrleulyslyspheproleuaspthr354045leuileproaspglylysargileiletrpaspserarglysglyphe505560ileileserasnalathrtyrlysgluileglyleuleuthrcysglu65707580alathrvalasnglyhisleutyrlysthrasntyrleuthrhisarg859095glnthrasnthrileile100<210>2<211>233<212>prt<213>人工序列<220><223>人igg1fc区域<400>2alagluprolyssercysasplysthrhisthrcysproprocyspro151015alaprogluleuleuglyglyproservalpheleupheproprolys202530prolysaspthrleumetileserargthrprogluvalthrcysval354045valvalaspvalserhisgluaspprogluvallyspheasntrptyr505560valaspglyvalgluvalhisasnalalysthrlysproarggluglu65707580glntyrasnserthrtyrargvalvalservalleuthrvalleuhis859095glnasptrpleuasnglylysglutyrlyscyslysvalserasnlys100105110alaleuproalaproileglulysthrileserlysalalysglygln115120125proarggluproglnvaltyrthrleuproproserargaspgluleu130135140thrlysasnglnvalserleuthrcysleuvallysglyphetyrpro145150155160seraspilealavalglutrpgluserasnglyglnprogluasnasn165170175tyrlysthrthrproprovalleuaspseraspglyserphepheleu180185190tyrserlysleuthrvalasplysserargtrpglnglnglyasnval195200205phesercysservalmethisglualaleuhisasnhistyrthrgln210215220lysserleuserleuserproglylys225230<210>3<211>103<212>prt<213>人工序列<220><223>vegfr2-d3<400>3aspvalvalleuserproserhisglyilegluleuservalglyglu151015lysleuvalleuasncysthralaargthrgluleuasnvalglyile202530asppheasntrpglutyrproserserlyshisglnhislyslysleu354045valasnargaspleulysthrglnserglyserglumetlyslysphe505560leuserthrleuthrileaspglyvalthrargseraspglnglyleu65707580tyrthrcysalaalaserserglyleumetthrlyslysasnserthr859095phevalargvalhisglulys100当前第1页12
相关技术
网友询问留言
已有0条留言
- 还没有人留言评论。精彩留言会获得点赞!
1
- 血管内皮生长因子时间分辨荧光免疫分析方法及试剂盒的制作方法
- 基于模拟人血管内皮细胞生长因子vegf表位的疫苗及其制备方法
- 人血管内皮生长因子抗原表位及其表位疫苗的制作方法
- 重组人血管内皮生长因子165与免疫球蛋白Fc片段融合蛋白(VEGF165-Fc)的实验技术的制作方法
- 抗人促血液血管生长因子(hapo)的单克隆抗体、多克隆抗体及其应用的制作方法
- 针对血管内皮生长因子的氨基酸序列和包括其的多肽用于治疗特征在于过量和 /或病理 ...的制作方法
- 一种血管生长抑制因子Kringle 5融合和非融合基因的克隆、鉴定和表达方法
- 改造的血管内皮生长因子多肽片段及其应用的制作方法
- 一种抗血管内皮生长因子的单克隆抗体及应用的制作方法
- 人血管内皮生长因子165b与人血清白蛋白的融合蛋白及其制备的制作方法
- 用于血管内皮生长因子定量测定试剂盒及其发光底物溶液的制作方法
- 血管内皮生长因子b(vegf-b)缺陷动物的心脏异常及与这些心脏异常相关的方法
- 血管内皮生长因子时间分辨荧光免疫分析方法及试剂盒的制作方法
- 一种检测血清结缔组织生长因子用试剂盒的制作方法
- 人血管内皮生长因子抗原表位及其表位疫苗的制作方法
- 重组人血管内皮生长因子165与免疫球蛋白Fc片段融合蛋白(VEGF165-Fc)的实验技术的制作方法
- 抗人促血液血管生长因子(hapo)的单克隆抗体、多克隆抗体及其应用的制作方法
- 针对血管内皮生长因子的氨基酸序列和包括其的多肽用于治疗特征在于过量和 /或病理 ...的制作方法
- 改造的血管内皮生长因子多肽片段及其应用的制作方法
- 一种抗血管内皮生长因子的单克隆抗体及应用的制作方法