基于香豆素类的接力响应型荧光分子探针及其制备方法和用途与流程
本发明涉及一种基于香豆素类的接力响应型荧光分子探针及其制备方法和
用途,属于化学荧光传感材料技术领域。
背景技术:
铁作为生命体中重要的微量元素之一,在生命体生长发育过程中,具有举足轻重的作用。其参与血红蛋白、肌红蛋白、细胞色素,细胞色素氧化酶等的合成并能激活琥珀脱氢酸、黄嘌呤氧化酶等的活性。
铁还参与造血功能,影响蛋白质及去氧核糖核酸的合成及造血维生素代谢,缺铁时肝脏内合成去氧核糖核酸将收到抑制,肝脏发育减慢,肝细胞及其它细胞内的线粒体和微粒体发生异常,细胞色素c,含量减少,导致蛋白质的合成及能量运用减少,进而发生贫血及发育不良。相反盲目的摄入过量的铁也会对健康造成威胁,相关研究表明,脑铁异常沉淀会参与中枢神经系统变性疾病的病理过程,引起或加重神经功能改变,引起阿尔兹海默病,帕金森病等中枢神经退行性变疾病。
在生态环境中,水体系统中铁离子含量过高会影响水体颜色并会散发恶臭,严重危害水生生物的正常生长发育,而且随着生态系统的迁移和富集作用,经生物链最终还会进入人体危害人体健康。而磷酸根离子在生物系统中无处不在,是一个重要的核苷酸新陈代谢的产物,在生物系统的能量转换和储存中扮演着至关重要的角色,它在细胞信号转导、膜完整性、骨矿化、肌肉功能以及其他重要生物过程中起着至关重要的作用,其与铁离子都是生物不可或缺的离子之一。传统的检测技术通常有电感耦合等离子体法、原子吸收法、离子色谱法、紫外可见分光光度法和电化学法等,但这些技术通常需要大型的仪器,并且对样品的要求较高,检测前需要进行严格的预处理,具有操作复杂,耗时,成本高,抗干扰性差等缺点,很难实现快速有效的检测目的。基于此,构建一种快速、便捷、有效的能用于水体及生物体中铁离子及磷酸根离子检测的方法是非常必要的。
近年来,荧光传感信号检测技术已经引起了研究人员的关注,其在检测分析生物分子,阴阳离子等方面的研究已有大量报道。由于该技术具有灵敏度高、选择性好、响应速度快、操作方便、成本低等一系列的优点。其已经被广泛的应用于生物医学、环境科学和分子生物学等众多领域。荧光传感材料一般由荧光信号报告单元和底物接收单元两个主要基本要素构成。待测目标离子/分子与探针受体单元通过各种作用力(如分子间氢键,静电作用,共价键等)相互作用,引起信号报告单元荧光信号的改变,进而实现对目标物的光学传感检测。
接力识别是荧光探针分子功能强化的一个新方向。所谓接力识别是指探针分子在一定条件下对某一离子进行选择性识别后,利用原位生成的中间产物(新的中间体或者是配合物)与新的离子物种间的特殊作用直接在原测试条件下继续进行新的离子识别。显然,接力识别型荧光探针能够使得两种离子的识别操作可在同一测试条件下连续进行,具有操作简单的显著优点,并能降低探针合成的工作量,有利于节能减排。由于金属离子和阴离子电荷互补,某些“荧光探针-金属离子”络合物又可以作为间接识别阴离子的荧光探针,并具有实时响应的优点,所以设计合成对特定金属离子和阴离子具有接力识别功能的荧光探针备受关注,并已经成为当前接力识别荧光探针研究的主要方向。
众所周知,香豆素类化合物是易合成的苯并吡喃酮结构,其具有相对光稳定性,低毒性,易修饰和较长的激发波长。香豆素及其衍生物具有很大的斯托克斯位移,一定可调性的光物理参数和优良的量子产率,进而有效地防止了激发和发射光谱之间的重叠。其还具有良好的水溶性,低细胞毒性和良好的细胞兼容性,即其结构单元可以穿过细胞膜,为其进行活细胞试验提供了可能。香豆素母体结构的各个位置相对活泼,易于被修饰,因此多有报道以香豆素为荧光团,在母体不同位置c-4、c-6、c-7、c-8上修饰不同类型的基团,从而得到性能好、应用广泛的探针材料,并很好的用于阴阳离子和生物分子的识别检测。
技术实现要素:
本发明旨在克服传统检测技术的限制,目的在于提供一种新型的基于香豆素类的接力响应型荧光分子探针及其制备方法和用途,本发明涉及的荧光分子探针能够很好的实现对fe3+和po43-的接力识别。检测条件温和能成功地应用于生物细胞中fe3+和po43-的有效识别成像,具有成本低,合成简单,响应快速和检测灵敏度高等特点。
本发明采取的技术方案如下:
本发明提供一种新型的基于香豆素类的接力响应型荧光分子探针,所述材料是由4-甲基伞型酮作为荧光基团,首先采用氯乙酰氯取代4-甲基伞型酮上c-7位上的羟基氢形成中间化合物r,随后将该化合物r与2-氨甲基吡啶同样通过取代反应进行结合制得荧光分子探针材料。
本发明还提供一种新型的基于香豆素类的接力响应型荧光分子探针的制备方法,包括如下步骤:
步骤1、化合物r(7-氯乙酰氧基-4-甲基-香豆素)的制备:
参考文献poshiyaa.synthesisstudiesofbacterialdna-gyraseinhibitors[j].ijpt,2011,3(3):3048-3059.进行制备。
将一定量的4-甲基伞型酮和三乙胺溶解在无水二氯甲烷,置于圆底烧瓶中,在冰浴锅中将混合物降至0℃,将氯乙酰氯逐滴加入上述溶液中,然后在n2保护下搅拌。反应结束后,加入100ml蒸馏水,然后用ch2cl2萃取三次。合并有机层,用无水na2so4干燥,过滤并减压蒸馏除去溶剂,得到白色固体产物,粗产物在乙醇中重结晶纯化得到化合物r。
步骤2、荧光分子探针xds的制备:
将2-氨甲基吡啶、nahco3、k2co3和ki置于圆底烧瓶中,称取化合物r溶于无水乙腈中,将其在室温下边搅拌边逐滴加入到上述混合物中,在n2保护下,冷凝回流反应;反应结束后将混合物冷却至室温,过滤,减压蒸馏除去溶剂,得到固体产物,在乙醇中重结晶纯化,得到白色化合物xds,即为本发明所述的基于香豆素类的接力响应型荧光分子探针。
上述步骤1中,4-甲基伞型酮,三乙胺,氯乙酰氯和无水二氯甲烷的用量分别为0.5~1.6g(3-9mmol):0.1~0.5ml:0.24~0.72ml(3~9mmol):25~50ml,反应时间为6~12h。
上述步骤2中,nahco3,k2co3,ki,化合物r和2-氨甲基吡啶的加入量分别为0.34~3.5g(4~20mmol):0.55~2.8g(4~20mmol):0.64~3.4g(4~20mmol):1.0~2.5g(4~10mmol):0.45~2.2g(4~20mmol);回流温度为70~80℃;反应时间为6~12h。
本发明另一目的是将上述合成的荧光探针用于水体和生物体细胞中fe3+离子和po43-离子的接力检测。
本发明的技术效果为:
(1)本发明提供了一种新型的基于香豆素类的接力响应型荧光分子探针的制备方法及用途。该探针由于结构中香豆素荧光基团的存在,荧光分子探针本身具有强的蓝色荧光发射。并且探针结构稳定,本身具有很好的水溶性,该探针可以实现完全水溶,无需借助于其他有机溶剂,在应用过程中不会造成二次污染。相比于需要借助有机溶剂的荧光分子探针具有更好的应用前景。
(2)本发明中荧光分子探针是采用氯乙酰氯经两步简单的反应将4-甲基伞型酮和2-氨甲基吡啶进行结合,原料相对廉价,合成条件温和易于控制,后处理简单。
(3)fe3+存在是会形成“分子探针—fe3+”络合物,改变了探针分子结构的电荷分布,本身的蓝色荧光发生猝灭,在进一步加入po43-离子后,由于金属离子和阴离子电荷互补作用使得探针的荧光恢复,实现了在同一个体系中对fe3+和po43-离子的接力识别检测,效果显著。相比传统的检测技术,采用本发明制备的荧光分子探针对fe3+和po43-进行检测,选择性和灵敏度高,其他常见的金属离子和阴离子的干扰小,无需大型仪器,可以在100%水溶液中进行检测,检测条件温和,响应时间快,识别信号可视化。
(4)本发明中荧分子探针能够用于生物体细胞中fe3+离子和po43-离子荧光成像检测分析。
附图说明
图1为实施例3所制备的基于香豆素类的接力响应型荧光分子探针的合成过程示意图。
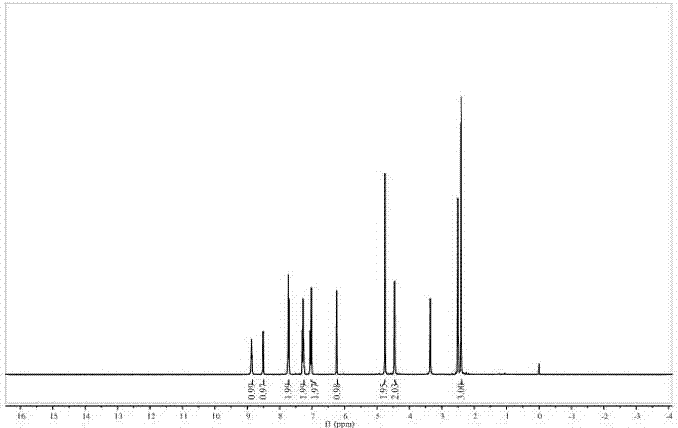
图2为实施例3所制备荧光分子探针的1hnmr,其中溶剂为dmso-d6。
图3为实施例3所制备荧光分子探针的13cnmr图,其中溶剂为dmso-d6。
图4为实施例3所制备荧光分子探针的ms图。
图5为实施例3所制备荧光分子探针的荧光发射光谱。
图6为实施例3所制备荧光分子探针在不同金属离子存在时的荧光光谱图;图中的xds表示的是本发明制备的荧光分子探针材料。
图7为实施例3所制备荧光分子探针在不同浓度fe3+存在时的荧光光谱图,插图为体系荧光减弱程度(i0-i)与fe3+浓度之间的线性关系,其中i0为荧光分子探针自身的在380nm处的荧光发射强度,i表示加入fe3+后对应的荧光发射强度。
图8为实施例3所制备荧光分子探针在加入fe3+前后一段时间内的光学稳定性。
图9为实施例3所制备的荧光分子探针与fe3+结合后加入不同阴离子的荧光光谱图。
图10为实施例3所制备荧光分子探针与fe3+结合后,在不同浓度po43-加入时的荧光光谱图,插图为体系荧光增强程度(i-i0)与po43-浓度之间的线性关系,其中i0为荧光分子探针与fe3+结合后在380nm处的荧光发射强度,i表示加入po43-后对应的荧光发射强度。
图11为实施例3所制备荧光分子探针用于水体中多次重复接力识别fe3+和po43-图。
图12为实施例3所制备荧光分子探针用于生物体活细胞中fe3+和po43-的成像图;图中a为加入荧光分子探针培养后的细胞在明场下的成像,b为加入荧光分子探针培养后的细胞在荧光场下的成像,c为加入20μmfe3+后细胞在荧光场下的成像,d为再次加入20μmpo43-后细胞在荧光场下的成像。
具体实施方式:
为使本发明实施例的目的、技术方案和优点更加清楚,下面将结合附图说明对本发明实施例中的技术方案进行清楚、完整地描述,显然,所描述的实施例是本发明一部分实施例,而不是全部的实施例,基于本发明中的实施例,本领域普通技术人员在没有做出创造性劳动的前提下所获得的所有其他实施例,都属于本发明保护的范围。
实施例1:
步骤1、化合物r的制备:将0.5g(3mmol)4-甲基伞型酮和0.1ml三乙胺溶解在25ml无水二氯甲烷置于圆底烧瓶中,在冰浴锅中将混合物降至0℃,将0.24ml(3mmol)氯乙酰氯逐滴加入上述溶液中,然后在n2保护下搅拌反应6h。反应结束后,加入100ml蒸馏水,然后用ch2cl2萃取三次。合并有机层用无水na2so4干燥,过滤并减压蒸馏除去溶剂,得到白色固体产物。粗产物在乙醇中重结晶纯化得到0.47g化合物r,产率为63%.
步骤2、荧光分子探针xds的制备:将0.45g(4mmol)2-氨甲基吡啶,0.34g(4mmol)nahco3,0.55g(4mmol)k2co3和0.64g(4mmol)ki置于圆底烧瓶中,称取1.006g(4mmol)化合物r溶于无水乙腈中,将其在室温下边搅拌边逐滴加入到上述混合物中,在n2保护下,70℃条件下冷凝回流反应6h。反应结束后将混合物冷却至室温,过滤,减压蒸馏除去溶剂,得到固体产物,在乙醇中重结晶纯化,得到0.66g白色化合物xds,产率为50.6%
实施例2:
步骤1、化合物r的制备:将1g(6mmol)4-甲基伞型酮和0.3ml三乙胺溶解在35ml无水二氯甲烷置于圆底烧瓶中,在冰浴锅中将混合物降至0℃,将0.48g(6mmol)氯乙酰氯逐滴加入上述溶液中,然后在n2保护下搅拌反应9h。反应结束后,加入100ml蒸馏水,然后用ch2cl2萃取三次。合并有机层用无水na2so4干燥,过滤并减压蒸馏除去溶剂,得到白色固体产物。粗产物在乙醇中重结晶纯化得到0.87g化合物r,产率为70%.
步骤2、荧光分子探针xds的制备:将1.35g(12mmol)2-氨甲基吡啶,1.02g(12mmol)nahco3,1.65g(12mmol)k2co3和1.86g(12mmol)ki置于圆底烧瓶中,称取3.018g(12mmol)化合物r溶于无水乙腈中,将其在室温下边搅拌边逐滴加入到上述混合物中,在n2保护下,75℃条件下冷凝回流反应9h。反应结束后将混合物冷却至室温,过滤,减压蒸馏除去溶剂,得到固体产物,在乙醇中重结晶纯化,得到2.05g白色化合物xds,产率为52.4%
实施例3:
步骤1、化合物r的制备:将1.6g(9mmol)4-甲基伞型酮和0.5ml三乙胺溶解在50ml无水二氯甲烷置于圆底烧瓶中,在冰浴锅中将混合物降至0℃,将0.72ml(9mmol)氯乙酰氯逐滴加入上述溶液中,然后在n2保护下搅拌反应12h。反应结束后,加入100ml蒸馏水,然后用ch2cl2萃取三次。合并有机层用无水na2so4干燥,过滤并减压蒸馏除去溶剂,得到白色固体产物。粗产物在乙醇中重结晶纯化得到1.27g化合物r,产率为68%。
步骤2、荧光分子探针xds的制备:将2.2g(20mmol)2-氨甲基吡啶,3.5g(20mmol)nahco3,2.8g(20mmol)2.5gk2co3(20mmol)和3.4g(20mmol)ki置于圆底烧瓶中,称取1.006g(20mmol)化合物r溶于无水乙腈中,将其在室温下边搅拌边逐滴加入到上述混合物中,在n2保护下,80℃条件下冷凝回流反应12h。反应结束后将混合物冷却至室温,过滤,减压蒸馏除去溶剂,得到固体产物,在乙醇中重结晶纯化,得到3.84g白色化合物xds,产率为60%。
如图1所示是基于香豆素类的接力响应型荧光分子的合成过程示意图。
如图2和图3所示分别为所制备荧光分子探针的1hnmr和13cnmr图。1hnmr(400mhz,dmso-d6)δ8.87(t,j=5.7hz,1h),8.51(d,j=4.5hz,1
h),7.74(dd,j=12.8,5.1hz,2h),7.31–7.24(m,2h),7.07–7.00(m,2h),6.24(s,1h),4.75(s,2h),4.46(d,j=5.9hz,2h),2.41(s,3h).
13cnmr(101mhz,dmso-d6)δ167.82,161.15,160.54,158.62,154.99,153.85,149.29,137.12,126.98,122.61,121.48,114.10,113.04,111.91,102.22,67.66,44.30,18.61.
通过核磁谱图可以确定制备合成的荧光分子探针与图1中预期的结构是一致的。
如图4所示为本发明所制备的荧光分子探针(c18h16n2o4,mn=324)的质谱图,其中,325.60为[m+h]对应的分子量,进一步证实了该荧光传感材料的结构。
图5为荧光分子探针(10µm)在水溶液中的的荧光发射光谱。激发波长为320nm,荧光狭缝宽度均为5。从图中可以看出该荧光分子探针在380nm处有强的荧光发射峰。
实施例4:本发明制备的荧光分子探针对fe3+检测的特异性验证
将实施例3中制备的荧光分子探针用去离子水配制1mm的储备液置于-4oc冰箱中备用;在检测前用hepes缓冲溶液(0.05m,ph=7.4)稀释到10µm作为待用探针溶液。浓度为10mm的金属离子(al3+,cr3+,fe3+,ca2+,cd2+,co2+,cu2+,fe2+,mg2+,mn2+,sr2+,zn2+,pb2+,hg2+,ni2+,cs+,k+,li+和na+)储备液同样用去离子水配制待用。移取10µm待用探针溶液,分别加20当量不同种金属离子溶液,采用荧光光谱仪分别对各自的荧光光谱进行测定,其中激发波长为320nm。
荧光传感材料自身具有强的蓝色荧光,在380nm处有荧光发射,当加入10当量不同金属离子后的荧光光谱如图6所示,从图中可以看出,荧光分子探针对fe3+表现出独特的选择性,当fe3+存在时,在紫外灯照射下可呈现出肉眼可见的荧光淬灭现象。荧光光谱中380nm处的荧光发射在很大程度上被减弱,然而,其他金属离子的存在并没有引起荧光分子探针荧光的改变。这个结果充分的说明本发明制备的荧光分子探针对fe3+具有选择性识别性能。
实施例5:本发明制备的荧光分子探针对fe3+检测的灵敏性验证
移取实施例4中的10μm的待用探针溶液,对fe3+进行荧光滴定实验,即分别加入0~10当量的fe3+进行荧光光谱测定并讨论荧光强度变化与加入fe3+量之间的关系。本实施例中用到的金属离子浓度分别为:0.05×10-5m、0.1×10-5m、0.2×10-5m、0.3×10-5m、0.4×10-5m、0.5×10-5m、0.6×10-5m、0.7×10-5m、0.8×10-5m、0.9×10-5m、1.0×10-5m、1.1×10-5m、1.2×10-5m、1.3×10-5m、1.4×10-5m、2.0×10-5m、4.0×10-5m、6.0×10-5m、8.0×10-5m、10.0×10-5m。
荧光滴定实验的荧光发射光谱如图7所示,从图中可以看出,荧光分子探针体系在380nm处荧光发射强度随着fe3+加入量的增加而逐渐减弱。
图7中的插图为相应的荧光减弱程度(i0-i)与金属离子的浓度之间的线性关系,当fe3+浓度在0-10µm范围内时呈现两者呈现出良好的线性关系,相关系数为0.996,线性方程的斜率(slope)分别为3.66×107,根据方程lod=3σ/slope(20次空白样的标准偏差σ=1.568)计算得最低检出限lod可低达1.285×10-7m。结果表明该荧光分子探针在该范围内的fe3+可进行定量检测并具有高的灵敏性。实施例6:本发明制备的荧光分子探针光学性质的稳定性及与金属fe3+结合后稳定性的验证
移取实施例4中的10μm的待用探针溶液,将其放置在紫外灯下照射60min,每隔10min检测一次荧光强度。随后加入10当量的fe3+,并在接下来的90min内,每隔10min检测一次体系的荧光强度。
在加入fe3+前后不同时间段的荧光强度如图8所示,探针在fe3+加入之前荧光强度在60min内基本保持稳定不变,这表明本发明制备的荧光分子探针自身具有很好的光学稳定性。加入fe3+之后的荧光强度迅速大幅度减弱,并在90min内依旧保持稳定,这也表明本发明制备的荧光分子探针对fe3+具有快速识别性能,并能形成稳定的探针-金属络合物。
实施例7:本发明制备的荧光分子探针与fe3+结合后接力识别检测磷酸根离子(po43-)验证
移取实施例4中的10μm的待用探针溶液,加入10当量金属fe3+,混合均匀作为检测溶液待用。配制一系列浓度为10mm的f-,cl-,br-,i-,so42-,scn-,clo4-,po43-,co32-,no3-,no2-,aco–和cn-离子溶液,将10当量的这一系列阴离子溶液分别加入到上述探针-fe3+混合待用溶液中并对体系的荧光光谱进行检测。
荧光光谱如图9所示,不难看出在加入不同阴离子之后,只有po43-的加入可以使380nm处的荧光发射强度恢复,荧光从无色恢复到探针原有的蓝色,然而其他阴离子的加入并不会对探针-fe3+混合溶液体系的荧光造成影响。这充分的说明探针-fe3+混合溶液可以作为新的探针体系接力识别po43-。
实施例8:本发明制备的荧光分子探针与fe3+结合后对po43-离子接力识别的灵敏性验证
移取实施例7中的探针-fe3+混合待用溶液,对po43-进行荧光滴定实验,即分别加入0~10当量的po43-进行荧光光谱测定并讨论荧光强度变化与加入po43-量之间的关系。本实施例中用到的po43-浓度分别为:0.1×10-5m、0.2×10-5m、0.3×10-5m、0.4×10-5m、0.5×10-5m、0.6×10-5m、0.7×10-5m、0.8×10-5m、0.9×10-5m、1.0×10-5m、2.0×10-5m、3.0×10-5m、4.0×10-5m、5.0×10-5m、6.0×10-5m、7.0×10-5m、8.0×10-5m、9.0×10-5m、10.0×10-5m。
荧光滴定实验的荧光发射光谱如图10所示,从图中可以看出,荧光分子探针体系在380nm处荧光发射强度随着po43-加入量的增加而逐渐增强,插图为在380nm处的荧光强度与加入的po43-含量的线性关系图,从中可以看出在po43-浓度为0-1μm范围内,荧光强度与po43-浓度呈现出很好的线性关系。
图10中插图为相应的荧光增强程度(i-i0)与po43-的浓度之间的关系,当po43-的浓度在0-10µm范围内两者呈现良好的线性关系,线性方程的斜率(slope)分别为4.94×107,根据方程lod=3σ/slope(20次空白样的标准偏差σ=2.47)计算得最低检出限lod可低达1.49×10-7m。结果表明该荧光分子探针在该范围内可对po43-进行定量检测并具有高的灵敏性。
实施例9:荧光分子探针用于水体中接力识别fe3+和po43-多次重复验证
采集长江水进行fe3+和po43-的加标实验,分别配制成浓度为10mm的fe3+溶液和po43-溶液待用。移取实施例4中的配制的10μm的荧光分子探针溶液,交替的加入10当量的fe3+溶液和10当量的po43-溶液,反复进行4次,并检测每个阶段的荧光光谱,记录在380nm处的荧光强度。
荧光分子探针用于水体中fe3+和po43-多次重复接力识别的结果如图11所示,从结果可以看出,该荧光分子探针溶液中反复多次加入fe3+和po43-依然能通过荧光发射强度的变化达到水体中两种离子识别检测的目的。这也充分的说明本发明制备的荧光分子探针可以用于真实水体中目标离子的检测并且具有多次重复利用性。
实施例10:本发明制备的荧光分子探针对细胞中fe3+和po43-的成像分析
将ramos细胞(人b淋巴瘤细胞,购买于sigma)在rpmi-1640培养液中培养24h,加入20μm的实施例3制备的荧光分子探针继续培养30min,用缓冲溶液洗涤三次来移除残余的荧光分子探针;之后加入fe3+(20μm)溶液继续培养30min;洗涤后在倒置荧光显微镜下观察加入fe3+培养前后的细胞荧光成像情况。随后在fe3+培养过的细胞中加入po43-(20μm)溶液再次培养30min,洗涤在倒置荧光显微镜观察细胞荧光成像。
荧光分子探针对生物细胞中fe3+和po43-的荧光成像结果如图12所示,图12-a和图12-b分别为加入荧光分子探针培养后的细胞在明场和荧光场下的成像,图12-a细胞的完整性可以间接表明本发明制备的荧光分子探针具有较低的生理毒性,不会对生物细胞造成破坏,图12-b表明用荧光分子探针培养后的细胞具有蓝色荧光,这也说明探针分子成功地进入细胞内部;图12-c为加入fe3+后细胞在荧光场下的成像,fe3+的存在导致细胞中荧光发生淬灭。图12-d为再次加入po43-培养后细胞的成像,从图中可以发现,由于细胞中po43-的存在,细胞内部重新呈现出强的蓝色荧光发射。这一结果充分证明了该荧光分子探针由于检测条件的温和性同样也可以用于生物体内fe3+和po43-的检测分析。
- 还没有人留言评论。精彩留言会获得点赞!