一种乙酰化粒毛盘菌胞外多糖及其制备心血管药物用途的制作方法
本发明属于粒毛盘菌胞外多糖的应用技术领域,具体涉及乙酰化粒毛盘菌胞外多糖及其在制备心血管保护药物方面的用途。
背景技术:
糖尿病(dm)是当代社会最重要的慢性代谢性疾病,源于体细胞无法正常利用葡萄糖。作为糖尿病患者死亡的主要原因,心血管疾病因其高死亡率已引起人们的广泛关注。许多口服降糖药,包括磺脲类、非磺脲类胰岛素促泌剂、双胍类、α-葡萄糖苷酶抑制剂和胰岛素增敏剂已被开发用于治疗糖尿病。然而,糖尿病相关并发症,尤其是心血管疾病的治疗仍是一项重要挑战。因此,研究开发新型无毒副作用的心血管保护药物具有重要意义。
大量的天然提取物,尤其是多糖能够有效治疗糖尿病。据《碳水化合物杂志》(carbohydratepolymers,2011,86:285-290)报道,萼状粒毛盘菌胞外多糖(lep-1)对四氧嘧啶致糖尿病小鼠具有强的降糖作用。但是,多糖对糖尿病相关并发症是否具有治疗效果,还有待于进一步研究。
中国专利申请号201510030199.7公开了一种磷酸酯化瓜蒌皮多糖(pttp-1),并通过对衰老模型小鼠的抗衰老作用药理实验,表明磷酸酯化修饰能够显著提高瓜蒌皮多糖的抗衰老作用。中国专利申请号201510418916.3公开了一种硫酸酯化粒毛盘菌胞外多糖(slep-1),并通过对高凝模型小鼠的抗凝作用药理实验,表明硫酸酯化修饰能够显著提高粒毛盘菌胞外多糖的抗凝作用。本发明人课题组于2016年10月31日将一株粒毛盘菌ym216(本发明人课题组自定编号代码)菌株保藏于湖北省武汉市武汉大学生命科学学院中国典型培养物保藏中心(简称cctcc),菌种保藏编号为cctccm2016603。目前,有关粒毛盘菌胞外多糖修饰改性的报道相对较多,但未见有公开文献提及将粒毛盘菌胞外多糖修饰改性为乙酰化粒毛盘菌胞外多糖,以及将其作为制备心血管保护药物的应用方面的报道。
技术实现要素:
本发明的目的在于提供一种采取乙酰化修饰改性的粒毛盘菌胞外多糖及其在制备心血管保护药物中的应用。
本发明的乙酰化粒毛盘菌胞外多糖,是将菌种保藏编号为cctccm2016603的粒毛盘菌lachnumsp.ym216接种于100l发酵罐中发酵8-10d;抽滤、浓缩后,将浓缩的发酵液与3-4倍体积的体积百分浓度为95%的乙醇混合,然后于4℃醇沉24-48h;4000r/min离心10-15min后,滤出沉淀,并将沉淀复溶于蒸馏水;经sevage法除蛋白、以质量百分浓度为30%的h2o2脱色、透析除杂、冷冻干燥得到粒毛盘菌胞外粗多糖;然后通过deae-纤维素52柱层析和琼脂糖凝胶cl-6b柱层析依次对得到的粗多糖进行分离纯化获得均一的粒毛盘菌胞外多糖;其特征在于通过以乙酸酐对粒毛盘菌胞外多糖进行如下的乙酰化修饰改性获得乙酰化粒毛盘菌胞外多糖:即,将2-3g粒毛盘菌胞外多糖与80-150ml甲酰胺混合,于60℃搅拌30-60min后,加入50-80ml由n-溴代丁二酰亚胺(nbs)和乙酸酐(1:1,mg/ml)配制而成的溶液,于60℃反应6-8h后,加入20-30ml蒸馏水终止反应;冷却至室温后,使用体积百分浓度为95%的乙醇将溶液于4℃醇沉24-48h;4000r/min离心10-15min,滤出沉淀,并将沉淀复溶于100-150ml蒸馏水;使用1mol/lnaoh溶液中和该溶液,于截留分子量为14000da透析袋中先用自来水逆向流动透析48h,再用蒸馏水透析24h;将获得物浓缩并冻干,所得到的乙酰化粒毛盘菌胞外多糖。
本发明的乙酰化粒毛盘菌胞外多糖的医药用途,其特征在于是由菌种保藏编号为cctccm2016603的粒毛盘菌ym216胞外多糖进行乙酰化修饰改性获得的乙酰化粒毛盘菌胞外多糖,在制备心血管保护药物中的应用;通过对糖尿病模型小鼠的心血管保护作用药理实验,确立了乙酰化粒毛盘菌胞外多糖的心血管保护作用,从而将乙酰化粒毛盘菌胞外多糖用于制备心血管保护药物,即,按药剂学的常规制备方法,将有效量的该乙酰化粒毛盘菌胞外多糖作为活性物质与药用辅料混合加工,制备成片剂或胶囊剂。
与已有技术相比,本发明的有益效果体现在:
本发明的乙酰化粒毛盘菌胞外多糖具有显著的心血管保护作用,且无毒副作用,不会对体内器官造成损伤。本发明方法简单经济,可将该乙酰化粒毛盘菌胞外多糖应用于制备片剂或胶囊剂型的心血管保护药物。
附图说明
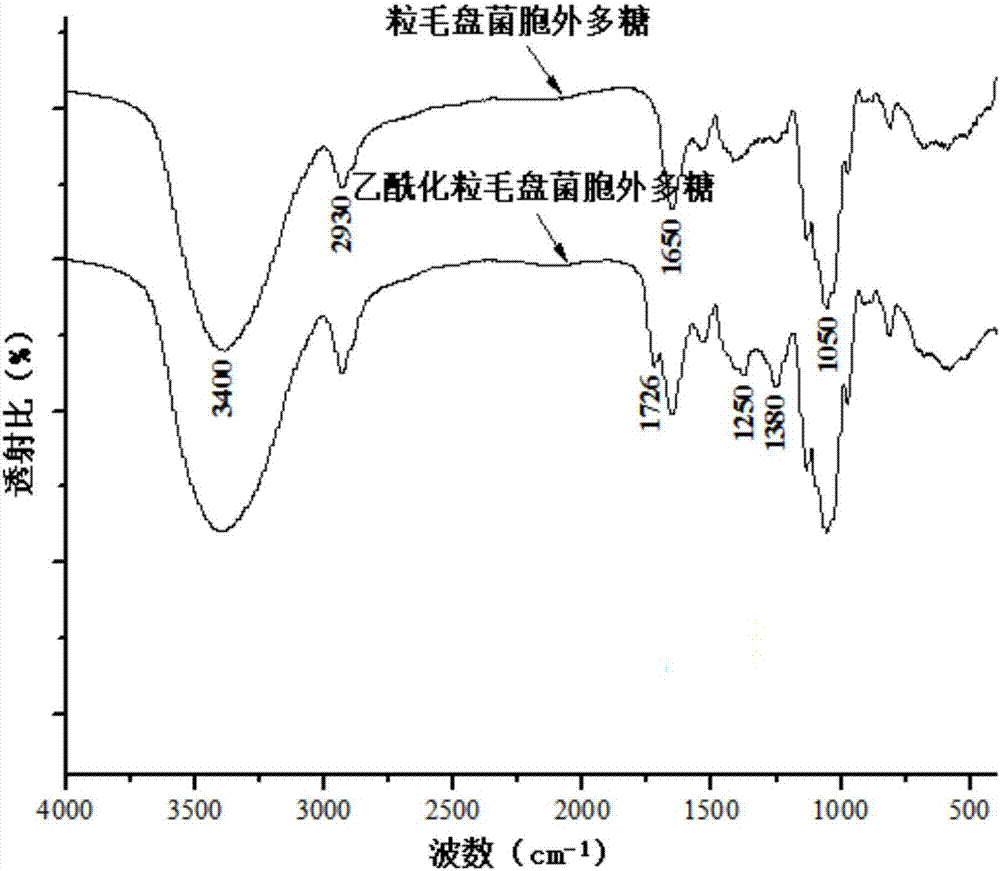
图1为粒毛盘菌胞外多糖和乙酰化粒毛盘菌胞外多糖的红外光谱;
图2为粒毛盘菌胞外多糖和乙酰化粒毛盘菌胞外多糖的核磁共振碳谱。
具体实施方式
下面通过实施例并结合附图对本发明作进一步具体详细的说明。
实施例1:
一、粒毛盘菌胞外多糖(lep-2a)的制备
本实施例首先按如下步骤制备粒毛盘菌胞外多糖:
将菌种保藏编号为cctccm2016603的粒毛盘菌ym216接种于100l发酵罐中发酵8d。抽滤、浓缩后,将浓缩的发酵液与3倍体积的体积百分浓度为95%的乙醇混合,然后于4℃醇沉24h。4000r/min离心15min后,滤出沉淀,并将沉淀复溶于蒸馏水。经sevage法除蛋白、以质量百分浓度30%的h2o2脱色、透析除杂、冷冻干燥得到粒毛盘菌胞外粗多糖(lep)。
通过deae-纤维素52柱层析和琼脂糖凝胶cl-6b柱层析依次对得到的粗多糖进行分离纯化。将300mglep溶于2ml蒸馏水,然后装入deae-纤维素52色谱柱(2.6cm×60cm),依次使用蒸馏水和浓度为0.3mol/l的nacl溶液以0.5ml/min的速率进行洗脱。采用苯酚-硫酸法进行追踪检测,然后收集两个组分(lep-1和lep-2)、透析、冻干。将主要组分(lep-2)溶于蒸馏水,然后装入琼脂糖凝胶cl-6b色谱柱(1.6cm×60cm),使用质量百分浓度为0.9%的nacl溶液以0.5ml/min的速率进行洗脱。收集单一组分(lep-2a)、透析、冻干。
二、乙酰化粒毛盘菌胞外多糖(alep-2a)的制备
本实施例以上述所获得的粒毛盘菌胞外多糖为原料,按如下方法制备乙酰化粒毛盘菌胞外多糖:
将2g粒毛盘菌胞外多糖与80ml甲酰胺混合,于60℃搅拌30min后,加入50ml由n-溴代丁二酰亚胺(nbs)和乙酸酐(1:1,mg/ml)配制而成的溶液,于60℃反应6h后,加入20ml蒸馏水终止反应。冷却至室温后,使用体积百分浓度为95%的乙醇将溶液于4℃醇沉24h。4000r/min离心15min,滤出沉淀,并将沉淀复溶于100ml蒸馏水。使用1mol/lnaoh溶液中和该溶液,于截留分子量为14000da透析袋中先用自来水逆向流动透析48h,再用蒸馏水透析24h。将获得物浓缩并冻干得到乙酰化粒毛盘菌胞外多糖(alep-2a)。
按如下方法测试产物alep-2a中乙酰基的含量:
乙酰基标准曲线的绘制:将50ml盐酸羟胺溶液(0.1mol/l)与50mlnaoh溶液(1.5mol/l)混合,然后分别向5ml含不同浓度乙酰基(0、20、40、60、80和100mg/l)的标准溶液中加入10ml该混合液。此后,依次加入5ml盐酸(2mol/l)和10mlfecl3溶液(0.37mol/l)。于500nm处测定其吸光度值,并以a500对乙酰基浓度绘制标准曲线。
乙酰基含量的测定:将5mgalep-2a溶于5ml蒸馏水,然后依次加入5ml盐酸羟胺溶液(0.1mol/l)、5mlnaoh溶液(1.5mol/l)、5ml盐酸(2mol/l)和10mlfecl3溶液(0.37mol/l)。于500nm处测定其吸光度值,并根据标准曲线计算乙酰基含量。
经上述测试可知本实施例所得alep-2a中乙酰基的质量分数为4.6%。
三、乙酰化粒毛盘菌胞外多糖(alep-2a)的结构验证
红外光谱测定:分别取2mglep-2a和alep-2a与kbr(1:100)混合均匀,研磨后压片,采用傅里叶变换红外光谱仪(nexus670)进行ir分析,扫描范围为4000-400cm-1。
图1为lep-2a和alep-2a的红外光谱。对比分析发现,lep-2a和alep-2a均具有粒毛盘菌胞外多糖的特征吸收,3400、2930和1650cm-1处的强吸收峰分别归因于o-h的伸缩振动、c-h的伸缩振动和结合水的弯曲振动,1050cm-1处的峰表明存在吡喃糖环;对于alep-2a,1726cm-1处的峰归因于c=o伸缩振动的特征吸收,1380cm-1处的峰是由c-ch3伸缩振动引起的,1250cm-1处的强吸收峰归因于c-o的伸缩振动。以上结果表明,乙酰化修饰成功。
核磁共振碳谱测定:分别取50mglep-2a和alep-2a溶于1mld2o,采用brukerav-500核磁共振光谱仪进行13cnmr分析。
图2为lep-2a和alep-2a的核磁共振碳谱。对比分析发现,alep-2a的核磁共振碳谱中δ99.469ppm、δ70.399ppm、δ70.091ppm、δ66.925ppm和δ61.031ppm处碳信号明显减弱,表明→2)-α-d-manp-(1→的c-3、c-4和c-6位,α-d-manp-(1→的c-2、c-3、c-4和c-6位,→2,6)-α-d-manp-(1→的c-3和c-4位,→3,4)-α-d-manp-(1→的c-2、c-4和c-6位,→3)-β-d-galp-(1→的c-1、c-2、c-4和c-6位以及β-d-galp-(1→的c-2、c-4和c-6位可能被乙酰基部分取代。这一结果进一步证实了乙酰化修饰成功。
四、粒毛盘菌胞外多糖(lep-2a)及乙酰化粒毛盘菌胞外多糖(alep-2a)的心血管保护作用药理实验
(1)实验所用动物:昆明小鼠42只,雄性,体重20±2g。
(2)实验所用试剂盒:超氧化物歧化酶(sod)测定试剂盒、谷胱甘肽过氧化物酶(gsh-px)测试盒、过氧化氢酶(cat)测试盒、丙二醛(mda)测试盒和一氧化氮(no)试剂盒购自南京建成生物工程研究所;小鼠晚期糖基化终末产物(ages)elisa检测试剂盒、小鼠可溶性细胞间粘附分子1(sicam-1)elisa检测试剂盒、小鼠高敏c反应蛋白(hs-crp)elisa检测试剂盒和小鼠内皮素1(et-1)elisa检测试剂盒购自上海研生生物技术科技有限公司。
(3)实验方法:首先对42只昆明小鼠进行适应性喂养1周后,称重。取36只昆明小鼠,腹腔注射60mg/kg剂量的链脲佐菌素(stz),若血糖水平>16.7mmol/l,表明糖尿病模型小鼠建模成功;同时对剩余的6只昆明小鼠腹腔注射等剂量的0.9%生理盐水。然后,将36只糖尿病模型小鼠随机分为6组(每组6只):
模型组:每日灌胃10ml/kg剂量的生理盐水;
二甲双胍组:每日灌胃100mg/kg剂量的二甲双胍;
低剂量lep-2a组:每日灌胃50mg/kg剂量的lep-2a;
高剂量lep-2a组:每日灌胃200mg/kg剂量的lep-2a;
低剂量alep-2a组:每日灌胃50mg/kg剂量的alep-2a;
高剂量alep-2a组:每日灌胃200mg/kg剂量的alep-2a;
此外,将6只正常昆明小鼠作为正常组,每日灌胃10ml/kg剂量的生理盐水。
连续灌胃4周后,将小鼠禁食过夜,并再次测量血糖水平。称重后,摘眼球取血,并通过颈椎脱位处死小鼠。于4℃以3500r/min离心10min立即分离血清,并于-80℃贮存直至测定。迅速取出心脏、肾脏和肝脏,吸干并称重。将心脏组织于生理盐水中均质化(1:10,g/ml),然后于4℃以3500r/min离心10min,取上清用于生化测定。
(4)相关指标测定:
使用商用试剂盒测定心脏组织中sod、gsh-px、cat活性和mda水平;
参照检测试剂盒的制造说明书并通过酶法测定血清中ages、hs-crp、sicam-1、no和et-1含量。
(5)药理实验结果:
表1给出了粒毛盘菌胞外多糖及乙酰化粒毛盘菌胞外多糖对糖尿病小鼠血糖水平的影响。
表1lep-2a及alep-2a对糖尿病小鼠血糖水平的影响
注:#p<0.05,##p<0.01,与正常组相比;*p<0.05,**p<0.01,与模型组相比。
对表1中的各组指标参数进行比较分析,可以看出lep-2a及alep-2a对各治疗组小鼠相关指标的影响。如表1中所示,正常小鼠的血糖水平明显(p<0.01)低于stz诱导的糖尿病小鼠的血糖水平。连续灌胃4周后,模型组小鼠的血糖水平仍处于较高水平(22.80±1.41),而lep-2a及alep-2a治疗组小鼠的血糖水平显著(p<0.01)降低,尤其是200mg/kg剂量的alep-2a治疗组。
表2给出了粒毛盘菌胞外多糖及乙酰化粒毛盘菌胞外多糖对糖尿病小鼠心脏、肾脏和肝脏指数的影响。
表2lep-2a及alep-2a对糖尿病小鼠心脏、肾脏和肝脏指数的影响
注:#p<0.05,##p<0.01,与正常组相比;*p<0.05,**p<0.01,与模型组相比。
对表2中的各组指标参数进行比较分析,可以看出lep-2a及alep-2a对各治疗组小鼠相关指标的影响。如表2中所示,与正常小鼠相比,stz诱导的糖尿病小鼠的心脏、肾脏和肝脏指数显著(p<0.01)增加。与模型组小鼠相比,lep-2a及alep-2a治疗组小鼠心脏、肾脏和肝脏指数显著(p<0.05或p<0.01)降低;二甲双胍治疗也显著(p<0.01)降低了糖尿病小鼠的这些指数。
表3给出了粒毛盘菌胞外多糖及乙酰化粒毛盘菌胞外多糖对糖尿病小鼠心脏组织中sod、gsh-px、cat活性和mda水平的影响。
表3lep-2a及alep-2a对糖尿病小鼠心脏组织中sod、gsh-px、cat活性和mda水平的影响
注:#p<0.05,##p<0.01,与正常组相比;*p<0.05,**p<0.01,与模型组相比。
对表3中的各组指标参数进行比较分析,可以看出lep-2a及alep-2a对各治疗组小鼠相关指标的影响。如表3中所示,与正常小鼠相比,stz诱导的糖尿病小鼠心脏组织中sod活性显著(p<0.01)降低。与模型组小鼠相比,lep-2a及alep-2a治疗显著(p<0.05或p<0.01)增加了糖尿病小鼠心脏组织中sod活性,尤其是200mg/kg剂量的alep-2a治疗,而50mg/kg剂量的lep-2a治疗无显著差异;二甲双胍治疗也显著(p<0.01)增加了糖尿病小鼠心脏组织中sod活性,且稍强于200mg/kg剂量的alep-2a治疗。
与正常小鼠相比,stz诱导的糖尿病小鼠心脏组织中gsh-px活性显著(p<0.01)降低。与模型组小鼠相比,lep-2a、alep-2a及二甲双胍治疗均显著(p<0.01)增加了糖尿病小鼠心脏组织中gsh-px活性,且200mg/kg剂量的alep-2a治疗相比二甲双胍治疗作用更强。
与正常小鼠相比,stz诱导的糖尿病小鼠心脏组织中另一种抗氧化酶cat活性显著(p<0.01)降低。与模型组小鼠相比,lep-2a及alep-2a治疗显著(p<0.01)增加了糖尿病小鼠心脏组织中cat活性,尤其是200mg/kg剂量的alep-2a治疗,但稍弱于二甲双胍治疗。
与正常小鼠相比,stz诱导的糖尿病小鼠心脏组织中mda水平显著(p<0.01)增加。与模型组小鼠相比,lep-2a、alep-2a及二甲双胍治疗均显著(p<0.01)降低了糖尿病小鼠心脏组织中mda水平,且200mg/kg剂量的alep-2a治疗相比二甲双胍治疗作用更强。以上结果表明,lep-2a及alep-2a可能通过维持抗氧化酶水平以及改善糖代谢和脂质代谢发挥心血管保护作用。
表4给出了粒毛盘菌胞外多糖及乙酰化粒毛盘菌胞外多糖对糖尿病小鼠血清ages、hs-crp、sicam-1、no和et-1的影响。
表4lep-2a及alep-2a对糖尿病小鼠血清ages、hs-crp、sicam-1、no和et-1的影响
注:#p<0.05,##p<0.01,与正常组相比;*p<0.05,**p<0.01,与模型组相比。
对表4中的各组指标参数进行比较分析,可以看出lep-2a及alep-2a对各治疗组小鼠相关指标的影响。如表4中所示,与正常小鼠相比,stz诱导的糖尿病小鼠血清中ages、hs-crp和sicam-1水平显著(p<0.05或p<0.01)增加。经lep-2a及alep-2a治疗,糖尿病小鼠血清中ages、hs-crp和sicam-1水平显著(p<0.05或p<0.01)降低,尤其对于sicam-1。与模型组小鼠相比,二甲双胍治疗也显著(p<0.05或p<0.01)降低了糖尿病小鼠血清中ages、hs-crp和sicam-1水平。
与正常小鼠相比,stz诱导的糖尿病小鼠血清中no水平显著(p<0.01)降低。经lep-2a、alep-2a及二甲双胍治疗,糖尿病小鼠血清中no水平显著(p<0.05或p<0.01)增加。
与正常小鼠相比,stz诱导的糖尿病小鼠血清中et-1水平显著(p<0.01)增加。与模型组小鼠相比,lep-2a、alep-2a及二甲双胍治疗均显著(p<0.01)降低了糖尿病小鼠血清中et-1水平,而50mg/kg剂量的lep-2a治疗无显著差异。以上结果表明,lep-2a及alep-2a主要通过改善心血管功能发挥心血管保护作用。
(6)结论:
综上所述,lep-2a及alep-2a能够有效治疗糖尿病小鼠的心血管疾病,尤其是200mg/kg剂量的alep-2a治疗,表明采取乙酰化修饰改性的粒毛盘菌胞外多糖的心血管保护作用明显增强。一方面,主要通过提高抗氧化酶水平,从而抑制氧化应激;另一方面,主要通过增加no水平并降低et-1水平,恢复血管收缩和舒张平衡以改善心血管功能。
五、乙酰化粒毛盘菌胞外多糖(alep)制剂的加工
1、片剂加工
将300-600g乙酰化粒毛盘菌胞外多糖与药用辅料稀释剂200-300g、助流剂20-50g混匀后,与200-400ml乙醇混合均匀制得软材,软材过筛得到湿颗粒,干燥后整粒,最后加入润滑剂5-10g混匀后压片,制成1000片片剂。所述药用辅料稀释剂选用糊精或干淀粉;所述助流剂采用滑石粉、微粉硅胶或微晶纤维素;所述润滑剂采用硬脂酸镁或硬脂酸锌。
本实施例推荐的片剂加工的优选例为:取过80-100目筛的上述乙酰化粒毛盘菌胞外多糖500g、稀释剂糊精250g、助流剂滑石粉40g,混合均匀后加300ml乙醇混合均匀制得软材,软材过筛得到湿颗粒,干燥后整粒,最后加入润滑剂硬脂酸镁10g混匀后压片,制成1000片,片重0.8g,乙酰化粒毛盘菌胞外多糖含量0.5g/片。
2、胶囊剂加工
将药用辅料稀释剂200-300g、助流剂50-70g、润湿剂2-6g混匀后,再与300-600g的上述乙酰化粒毛盘菌胞外多糖混合均匀,装1#空心胶囊,制得胶囊剂1000粒。所述药用辅料稀释剂选用糊精或干淀粉;所述助流剂采用滑石粉或微粉硅胶或微晶纤维素;所述润湿剂采用十二烷基硫酸钠或者磺基丁二酸二辛酯。
本实施例推荐的胶囊剂加工优选例为:取稀释剂干淀粉200g,助流剂滑石粉40g,润湿剂十二烷基硫酸钠5g混合均匀后,再与400g上述乙酰化粒毛盘菌胞外多糖混合均匀后装1#空心胶囊1000粒,多糖含量0.4g/粒。
- 还没有人留言评论。精彩留言会获得点赞!