解鸟氨酸拉乌尔菌及其应用的制作方法
(一)技术领域
本发明涉及一株产腈水解酶的菌株,及其在生物催化α-氨基腈底物(2-氨基-4(羟乙基甲基磷酰基)-丁腈)制备作为l-草铵膦重要手性前体的l-2-氨基-4(羟乙基甲基磷酰基)-丁酸的应用。
(二)
背景技术:
腈水解酶(nitrilase,ec3.5.5.1)能将腈类化合物中的氰基直接转化为羧基制备羧酸,它对腈化合物具有独特的化学选择性、立体选择性和区域选择性,可以用于合成多种化学法合成效率低下或难以合成的羧酸。其选择性好,转化率高,同时,该途径与传统工艺相比具有反应条件温和,无需高温高压、强酸强碱,污染较少,有着化学方法无可比拟的优越性,符合原子经济型和绿色化学的发展方向,在化学合成中表现出巨大的应用潜力,无论在应用数量还是种类上都有较大发展,在医药及其中间体、农药及其中间体、食品及饲料添加剂等领域得到了广泛应用:腈水解酶催化制备瑞舒伐他汀(rosuvastatin)的关键中间体(r)-3-羟基戊二酸乙酯;制备抗血小板聚集药物氯吡格雷(clopidogrel)的关键中间体r型邻氯扁桃酸;制备ida路线生产除草剂草甘膦的关键中间体亚氨基二乙酸等。
l-2-氨基-4(羟乙基甲基磷酰基)-丁酸是制备l-草铵膦的重要手性前体。dl-草铵膦,有效成分是phosphinothricin(简称ppt),其化学名称为:4-[羟基甲基膦酰基]-dl-高丙氨酸(别名:d,l-草铵膦胺盐),为广谱、触杀型、灭生性、非残留除草剂,是由德国赫斯特公司(目前为拜耳公司旗下企业)于20世纪80年代开发的新型灭生性除草剂。除了具有除草活性外还具有杀虫杀菌活性可以与杀虫剂等混配达到同时防治的效果。该除草剂具有高效、低毒、易降解等特点。草铵膦是外消旋体混合物,只有l–型具有植物毒性,其除草活性为外消旋混合物的2倍。目前,市售的草铵膦一般都是外消旋混合物,如果能以l-型的草铵膦来代替其使用,不仅可以降低使用成本,还能减轻环境压力。草铵膦的合成方法有很多,包括化学法合成外消旋草铵膦:盖布瑞尔(gabriel)–丙二酸二乙酯合成法、阿布佐夫(arbuzov)合成法、高压催化合成法、赫勒-贝格斯(bucherer-bergs)法、赫勒-贝格斯(bucherer-bergs)法、(neber)重排法、michael自由基加成法、(srecker)法合成dl-草铵膦;化学法合成l-草铵膦:d-缬氨酸甲酯和(s)-2-羟基-3-蒎酮为辅助剂的手性辅助剂诱导法、l-谷氨酸和l-蛋氨酸为手性源的天然氨基酸手性源法、不对称strecker反应和不对称michael加成法、利用奎宁进行外消旋体拆分法;酶法合成l-草铵膦主要有蛋白酶水解法、磷酸二酯酶i水解法,酰基转移酶i催化法,谷氨酰胺酶三种酶协同水解法;转氨酶法;α-胰乳蛋白酶拆分法、酰胺酶拆分法、脱乙酰基酶拆分法、d-氨基酸氧化酶拆分法等(现代农药,2009,8(3):1-5)。
目前应用于工业化生产草铵膦的方法可归结为以下三条路线:拜耳公司利用michael自由基加成法制备d,l-草铵膦;srecker法合成d,l-草铵膦;明治制果不对称催化加氢合成l-草铵膦。其中srecker法合成d,l-草铵膦路线反应条件温和,是目前产业化大生产所采用的路线。该路线以亚磷酸三乙酯和三氯化磷为起始原料,经歧化、格氏、甲基化、加成、腈铵化、酸解、铵化反应制得d,l-草铵膦。用腈水解酶选择性催化水解反应替换srecker路线中的酸解步骤,催化路线中的α-氨基腈底物(2-氨基-4(羟乙基甲基磷酰基)-丁腈)制备合成l-草铵膦的重要手性前体:l-2-氨基-4(羟乙基甲基磷酰基)-丁酸,为实现工业化路线的srecker法合成l-草铵膦提供了依据。
(三)
技术实现要素:
本发明目的是提供一株产腈水解酶的菌株--解鸟氨酸拉乌尔菌(raoultellaornithinolytica)zjb-16008,及其生物催化α-氨基腈底物(2-氨基-4(羟乙基甲基磷酰基)-丁腈)制备l-2-氨基-4(羟乙基甲基磷酰基)-丁酸的应用。
本发明采用的技术方案是:
本发明提供一株具有产腈水解酶性能的新菌株--解鸟氨酸拉乌尔菌(raoultellaornithinolytica)zjb-16008,保藏于中国典型培养物保藏中心,保藏编号cctccno:m2017035,保藏日期2017年01月13日,地址:中国.武汉.武汉大学,邮编430072。
本发明还涉及所述的解鸟氨酸拉乌尔菌(raoultellaornithinolytica)zjb-16008催化α-氨基腈(2-氨基-4(羟乙基甲基磷酰基)-丁腈)制备作为l-草铵膦重要手性前体的l-2-氨基-4(羟乙基甲基磷酰基)-丁酸中的应用,所述的应用为:以解鸟氨酸拉乌尔菌zjb-16008经发酵培养获得的湿菌体为催化剂,以2-氨基-4(羟乙基甲基磷酰基)-丁腈为底物,以蒸馏水或100mm、ph7.0磷酸缓冲液为反应介质,在30-50℃、100-200rpm条件下进行转化反应,反应结束,将反应液分离纯化,获得l-2-氨基-4(羟乙基甲基磷酰基)-丁酸。
腈水解酶生物催化α-氨基腈(2-氨基-4(羟乙基甲基磷酰基)-丁腈)生成l-2-氨基-4(羟乙基甲基磷酰基)-丁酸过程如下:
进一步,所述催化剂用量以湿菌体重量计为10-100g/l反应介质,优选35g/l,所述底物初始加入终浓度为2-100g/l反应介质,优选5g/l。
进一步,所述催化剂按如下方法制备:(1)斜面培养:将解鸟氨酸拉乌尔菌zjb-16008接种至斜面培养基,在30℃培养48h,获得斜面菌体;所述斜面培养基终浓度组成为:甘露醇1~20.0g/l,谷氨酸钠1~10.0g/l,酵母膏1~5.0g/l,k2hpo40.1~1.0g/l,kh2po40.1~1.0g/l,mgso40.1~1.0g/l,己内酰胺0.1~2.0g/l,琼脂20.0g/l,溶剂为去离子水,ph7.0-7.5;优选所述斜面培养基终浓度组成为:甘露醇10.0g/l,谷氨酸钠7.0g/l,酵母膏3.0g/l,k2hpo40.75g/l,kh2po40.75g/l,mgso40.5g/l,己内酰胺1.0g/l,琼脂20.0g/l,溶剂为去离子水,ph7.0-7.5;
(2)种子培养:挑取斜面菌体接种至种子培养基,在30℃培养24h,获得种子液;所述种子培养基终浓度组成为:甘露醇1~20.0g/l,谷氨酸钠1~10.0g/l,酵母膏1~5.0g/l,k2hpo40.1~1.0g/l,kh2po40.1~1.0g/l,mgso40.1~1.0g/l,己内酰胺0.1~2.0g/l,溶剂为去离子水,ph7.0-7.5;优选所述种子培养基终浓度组成为:甘露醇10.0g/l,谷氨酸钠7.0g/l,酵母膏3.0g/l,k2hpo40.75g/l,kh2po40.75g/l,mgso40.5g/l,己内酰胺1.0g/l,溶剂为去离子水,ph7.0-7.5;
(3)发酵培养:将种子液以体积浓度1~10%的接种量接种至发酵培养基中,30℃,150rpm振荡培养48h后,在12000g下离心10min,收集湿菌体;所述发酵培养基终浓度组成为:甘露醇1~20.0g/l,谷氨酸钠1~10.0g/l,酵母膏1~5.0g/l,k2hpo40.1~1.0g/l,kh2po40.1~1.0g/l,mgso40.1~1.0g/l,己内酰胺0.1~2.0g/l,溶剂为去离子水,ph7.0-7.5。优选所述发酵培养基终浓度组成为:甘露醇10.0g/l,谷氨酸钠7.0g/l,酵母膏3.0g/l,k2hpo40.75g/l,kh2po40.75g/l,mgso40.5g/l,己内酰胺1.0g/l,溶剂为去离子水,ph7.0-7.5。
本发明所述反应液分离纯化的方法为:将反应液调至ph2.5,采用阴离子交换树脂201×7进行柱层析,以上柱流速为1~6.0bv/h(优选4bv/h)进行上样,先用去离子水洗涤,再用0.5~2.0m(优选1m)的氨水进行洗脱,洗脱速度为1.0~4.0bv/h(优选2bv/h),收集含有目标物的洗脱液;将洗脱液减压蒸馏至无溶剂流出,加入甲醇溶解,在冰浴下搅拌,重结晶,过滤,滤饼干燥,即得产物l-2-氨基-4(羟乙基甲基磷酰基)-丁酸。
本发明中利用腈水解酶选择性催化水解2-氨基-4(羟乙基甲基磷酰基)-丁腈制得作为l-草铵膦重要手性前体的l-2-氨基-4(羟乙基甲基磷酰基)-丁酸,为实现工业化路线成熟的srecker法合成l-草铵膦提供了依据。同时替代了国内工业化strecker路线中的酸解反应,减少了酸解反应产生的酸性废水污染和酸解反应对设备的腐蚀损害。
本发明的有益效果主要体现在:本发明提供了一株能够产生腈水解酶的菌株--解鸟氨酸拉乌尔菌(raoultellaornithinolytica)zjb-16008,本发明还提供了利用解鸟氨酸拉乌尔菌zjb-16008经发酵培养获得的湿菌体为生物催化剂催化2-氨基-4(羟乙基甲基磷酰基)-丁腈制得作为l-草铵膦重要手性前体的l-2-氨基-4(羟乙基甲基磷酰基)-丁酸的方法,具有重要应用前景。
(四)附图说明
图1为柱前衍生化反相高效液相色谱条件下d-2-氨基-4(羟乙基甲基磷酰基)-丁酸与l-2-氨基-4(羟乙基甲基磷酰基)-丁酸的液相结果谱图。
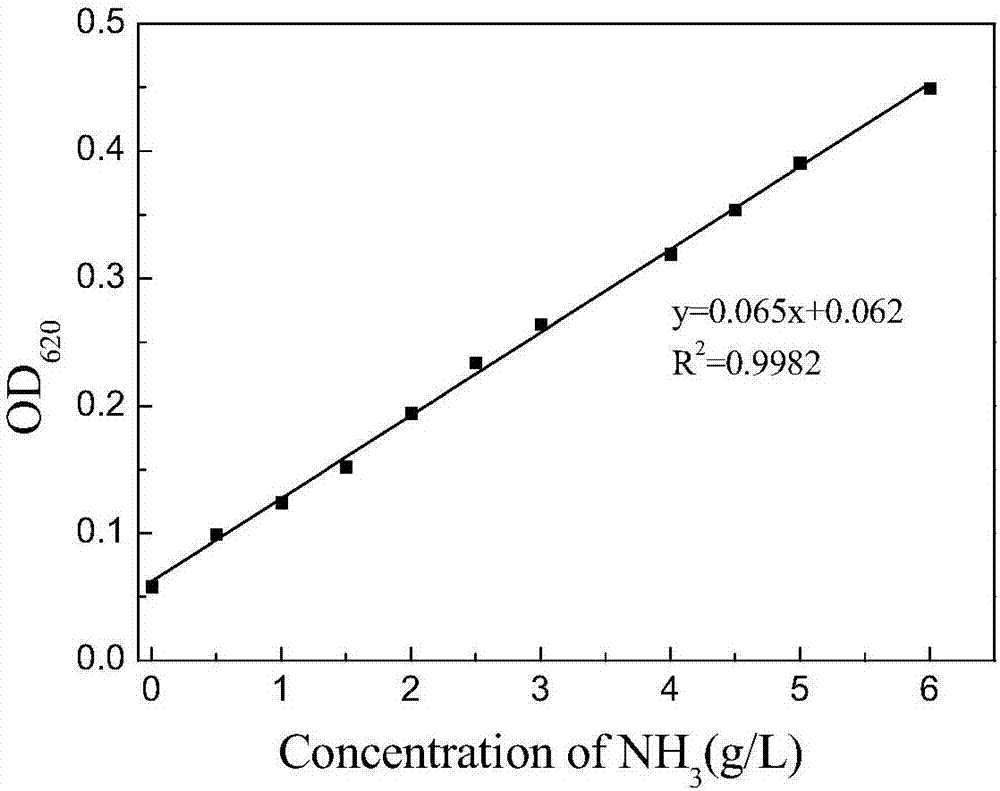
图2为铵根离子浓度标准曲线。
(五)具体实施方式
下面结合具体实施例对本发明进行进一步描述,但本发明的保护范围并不仅限于此:
实施例1:产腈水解酶菌株的筛选及鉴定
1、产腈水解酶菌株的筛选
(1)本发明从全国各地取土样,各称取1g用0.85%生理盐水悬浮,静置,加1ml上清于50ml添加有1g/lα-氨基腈底物(2-氨基-4(羟乙基甲基磷酰基)-丁腈)作为唯一碳源的富集培养基中,在30℃,150rpm的摇床上培养3天;待培养基浑浊后,取1ml培养液转接到添加有1g/l2-氨基-4(羟乙基甲基磷酰基)-丁腈的新鲜的富集培养基中,再培养3天。如此循环富集3~4个循环;
(2)将最后一次富集培养液用无菌水逐级稀释10个梯度,选取10-4、10-5、10-6、10-7、10-8五个梯度的稀释液各取0.1ml均匀涂布在添加有1g/l2-氨基-4(羟乙基甲基磷酰基)-丁腈的平板培养基上,在30℃恒温培养箱中培养2-3天,将平板上的单菌落挑取,接种于斜面培养基上,在30℃恒温培养箱中培养2-3天,于4℃保藏;
(3)将保存于斜面上的菌株接种至种子培养基中,在30℃培养24h。将种子液以体积浓度1%的接种量接种至发酵培养基中,30℃,150rpm振荡培养48h。在12000g下离心10min,收集湿菌体,取一定量的菌体和底物(2-氨基-4(羟乙基甲基磷酰基)-丁腈)悬浮于蒸馏水中,制成0.2g/10ml菌浓度,10g/l底物浓度的反应体系进行转化,置于30℃水浴摇床转化24h。取样,进行苯酚-次氯酸盐法初筛,腈水解酶活力相对好的,再进行高效液相色谱检测产物l-2-氨基-4(羟乙基甲基磷酰基)-丁酸的浓度和光学纯度,最终筛选获得菌株zjb-16008。
所述富集培养基终浓度组成为(g/l):葡萄糖5.0,氯化钠1.0,k2hpo4·3h2o0.8,kh2po43.3,mgso4·7h2o0.2,溶剂为去离子水,ph为7.0,在此培养基中添加1g/l的2-氨基-4(羟乙基甲基磷酰基)-丁腈作为唯一的碳源。
所述平板筛选培养基为(g/l):葡萄糖5.0,氯化钠1.0,k2hpo4·3h2o0.8,kh2po43.3,mgso4·7h2o0.2,琼脂20.0,溶剂为去离子水,ph为7.0。115℃30min灭菌。冷却至室温后加入2-氨基-4(羟基甲基磷酰基)-丁腈1.0g/l。
所述斜面培养基终浓度组成为(g/l):甘露醇10.0,谷氨酸钠7.0,酵母膏3.0,k2hpo40.75,kh2po40.75,mgso40.5,己内酰胺1.0,琼脂20.0,溶剂为去离子水,ph7.0-7.5。
所述发酵培养基终浓度组成为(g/l):甘露醇10.0,谷氨酸钠7.0,酵母膏3.0,k2hpo40.75,kh2po40.75,mgso40.5,己内酰胺1.0,溶剂为去离子水,ph7.0-7.5。
(4)苯酚-次氯酸盐法初筛
用移液管取2ml的a液置于10ml的离心管中,加入4μl待测液,盖上盖子,用力混匀。之后再用移液管加入2ml的b液,盖上盖子,再次混匀。置于37℃水浴加热5min后,至离心管内颜色不再发生变化,取200μl置于96孔板中,620nm处测量吸光度后同标准曲线对比得到待测液中铵根的浓度,铵根浓度等于转化后得到的2-氨基-4(羟乙基甲基磷酰基)-丁酸的浓度,用此可以检测转化过程中2-氨基-4(羟乙基甲基磷酰基)-丁酸的产量。
所述a液:称量5g苯酚和25mg亚硝基铁氰化钠,置于500ml容量瓶中,加入超纯水定容后,保存于棕色瓶中,4℃冰箱中储存。
所述b液:称量2.5g的naoh置于500ml容量瓶,用移液管加入4.4ml含5.2%有效氯的次氯酸钠水溶液后,用超纯水定容,保存于棕色瓶中,4℃冰箱中储存。
标准曲线的制备:苯酚-次氯酸盐法在室温下用比色皿和紫外-可见分光光度计或者在96孔板和通用微孔板分光光度计下都可以对铵根的浓度进行测量,在620nm波长下,od620值与铵根离子的浓度有着良好的线性关系(如图2),r2=0.9982,表明此法有很高的可行性和准确性。
(5)柱前衍生化反相高效液相色谱法复筛
取经初筛后得到的结果较好的反应液500μl,加入等体积的衍生化试剂,混匀,进行衍生化反应5min,然后进样15μl,进行hplc分析。
所述的衍生化试剂:分别称取10mg邻苯二甲醛(opa)和12mgn-乙酰-l-半胱氨酸(nac),以lml无水乙醇溶解后,用0.2mol/l硼酸缓冲液(ph值9.8)稀释至5ml,-4℃冰箱保存备用(存放时间不宜超过3d)。
高效液相色谱分析条件为:采用的气相色谱仪为美国戴安u3000液相色谱仪(配置荧光检测器);色谱柱:戴安c18(4.6mm×250mm,硅羟基填料);流动相:甲醇:0.05mol/l醋酸铵溶液(体积比10:90,ph值5.7);流速:1ml/min;柱温:35℃;进样量:15μl;荧光检测波长:激发波长ex350nm,发射波长em450nm。
在该条件下,l-2-氨基-4(羟乙基甲基磷酰基)-丁酸与d-2-氨基-4(羟乙基甲基磷酰基)-丁酸的出峰时间分别为9.2min和11.1min,见图1。
2、菌株zjb-16008的分子鉴定
将步骤1筛选得到的菌株zjb-16008用分子试剂盒提取其总dna,以该菌株zjb-16008的总dna为模板,利用引物:p1:5'-agagtttgatcctggctcag-3'和p2:5'-aaggaggtgatccagccgca-3'扩增菌株的16srdna基因(seqidno:1所示),将基因产物同t载体连接后,委托上海生工对该菌16srdna扩增及测序,得到该菌株的16srdna序列后,在ncbi网站上用blast检索genbank中相关菌株的16srdna基因序列,并进行同源性比对。本发明微生物与raoultellaornithinolytica菌株mg同源性最高(homology,100%,basedon16srdna),根据微生物分子遗传学鉴定原则,基于16srdna序列的同源性高于95%,鉴定菌基本属于对照菌。因此,本实验鉴定的菌株zjb-16008为解鸟氨酸拉乌尔菌(raoultellaornithinolytica),拟命名为解鸟氨酸拉乌尔菌(raoultellaornithinolytica)zjb-16008。
任何对seqidno:1所示核苷酸序列进行一个或多个核苷酸的取代、缺失或插入处理获得的核苷酸序列,只要其与该核苷酸具有90%以上的同源性,均属于本发明的保护范围。
实施例2:湿菌体的制备
(1)斜面培养
将解鸟氨酸拉乌尔菌(raoultellaornithinolytica)zjb-16008接种至斜面培养基,在30℃培养48h,获得斜面菌体。
所述斜面培养基终浓度组成为(g/l):甘露醇10.0,谷氨酸钠7.0,酵母膏3.0,k2hpo40.75,kh2po40.75,mgso40.5,己内酰胺1.0,琼脂20.0,溶剂为去离子水,ph7.0-7.5。
(2)种子培养
从斜面菌体挑取菌体接种至种子培养基,在30℃培养24h,获得种子液;所述种子培养基终浓度组成为(g/l):甘露醇10.0,谷氨酸钠7.0,酵母膏3.0,k2hpo40.75,kh2po40.75,mgso40.5,己内酰胺1.0,溶剂为去离子水,ph7.0-7.5;
(3)发酵培养
将种子液以体积浓度1%的接种量接种至发酵培养基中,30℃,150rpm振荡培养48h后,在12000g下离心10min,收集湿菌体。
所述发酵培养基终浓度组成为(g/l):甘露醇10.0,谷氨酸钠7.0,酵母膏3.0,k2hpo40.75,kh2po40.75,mgso40.5,己内酰胺1.0,溶剂为去离子水,ph7.0-7.5。
实施例3:以α-氨基腈(2-氨基-4(羟乙基甲基磷酰基)-丁腈)为底物的生物转化反应
(1)在10ml磷酸缓冲液(100mm,ph7.0)中加入实施例2方法制备的湿菌体0.2g,底物2-氨基-4(羟乙基甲基磷酰基)-丁腈终浓度为2g/l,放入水浴摇床30℃,150rpm条件下转化24h。取1ml转化液于ep管中,12000r/min离心2min,取上清进行手性液相检测。结果表明菌株zjb-16005对2-氨基-4(羟乙基甲基磷酰基)-丁腈的转化得到产物l-2-氨基-4(羟乙基甲基磷酰基)-丁酸的光学纯度为99.9%。
(2)酶反应得到含产物l-2-氨基-4(羟乙基甲基磷酰基)-丁酸的转化液在离子交换柱上采用阴离子交换树脂201×7进行产物的分离。
1)树脂预处理
用50℃温水浸泡,使其充分膨胀并除去细小颗粒(倾斜或浮选法);依次用l.0m的naoh水溶液浸泡3h用去离子水洗至中性,再用l.0m的hcl水溶液浸泡3h后用去离子水洗至中性,然后用l.0m的naoh水溶液浸泡3h,转化为oh-形式,最后用去离子水洗至中性备用。
2)装柱
采用湿法装柱(内径1.5cm,高40cm),先在离子交换柱内先加入一定高度的去离子水(一般为柱长的1/3),在取30ml湿树脂201×7装入玻璃杯,加入50ml去离子水,慢慢搅拌,悬浮状的树脂倒入离子交换柱中,让其自然沉降,树脂在柱内必须分布均匀,不应有明显的分界线,不要有气泡产生。
3)上样,洗脱
将步骤(1)转化液调至ph2.5,以上柱流速为4.0bv/h进行上样,每隔一段时间取流出的液体进行液相检测,当吸附达到了最高值时,柱子先用去离子水洗涤,再用1.0m的氨水进行洗脱,洗脱速度为2.0bv/h,收集洗脱液,并每隔一段时间进行检测其中所含的l-2-氨基-4(羟乙基甲基磷酰基)-丁酸。洗脱完毕后离子交换柱用去离子水洗涤,并将树脂201×7转化为oh-用于下一次的分离提取。
4)纯化
洗脱液减压蒸馏得黄色粘稠物质,加入甲醇溶解,在冰浴下搅拌,重结晶得白色固体,过滤即得产物l-2-氨基-4(羟乙基甲基磷酰基)-丁酸。
以步骤(1)的反应条件制备转化液1l,经上述分离纯化后,最后得到l-2-氨基-4(羟乙基甲基磷酰基)-丁酸固体0.72g。
实施例4:
在10ml磷酸缓冲液(100mm,ph7.0)中加入实施例2方法制备的湿菌体0.2g,底物2-氨基-4(羟乙基甲基磷酰基)-丁腈终浓度为10g/l,放入水浴摇床30℃,150rpm条件下转化24h。取1ml转化液于ep管中,12000r/min离心2min,取上清进行手性液相检测。同样的反应条件下制备转化液1l,经实施例3的方法进行分离纯化后,得到产物l-2-氨基-4(羟乙基甲基磷酰基)-丁酸3.5g,光学纯度为99.9%。
实施例5:
在10ml磷酸缓冲液(100mm,ph7.0)中加入实施例2方法制备的湿菌体1g,底物2-氨基-4(羟乙基甲基磷酰基)-丁腈终浓度为10g/l,放入水浴摇床30℃,150rpm条件下转化24h。取1ml转化液于ep管中,12000r/min离心2min,取上清进行手性液相检测。同样的反应条件下制备转化液1l,经实施例3的方法进行分离纯化后,得到产物l-2-氨基-4(羟乙基甲基磷酰基)-丁酸4.5g,光学纯度为99.9%。
实施例6:
在10ml磷酸缓冲液(100mm,ph7.0)中加入实施例2方法制备的湿菌体0.2g,底物2-氨基-4(羟乙基甲基磷酰基)-丁腈终浓度为10g/l,放入水浴摇床40℃,150rpm条件下转化24h。取1ml转化液于ep管中,12000r/min离心2min,取上清进行手性液相检测。同样的反应条件下制备转化液1l,经实施例3的方法进行分离纯化后,得到产物l-2-氨基-4(羟乙基甲基磷酰基)-丁酸3.5g,光学纯度为99.9%。
实施例7:
在100ml磷酸缓冲液(100mm,ph7.0)中加入实施例2方法制备的湿菌体5g,底物2-氨基-4(羟乙基甲基磷酰基)-丁腈终浓度为10g/l,放入水浴摇床30℃,150rpm条件下转化48h。取1ml转化液于ep管中,12000r/min离心2min,取上清进行手性液相检测。同样的反应条件下制备转化液1l,经实施例3的方法进行分离纯化后,得到产物l-2-氨基-4(羟乙基甲基磷酰基)-丁酸5.5g,光学纯度为99.9%。
sequencelisting
<110>浙江工业大学
<120>解鸟氨酸拉乌尔菌及其应用
<130>
<160>1
<170>patentinversion3.5
<210>1
<211>1444
<212>dna
<213>raoultellaornithinolytica
<400>1
tgcaagtcgagcggtagcacagagagcttgctctcgggtgacgagcggcggacgggtgag60
taatgtctgggaaactgcctgatggagggggataactactggaaacggtagctaataccg120
cataacgtcgcaagaccaaagtgggggaccttcgggcctcatgccatcagatgtgcccag180
atgggattagctagtaggtggggtaatggctcacctaggcgacgatccctagctggtctg240
agaggatgaccagccacactggaactgagacacggtccagactcctacgggaggcagcag300
tggggaatattgcacaatgggcgcaagcctgatgcagccatgccgcgtgtatgaagaagg360
ccttcgggttgtaaagtactttcagcgaggaggaaggcattaaggttaataaccttagtg420
attgacgttactcgcagaagaagcaccggctaactccgtgccagcagccgcggtaatacg480
gagggtgcaagcgttaatcggaattactgggcgtaaagcgcacgcaggcggtctgttaag540
tcagatgtgaaatccccgggctcaacctgggaactgcatttgaaactggcaggcttgagt600
cttgtagaggggggtagaattccaggtgtagcggtgaaatgcgtagagatctggaggaat660
accggtggcgaaggcggccccctggacaaagactgacgctcaggtgcgaaagcgtgggga720
gcaaacaggattagataccctggtagtccacgctgtaaacgatgtcgacttggaggttgt780
tcccttgaggagtggcttccggagctaacgcgttaagtcgaccgcctggggagtacggcc840
gcaaggttaaaactcaaatgaattgacgggggcccgcacaagcggtggagcatgtggttt900
aattcgatgcaacgcgaagaaccttacctactcttgacatccagagaacttagcagagat960
gctttggtgccttcgggaactctgagacaggtgctgcatggctgtcgtcagctcgtgttg1020
tgaaatgttgggttaagtcccgcaacgagcgcaacccttatcctttgttgccagcgattc1080
ggtcgggaactcaaaggagactgccagtgataaactggaggaaggtggggatgacgtcaa1140
gtcatcatggcccttacgagtagggctacacacgtgctacaatggcatatacaaagagaa1200
gcgacctcgcgagagcaagcggacctcataaagtatgtcgtagtccggattggagtctgc1260
aactcgactccatgaagtcggaatcgctagtaatcgtagatcagaatgctacggtgaata1320
cgttcccgggccttgtacacaccgcccgtcacaccatgggagtgggttgcaaaagaagta1380
ggtagcttaaccttcgggagggcgcttaccactttgtgattcatgactggggtgaagtcg1440
aaca1444
- 还没有人留言评论。精彩留言会获得点赞!