一种MTGase粗酶的纯化方法与流程
本发明涉及一种酶的纯化方法,尤其是一种mtgase粗酶的纯化方法。
背景技术:
谷氨酰胺转胺酶(transglutaminase,简称tgase)是一种催化酰胺转移反应的转移酶,能催化蛋白质分子内与分子间发生交联、蛋白质与氨基酸之间的连接、蛋白质分子内谷氨酰胺基的水解反应,从而直接改变蛋白质本身以及蛋白质所附着的细胞、组织等的结构与功能性质的特性,提高蛋白质的营养价值,生产出满足人们需求的新型蛋白食品。微生物来源的tgase(mtgase)酶活性完全不依赖于钙离子的存在,分子量小,更容易常温保存,而功能上与动物来源的tgase相似,这些性质使得微生物谷氨酰胺转胺酶在工业生产和应用的前景十分巨大。目前《食品安全国家标准食品添加剂使用标准》仅允许茂原链轮丝菌来源的mtgase作为食品酶制剂使用,mtgase作为蛋白质功能改善剂广泛运用在水产品、肉制品、乳制品、豆制品以及烘焙产品中,可改善蛋白质的凝胶特性、乳化能力、持水力、起泡性以及稳定性。
目前mtgase纯化方法一般采用离子交换层析或凝胶柱层析的方法,本领域技术人员利用双水相萃取技术进行酶的纯化时,一般选择peg4000、peg2000、peg1000等分子量较小的peg,萃取时,待纯化的酶都会分配在peg富集的上相,为了使得peg与待纯化的酶分开,需进行反萃取,将待纯化的酶再萃取进盐相(下相),这样使得生产工艺复杂,成本高,存在工艺繁琐、样品回收率低、分离材料和设备昂贵、样品处理量小、单一方法分离纯度低等问题,难以满足生产和应用中的需要。
技术实现要素:
本发明要解决的技术问题是提供一种mtgase粗酶的纯化方法,其纯化简便,纯化分离获得的mtgase纯度较高,回收率高。
为达到上述目的,本发明的技术方案是:一种mtgase粗酶的纯化方法,包括以下步骤:
将mtgase粗酶粉末用水溶解,配制成1-2wt%浓度的mtgase粗酶液;
配制peg/(nh4)2so4双水相溶液形成上层的peg相和下层的盐相;
将mtgase粗酶液与peg/(nh4)2so4双水相溶液混合均匀,20-40℃静置1-2h,mtgase进入双水相体系中的盐相,收集双水相体系中的盐相;
将收集的盐相进行纳滤膜处理,收集纳滤膜处理膜内液获得纯化的mtgase。
优选所述peg/(nh4)2so4双水相溶液的组成为:
peg15-40wt%
(nh4)2so45-20wt%
水50-80wt%。
优选所述peg/(nh4)2so4双水相溶液的组成为:
peg25-30wt%
(nh4)2so47-13wt%
水60-68wt%。
优选所述peg为peg-6000、peg-8000或peg-10000中的任一一种和硫酸铵配合使用,可以达到比较合适的分配系数,使得mtgase的纯化效果较好。
优选将所述mtgase粗酶液与peg/(nh4)2so4双水相溶液混合均匀时,两者的混合的质量比例为1:2-1:5,利于mtgase分散在peg/(nh4)2so4双水相溶液中,使得mtgase的纯化效果较好。
优选所述纳滤膜所用的材料为聚丙烯腈,截留分子量为1kda,纳滤膜具有良好的截留效果,利于mtgase的提纯和浓缩。
优选将收集的盐相进行纳滤膜处理过程中,温度控制在20-40℃,进压2~6bar,出压1~5bar,利于提高mtgase的提纯和浓缩的速度和效率。
本发明配制合适比例的peg和(nh4)2so4在水中能形成两层互不相溶的均相水溶液,运用mtgase和杂质在双水相中的分配系数不同的性质,使得mtgase和杂质分配在不同的相中。经过发明人的研究发现,当所用的peg的分子量大于等于6000,小于等于10000时,亲水性的mtgase酶不再向富含peg相(上相)中聚集,而转向盐相(下相),并且此时的mtgase酶在下相的分配系数也足够满足酶的纯化,酶的纯化效果可以达到电泳纯,回收率达到81.45-92.23%,纯化后的mtgase的酶活力达到5.24-10.87u/ml。再对盐相利用纳滤膜进行过滤处理,在去除盐相中的硫酸铵和小分子杂质的同时,对mtgase溶液进行浓缩,获得较高纯度的mtgase,利于mtgase的应用。
与本领域现有技术相比,本发明利用双水相萃取技术进行酶的纯化时,通过一次萃取就可实现酶纯化,工艺更简单,酶纯度高,酶活回收率和酶活力更高。省略反萃取步骤,也可实现酶的纯化,极大的简化了利用现有双水相萃取技术进行酶纯化的工艺。
附图说明
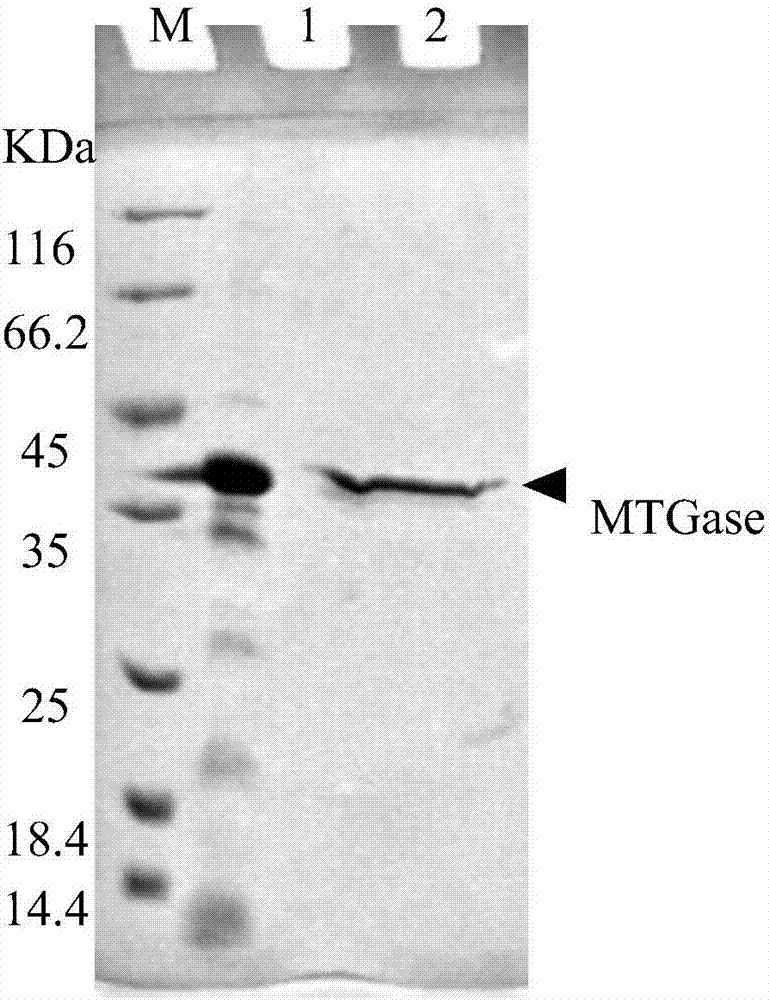
图1是本发明中实施例1中纯化的mtgase的sds-page电泳图;
图2是本发明中实施例2中纯化的mtgase的sds-page电泳图。
具体实施方式
下面结合附图和具体的实施方式对本发明作进一步详细说明。
下面结合实施例,更具体地说明本发明的内容。应当理解,本发明的实施例是示例性的,旨在用于解释本发明,而不能理解为对本发明的限制。实施例中未注明具体技术或条件者,按照本领域内的文献所描述的技术或条件或者按照产品说明书进行。所用试剂或仪器未注明生产厂商者,均为可以通过市购获得的常规产品。
mtgase的酶活力测定方法:取50µl待测溶液于试管中,加入500µl底物溶液,并立即混匀,37±1℃条件下准确反应10min,加入500µl显色溶液终止反应,反应终止后,将反应混合液3000rpm离心10min,取上清,以水作对照,于525nm波长处测定其吸收值,为待测酶液吸收值。以l-谷氨酸-γ-单异羟肟酸为标准品作标准曲线。酶活力单位定义:该酶在37℃时每分钟催化底物生成1µmol的l-谷氨酸-γ-单异羟肟酸所需要的酶量。
实施例1
mtgase粗酶的纯化方法,包括以下步骤:
将mtgase的粗酶粉末用水溶解,配制成2wt%的mtgase粗酶液;
配制peg-6000/(nh4)2so4双水相溶液,组成为:
peg-600027wt%
(nh4)2so413wt%
水60wt%;
peg-6000/(nh4)2so4双水相溶液形成上层的peg-6000相和下层的盐相;
将mtgase粗酶液与peg-6000/(nh4)2so4双水相溶液按照1:5的质量比混合均匀,30℃静置1h,mtgase进入双水相体系中的盐相,收集双水相体系中的盐相;
将收集的盐相泵入纳滤膜设备中处理,所用纳滤膜材料为聚丙烯腈,截留分子量为1kda,温度控制在35℃,进压4bar,出压3bar。收集纳滤膜处理膜内液即为纯化的mtgase。纯化的mtgase的sds-page电泳图见图1所示。从图1中可以看出,mtgase粗酶液的蛋白条带较多,说明mtgase粗酶中含有大量杂蛋白,其中最粗的条带为mtgase。纯化的mtgase为单一条带,对应分子量约为37kda,与茂原链霉菌发酵的谷氨酰胺转胺酶的分子量一致。说明经过本实施例的处理,能够去除mtgase粗酶中的大量杂蛋白,得到纯化的mtgase。mtgase的回收率为90.74%,纳滤膜处理膜内液中mtgase的酶活力为5.24u/ml。
实施例2
mtgase粗酶的纯化方法,包括以下步骤:
将mtgase的粗酶粉末用水溶解,配制成2wt%的mtgase粗酶液;
配制peg-8000/(nh4)2so4双水相溶液,组成为:
peg-1000030wt%
(nh4)2so412wt%
水58wt%;
peg-8000/(nh4)2so4双水相溶液形成上层的peg-8000相和下层的盐相;
将mtgase粗酶液与peg-8000/(nh4)2so4双水相溶液按照1:5的质量比混合均匀,20℃静置1h,mtgase进入双水相体系中的盐相,收集双水相体系中的盐相;
将收集的盐相泵入纳滤膜设备中处理,所用纳滤膜材料为聚丙烯腈,截留分子量为1kda,温度控制在30℃,进压3bar,出压2bar。收集纳滤膜处理膜内液即为纯化的mtgase。纯化的mtgase的sds-page电泳图见图2所示。从图2中可以看出,mtgase粗酶液的蛋白条带较多,说明mtgase粗酶中含有大量杂蛋白,其中最粗的条带为mtgase。纯化的mtgase为单一条带,对应分子量约为37kda,与茂原链霉菌发酵的谷氨酰胺转胺酶的分子量一致。说明经过本实施例的处理,能够去除mtgase粗酶中的大量杂蛋白,得到纯化的mtgase。mtgase的回收率为83.99%,纳滤膜处理膜内液中mtgase的酶活力为10.87u/ml。
实施例3
mtgase粗酶的纯化方法,包括以下步骤:
将mtgase的粗酶粉末用水溶解,配制成1.8wt%的mtgase粗酶液;
配制peg-10000/(nh4)2so4双水相溶液,组成为:
peg-1000025wt%
(nh4)2so420wt%
水55wt%;
peg-10000/(nh4)2so4双水相溶液形成上层的peg-10000相和下层的盐相;
将mtgase粗酶液与peg/(nh4)2so4双水相溶液按照1:3的质量比混合均匀,40℃静置1h,mtgase进入双水相体系中的盐相,收集双水相体系中的盐相;
将收集的盐相泵入纳滤膜设备中处理,所用纳滤膜材料为聚丙烯腈,截留分子量为1kda,温度控制在25℃,进压4bar,出压3bar。收集纳滤膜处理膜内液即为纯化的mtgase。mtgase的回收率为84.36%,纳滤膜处理膜内液中mtgase的酶活力为7.56u/ml。
实施例4
mtgase粗酶的纯化方法,包括以下步骤:
将mtgase的粗酶粉末用水溶解,配制成1.5wt%的mtgase粗酶液;
配制peg-6000/(nh4)2so4双水相溶液,组成为:
peg-600040wt%
(nh4)2so410wt%
水50wt%;
peg-6000/(nh4)2so4双水相溶液形成上层的peg-6000相和下层的盐相;
将mtgase粗酶液与peg-6000/(nh4)2so4双水相溶液按照1:4的质量比混合均匀,30℃静置1h,mtgase进入双水相体系中的盐相,收集双水相体系中的盐相;
将收集的盐相泵入纳滤膜设备中处理,所用纳滤膜材料为聚丙烯腈,截留分子量为1kda,温度控制在30℃,进压5bar,出压4bar。收集纳滤膜处理膜内液即为纯化的mtgase。mtgase的回收率为89.12%,纳滤膜处理膜内液中mtgase的酶活力为6.76u/ml。
实施例5
mtgase粗酶的纯化方法,包括以下步骤:
将mtgase的粗酶粉末用水溶解,配制成1.2wt%的mtgase粗酶液;
配制peg-8000/(nh4)2so4双水相溶液,组成为:
peg-800020wt%
(nh4)2so47wt%
水73wt%;
将mtgase粗酶液与peg-8000/(nh4)2so4双水相溶液按照1:3的质量比混合均匀,40℃静置1h,mtgase进入双水相体系中的盐相,收集双水相体系中的盐相;
将收集的盐相泵入纳滤膜设备中处理,所用纳滤膜材料为聚丙烯腈,截留分子量为1kda,温度控制在40℃,进压6bar,出压5bar。收集纳滤膜处理膜内液即为纯化的mtgase。mtgase的回收率为92.23%,纳滤膜处理膜内液中mtgase的酶活力为8.37u/ml。
实施例6
mtgase粗酶的纯化方法,包括以下步骤:
将mtgase的粗酶粉末用水溶解,配制成1wt%的mtgase粗酶液;
配制peg-10000/(nh4)2so4双水相溶液,组成为:
peg-1000015wt%
(nh4)2so45wt%
水80wt%;
peg-10000/(nh4)2so4双水相溶液形成上层的peg-10000相和下层的盐相;
将mtgase粗酶液与peg-10000/(nh4)2so4双水相溶液按照1:2的质量比混合均匀,20℃静置1h,mtgase进入双水相体系中的盐相,收集双水相体系中的盐相;
将收集的盐相泵入纳滤膜设备中处理,所用纳滤膜材料为聚丙烯腈,截留分子量为1kda,温度控制在20℃,进压2bar,出压1bar。收集纳滤膜处理膜内液即为纯化的mtgase。mtgase的回收率为81.45%,纳滤膜处理膜内液中mtgase的酶活力为5.88u/ml。
尽管上面已经示出和描述了本发明的实施例,可以理解的是,上述实施例是示例性的,不能理解为对本发明的限制,本领域的普通技术人员在不脱离本发明的原理和宗旨的情况下在本发明的范围内可以对上述实施例进行变化、修改、替换和变型。
- 还没有人留言评论。精彩留言会获得点赞!