一种检测鉴定非典型猪瘟病毒(APPV)的PCR引物及检测方法与检测试剂盒与流程
本发明属于生物技术领域,具体地,公开了一种检测鉴定非典型猪瘟病毒(appv)的pcr引物及检测方法与检测试剂盒。
背景技术:
仔猪先天性震颤(congenitaltremorsofpiglet,ct),一般亦被称作“仔猪抖抖病”,是指刚出生仔猪由于脊髓水平以上的中枢神经系统髓鞘形成了阻滞,出现的猪站立时全身性或局部性阵发痉挛的一种疾病。1854年德国首次报道此病,以后世界各地陆续报道了此病。目前为止,该病无有效的治疗措施,大部分发病仔猪以死亡转归或淘汰处理。
2016年,pauloarruda等通过新一代基因测序技术确定致病病原,发现该致病病原与猪的瘟病毒(porcinepestivirus)更为接近,并用仔猪先天性颤抖病料接种怀孕中后期胎儿,成功复制出先天性震颤病例;该病原存在于血清、全血、小脑、大脑、脑干、脊髓、肠系膜淋巴结和支气管淋巴结中。此外,pauloarruda等对美国5个不同的农场中患有先天性震颤仔猪组织提取出的病毒进行基因测序,推定该病毒为“非典型猪瘟病毒”(appv)。而目前,我国关于appv病毒研究进展的报道仍然很少,还尚未有检测鉴定非典型猪瘟病毒的方法或试剂盒。
技术实现要素:
本发明要解决的技术问题是克服现有非典型猪瘟病毒检测鉴定方面存在的缺陷和不足,通过参考比对非典型猪瘟病毒的基因组序列,选择保守的核甘酸序列作为扩增区域,设计了一对检测非典型猪瘟病毒的pcr引物,所述引物能快速、方便、高效地检测鉴定非典型猪瘟病毒,特异性好,灵敏度高。
本发明的目的是提供一种检测鉴定非典型猪瘟病毒的pcr引物。
本发明另一目的是提供利用上述pcr引物来检测鉴定非典型猪瘟病毒的方法。
本发明的再一目的是提供一种检测鉴定非典型猪瘟病毒的试剂盒。
本发明的上述目的是通过以下技术方案给予实现的:
一对检测鉴定非典型猪瘟病毒的pcr引物,所述pcr上下游引物appv-f/r的序列依次如seqidno.1~seqidno.2所示:
上游引物appv-f:5’-ctgccttatgggcggtagaat-3’(seqidno.1);
下游引物appv-r:5’-atcagcaccatgttcttgggat-3’(seqidno.2)。
本发明根据参考与比对genbank中非典型猪瘟病毒基因序列,选择保守的核甘酸序列作为扩增区域,根据非典型猪瘟病毒cap蛋白设计出了一对检测非典型猪瘟病毒基因的pcr引物,通过对该pcr引物的特异性、敏感性和重复性进行试验,证实此引物能用于快速、方便、高效地检测非典型猪瘟病毒,且特异性好,灵敏度高。
所述引物pcr引物可用于检测和/或鉴定猪病样组织中是否含有非典型猪瘟病毒;或用于检测和/或鉴定非典型猪瘟病毒。
一种利用上述pcr引物检测鉴定非典型猪瘟病毒的方法,包括如下步骤:
s1.提取待测样品rna,反转成cdna;
s2.将步骤s1所述cdna为模板,以权利要求1所述引物进行pcr反应;
s3.将扩增产物电泳检测,根据电泳结果判断待测样品中是否含有非典型猪瘟病毒;
优选地,所述pcr的反应体系为:2×taqmastermix10µl,10µmol/lappv-f1µl,10µmol/lappv-r1µl,cdna模板2µl,ddh2o6µl,共20µl。
更优选地,所述2×taqmastermix所含成分浓度为:taqdnapolymerase(recombinant)0.05units/µl,mgcl24mm,dntps(datp,dctp,dgtp,dttp)0.4mm。
优选地,所述pcr反应程序为:94℃预变性5min;94℃变性30s,49℃退火30s,72℃延伸90s,共33个循环;72℃终延伸10min。
优选地,所述电泳检测为取8μlpcr扩增产物,加入含溴化乙锭的1%琼脂糖凝胶中进行电泳,条件为130v,25min。
优选地,所述结果判断的标准为:当pcr产物在1491bp处有明显发亮条带,且阴性对照无同大小条带,则显示为对非典型猪瘟病毒呈阳性反应,即待测样品中含有非典型猪瘟病毒。
上述检测方法在检测和/或鉴定猪病样组织中是否含有非典型猪瘟病毒方面的应用;或在检测和/或鉴定非典型猪瘟病毒方面的应用均在本发明保护范围内。
同时,本发明还提供一种用于检测鉴定非典型猪瘟病毒的试剂盒,所述试剂盒包含上述非典型猪瘟病毒pcr引物。
优选地,所述试剂盒还包含有猪待测样品rna提取及反转录所需试剂和pcr扩增所需试剂。
更优选地,所述试剂包括pcr缓冲液,taqdnapolymerase(recombinant),mgcl2,dntps(datp,dctp,dgtp,dttp),ddh2o。
优选地,所述试剂盒中还包含非典型猪瘟病毒的核酸模板,即阳性对照。
优选地,所述试剂盒还包括阴性对照;所述阴性对照为除去非典型猪瘟病毒之外的其他种类的猪病毒的dna或cdna。
更优选地,所述阴性对照为猪流行性腹泻病毒,猪塞内加谷病毒,口蹄疫病毒,猪德尔塔冠状病毒,猪库布病毒,猪博卡病毒或猪萨佩罗病毒中的一种或多种的cdna。
作为一种可选择的实施方式,所述检测试剂盒的使用方法具体如下:
(1)用rna抽提试剂及反转录试剂对待测样品进行rna抽提后反转录合成cdna;
(2)以步骤(1)的cdna为模板,以本发明所提供的非典型猪瘟病毒pcr引物进行扩增,所述pcr扩增引物为:
上游引物appv-f:5’-ctgccttatgggcggtagaat-3’;
下游引物appv-r:5’-atcagcaccatgttcttgggat-3’
所述pcr扩增反应体系为:扩增反应的总体积为20.0µl,其各种成分分别为:2×taqmastermix10µl,cdna模板2µl,10µmol/l上游引物appv-f1µl;10µmol/l下游引物appv-r1µl,ddh2o加至20.0µl。
所述pcr扩增反应过程为:94℃预变性5min;94℃变性30s,49℃退火30s,72℃延伸90s,共33个循环;72℃终延伸10min。
(3)扩增产物的鉴定:取8μlpcr扩增产物,加入含溴化乙锭的1%琼脂糖凝胶中进行电泳,条件为130v,25min。紫外灯下观察pcr产物,若在1491bp处有明显发亮条带且阴性对照无条带,则显示为对非典型猪瘟病毒呈阳性反应,即待测样品中含有非典型猪瘟病毒。
本发明所提供的非典型猪瘟病毒的检测方法操作简便高效、pcr引物特异性高,便于临床检测和方便开展流行病学调查。所开展的收集广东地区26份疑似仔猪ct病料,进行检测后发现其中22份为阳性,阳性率可达到84.6%。
与现有技术相比,本发明具有以下有益效果:
(1)本发明所述非典型猪瘟病毒检测引物及方法,操作简便、高效、pcr扩增特异性好、灵敏度好,应用于非典型猪瘟病毒的pcr检测中的最低检测浓度限值可达到8.572ng/µl,便于临床检测和方便开展流行病学调查,具有较大的应用前景。
附图说明
图1为非典型猪瘟病毒pcr电泳结果图,泳道从左到右分别为m:2000dldnamarker;1:非典型猪瘟病毒阳性样品;2:空白对照。
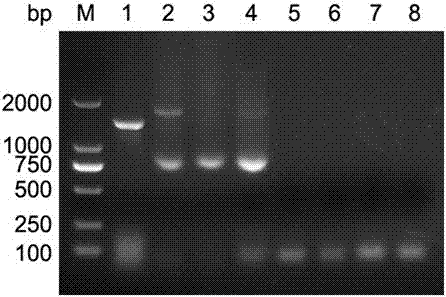
图2为非典型猪瘟病毒pcr引物特异性检测电泳结果图,泳道从左到右分别为m:2000dldnamarker;1:非典型猪瘟病毒;2:猪流行性腹泻病毒;3:猪塞内加谷病毒;4:口蹄疫病毒;5:猪德尔塔冠状病毒;6:猪库布病毒;7:猪博卡病毒;8:猪萨佩罗病毒。
图3为非典型猪瘟病毒pcr引物敏感性检测电泳结果图,泳道从左到右分别为:m:2000dldnamarker;1~7代表10-1至10-7的模板稀释度。
具体实施方式
以下结合说明书附图和具体实施例来进一步说明本发明,但实施例并不对本发明做任何形式的限定。除非特别说明,本发明采用的试剂、方法和设备为本技术领域常规试剂、方法和设备。
除非特别说明,以下实施例所用试剂和材料均为市购。
实施例1非典型猪瘟病毒pcr引物的设计
1、本发明参考与比对genbank中非典型猪瘟病毒基因组序列,选择保守的核甘酸序列作为扩增区域,根据非典型猪瘟病毒的cap蛋白设计了一对检测非典型猪瘟病毒基因的pcr引物;所述pcr引物如下所示:
上游引物appv-f:5’-ctgccttatgggcggtagaat-3’(seqidno.1);
下游引物appv-r:5’-atcagcaccatgttcttgggat-3’(seqidno.2)。
2、经过验证,以非典型猪瘟病毒的cdna为模板进行扩增,结果显示,该引物组能够特异性的扩增检测非典型猪瘟病毒。
实施例2pcr引物检测非典型猪瘟病毒样品
1、rna抽提
(1)取30mg病猪组织于离心管中,加入1mltrizolreagent,匀浆磨碎过后静置5min,在4℃条件下以12,000rpm的离心力高速冷冻离心10min,将离心后的上清液移入新的1.5ml离心管中;
(2)加入0.2ml的氯仿,盖紧离心管盖,剧烈震荡离心管15s,其在15-30℃下孵育2~3min,然后在4℃条件下以12,000rpm高速冷冻离心15min;
(3)离心后混合物分成三层,rna在上层无色的水样层中。将水样层转移到一干净离心管中,加入0.5ml异丙醇混合均匀,在15~30℃下孵育10min,并在4℃条件下以12,000rpm高速冷冻离心10min;
(4)移去上层悬液,加入1ml预冷的75%的乙醇混合后,在4℃条件下以7,500rpm冷冻离心5min;
(5)尽量移除上层悬液,室温放置5min干燥rna,然后加入适量的无rnaase水溶解rna沉淀。
2、cdna的合成使用revertraaceqpcrrtkit(toyobo,osaka,japan),按试剂盒说明书操作,30μl反应体系及程序如下:
总rna3μg
primermix1.5μl
rnasefreeh2o补至30μl
反应液轻轻混合离心,在65℃下变性5min后,迅速放置冰上冷却,然后加入6.0μl5×rtbuffer,1.5μlenzymemix反应液,轻轻混合离心,37℃逆转录反应15min,98℃酶失活反应5min,降温至4℃终止反应。所得cdna产物保存于-20℃冰箱内。
3、使用本发明所提供的扩增引物进行扩增:
上游引物appv-f:5’-ctgccttatgggcggtagaat-3’;
下游引物appv-r:5’-atcagcaccatgttcttgggat-3’
扩增反应体系为:扩增反应的总体积为20.0µl,其各种成分分别为:2×taqmastermix10µl,cdna模板2µl,上游引物appv-f终浓度10µmol/l1µl;下游引物appv-r终浓度10µmol/l1µl;ddh2o加至20.0µl。
pcr反应过程为:94℃预变性5min;94℃变性30s,49℃退火30s,72℃延伸90s,共33个循环;72℃终延伸10min,4℃下保存。
其中所提供的2×taqmastermix所含成分浓度为:
taqdnapolymerase(recombinant):0.05units/µl;
mgcl2:4mm;
dntps(datp,dctp,dgtp,dttp):0.4mm。
4、扩增产物的鉴定:取8μlpcr扩增产物,加入含溴化乙锭的1%琼脂糖凝胶中进行电泳,条件为130v,25min。紫外灯下观察pcr产物,结果如图1所示,在1491bp处有明显发亮条带,且阴性对照无条带,表明该pcr引物对非典型猪瘟病毒呈阳性反应。
5、回收阳性条带后将样品送至基因测序公司进行产物基因测序,根据测序反馈结果与ncbi上的序列进行blast分析比对,确定样品中含非典型猪瘟病毒。所述病毒毒株均由广东温氏集团惠赠。
实施实例3非典型猪瘟病毒pcr引物特异性检测
参考实施实例2中步骤1至步骤3,利用实施例1所述pcr引物对非典型猪瘟病毒、猪流行性腹泻病毒、猪塞内加谷病毒、口蹄疫病毒、猪德尔塔冠状病毒、猪库布病毒、猪博卡病毒和猪萨佩罗病毒分别进行pcr检测。电泳结果如图2所示,所述pcr引物对非典型猪瘟病毒呈阳性反应,而对猪流行性腹泻病毒、猪塞内加谷病毒、口蹄疫病毒、猪德尔塔冠状病毒、猪库布病毒、猪博卡病毒和猪萨佩罗病毒呈阴性反应,说明该引物对非典型猪瘟病毒有着较强的特异性。
实施实例4非典型猪瘟病毒pcr引物敏感性检测
参考实施实例2中步骤1和2抽提并合成非典型猪瘟病毒cdna后,用ddh2o将样品cdna模板按照10-1,10-2,10-3,10-4,10-5,10-6,10-7的稀释浓度进行稀释,按照实施步骤3的方法用实施例1的pcr引物进行pcr检测。电泳结果如图3所示,本发明引物在10-3的模板稀释度上仍然呈阳性反应,表明其敏感性较高。同时,本发明引物最低检测模板浓度为8.572ng/µl。
实施实例5非典型猪瘟病毒pcr检测引物及检测方法的应用
本实施例收集了来自广东省7个猪场共26份疑似病猪样品,采用实施例2所述方法进行非典型猪瘟病毒pcr检测。
试验结果表明,26份样品中有22份呈阳性反应,阳性率高达84.6%,说明本发明所述pcr检测引物可快速、方便、高效地鉴定并诊断非典型猪瘟病毒,且特异性好,灵敏度高,具有较大的应用前景。
- 还没有人留言评论。精彩留言会获得点赞!
- 一种非洲猪瘟病毒检测用酶标板清洗装置的制造方法
- 非洲猪瘟病毒cp530r基因的荧光pcr检测试剂及其制备方法与用图
- 非洲猪瘟病毒、猪瘟病毒和猪繁殖与呼吸综合症病毒的三重荧光rt-pcr检测试剂及其制 ...的制作方法
- 非洲猪瘟病毒cp204l基因的荧光pcr检测试剂及其制备方法与用图
- 非洲猪瘟病毒和猪繁殖与呼吸综合症病毒的二重荧光rt-pcr检测试剂及其制备方法与用图
- 低血清培养st细胞生产猪瘟c株病毒的方法
- 一种非洲猪瘟抗原及其制备的荧光纳米晶试纸条的制作方法
- 非洲猪瘟病毒vp73蛋白特异性多克隆抗体的制备方法及应用的制作方法
- 一种抗非洲猪瘟病毒的特异性IgY抗体及制备方法和用途
- 一种利用间接免疫荧光检测猪瘟活疫苗病毒含量的方法
- 猪瘟病毒抗体竞争AlphaLISA检测试剂盒及检测方法
- 双峰驼源抗猪瘟兔化弱毒疫苗株e2抗原重链抗体vhh和用途
- 用于检测非洲猪瘟病毒抗体的间接elisa试剂盒及其用途的制作方法
- 猪瘟病毒抗体、猪蓝耳病病毒抗体和猪伪狂犬病病毒抗体的elisa检测试剂盒的制作方法
- 一种猪瘟抗体快速金标检测卡的制作方法
- 用于检测非洲猪瘟病毒抗体的竞争elisa试剂盒及其用途的制作方法
- 一种用于检测非洲猪瘟病毒抗体的竞争elisa试剂盒及其用途的制作方法
- 抗非洲猪瘟病毒单克隆抗体的杂交瘤细胞系及其所分泌的单克隆抗体的制作方法
- 一种非洲猪瘟病毒vp73基因的原核表达蛋白及其制备方法
- 一种猪瘟病毒阻断elisa抗体检测试剂盒及应用的制作方法