线粒体靶向测定粘度的荧光探针及其制备方法和应用与流程
本发明涉及一种检测线粒体中粘度的荧光探针及其制备和利用光谱测试、细胞成像等方法检测溶液和细胞粘度,属于有机小分子荧光探针领域。
背景技术:
粘度是衡量一种浓稠流体的流动性和扩散性的主要因素,同时是流体扩散速率的主要参考指标。微环境的粘度在病理学研究中起到非常重要的作用,因为细胞内不同区域具有不同的粘度,粘度的变化往往会影响细胞微环境中各种新陈代谢的进行。当细胞处于病理状态时,细胞内粘度就会发生变化。当细胞内粘度值发生异常变化时,会影响膜结合蛋白活性、抑制胰岛素合成等,导致产生相关疾病。粘度极大地影响细胞质内物质和信号的运输,生物大分子之间的相互作用,以及活性代谢产生的ros和rns在细胞水平上的扩散。
细胞内的粘度在生物系统中起着非常重要的作用,而不同区域粘度的变化会引起相应的生理功能的改变或疾病的发生。线粒体是细胞产生能量的仓库,粘度的改变会降低线粒体膜的流动性,从而增加ros的产生。已被广泛证明,增加线粒体的粘度可能会导致一些疾病,如阿兹海默症,帕金森病,糖尿病等。因此,量化细胞内线粒体粘度十分重要。传统检测粘度的方法有:毛细管粘度计、落球粘度计、旋转粘度计等。但是传统粘度计容易造成样品污染,造成较大测量误差,并且,只能检测血浆粘度,无法实现对细胞或组织样本中粘度的检测。相对传统检测方法,荧光光谱法具有操作简单、响应迅速、空间分辨率高等特点,已经实现在细胞、组织中的实时监控,在生物领域发挥着重要的作用。然而目前能够对线粒体内粘度进行荧光成像的荧光探针还不是很多。因此很有必要开发能够定位到线粒体中,并对线粒体内粘度改变进行荧光成像的荧光探针。
技术实现要素:
针对目前有机小分子荧光探针在线粒体中细胞粘度的检测中存在的问题,本发明通过分子设计,合成了一类具有线粒体靶向的测定粘度的荧光探针。
本发明还提供了一种上述荧光探针的简便制备方法和该探针对溶液和细胞内细胞器微环境中的粘度进行传感检测的应用。
为实现上述目的,本发明采用如下技术方案。
一种线粒体靶向测定粘度的荧光探针,具有如通式(ⅰ)所示的结构:
通式(i)中,
r1-r2各自独立地选自h或c1-4的烷基。
所述的荧光探针选自如下化合物中的一种:
civ1:
civ2:
所述的荧光探针,以咔唑为荧光基团,以氮正离子为线粒体定位基团。
一种上述荧光探针的制备方法,包括以下步骤:
(1)2,3,3-三甲基吲哚,溴乙烷在乙腈中发生取代反应,生成化合物1,反应式为:
(2)咔唑或取代咔唑与4-溴苯甲醛在铜粉存在的碱性条件下在硝基苯中发生取代反应,生成化合物2,反应式为:
(3)化合物1与化合物2在dmf中发生加成-消除反应,生成如通式(ⅰ)所示的化合物,反应式为:
上述制备方法,2,3,3,-三甲基吲哚与溴乙烷摩尔比为2:3;咔唑或取代咔唑与4-溴苯甲醛的摩尔比为1:2;所述碱为碳酸钾,铜粉与碳酸钾的摩尔比为1:9;化合物1与化合物2摩尔比为1:1-1.5。
上述制备方法,步骤(2)中160-200℃加热反应;步骤(2)与步骤(3)反应过程氮气保护。
一种上述荧光探针用于水溶液和生物体系检测粘度的应用,检测包含荧光检测,目视定性检测和细胞成像检测。
上述应用,荧光探针civ1应用于溶液时的激发波长为470nm,应用于细胞时的激发波长为561nm,荧光峰值为628nm;荧光探针civ2应用于溶液时的激发波长为545nm,应用于细胞时的激发波长为561nm,荧光峰值为579nm。
本发明的荧光探针中供电子基团与荧光基团通过单键相连,当荧光探针的分子被光子激发后,电子重新分布的驱动力导致激发态的供电子基旋转,光诱导作用导致电荷完全分离,从而形成扭转的分子内电荷转移态(tict态),此过程不发射荧光或者发光很弱。分子内旋转易受到溶剂粘度的影响,粘度增大,分子内旋转受到限制,用于非辐射跃迁的能量被保留下来进行荧光发射,荧光探针civ随着溶剂粘度的增加,荧光逐渐增强。
本发明具有以下优点:荧光探针的合成方法简单;粘度探针的灵敏性高,靶向性好。随着溶液粘度的改变,用肉眼就可以观察到溶液颜色的变化,伴随着紫外灯下同样可以观察到荧光颜色变化,是一种具有生色传感功能的粘度荧光探针。基于其特异性且显著的颜色变化,该试剂可作为显示水溶液中和生物细胞内粘度变化的指示剂,可进行实时定性及定量的比色法检测。故而,本发明是一种简单,快速,灵敏的粘度特异性检测试剂,在生物分子检测领域具有广阔的应用前景。
附图说明
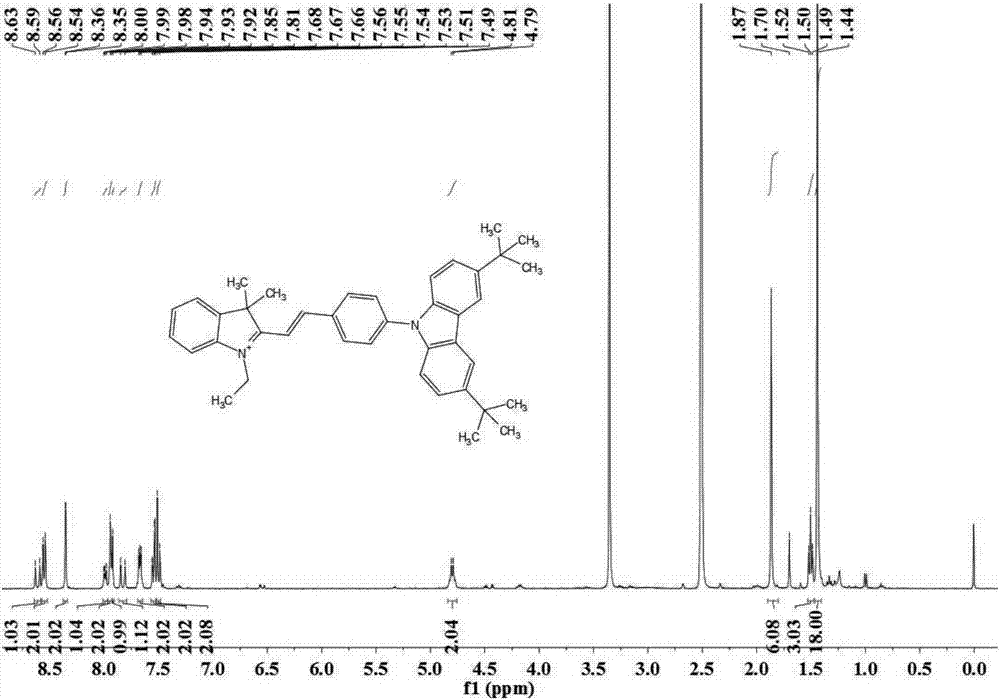
图1是实施例1中荧光探针civ1的1hnmr图谱;
图2是实施例2中荧光探针civ2的1hnmr图谱;
图3是荧光探针civ1和civ2随粘度的增加荧光谱图的变化;
图4是荧光探针civ1和civ2荧光强度与粘度的关系;
图5是荧光探针civ1和civ2溶液分别在不同粘度溶液中颜色的变化;
图6是荧光探针civ1和civ2溶液分别在不同粘度溶液中用紫外灯照射后荧光颜色的变化;图7是荧光探针civ1应用于细胞中进行的粘度荧光成像;
图8是荧光探针civ2应用于细胞中进行的粘度荧光成像。
具体实施方式
下面结合实施例和附图对本发明做进一步说明,但本发明不受下述实施例的限制。
实施例1荧光探针civ1的合成。
荧光探针civ1的合成路线如下:
荧光探针civ1的合成步骤如下:
(1)将2,3,3,-三甲基吲哚(2.0g,12.6mmol,1.0eq),溴乙烷(2.1g,18.9mmol,1.5eq)溶于2ml乙腈中,85℃加热回流反应15h。旋干反应液,减压抽滤,乙醚洗涤,得到化合物1。
(2)将咔唑(1.0g,6mmol,6.0eq),4-溴苯甲醛(2.2g,12mmol,12.0eq),铜粉(64mg,1mmol,1.0eq),k2co3(1.24g,9mmol,9.0eq)溶于10ml硝基苯中,氮气保护,180℃加热回流反应24h。用tcl板检测反应,反应完全后,冷却至室温,用硅胶柱进行分离,硅胶颗粒大小为200-300目,洗脱剂配比为乙酸乙酯/石油醚=1:50,得产物2-1,产率为87%。
(3)将化合物2-1(500mg,1.84mmol,1.0eq),化合物1(540mg,2mmol,1.1eq)溶于6mldmf中,氮气保护,90℃加热回流反应6h,用tcl板检测反应,反应完全后,二氯甲烷萃取2次,饱和食盐水洗涤2-3次,无水硫酸钠干燥。减压旋干溶剂得粗产品,并用硅胶柱进行分离,硅胶颗粒大小为200-300目,洗脱剂配比为甲醇/二氯甲烷=1:20,得产物civ1,产率为47%。1hnmr(400mhz,dmso-d6)δ8.63(d,j=16.3hz,1h),8.58(d,j=8.6hz,2h),8.31(d,j=7.7hz,2h),8.00(dd,j=6.1,3.0hz,1h),7.95(t,j=4.3hz,2h),7.93(s,1h),7.85(d,j=16.4hz,1h),7.71–7.65(m,2h),7.57(d,j=8.2hz,2h),7.54–7.47(m,2h),7.40–7.33(m,2h),4.81(q,j=7.1hz,2h),1.87(s,6h),1.51(t,j=7.2hz,3h).
实施例2荧光探针civ2的合成。
荧光探针civ2的合成路线如下:
荧光探针civ2的合成步骤如下:
(1)化合物1的合成同实施例1。
(2)将咔唑(1.0g,6mmol,1.0eq)和zncl2(2.45g,18mmol,3.0eq)溶于20ml硝基甲烷中,氮气保护,常温下搅拌数分钟后,用注射器将氯代叔丁烷(1.7g,18mmol,3.0eq)注入上述反应体系,常温反应5h。tcl板检测反应,反应完全后,加水淬灭,二氯甲烷萃取2次,饱和食盐水洗涤2-3次,无水硫酸钠干燥。减压旋干溶剂得粗产品,并用硅胶柱进行分离,硅胶颗粒大小为200-300目,洗脱剂配比为乙酸乙酯/石油醚=1:20,得产物3,产率为40%。
将化合物3(1.0g,3.6mmol,6.0eq),4-溴苯甲醛(1.3g,7.2mmol,12.0eq),铜粉(38mg,0.6mmol,1.0eq),k2co3(740mg,5.4mmol,9.0eq)溶于6ml硝基苯中,氮气保护,180℃加热回流反应24h。用tcl板检测反应,反应完全后,冷却至室温,用硅胶柱进行分离,硅胶颗粒大小为200-300目,洗脱剂配比为乙酸乙酯/石油醚=1:50,得产物2-2,产率为37%。
(3)将化合物2-2(450mg,1.2mmol,1.0eq),化合物1(410mg,1.5mmol,1.3eq)溶于2mldmf中,氮气保护,90℃加热回流反应6h,用tcl板检测反应,反应完全后,二氯甲烷萃取2次,饱和食盐水洗涤2-3次,无水硫酸钠干燥。减压旋干溶剂得粗产品,并用硅胶柱进行分离,硅胶颗粒大小为200-300目,洗脱剂配比为甲醇/二氯甲烷=1:20,得产物civ2,产率为44%。1hnmr(400mhz,dmso-d6)δ8.61(d,j=16.2hz,1h),8.55(d,j=8.5hz,2h),8.35(d,j=1.5hz,2h),8.01–7.97(m,1h),7.94(d,j=4.2hz,2h),7.92(s,1h),7.83(d,j=16.3hz,1h),7.69–7.65(m,2h),7.55(dd,j=8.7,1.7hz,2h),7.50(d,j=8.7hz,2h),4.80(d,j=7.1hz,2h),1.87(s,6h),1.50(t,j=7.2hz,3h),1.44(s,18h).
实施例2荧光探针civ1和civ2的荧光强度随粘度的变化。
取实施例1与实施例2制备的粘度荧光探针civ1和civ2分别溶于二甲基亚砜(dmso)中,制成1mmol/l储备液。从储备液中取出100μl加入到10ml的离心管当中,加入不同比例的乙醇:甘油(乙醇:甘油=100:0,90:10,80:20,70:30,60:40,50:50,40:60,30:70,20:80,10:90),配制成不同粘度(3.2,3.7,5.0,9.9,15.0,29.0,56.1,115.2,206.0,317.0mpa·s)的溶液,荧光探针终浓度为10μmol/l;civ1以470nm为激发光,civ2以545nm为激发光测量其荧光性质,荧光光谱如图3所示,其中(a)为civ1荧光图谱,(b)为civ2荧光图谱。以粘度的常用对数为横坐标,以荧光强度的常用对数为纵坐标作图,得图4。由图3及图4数据可知,荧光探针civ1和civ2随着粘度的增加荧光逐渐增强,在3.2-317.0mpa·s粘度范围内,荧光强度与粘度各自取对数呈线性正相关。
实施例3荧光探针civ1和civ2荧光探针对粘度的可视化检测。
从实施例1获得的荧光探针civ1储备液中各取出分别40μl加入到两个5ml的样品管当中,一个加入3ml乙醇,一个加入3ml90%的甘油溶液。对荧光探针civ2进行同样操作。观察到溶液发生明显的颜色变化:civ1的溶液颜色从无色变成浅橙色(图5a),伴随着紫外灯下肉眼可视的粘度荧光探针发出红色荧光(图6a);civ2的溶液颜色从几乎无色变成红色(图5b),伴随着紫外灯下肉眼可视的粘度荧光探针发出红色荧光(图6b)。说明civ1和civ2是一种具有生色传感功能的荧光探针,可通过肉眼进行溶液粘度变化的定性判定。
实施例4荧光探针civ1和civ2对细胞线粒体粘度荧光成像测定。
将本发明荧光探针civ1应用于hela细胞中,利用制霉菌素作为刺激物来改变细胞中线粒体内的粘度,并进行荧光成像,来研究粘度变化前后荧光强度的变化,并成像,进一步说明探针可以应用于细胞线粒体中对其粘度的变化进行荧光成像的应用,得图7,具体操作步骤如下:
(1)将5μm荧光探针civ1的dmso溶液加入到育有hela细胞的培养液中在二氧化碳培养箱中在37度条件下培养30min后,明场成像,得图(a);
(2)上述细胞用共聚焦显微镜进行荧光成像(λex=561nm;λem=570-620nm),得图(b);
(3)将图(a)与图(b)重叠得图(c);
(4)将10μm的制霉菌素加入到育有hela细胞的培养液中在二氧化碳培养箱中在37度条件下培养30min后,加入5μm荧光探针civ1的dmso溶液,并继续孵育30min,明场成像,得图(d);
(2)上述细胞用共聚焦显微镜进行荧光成像(λex=561nm;λem=570-620nm),得图(e);
(3)将图(d)与图(e)重叠得图(f)。
重复上述步骤,不同之处在于,荧光探针为civ2,荧光成像条件为λex=561nm,λem=570-620nm,得图8。
如图7-8所示,正常培养状态下,hela细胞内粘度较小,荧光较弱;加入莫能菌素刺激细胞,得到了更强的荧光,说明细胞粘度增大,探针发光效果增强;利用荧光探针civ1和civ2在细胞内荧光强度变化,能够指示细胞粘度变化。
- 还没有人留言评论。精彩留言会获得点赞!
- 靶向线粒体苝酐荧光探针及其应用的制作方法与工艺
- 一种线粒体靶向pH比率型荧光探针的制备方法和应用与流程
- 线粒体耳聋A1555G突变的荧光定量PCR检测试剂盒及其应用的制作方法与工艺
- 线粒体耳聋T12201C突变的荧光定量PCR检测试剂盒及其应用的制作方法与工艺
- 一种通过光调控精确检测线粒体内铜离子的荧光探针及其制备方法和应用与流程
- 线粒体耳聋A7445G突变的荧光定量PCR检测试剂盒及其应用的制作方法与工艺
- 一种Mn4+激活的红色荧光材料及其制备方法与流程
- 红色荧光体及发光装置的制造方法
- 一种线粒体定位用于光动力疗法的双光子荧光探针库及其应用的制造方法与工艺
- 一种具有线粒体直接靶向效应的荧光探针及其合成方法和应用与流程
- 靶向PD-1的多肽及其应用的制造方法与工艺
- 靶向同位素生产系统的制造方法与工艺
- 在制备68GA‑螯合物官能化的靶向剂中用作金属抑制剂的单糖、二糖或多糖的制造方法与工艺
- 用于引导和靶向按需物质递送的纳米结构的载体的制造方法与工艺
- 通过PROSTRATIN靶向K‑RAS介导的信号转导通路和恶性肿瘤的制造方法与工艺
- 肿瘤靶向核磁共振/荧光双模态成像造影剂及其制备和应用的制造方法与工艺
- pH氧化还原双敏感的PAMAM靶向纳米给药载体及其制备方法与制造工艺
- 具有卵巢肿瘤靶向D构型多肽及其基因递释系统的制造方法与工艺
- 靶向survivin纳米抗体及其制备方法和应用与制造工艺
- 用于PSMA靶向的成像和放射疗法的金属/放射性金属标记的PSMA抑制物的制造方法与工艺
- 阻断UBE2M介导Neddylation修饰在肾细胞癌治疗中的应用的制造方法与工艺
- 无载体共组装肿瘤靶向抗癌纳米药物及其制备方法与应用与流程
- 一种用于判断靶向单克隆抗体治疗肿瘤疗效的预测分子的制造方法与工艺
- 一种靶向CD47的免疫检查点抑制剂药物组合物及其制备方法与流程
- 具有淋巴靶向功能的生物自组装纳米晶注射剂及制备方法与流程
- 用于检测肝癌的基因标志物及其用途的制造方法与工艺
- 特异性shRNA筛选及其靶向Ang‑2基因抑制肺癌细胞的验证方法与流程
- 一种多功能自动化生物细胞提取分离控制系统及采用该系统实现的细胞提取分离方法与流程
- 一种融合蛋白及光敏剂复合物及其制备方法和应用与流程
- 具有可视化和显示光斑边界功能的光动力治疗系统的制造方法与工艺
- 肿瘤靶向核磁共振/荧光双模态成像造影剂及其制备和应用的制造方法与工艺
- pH氧化还原双敏感的PAMAM靶向纳米给药载体及其制备方法与制造工艺
- 具有卵巢肿瘤靶向D构型多肽及其基因递释系统的制造方法与工艺
- 靶向survivin纳米抗体及其制备方法和应用与制造工艺
- 用于PSMA靶向的成像和放射疗法的金属/放射性金属标记的PSMA抑制物的制造方法与工艺
- 一种线粒体靶向的粘度荧光探针及其制备方法和应用与制造工艺
- 一种兼具荧光可视、磁靶向和pH敏多功能的复合空心微球药物载体及其制备方法与制造工艺
- 一种用于修饰微泡的多肽以及靶向GBM的药物制剂的制造方法与工艺
- 白果内酯作为脑靶向增效剂在制备防治脑肿瘤药物的应用的制造方法与工艺
- 机器人辅助精确靶向穿刺软组织目标柔性针夹紧固定装置的制造方法
- 一种用于判断靶向单克隆抗体治疗肿瘤疗效的预测分子的制造方法与工艺
- 一种检测肺癌相关基因热点突变的试剂盒及其应用的制造方法与工艺
- 一种为肺癌提供离体个体化药物测试的方法及培养基与流程
- 一种谷胱甘肽/超声双重刺激响应纳米聚合物囊泡、其制备方法及应用与流程
- 一种多重刺激响应交联型聚合物纳米水凝胶、其制备方法及应用与流程
- 一种靶向CD47的免疫检查点抑制剂药物组合物及其制备方法与流程
- 具有淋巴靶向功能的生物自组装纳米晶注射剂及制备方法与流程
- 用于检测肝癌的基因标志物及其用途的制造方法与工艺
- 特异性shRNA筛选及其靶向Ang‑2基因抑制肺癌细胞的验证方法与流程
- 一种具有靶向功能仿病毒结构高分子囊泡及其制备与应用的制造方法与工艺