一种高纯度P1,P4‑二(尿苷‑5’‑四磷酸)盐的制备方法与流程
本发明属于医药技术领域,具体涉及一种p1,p4-二(尿苷-5’-四磷酸)盐的制备方法。
背景技术:
地夸磷索钠滴眼液是全球获准上市的首个p2y2受体激动剂滴眼液,其作用于结膜上皮及杯状细胞膜上的p2y2受体,通过上调细胞内的钙离子浓度,促进水分及黏蛋白的分泌,从而改善干眼病症状,使泪膜更接近正常状态。另外,本品作为具有诱导排痰作用的去痰剂或肺炎治疗药而期待开发的化合物。本品由参天制药株式会社获得inspire制药公司(默克子公司)授权后开发,于2010年12月在日本上市。地夸磷索滴眼液2015年的销售额约为0.8亿美元。
地夸磷索钠化学名(diquafosoltetrasodium),化学名为p1,p4-二(尿苷5’-)四磷酸四钠盐,由参天制药公司和inspire制药公司联合开发,2010年在日本上市,商品名为diquas。
cn1265114公开了式i的四钠盐(x=na)化合物及其多种制备方法,和本专利相似的方法如下:
该路线采用utp在缩合剂碳二酰亚胺类化合物(实施例采用二环己基碳二亚胺)成环状三磷酸,再和ump在三丁胺下反应得到式i化合物。
cn101495497对上述方法进行改进,utp在缩合试剂下采用镁、锰和铁金属盐作为催化试剂得到环状三磷酸,再和ump反应得到式i化合物。
cn105026414采用ump、utp的活化咪唑基作为原料,采用专利cn1265114的合成方法,避免使用毒性试剂三丁胺得到式i化合物。
以上专利公开了在制备式i化合物中提高反应效率和产品收率的内容,但是对于提高产物纯度方面没有提及,难以制备复核要用要求的p1,p4-二(尿苷-5’-四磷酸)盐。
cn1321163提供了一种式i化合物的纯化方法,依次采用阴离子交换色谱和活性炭色谱纯化得到式i,纯度为至少95%,其中杂质udp、utp约为1%,该纯度在药学上也是不可接受的。
以上专利文献在制备式i化合物的反应液加水淬灭后均需要浓缩后才能进行后续操作,众所周知反应所用溶剂n,n-二甲基甲酰胺,n,n-二甲基乙酰胺、二甲亚砜等都属于高沸点溶剂,沸点均高于150℃,浓缩以上溶剂都需要高真空和较高温度,不可避免的导致了产物发生降解,难以制备出符合药用要求的产品。
技术实现要素:
为了能够获得符合药用要求的p1,p4-二(尿苷-5’-四磷酸)盐,本发明人对其合成工艺进行了大量研究,发现该产品难除的杂质有udp、utp、up5u、up6u。其中utp的残留是反应不充分和高温浓缩水降解产生;udp主要是残留的utp在高温下降解产生;up5u是原料utp和原料杂质udp反应产生;up6u是2分子原料utp自身反应所得。以上杂质通过溶剂结晶法或者阴离子树脂纯化法都很难降低到药用要求。
表1:式i化合物已知杂质列表
另外,本行业技术人员悉知用离子交换法或者活性炭色谱法将会产生含有大量产物和盐的水溶液,而这些水溶液须要在较高温度和较长的时间下才能浓缩至干得到所要的产物,而高温和长时间浓缩极易导致产物发生降解。另外,若是碳酸氢铵盐更会分解为氨气和二氧化碳,由于二氧化碳的溢出远快于氨气,导致浓缩液碱性逐渐增强,又不可避免的加速了产物的进一步降解。
utp:尿苷三磷酸
udp:尿苷二磷酸
ump:尿苷酸
ump-2bu3nh:尿苷酸的三丁胺盐
utp-3bu3nh:尿苷三磷酸的三丁胺盐
up2u:p1,p2-二(尿苷5’-)二磷酸二钠盐
up3u:p1,p3-二(尿苷5’-)三磷酸三钠盐
up5u:p1,p5二(尿苷5’-)五磷酸五钠盐
up6u:p1,p6-二(尿苷5’-)六磷酸六钠盐
本发明人为了确定适合于药用级式i的有效合成方法和纯化工艺进行了深入研究,预料不到发现:通过将市售的utp的钠盐通过阳离子交换树脂制备utp的三丁胺盐dmf溶液,在缩合剂碳二酰亚胺存在下形成环状三磷酸,与同样方法制备的过量的ump三丁胺盐在温和的温度下反应得到式i的粗品溶液,浓缩过滤后,经过阴离子交换树脂和盐的水溶液洗脱得到精品i游离体水溶液,产生的大量水溶液(100g/批式i化合物,水约300l)不经过浓缩,采用加水稀释法使得盐的水溶液浓度降低到0.15mol/l以内,再次经过阴离子树脂(氯型)梯度洗脱,采用高浓度的盐的水溶液一次洗脱出产物,浓缩干得到式i游离基,经过阳离子树脂成式i的钠盐,再通过溶剂精制将单个杂质含量降低到0.1%以下,达到发明目的。
本发明的目的是提供一种高纯度p1,p4-二(尿苷-5’-四磷酸)及其盐的制备方法。
本发明的目的是这样实现的:
本发明的一种p1,p4-二(尿苷-5’-四磷酸)盐的制备方法,将utp与三丁胺反应得到utp的三丁胺盐在极性非质子性溶剂中,经过碳二酰亚胺类缩合剂形成环状三磷酸,再和ump与三丁胺反应制备的ump的三丁胺盐在金属盐存在下反应得到p1,p4-二(尿苷-5’-四磷酸)粗品,经过阴离子交换树脂上样后用盐的水溶液梯度洗脱,洗脱液用水稀释到一定浓度再次通过阴离子交换树脂,用高浓度的盐溶液洗脱出p1,p4-二(尿苷-5’-四磷酸)游离基,成盐制备p1,p4-二(尿苷-5’-四磷酸)的盐。
在本发明的p1,p4-二(尿苷-5’-四磷酸)盐的制备方法中,所述p1,p4-二(尿苷-5’-四磷酸)盐为下述式i所示化合物。
式中盐选自钠、钾的一种。
本发明的p1,p4-二(尿苷-5’-四磷酸)盐的制备方法,包括如下步骤:
a)ump在水中溶解,通过阳离子交换树脂(氢型)离子交换后和三丁胺室温反应得到式ump-2bu3nh,减压浓缩,用亲水性有机溶剂共沸带水,加入极性非质子溶剂保存;
b)utp在水中溶解,通过阳离子交换树脂(氢型)交换后和三丁胺室温反应得到式utp-3bu3nh,减压浓缩,用亲水性有机溶剂共沸带水,加入极性非质子溶剂保存;
c)utp-3bu3nh的极性非质子溶剂的溶液加入碳二酰亚胺类缩合剂温和的温度下反应0.1~5h得到utp-环状三磷酸二三丁胺盐,加入过量的ump-2bu3nh的亲水性有机溶剂溶液和金属盐(可以是氯化镧),在温和的温度下反应1~5h,得到难除杂质很小的式i的反应液;
d)反应液加水淬灭后,一定温度下浓缩式i的反应液,加入水搅拌析晶,过滤除去碳二酰亚胺反应后产生的脲,滤液经过阳离子树脂(氢型)离子交换后得到式i游离基水溶液,加入三乙胺调节ph为中性;
e)式i的三乙胺盐经过阴离子交换树脂(氯型)上样,盐的水溶液梯度洗脱(浓度0~0.35mol/l),收集up5u和up6u单杂小于0.1%的洗脱液;
f)合并洗脱液,加水稀释使得盐的水溶液到一定浓度,再次通过阴离子交换树脂(氯型)上样,采用高浓度的盐的水溶液一次洗脱出产物,得到式i高浓度的水溶液;
g)洗脱液一定温度下减压浓缩得到高纯度式i游离基;
h)浓缩物水溶液通过阳离子交换树脂(钠型)离子交换,浓缩干得到式i钠盐精品,采用醇和水的混合溶剂精制得到高纯度式i钠盐。
在本发明的p1,p4-二(尿苷-5’-四磷酸)盐的制备方法中,所述的金属盐选自锶、钡、锌、镧、铑、铈、铜、铝、镁、锰、铁的盐的一种或多种,优选锶盐、锌盐;其用量为utp物质的量的0.1~5当量,优选2当量。
在本发明的p1,p4-二(尿苷-5’-四磷酸)盐的制备方法中,所述的极性非质子性溶剂为n,n-二甲基甲酰胺、n,n-二甲基乙酰胺、二甲亚砜的一种或多种。
在本发明的p1,p4-二(尿苷-5’-四磷酸)盐的制备方法中,所述的ump与utp的摩尔比为1.1~5.0:1,更优选为2.0~5.0:1。
在本发明的p1,p4-二(尿苷-5’-四磷酸)盐的制备方法中,所述的洗脱的盐选自氯化钠、碳酸氢铵、碳酸钠、碳酸氢钠、氯化铵的一种或多种,更优选为氯化钠、碳酸氢铵。
在本发明的p1,p4-二(尿苷-5’-四磷酸)盐的制备方法中,所述的洗脱的盐的水溶液用水稀释后的浓度为0.001~0.3mol/l,更优选为0.01~0.15mol/l。
在本发明的p1,p4-二(尿苷-5’-四磷酸)盐的制备方法中,所述的高浓度洗脱的盐溶液的浓度为0.5~2.0mol/l,更优选为1.5~2.0mol/l。
在本发明的p1,p4-二(尿苷-5’-四磷酸)盐的制备方法中,所述的式i成盐的方法选自溶剂成盐法或离子交换成盐法,更优选离子交换成盐法。
在本发明的p1,p4-二(尿苷-5’-四磷酸)盐的制备方法中,包括如下步骤:
a)将ump在水中溶解,通过阳离子交换树脂(氢型)离子交换后和三丁胺室温反应得到式ump-2bu3nh,减压浓缩,用二氧六环共沸带水,加入极性非质子溶剂保存,所述极性非质子溶剂选自n,n-二甲基甲酰胺、n,n-二甲基乙酰胺、二甲亚砜的一种或几种混合溶剂;
b)utp在水中溶解,通过阳离子交换树脂(氢型)交换后和三丁胺室温反应得到式utp-3bu3nh,减压浓缩,用二氧六环共沸带水,加入极性非质子溶剂保存,所述极性非质子溶剂选自n,n-二甲基甲酰胺、n,n-二甲基乙酰胺、二甲亚砜的一种或几种混合溶剂;
c)utp-3bu3nh的极性非质子溶剂的溶液加入n,n二异丙基碳二酰亚胺或n,n环己基碳二酰亚胺在15℃~25℃温度下反应0.1~5h得到utp-环状三磷酸二三丁胺盐,加入过量的ump-2bu3nh的亲水性有机溶剂溶液和金属盐,在温和的温度下反应1~5h,得到难除杂质很小的式i的反应液,所述过量的ump与utp的摩尔比为2.0~5.0:1;
d)反应液加水淬灭后,40℃~80℃温度下浓缩式i的反应液,加入水搅拌析晶,过滤除去碳二酰亚胺反应后产生的脲,滤液经过阳离子树脂(氢型)离子交换后得到式i游离基水溶液,加入三乙胺调节ph为中性;
e)式i的三乙胺盐经过阴离子交换树脂(氯型)上样,盐的水溶液梯度洗脱(浓度0~0.35mol/l),收集up5u和up6u单杂小于0.1%的洗脱液,所述的盐为氯化钠或碳酸氢铵;
f)合并洗脱液,加水稀释使得盐的水溶液到0.001~0.15mol/l,再次通过阴离子交换树脂(氯型)上样,采用浓度为1.5~2mol/l的盐的水溶液一次洗脱出产物,得到式i高浓度的水溶液;
g)洗脱液在40℃~80℃温度下减压浓缩得到高纯度式i游离基;
h)浓缩物水溶液通过阳离子交换树脂(钠型)离子交换,浓缩干得到式i钠盐精品,采用醇和水的混合溶剂精制得到高纯度式i钠盐,所述醇选自甲醇、乙醇的一种或其混合溶剂。
与现有技术相比,本发明的p1,p4-二(尿苷-5’-四磷酸)盐的制备方法至少具有以下两个创新点和有益效果:
1.采用过量的ump和utp反应,提高ump反应的竞争性,使得大部分的utp被反应为产物,且避免utp和udp或者和自身发生反应产生up5u/up6u。为此可以有效的降低式i反应液中utp/up5u/up6u,过量的ump会反应成容易除去的up2u,对产物的提纯不产生影响。
2.经过阴离子树脂梯度洗脱得到式i大量的水溶液(100g/批式i化合物,水约300l),不经过浓缩,采用加水稀释法使得盐的水溶液浓度降低到一定浓度,再次经过阴离子树脂(氯型)上样,采用高浓度的盐的水溶液一次洗脱出产物,洗脱水量极大降低,浓缩干得到式i游离基,不仅大大缩短了生产周期,而且避免了由于高温长时间浓缩水导致产物的降解产生杂质。
因此,本发明公开的utp的三丁胺盐使用碳二酰亚胺类缩合剂得到环状三磷酸,再和过量的ump的三丁胺盐合成p1,p4-二(尿苷-5’-四磷酸),经过阴离子交换树脂梯度洗脱后不需浓缩水,稀释后再次阴离子树脂洗脱,成盐精制得到高纯度p1,p4-二(尿苷-5’-四磷酸)及其盐。本发明的方法可以显著缩短生产周期,制备得到药用纯度的产品。
附图说明
图1是式i化合物制备路线图。
图2是实施例5制备的式i反应液三丁胺盐的hplc图。
图3是实施例10制备的式i反应液三丁胺盐的hplc图。
图4是实施例12制备的式i浓缩液的hplc图。
图5是实施例14制备的式i钠盐的hplc图。
具体实施方式
以下通过具体的实施例结合附图来说明本发明。本领域技术人员能够理解,这些实施例仅用于说明本发明,其不以任何方式限制本发明的范围。
下述实施例中的实验方法,如无特殊说明,均为常规方法。下述实施例中所用的试验材料,如无特殊说明,均为常规商购得到。
实施例1:ump-2bu3nh制备
ump的二钠盐208.5g(0.566)加入水1.25l搅拌溶解,水溶液加到阳离子交换树脂(氢型)中,浸泡2h,用水淋洗至无ump流出,合并流出液,加入三丁胺214.8g(1.159mol),室温搅拌1h,60℃减压浓缩干,用二氧六环500ml共沸带水浓缩干,用n,n二甲基甲酰胺2.5l溶解,0℃以内保存备用。
实施例2:utp-3bu3nh制备
utp的三钠盐289.4g(0.526mol)加入水1.25l搅拌溶解,水溶液加到阳离子交换树脂(氢型)中,用水淋洗至无utp流出,合并流出液,加入三丁胺394.8g(2.13mol),室温搅拌1h,50℃减压浓缩干,用二氧六环500ml共沸带水浓缩干,用n,n二甲基甲酰胺2.5l溶解,0℃以内保存备用。
实施例3-9、p1,p4-二(尿苷-5’-四磷酸)的制备
utp-3bu3nh的n,n二甲基甲酰胺溶液25.0ml(5.0mmol)、18.0ml(3.6mmol)、13.5ml(2.7mmol)、10.8ml(2.16mmol)、9.0ml(1.8mmol)、6.75ml(1.35mmol)、5.4ml(1.08mmol),搅拌下加入n,n二异丙基碳二亚胺1.04g,25℃反应2h,分别加入ump-2bu3nh的n,n二甲基甲酰胺溶液25ml(5.4mmol)和1.36g(10.0mmol)氯化锌,25℃反应3h,反应毕,加入20ml水淬灭,65℃减压浓缩至干,加入水100ml搅拌析晶30min,过滤,收集滤液,得到p1,p4-二(尿苷-5’-四磷酸)的三丁胺盐。hplc检测纯度,结果如下表:
表2:ump:utp不同配比下有关物质的变化列表
从上表可以明显看出,随着ump配比的不断提高,难除杂质udp/ump/up5u/up6u都在减少,尤其当ump配比提到到4.0时,utp完全消失,考虑到ump配比的不断提到带来的生产成本的增加和杂质纯化的效果,为此更优选择2.0~5.0的配比,残留的杂质可以在阴离子梯度洗脱和醇水精制基本除去。实施例5有关物质的hplc图如图2所示。
实施例10、p1,p4-二(尿苷-5’-四磷酸)的制备
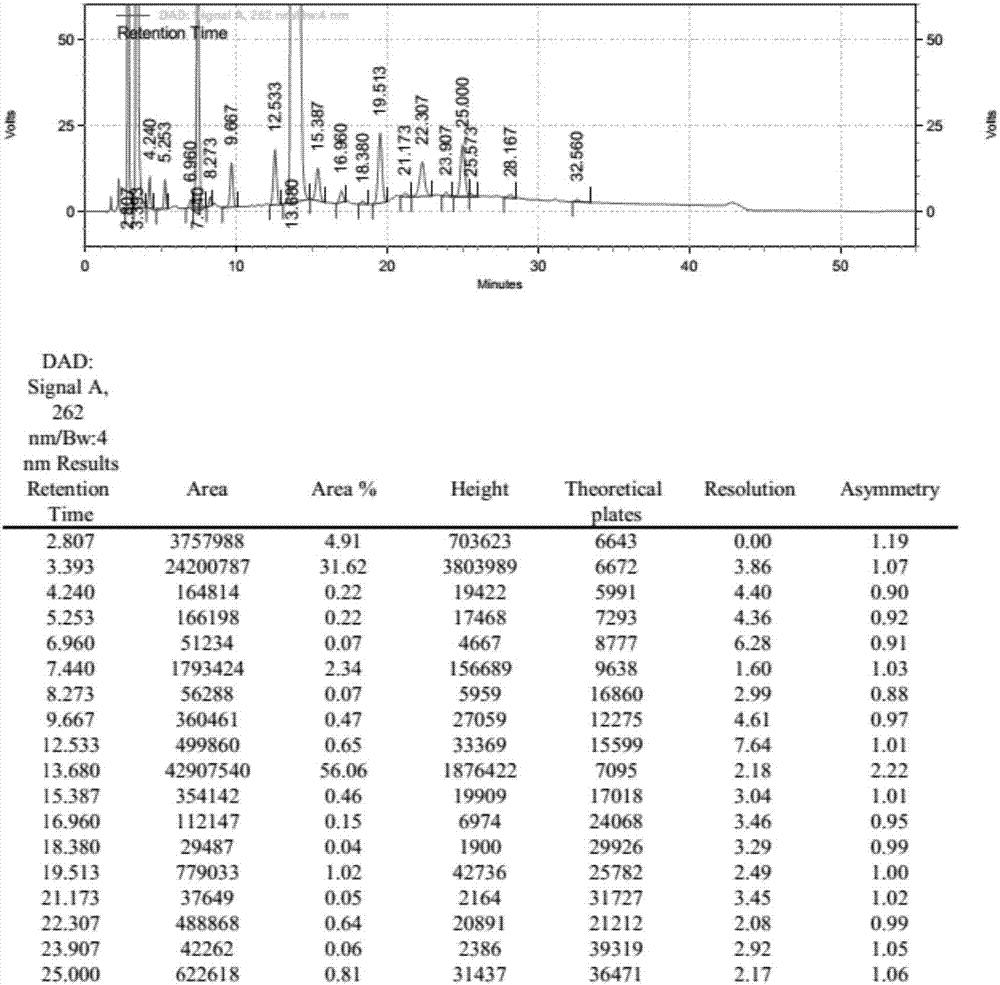
utp-3bu3nh的dmf溶液125ml(25mmol),搅拌下加入n,n二异丙基碳二亚胺9.46g(75mmol),25℃反应2h,分别加入ump-2bu3nh的dmf溶液231ml(50mmol)和13.33g(50mmol)六水氯化锶,25℃反应3h,反应毕,加入50ml水淬灭,65℃减压浓缩至干,加入水250ml搅拌析晶30min,过滤,收集滤液,得到p1,p4-二(尿苷-5’-四磷酸)的三丁胺盐。(hplc测定其杂质含量,其中udp=0.22%;utp=0.47%;up5u=1.02%;up6u=0.64%)
实施例10有关物质的hplc图如图3所示。
实施例11、p1,p4-二(尿苷-5’-四磷酸)的制备
utp-3bu3nh的dmf溶液125ml(25mmol),搅拌下加入n,n二异丙基碳二亚胺9.46g(75mmol),25℃反应2h,分别加入ump-2bu3nh的dmf溶液231ml(50mmol)和4.29g(17.5mmol)氯化镧,25℃反应3h,反应毕,加入50ml水淬灭,65℃减压浓缩至干,加入水250ml搅拌析晶30min,过滤,收集滤液,得到p1,p4-二(尿苷-5’-四磷酸)的三丁胺盐。
实施例12、p1,p4-二(尿苷-5’-四磷酸)的纯化
实施例10的p1,p4-二(尿苷-5’-四磷酸)的水溶液通过阳离子交换树脂(氢型)水洗脱用三乙胺调节ph到中性,水溶液加入到阴离子交换树脂(氯型)上样,用碳酸氢铵水溶液(0~0.35mol/l)梯度洗脱,收集up5u和up6u小于0.1%的洗脱液。
合并洗脱液约15l。加水稀释到碳酸氢铵水溶液浓度低于0.1mol/l,通过阴离子交换树脂(氯型)上样用1.5mol/l碳酸氢铵水溶液约1.5l洗出产物,60℃减压浓缩干。得到一定纯度的式i化合物约13g。
实施例12有关物质的hplc图如图4所示。
实施例13、p1,p4-二(尿苷-5’-四磷酸)的纯化
实施例10的p1,p4-二(尿苷-5’-四磷酸)的的水溶液通过阳离子交换树脂(氢型)水洗脱用三乙胺调节ph到中性,水溶液加入到阴离子交换树脂(氯型)上样,用氯化钠水溶液(0~0.15mol/l)梯度洗脱,收集up5u和up6u小于0.1%的洗脱液。
合并洗脱液约25l,加水稀释到氯化钠水溶液浓度低于0.05mol/l,通过阴离子交换树脂(氯型)上样用2mol/l氯化钠水溶液洗脱产物约2l,60℃减压浓缩干。得到一定纯度的式i化合物约12g。
实施例14、p1,p4-二(尿苷-5’-四磷酸)的成盐精制
实施例12浓缩物加水溶解通过阳离子交换树脂(钠型)成盐,得到一定纯度的式i钠盐,浓缩干,加入90ml水搅拌溶解,室温下加入甲醇180ml搅拌析晶,得到药用纯度的式i钠盐。
实施例15、p1,p4-二(尿苷-5’-四磷酸)的成盐精制
实施例12浓缩物加水溶解通过阳离子交换树脂(钾型)成盐,得到一定纯度的式i钾盐,浓缩干,加入90ml水搅拌溶解,室温下加入乙醇135ml搅拌析晶,得到药用纯度的式i钾盐。
实施例16、p1,p4-二(尿苷-5’-四磷酸)的成盐精制
实施例12浓缩物加入90ml水搅拌溶解,加入醋酸钠3.7g(45mmol)室温搅拌2h,加入甲醇2.88l搅拌析晶,得到药用纯度的式i钠盐。
以上内容是结合具体的优选实施方式对本发明所作的进一步详细说明,不能认定本发明的具体实施只局限于这些说明。对于本发明所属技术领域的普通技术人员来说,在不脱离本发明构思的前提下,还可以做出若干简单推演或替换,都应当视为属于本发明的保护范围。
- 还没有人留言评论。精彩留言会获得点赞!