本发明涉及一种共递送药物和基因的纳米载体,具体涉及一种同时荷载化疗药物和基因药物的共输送分级靶向递药系统,本发明递药系统能够靶向肿瘤细胞并递送基因药物到达细胞质以及将化疗药物递送到线粒体,二者协同触发线粒体途径的凋亡,达到协同治疗肿瘤的目的,属于药物制剂技术领域。
背景技术:
癌症严重威胁着人类健康,单一手段的治疗一般难以达到最佳的疗效。两种或多种治疗途径协同起效,是肿瘤治疗的有效策略之一。化学药物治疗,也称化疗,是目前临床治疗的主要手段。这些抗肿瘤药物多数能直接快速的杀死肿瘤细胞,但是其毒副作用也令人难以忍受,更主要的是长时间使用一些化疗药物还会产生多药耐药,进一步降低治疗效果。线粒体作为介导细胞凋亡的重要细胞器,是抗肿瘤药物重要的治疗靶点。然而作用于线粒体的化疗药物在临床上的疗效一般,原因是由于药物到达线粒体的量太少,以及肿瘤细胞的线粒体上的抗凋亡蛋白抑制这些药物的功能所致。因此,将作用于线粒体的药物靶向递送到线粒体,同时采用基因沉默技术消除抗凋亡蛋白的抑制,可实现化疗和基因治疗的协同作用,从而增强抗肿瘤疗效,降低毒副作用。
rna干扰技术(小干扰rna,sirna)可特异性和选择性地沉默靶基因表达。其机制是外源性双链rna如sirna进入细胞后,在胞质中的rna解旋酶的作用下解链成正义链和反义链,随后反义链再与细胞内的一些切酶或解旋酶等结合形成rna诱导的沉默复合物(risc)。risc与目标基因的mrna同源区特异性结合,在结合部位酶解切割mrna,从而使mrna降解导致相应的基因表达沉默。sirna是约22个碱基对长度的双链核糖核酸序列,呈负电性,易溶于水,具有高效的沉默效应。然而,sirna这种负电性的生物大分子递送到肿瘤细胞内相对很困难,因此,制备合适的载体是有效实现rna沉默功能的关键环节。
目前,传统的化学治疗和sirna基因沉默结合治疗肿瘤已获得极大的关注并取得较好的治疗效果。近年来用于共递送化疗药物和治疗基因sirna的载体,包括无机纳米粒、聚合物胶束、脂质复合物、树状大分子等。这些共递送体系能够实现药物与基因的共载,并且能同时将化疗药物和基因递送到同一个肿瘤细胞内。然而,能否实现将二者在胞内更好地递送到各自的作用位点,这样的协同起效应该是最有效的。因此,设计一种可实现肿瘤细胞靶向以及胞内作用位点靶向并能同时装载药物和基因的递送载体将具有重要的意义。
聚合物壳聚糖-聚乙烯亚胺(cs-pei,cp)是一种生物相容性良好的的非病毒基因载体材料,可有效地保护sirna,并能高效地递送sirna进入细胞,实现目标基因的表达沉默。壳聚糖-聚乙烯亚胺中聚乙烯亚胺具有很多游离的伯胺,这些伯胺不仅能结合负电性的基因药物,同时也能通过化学键与抗肿瘤化疗药物结合,从而可实现化疗药物和基因共载。
技术实现要素:
目的:为了克服现有技术中存在的不足,本发明提供一种共递送药物和基因的纳米载体,该递药系统是可用于协同治疗肿瘤的化疗药物和基因共递送纳米给药系统,涉及一种自组装形成共载药物和基因的纳米共递送系统,本发明的自组装纳米递送系统能够将化疗药物和基因同时递送到靶细胞内,在靶细胞胞质释放基因,化疗药物递送到线粒体;本递送系统中化疗药物和基因能协同触发线粒体途径的凋亡来治疗肿瘤。
技术方案:为解决上述技术问题,本发明采用的技术方案为:
一种共递送纳米载体,由聚合物前药载体tcpl与sirna形成复合物,然后再与多功能聚阴离子聚合物ppx自组装形成共递送纳米载体tcpl-sirna-ppx;
其中,聚合物前药载体tcpl的化学结构式如下:其中,n、y、z为正整数,
多功能聚阴离子聚合物ppx的化学结构式如下:
其中,p、m1、m2为正整数,x为靶向配基,选自叶酸或乳糖酸或rgd。
上述的共递送纳米载体,制备方法包括以下步骤:将sirna溶液在涡旋下加入到等体积的tcpl溶液中,涡旋30s,室温静置30min;然后取与sirna溶液等体积的ppx溶液在涡旋下加入,涡旋30s,室温静置30min,即得共递送纳米载体tcpl-sirna-ppx。
纳米载体粒径范围为100nm-300nm,电位为-15mv-+5mv。可适用于静脉注射给药。
作为优选方案,所述的共递送纳米载体,其特征在于:所述sirna为bcl-2sirna,和/或;所述多功能聚阴离子聚合物ppx溶解于ph7.4的磷酸盐缓冲液形成ppx溶液。
上述的共递送纳米载体在制备用于治疗癌症(特别是子宫颈癌和肝癌等)药物中的用途。
本发明还提供了一种聚合物前药载体tcpl,聚合物前药载体为tpp和氯尼达明分别与pei以酰胺键相连,pei再以席夫碱键与氧化壳聚糖相连,其化学结构式如下:
其中,n、y、z为正整数。
所述聚合物前药载体tcpl的合成方法如下:
其中,聚乙烯亚胺pei的分子量为800-3500。
所述的聚合物前药载体的制备方法,具体包括以下步骤:
1)tpp-cooh的合成:三苯基膦tpp和6-溴己酸以一定比例摩尔比(1:1.0-3.0)投料,溶解于无水乙腈中,氮气保护下反应10-24h,重结晶得到tpp-cooh;
2)取适量tpp-cooh,无水dmso溶解,加入dcc和nhs(摩尔比dcc:nhs:tpp-cooh=1.0-5.0:1.0-5.0:1),室温下搅拌反应6-24h,离心除去沉淀,上清液与含聚乙烯亚胺pei的无水dmso溶液混合,室温下搅拌反应6-24h得反应液;
3)取适量药物氯尼达明lnd,无水dmso溶解,加入dcc和nhs(摩尔比dcc:nhs:lnd=1.0-5.0:1.0-5.0:1),室温下搅拌反应6-24h,离心除去沉淀得上清液,上清液与反应液(tpp-cooh与pei反应)混合均匀,室温下继续搅拌反应6-24h,然后反应液用分子量截留值1000的透析袋透析,先用dmso透析,再用不同体积比(dmso:h2o体积比)的dmso水溶液分别透析1次,每次24h;最后用蒸馏水透析,透析液经冷冻干燥得到tpp-pei-lnd;
4)取适量tpp-pei-lnd,用dmso溶解;氧化壳聚糖的醋酸盐缓冲液(ph4.5)逐滴加入到tpp-pei-lnd的dmso溶液中,4℃反应24-72h,然后用分子量截留值3500的透析袋透析,蒸馏水透析,微孔滤膜过滤,滤液冷冻干燥得到聚合物前药载体tcpl。
本发明还提供了一种多功能聚阴离子聚合物ppx,其特征是聚丙烯酸paa和靶向配基x与两端带氨基的聚乙二醇peg相连,其化学结构式如下:
其中,p、m1、m2为正整数,x为靶向配基,选自叶酸或乳糖酸或rgd。
所述的多功能聚阴离子聚合物ppx,合成路线如下:
其中,聚丙烯酸paa分子量为2000-10000,聚乙二醇peg分子量为1000-6000。
所述多功能聚阴离子聚合物ppx的制备方法具体包括以下步骤:
1)靶向配基x0.1mmol,溶解于na2co3溶液中,然后分别加入0.1-2mmoledc、nhs,搅拌,活化10-60min后,转入到含0.1mmolh2n-peg-nh2的na2co3溶液中,搅拌,室温下反应1-12h;采用分子量截留值1000的透析袋透析,na2co3溶液为透析液,透析至外液中无x为止,再用蒸馏水透析24h,冷冻干燥后得到peg-x;
2)称取适量的聚丙烯酸,溶解于碳酸钠溶液中,加入聚丙烯酸羧基摩尔量4%的edc、nhs,10-60min后,加入peg-x,室温下反应1-12h,透析后冷冻干燥得到多功能聚阴离子聚合物ppx,避光保存。
有益效果:本发明以壳聚糖-聚乙烯亚胺为载体制备成聚合物前药tcpl,与负电性sirna混合,该混合物带正电荷,再通过静电作用与负电性的聚合物聚丙烯酸-聚乙二醇-靶向配基x(ppx)结合形成共递送药物和基因的纳米载体。负电性的外层聚合物ppx,实现ph敏感(paa)、长循环(peg)和主动靶向(x)等多功能化修饰。同时,负电性ppx可屏蔽内核正电荷,降低血液循环时与血浆蛋白的作用,降低毒副作用。外层paa被细胞摄取后,在溶酶体中可酸敏感与内核脱离,tcpl之间的席夫碱键可在酸性条件下断裂,pei可以质子海绵效应破裂溶酶体,在胞质中断裂的tcpl可促进sirna的释放,以及载运药物到达线粒体。
共载药物与基因的纳米载体,由于本身粒径范围为100-300nm,可适用于静脉注射给药。
采用壳聚糖-聚乙烯亚胺装载药物和基因,载体生物相容性良好,可降解,安全无毒。
外层负电性阴离子聚合物使得纳米载体在血液循环过程中内核正电荷被屏蔽,因此减少与血浆蛋白的作用,降低纳米载体被网状内皮系统识别和清除的可能。外层阴离子聚合物的修饰能实现主动靶向等功能化修饰,提高纳米载体在靶细胞的蓄积,提高抗肿瘤效果。纳米载体被靶细胞摄取后,在胞内可释放sirna,并利用主动靶向修饰实现靶向线粒体的功能,两种治疗途径协同作用于线粒体,触发线粒体途径的凋亡,在肿瘤治疗效果上有较大提高。
附图说明
图1是本发明按照实施例2制备的tcpl聚合物的表征:(a)tcpl的氢谱图,(b)tcpl的红外光谱图。
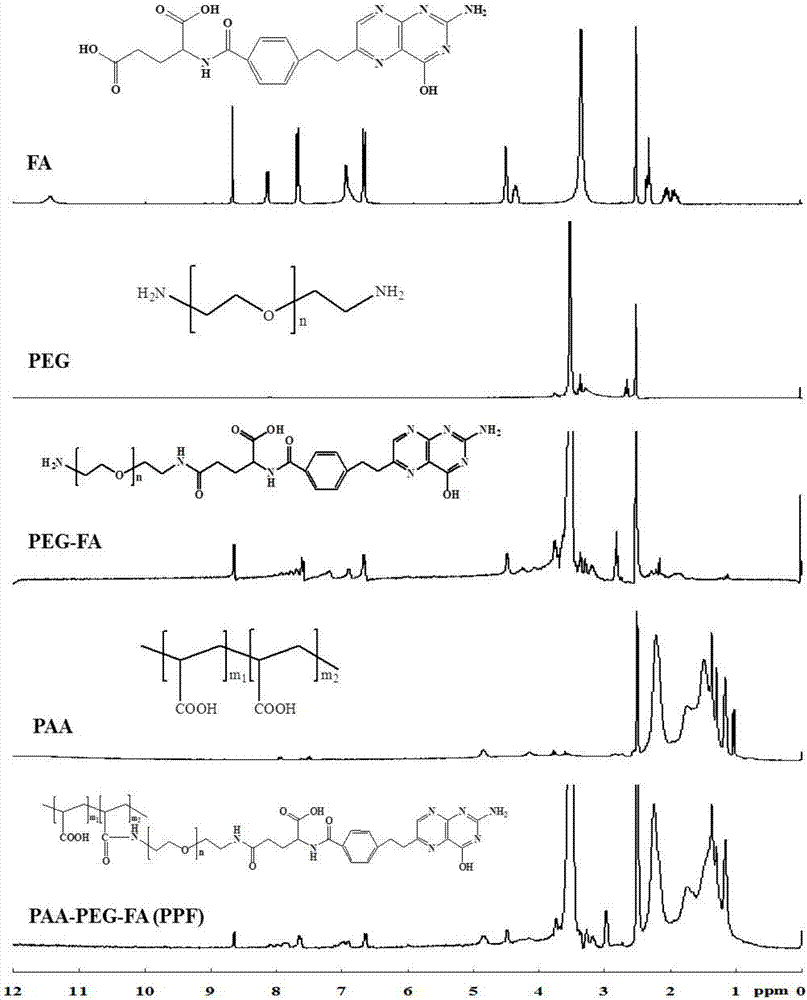
图2是本发明按照实施例4制备的ppx聚合物的氢谱图,以ppx为例,其中f代表叶酸。
图3是本发明按照实施例6的自组装纳米粒的表征:(a)tcpl与sirna以不同质量比制备的复合物凝胶电泳图,(b)tcpl、sirna和ppx以不同的质量比制备的纳米粒的凝胶电泳图,(c)tcpl/sirna复合物(质量比20/1)和tcpl/sirna/ppx纳米粒(质量比20/1/2)粒径和电位图,(d)tcpl/sirna/ppx纳米粒(质量比20/1/2)的透射电镜图(scalebar:1μm)。
图4是本发明按照实施例7的tcpl/sirna/ppx纳米粒的细胞内转运过程:(a)流式细胞仪检测摄取tcpl/sirna/ppx纳米粒的hela细胞(fitc标记tcpl,cy3标记sirna,二者在同一个细胞内),(b)激光共聚集显微镜观察在细胞内线粒体靶头tpp递送载体到达线粒体(fitc显绿色荧光,线粒体用mitotracker染成红色,二者重合区域显示为黄色,scalebar:25μm),(c)激光共聚集显微镜观察在tcpl/sirna/ppx纳米粒进入细胞后在胞内分离(fitc标记载体显示绿色荧光,cy3标记sirna显示红色荧光,scalebar:25μm)。
图5是本发明按照实施例8的体外抑制肿瘤细胞增殖。
图6是本发明按照实施例9的对hela细胞的凋亡结果。
图7是本发明按照实施例10的对hela细胞的线粒体途径凋亡相关蛋白的westernblotting检测。
图8是本发明按照实施例11的体内抗肿瘤药效的肿瘤组织形态图。
具体实施方式
下面结合附图对本发明作更进一步的说明。
本发明是通过以下的技术方案实现的,具体步骤如下:
tcpl聚合物前药的合成方案具体如下:三苯基膦tpp和6-溴己酸反应生成tpp-cooh。三苯基膦引入羧基后,采用dcc和nhs活化羧基,在无水dmso中与聚乙烯亚胺pei反应生成tpp-pei。药物氯尼达明(lnd),采用dcc和nhs活化其羧基,在无水dmso中与tpp-pei反应生成tpp-pei-lnd。氧化壳聚糖的醋酸盐缓冲液(ph4.5)逐滴加入到tpp-pei-lnd的dmso溶液中,反应生成tcpl,透析后冷冻干燥,-20℃放置备用。
x溶解于na2co3溶液中,加入edc和nhs活化x上的羧基,然后与h2n-peg-nh2反应以酰胺键相连形成peg-x。同样,聚丙烯酸用edc和nhs活化其上的羧基,与peg-x上peg另一端的氨基反应形成paa-peg-x(ppx),避光保存。
自组装纳米共递送系统均是新鲜制备,制备方案具体如下:将sirna溶液在涡旋下加入到等体积的tcpl溶液中,涡旋30s,室温静置30min。然后取等体积的ppx溶液在涡旋下加入,涡旋30s,室温静置30min,即得自组装纳米共递送系统tcpl-sirna-ppx。
上述制备方法所制备的自组装共递送药物和基因的纳米载体,所述的纳米载体粒径范围为100nm-300nm,电位为-15mv-+5mv。
上述共递送药物和基因的纳米载体在治疗癌症上的应用。
实施例1
tcpl聚合物前药的合成方案具体如下:三苯基膦(tpp)和6-溴己酸以摩尔比1:1.05投料,溶解于无水乙腈中,氮气保护下反应16h,重结晶得到tpp-cooh。取适量tpp-cooh,无水dmso溶解,加入二环己基碳二亚胺dcc和n-羟基琥珀酰亚胺nhs(摩尔比dcc:nhs:tpp-cooh=1.5:1.5:1),室温下搅拌反应12h,离心除去沉淀,上清液与含pei的无水dmso溶液混合,室温下搅拌反应12h得反应液。取适量lnd,无水dmso溶解,加入dcc和nhs(摩尔比dcc:nhs:tpp-cooh=1.5:1.5:1),室温下搅拌反应12h,离心除去沉淀,上清液与反应液(tpp-cooh与聚乙烯亚胺pei反应)混合均匀,室温下继续搅拌反应12h,然后反应液用分子量截留值1000的透析袋透析,先用dmso透析3次,每次12h;再用不同体积比(dmso:h2o体积比80%、50%、20%)的dmso溶液分别透析1次,每次24h;最后用蒸馏水透析48h,每4h换液一次。透析液经冷冻干燥得到产物tpp-pei-lnd。取适量tpp-pei-lnd,用dmso溶解;氧化壳聚糖的醋酸盐缓冲液(ph4.5)逐滴加入到tpp-pei-lnd的dmso溶液中,4℃反应48h,然后用分子量截留值3500的透析袋透析,蒸馏水透析48h,透析液用0.8μm的微孔滤膜过滤,滤液冷冻干燥得到聚合物前药tcpl,干燥箱放置备用。
实施例2
tcpl聚合物的结构鉴定。
tcpl聚合物通过氢核磁共振和红外光谱来鉴定结构。图1(a),氢谱结果显示:tcpl的氢谱谱图上,化学位移值7.75-7.91ppm为tpp苯环上的氢的特征峰,化学位移值为2.27-2.55ppm是pei上亚甲基的氢的特征峰,化学位移值为5.84ppm是lnd上亚甲基的氢的特征峰,化学位移值为3.71-3.81ppm是氧化壳聚糖糖链上亚甲基的氢的特征峰,上述特征峰均有显示,说明聚合物tcpl的合成成功。
图1(b),红外光谱结果显示:tcpl在1404cm-1有c=n伸缩振动峰,说明有席夫碱键的形成。
实施例3
ppx聚合物合成方案具体如下:以叶酸fa为例。称取fa0.1mmol,溶解于0.1mna2co3溶液中,然后分别加入0.2mmoledc、nhs,搅拌,活化30min后,转入到含0.1mmolh2n-peg-nh20.1mna2co3溶液中,搅拌,室温下反应2h。采用分子量截留值1000的透析袋透析,0.01mna2co3溶液为透析液,透析至外液中无fa为止(紫外检测),再用蒸馏水透析24h。冷冻干燥后得到peg-fa。称取适量的聚丙烯酸,溶解于碳酸钠溶液中,加入聚丙烯酸羧基摩尔量4%的edc、nhs,30min后,加入peg-fa,室温下反应2h,透析后冷冻干燥得到ppx(ppf),避光保存。
实施例4
ppx聚合物的结构鉴定。
ppx聚合物通过氢核磁共振来鉴定结构。图2,氢谱结果显示:在ppx氢谱谱图中,化学位移8.67ppm为叶酸蝶啶上氢的特征峰,化学位移3.53ppm是peg亚甲基上氢的特征峰,化学位移1.02-2.22ppm为paa上亚甲基氢的特征峰,上述特征峰均有显示,说明聚合物ppx的合成成功。
实施例5
tcpl/sirna/ppx自组装纳米共递送系统的制备。
制备方案具体如下:将sirna溶液在涡旋下加入到等体积的tcpl溶液中,涡旋30s,室温静置30min;然后取等体积的ppx溶液在涡旋下加入,涡旋30s,室温静置30min,即得。
实施例6
自组装纳米粒对sirna结合能力考察和纳米粒的表征
纳米粒对sirna压缩和保护能力通过电泳表征。tcpl/sirna和tcpl/sirna/ppx以不同的质量比结合后,加入上样颜料,最后的体积为10μl。被加到2%琼脂糖凝胶中,gelred染色,用tae缓冲液作为电解质,50v下跑40min。
图3(a)-(d),复合物的形貌通过透射电镜观察。取1滴tcpl/sirna/ppx纳米粒滴到铜网上,用1%乙酸双氧铀溶液染色10s。铜网干燥10min中在电镜下观察。
tcpl/sirna/ppx纳米粒的大小和表面电荷使用动态光散射测定。粒径约120nm,zeta电势约-8mv。
实施例7
tcpl/sirna/ppx纳米粒hela细胞摄取和细胞内转运过程
图4(a),细胞摄取采用流式细胞仪分析。hela细胞以每孔1×105细胞/孔接种于24孔板中,37℃培养24h。按照纳米粒制备方法制备fitc-tcpl/cy3-sirna/ppx纳米粒,用不含叶酸的rpmi1640培养基调整至适当浓度。弃去每孔的培养基,加入1ml的样品溶液,继续培养4h。之后弃去样品溶液,用冷pbs清洗3次,每孔用胰酶消化片刻,弃去胰酶,加入适当体积的pbs吹打成细胞悬液,300目尼龙网过滤后,立即进行流式细胞仪检测。结果显示纳米粒能将药物和sirna递送到同一个细胞内。
图4(b)-(c),细胞内转运过程采用激光共聚焦显微镜观察。hela细胞以每孔5×104细胞接种于激光共聚焦用培养皿中,37℃培养24h。含fitc-tcpl/sirna/ppx纳米粒的rpmi1640培养基,加入到培养皿中培养6h时,弃去样品溶液,加入100nmmitotrackerred染色30min。细胞经染色后,弃去染色液,用冷pbs清洗2次,4%多聚甲醛溶液固定20min,进行激光共聚焦显微镜观察。含fitc-tcpl/cy3-sirna/ppx纳米粒的rpmi1640培养基,加入到培养皿中6h,弃去样品溶液,用冷pbs清洗2次,4%多聚甲醛溶液固定20min,进行激光共聚焦显微镜观察。结果显示在细胞内药物靶向递送到线粒体,sirna在胞质释放。
实施例8
细胞毒性
采用mts法分析纳米粒载sirna和氯尼达明对hela细胞增殖抑制的影响。生长状态良好的hela细胞以1×104细胞/孔加入96孔板中,过夜培养后,弃去培养基,分别加入含tcp/siscr/ppx纳米粒、tcp/sibcl-2/ppx纳米粒、氯尼达明、cpl/siscr/ppx纳米粒、tcpl/siscr/ppx纳米粒、tcpl/sibcl-2/ppx纳米粒和tcpl/sibcl-2/pp纳米粒等的培养基,每个样品至少3复孔,以正常细胞作为对照组,只加培养基的为空白组。为使上述各个处理组有可比性,固定lnd浓度为1.31μg/ml,sirna浓度是0.5μg/ml。分别培养24h和72h后,每孔加入20μl的mts溶液,避光37℃振摇4h,酶标仪490nm检测吸光度值(a)。图5,细胞毒性结果显示,氯尼达明和sibcl-2可协同抑制hela细胞的增殖。
实施例9
细胞凋亡
纳米粒诱导细胞凋亡的研究按照annexinv-fitc细胞凋亡检测试剂盒的操作来进行。hela细胞以每孔3×105细胞接种于6孔板中,过夜培养后,每孔分别加入含tcp/siscr/ppx纳米粒、tcp/sibcl-2/ppx纳米粒、氯尼达明、cpl/siscr/ppx纳米粒、tcpl/siscr/ppx纳米粒、tcpl/sibcl-2/ppx纳米粒和tcpl/sibcl-2/pp纳米粒等。为使上述各个处理组有可比性,固定lnd浓度为1.31μg/ml,sirna浓度是0.5μg/ml。培养48h后,pbs清洗2次,每孔加入不含edta的胰酶200μl,吸去后加入1mlpbs将细胞收集到ep管中,2000rpm、4℃离心5min。弃去上清液,每孔加入500μlbindingbuffer重悬。每孔加入5μlannexinv-fitc混匀后,再加入5μlpropidiumiodide,混匀后室温下避光反应10min,并制备相应的单染管。尼龙膜过滤后,立即进行流式细胞仪检测。图6,凋亡结果显示,氯尼达明和sibcl-2可协同增加hela细胞的凋亡率。
实施例10
westernblotting检测线粒体途径的凋亡相关蛋白
纳米粒溶液处理hela细胞48h后,胰酶消化离心,收集细胞。用适量的细胞裂解液(含100μg/mlpmsf)重悬细胞,冰上放置1h,充分裂解细胞。4℃,12000rpm离心10min,取上清,采用bca法检测蛋白含量。蛋白样品按比例加入6×上样缓冲液,100℃加热5min使蛋白变性,取蛋白样品适量加入到上样孔中。电泳后湿法转膜,转完后将膜用1x丽春红染液染5min,5%脱脂牛奶封闭1h。加一抗孵育,一抗(如bcl-2、bax、caspase3、caspase9)分别用5%牛奶封闭液稀释(1:500),4℃过夜。二抗孵育:弃一抗,pbs-t洗膜3次,在室温下脱色摇床上振摇,每次10min。将膜和1%牛奶igg/hrp(二抗)一起孵育,37℃振摇2h。室温下用pbs-t在脱色摇床上洗膜后加入发光显色液,室温作用1min,置凝胶成像仪中拍照。并用凝胶图像处理系统扫描光密度值。图7,结果显示,氯尼达明和sibcl-2可协同触发线粒体途径的凋亡。
实施例11
体内抗肿瘤药效
h22接种于icr雄性小鼠右腋下,待肿瘤长至100mm3时,随机分成7组,每组6只,分别尾静脉注射给药。实验分组分别为:对照组(生理盐水组)、tcp/siscr/ppx组、lnd组(1.05mg/kg)、lnd组(40mg/kg)、tcp/sibcl-2/ppx组、tcpl/siscr/ppx组、tcpl/sibcl-2/ppx组。给药方案:荷瘤小鼠腋下瘤长至100mm3时开始给药,以第一次给药计为第0天,分别于0、2、4、6、8、10、12天给药。给药剂量:sirna0.2mg/kg,氯尼达明1.05mg/kg。治疗结束后,解剖取出肿瘤组织,按照每组排列好,拍照并称重。图8,体内抑瘤结果显示氯尼达明和sibcl-2可协同抑制肿瘤的生长。
以上所述仅是本发明的优选实施方式,应当指出:对于本技术领域的普通技术人员来说,在不脱离本发明原理的前提下,还可以做出若干改进和润饰,这些改进和润饰也应视为本发明的保护范围。