基于环境DNA技术的鱼类自然繁殖监测方法与流程
本发明涉及分子生态学
技术领域:
,特指水体环境dna样品的鱼种浓度分析,具体指一种基于环境dna技术的鱼类自然繁殖监测方法。
背景技术:
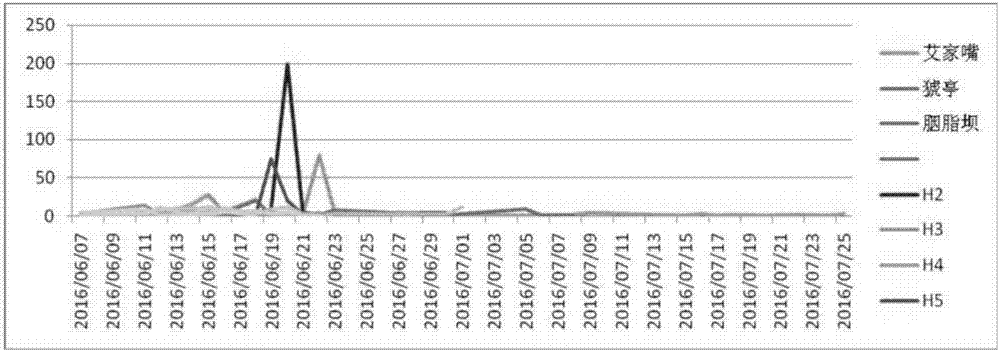
:由于水利工程建设、环境污染和变迁、过度捕捞等原因,长江流域等自然水体中,鱼类种群数量及多样性逐年递减,大坝的建设阻断了洄游性鱼类通道,比如中华鲟由于葛洲坝工程的建立无法上溯至原有产卵场繁殖,在葛洲坝下方形成新的产卵场。比如库区的建立使原本流水型鱼类占主体的鱼类群落结构慢慢演化成以静水鱼类居多的结构组成。根据多年的监测发现三峡大坝建立后,四大家鱼的数量锐减,为了避免大坝对家鱼产生的不良影响,三峡集团组织开展了针对四大家鱼繁殖的生态调度,以卵苗资源量监测方法为主,辅以繁殖群体数量监测及水文监测,评估三峡水库针对家鱼自然繁殖的试验性生态调度效果,试验给出了水温、涨水持续天数、洪峰流量、初始流量、流量涨幅等因素与家鱼产卵行为之间的关系。并通过对河流分段设置固定站位和流动监测点结合观测的的方式,根据捕捞不同发育期的鱼卵和早期发育的鱼苗,结合当时的水温条件,推算出鱼卵(苗)发育所需的时间,然后在根据当时江段平均流速推算出卵(苗)的漂流距离;有时也结合解剖亲鱼及食卵鱼,了解亲鱼性腺发育情况和群众生产经验判定某个产卵场较为准确的位置。上述方法虽然可以监测家鱼产卵行为及定位产卵场范围,但由于不同河流流量差异、水文状况不一,推算出来的产卵场江段存在较大的不确定性。且传统方法劳动强度大,操作难度高,所以,寻找一种能够快速、方便监测鱼类自然繁殖行为的方法是十分必要的。环境dna(环境dna)是指从有机体脱落释放进入到大自然环境中(如空气、水、土壤)的dna,包括细胞中的dna和细胞破碎后游离出细胞外的dna分子。环境dna技术就是直接从水、土壤、沉积物等环境样本中提取dna片段,然后通过pcr和测序等分子生物学检测技术来定性或定量目标产物,从而确定目标生物在该环境中的分布及功能特征的研究方法。jessica等对美国斯塔林湖鲤鱼分布情况及其环境dna做了研究。多年严密的监测研究使其对该湖泊中鲤鱼的分布及密度情况了如指掌,在湖泊22个地点采取表层水、次表面水及沉积物进行鲤鱼dna提取,结果显示,水体样品中鲤鱼分布高密度区的环境dna含量高,反之亦然,而沉积物环境dna则无变化。另外,表层水和次表层水的dna含量并无显着差异,即edna浓度的垂向分布成均匀状态,而在距离目标种十几米到几百米的较小空间范围内edna浓度发生从大到小的明显变化,即edna浓度在水平方向上呈不规律分布状态。其实,edna浓度是否能够准确反应出采样点的种群分布情况与edna的降解密切相关,不同采样点,取样位置受水质、ph值、光照、腐殖质、化学物质等多种因素的影响,其降解速率不同,检测出的edna浓度分布情况也不一样。如上述jessica研究结果显示,鱼类高密度区的edna浓度>低密度区的edna浓度>沉积物的edna浓度,而在pilliod的研究中,不同采样位置检测的edna浓度值并无明显变化。近年来,环境dna技术被广泛应用于鱼类物种鉴定、多样性分析及定量分析中。相对于传统的直接观察法来讲水环境dna的基因鉴定方法在推断水生物种地理分布中更易获得样品,且由于小片段dna可在干燥、冷冻或无光条件下可存在很长一段时间,即使在生物密度很低的情况下,环境dna技术仍有效,且无论水体状态是固定还是流动的情况,这也使得环境dna技术成为生态保护学研究中的一项非常有价值的工具。ddpcr指微滴数字pcr系统,是近期发展起来的一类新兴pcr技术,其荧光信号的产生原理与qpcr相同,微滴发生器可将含有核酸分子的荧光pcr反应体系“分割”成数万个纳米级的微滴,核酸分子在微滴中随机分装,每个微滴或不含待检测核酸靶分子,或者含有至少一个待检核酸靶分子,且每个微滴都是一个独立的pcr反应器。经pcr扩增后,分析仪逐个对每个微滴进行检测,有荧光信号的微滴判读为“1”,没有荧光信号的判读为“0”,从而将荧光模拟信号数字化,最终根据泊松分布原理及阳性微滴的比例,分析软件可直接给出待检靶分子的拷贝数浓度。所以,采用ddpcr方法进行浓度检测是不需要建立标准曲线的,大量实验证明,ddpcr相比于qpcr具有更好的准确性,特别针对物种浓度较低情况下的定量分析。技术实现要素:本发明的目的是克服了上述传统方法的不足,提供一种不依赖鱼种本身,采用鱼类线粒体基因通过ddpcr分析获取目标种dna浓度变化情况,从而判断鱼类自然繁殖行为的方法。为了实现上述目的,本发明提供一种基于环境dna技术的鱼类自然繁殖监测方法,包括以下步骤:步骤1:根据研究水域大小,合理布置采样点,采集水样。步骤2:将上述水样于4℃冷藏保存,并在24h内,采用0.22μm孔径的滤膜进行抽滤,并将滤膜放置-20℃度保存至dna提取。步骤3:采用水样dna提取试剂盒提取dna基因组。所述dna提取试剂盒厂家为waterdnakit(omega)。步骤4:利用qpcr对目的片段进行引物、探针有效性检测,在实验体系内,加入相对应体积的引物、探针、模板dna、rox参比荧光及mix后,与阴性对照、阳性对照一起进行荧光定量pcr扩增。验证引物、探针有效性后,进行ddpcr。步骤5:通过同一采样点监测时间内连续日的样品采集、edna浓度大小分析,初步判断目标种是否发生产卵行为;通过不同采样点同时间的edna浓度大小比较,推测产卵场位置。所述步骤1的采集水样,为不同深度分层采集水样混合后得到的1-2l水体。所述步骤2的抽滤,在水样量较大的情况下,可采用多张滤膜进行抽滤,抽滤后将得到的滤膜周边空余部分减去,以减少反应液的使用量。所述步骤3的dna提取过程中,将每张剪边滤膜沿中心线剪成4个面积相同的扇形后,加入装有反应液的离心管中,置于超声波仪器中超声处理,且整个超声过程对离心管进行间断涡旋,以便最大限度的获取滤膜上的dna,然后根据试剂盒步骤进行dna提取。具体步骤为:将剪好的滤膜,放入50ml离心管中,加入反应液,置于kq5200e型超声波清洗仪器(超声功率400w)中进行超声处理,超声过程中根据具体粘附情况不定时的将附着物较多的滤膜离心管放在涡旋振荡器上进行涡旋,以便最大限度的获取滤膜上的dna,超声处理直至滤膜上的附着物全部进入反应液中,整个超声处理过程不加热。所述步骤4中,qpcr反应体系为20μl,dna模板2μl,引物、探针、rox各0.4μl,taqpremix10μl,ddh206.4μl;pcr扩增条件为:94℃3min预变性,94℃15s变性,60℃30s退火延伸,40个循环。ddpcr扩增反应体系为20μl,其中dna模板2μl,引物1.8μl,探针0.5μl,taqpremix10μl,rnase/dnase-freewater3.9μl;将配置好的20μlpcr反应液,转移至微滴发生卡(dg8cartridge)sample孔中,再加入70μl微滴油至oil孔中,利用qx2000微滴式数字pcr仪的微滴生成器制备反应微滴;将制备好的反应微滴分别转移至96孔pcr反应板中对应的反应孔中,用铝膜热封(180℃,5sec)后,于普通pcr仪扩增,其扩增条件为:95℃5min预变性,95℃30s变性,60℃1min退火延伸,40个循环,98℃10minhold。本发明有益效果:本发明家鱼在合适的水温条件下,会首先聚集在产卵场范围,然后待适宜涨水条件下发生产卵,这种自然的聚群、产卵行为会增加释放到水体中的家鱼dna,这种dna浓度的变化是本发明所采用技术用以反应家鱼产卵行为和定位产卵场的基础。由于家鱼集群产卵行为仅持续较短一段时间,且长江干流水体流动性较强,流场变化复杂,家鱼edna分散速度较快被采集到的几率降低,那么以多年传统监测得到的家鱼产卵时间为标准的实时采样,不仅可以避免dna降解带来的结果偏差,而且一旦样品中可以检测到dna,从理论上讲也可较好的反应距离采样点较近的种群密度在采样时间段的分布情况,即采样时间段edna浓度高的位置,物种分布密度较大,反之亦然。1、该方法不依赖于鱼种的捕获,只需在目标水体一定范围、时间内进行水样采集即可快速、简便的获取目标种信息。对于一些珍稀特有鱼类及较难捕获的鱼种,该方法也较传统捕捞调查更为有效。2、利用ddpcr进行定量分析,无需制作标准曲线,简化定量实验操作步骤,且相比于传统的qpcr,ddpcr具有更高的检测灵敏度,对于一些珍稀特有鱼类在浓度很低的情况下一样可以进行浓度检测。3、通过qpcr验证引物、探针有效性后,采用ddpcr对水样进行扩增,每个样品不需重复测定。4、由于家鱼在产卵期间释放到水体中的dna高出平时聚群不发生产卵时很多,通过同一采样点监测时间内连续多日的样品采集、分析edna浓度大小可初步判断家鱼是否发生产卵行为。5、由于家鱼在产卵前会在产卵场范围发生聚群行为,那么产卵场范围所采水样的家鱼edna浓度会高于其他采样点。通过不同采样点同时间的edna浓度大小比较,可推测产卵场位置。附图说明图1为本发明在庙嘴码头至后江沱约36公里范围内,三峡水库2016年第一次调度期间家鱼edna连续5天的的日均总浓度;图2为本发明在庙嘴码头至后江沱约36公里范围内,三峡水库2016年第一次调度期间连续5天每个断面的家鱼edna浓度;图3为本发明在庙嘴码头至后江沱约36公里范围内,三峡水库2016年第二次调度期间家鱼edna连续4天的的日均总浓度;图4为本发明在庙嘴码头至后江沱约36公里范围内,三峡水库2016年第二次调度期间连续4天每个断面的家鱼edna浓度;图5为本发明监测期间第六个断面(宜都)四大家鱼鱼卵密度变化过程;图6红花套站点分布;图7红花套(去除h1)11个站点的监测数据。具体实施方式下面结合实施例来进一步说明本发明,但本发明要求保护的范围并不局限于实施例表述的范围。实施例1三峡水库2016年第一次调度时(2016年6月8日-12日)家鱼的自然繁殖情况。1、样品采集根据多年传统调查结果,在宜昌庙嘴码头至后江沱约36公里范围江段内,设置6个断面采集水样,每个断面设置左、中、右三个采样点,每个采样点分别采取不同深度水层进行混合的水样2l,并与4℃培养箱中保存。采样点具体地理位置见表1。2、dna提取将上述水样在24h内,通过孔径0.22μm的脂溶性滤膜真空抽滤,根据多次预实验比对,每升水体宜采用1张滤膜,故将过滤好的2张滤膜放入50ml离心管中-20℃保存备用。采用专业的水样dna提取试剂盒thewaterdnakit(omega)对上述滤膜进行dna提取。提取前先将滤膜周边空白部分剪掉,以使反应液充分浸泡滤膜,将每张滤膜沿中心线剪成4个扇形,放入50ml离心管中,加入3mlslx反应液和500mg微型玻璃珠,涡旋3分钟或至反应液均匀布满滤膜,放入超声仪进行超声波处理,期间间断涡旋离心管,以使滤膜上粘有的dna充分溶解在反应液中,之后根据试剂盒说明书的步骤进行dna提取,将提取好的dna-20℃保存备用。表1不同断面采样点的具体地址位置3、ddpcr扩增首先将设计好的引物、探针在qpcr上用鱼体或浓度较高的样品进行有效性验证后。引物序列为:sequencelisting1:both2-f(qpcr)5’-ggccggaacaggatgaacagtt-3’sequencelisting2:both2-r(qpcr)5’-taatagttgtggtgatgaagttaattg-3’探针序列为:sequencelisting3:probe25’-fam-cacgcaggagcatccgtagacct-bhq-3’qpcr扩增反应体系为20μl,其中dna模板2μl,引物、探针、rox各0.4μl,tappremix10μl,ddh206.4μl;扩增条件为:94℃3min预变性,94℃15s变性,60℃30s退火延伸,40个循环。ddpcr扩增反应体系为20μl,其中dna模板2μl,引物1.8μl,探针0.5μl,tappremix10μl,rnase/dnase-freewater3.9μl;扩增条件为:95℃5min预变性,95℃30s变性,60℃1min退火延伸,40个循环,98℃10minhold。扩增的目的片段序列为sequencelisting4:ggccggaacaggatgaacagtttacccgccactcgcgggtaatcttgctcacgcaggagcatccgtagacctaacaattttctccctccacttagcaggtgtatcatcaattttaggggcaattaacttcatcaccacaactatta4、浓度分析根据ddpcr的实验结果,得知每个样品包含的目标种拷贝数,见表2,其推算的家鱼日均edna总浓度见图1,每个断面的家鱼edna浓度见图2。比较监测时间内6个断面家鱼edna日均总浓度变化情况,可知,第一次生态调度第五天时家鱼环境dna含量发生大量增长,与前几日的edna浓度方差分析呈显著性差异,判定此次调度期间家鱼发生产卵行为,且未发生产卵前家鱼的edna浓度基数较小。比较同一天每个断面的家鱼dna浓度值,可知最大浓度值发生在第五天第四个断面。另外,每个断面dna浓度值比较发现第四、五个断面较其他断面浓度值高,由于水体流动方向为断面一至断面六,所以判定断面四附近为产卵场位置。表2第一次调度期间检测到的家鱼dna拷贝数实施例2:三峡水库2016年第二次调度时(2016年6月19日-22日)家鱼的自然繁殖情况,方法步骤与实施例一相同,表3为6个断面18个采样点连续4天时间ddpcr定量分析得到的家鱼dna拷贝数,其日均总浓度见图3,每个断面的浓度见图4。表3.第二次调度期间检测到的家鱼dna拷贝数根据ddpcr的实验结果,得知每个样品包含的目标种拷贝数,比较监测时间内6个断面家鱼edna日均总dna浓度变化情况,可知,第二次生态调度第一天时家鱼环境dna含量最大。比较同一天每个断面的家鱼dna浓度值,可知最大浓度值发生在监测第一天第四个断面。判定此次调度期间家鱼发生产卵行为,且判定断面四附近为产卵场位置为了验证环境dna方法是否可以准确的判定鱼类繁殖行为,监测期间内在第六个断面同时设置了传统卵苗捕捞点每日9:00,16:00放置一张表层弶网采取卵苗约1小时,将采集到的卵苗以大小、透明度、色泽进行简单分类,将疑似家鱼的卵苗带回室内培养至可分辨期,同时记录当日的流量、江水流速、断面流速等指标,用于卵苗密度及资源量统计。同时,使用声纳探测设备在产卵场进行走航式探测,通过对回声信号的分析判断四大家鱼繁殖亲鱼数量及信号分布。早期资源结果显示自2016年5月30日起开始采集到四大家鱼鱼卵,宜都断面鱼卵密度和径流量日变化过程见图5,可知在6月5日、12日及21日出现了3次产卵高峰期,产卵时间主要集中在5月下旬至6月份,7月份则基本无大的卵汛高峰。edna监测期间采集的四大家鱼鱼卵密度与相同断面edna浓度如表4所示,通过鱼卵密度与edna浓度间的相关性分析,可知,第六个断面采集的鱼卵密度与该断面检测到的edna浓度呈极显著相关(p=0.0071<0.01),说明edna浓度可以很好的反应出采样点较近距离内的家鱼密度分布情况,高密度区的edna浓度较大,低密度区的edna浓度较小。声纳监测站点布置如图6所示,结果如图7所示,在红花套站点中h2、h5两个站点在18-20日监测到大量鱼群,这与环境dna监测显示的较高dna浓度值发生的时间(6月19日)及地点(第四及第五断面)相吻合。该方法根据ddpcr检测的浓度结果,判定在两次调度期间的6月12日、6月19日左右均发生了家鱼产卵行为,且初步判断产卵场位于第4个断面附近。与此同时,从上述传统的卵苗捕捞调查中,可以得知两次调度期间6月12日、6月20及21日均出现了卵汛高峰;另外,声纳走航探测发现家鱼亲鱼在调度期间较多的聚集在第四、第五个断面附近,证明了该发明方法的有效性。所以,综上所述,基于环境dna的鱼种浓度监测方法可以有效的反应家鱼的自然繁殖情况。表4edna监测期间家鱼卵苗密度与浓度值时间6-86-96-106-116-126-196-206-216-22卵苗密度(a/m3)5.191.531.639.1658.1800.6243.7419.1edna浓度(copies/μl)108.738.721.971.35735.7653394.3801.71677.3尽管本发明的实施方案已公开如上,但其并不仅仅限于说明书和实施方式中所列运用,它完全可以被适用于各种适合本发明的领域,对于熟悉本领域的人员而言,可容易地实现另外的修改,因此在不背离权利要求及等同范围所限定的一般概念下,本发明并不限于特定的细节和这里示出与描述的实施例。。sequencelisting<110>中国长江三峡集团中华鲟研究所<120>基于环境dna技术的鱼类自然繁殖监测方法<130>2015<160>4<170>patentinversion3.5<210>1<211>22<212>dna<213>asiancarps<400>1ggccggaacaggatgaacagtt22<210>2<211>27<212>dna<213>asiancarps<400>2taatagttgtggtgatgaagttaattg27<210>3<211>23<212>dna<213>asiancarps<400>3cacgcaggagcatccgtagacct23<210>4<211>146<212>dna<213>asiancarps<400>4ggccggaacaggatgaacagtttacccgccactcgcgggtaatcttgctcacgcaggagc60atccgtagacctaacaattttctccctccacttagcaggtgtatcatcaattttaggggc120aattaacttcatcaccacaactatta146当前第1页12
相关技术
网友询问留言
已有0条留言
- 还没有人留言评论。精彩留言会获得点赞!
1