整合素胞内多肽序列在抑制新生血管形成中的应用的制作方法
本发明涉及三种基于整合素β亚基胞内保守序列的多肽化合物及其效应分子能够有效地在体内体外阻断新生血管形成并具有抑制小鼠皮下实体瘤生长的作用。
背景技术:
整合素是位于细胞表面的一类重要的细胞黏附分子,由α和β两个亚基通过非共价键连接而成的跨模异二聚体糖蛋白受体。整合素在人体内分布广泛,几乎所有不同组织的细胞上都表达有一种或几种整合素分子。在脊椎动物中,目前发现有18个α及8个β亚基,α亚基和β亚基的不同组合共形成24个α/β整合素异二聚体。整合素与肿瘤的发生、发展密切相关,其通过调节内皮细胞的分化、黏附、迁移及存活,参与新生血管的形成和血管网络的构建。肿瘤血管生成离不开血管内皮细胞与细胞外基质黏附,并借此侵入血管周围间质,然后通过细胞-细胞的黏附作用促进血管条索的形成。作为内皮细胞和细胞外基质(ecm)连接的桥梁,血管内皮细胞中的整合素在肿瘤新生血管形成中起重要的作用。
整合素αvβ3是目前研究较为深入的整合素家族成员,并参与肿瘤新生血管形成。其在休眠的内皮细胞中低表达,但在多种肿瘤细胞及肿瘤新生血管内皮细胞中表达量明显增加。研究显示,通过胞外抑制αvβ3的功能,可诱导新生血管内皮细胞凋亡,抑制肿瘤新生血管的形成,促使肿瘤细胞凋亡,达到抗肿瘤的目的,而这个过程并不会对正常组织的血管造成不良影响。因此,整合素αvβ3成为理想的抑制肿瘤及肿瘤血管生成的靶点。
以阻断整合素与其胞外配基结合为靶点的抗肿瘤新生血管形成药物主要分为以下几类:(1)整合素抗体类药物;(2)含有与整合素有高亲和力结合序列的多肽类小分子化合物,其中以含rgd序列(精氨酸-甘氨酸-天冬氨酸)的小分子多肽最为典型;(3)整合素为靶点的其他类药物等。其中一部分药物已显露出良好的抗血管新生和抗肿瘤作用,并已进入临床研究关键阶段(例如,抗体类vitaxin[1,2],多肽类cilengitide[3-5])。
通过阻断整合素信号通路抑制肿瘤的发生发展,因研究领域内一些不一致的研究数据,尚存争议。例如,β3型整合素缺失的小鼠反而促进体内肿瘤的生长[6];还有,低浓度的整合素抑制剂rgd拟肽cilengitide对小鼠体内血管新生和肿瘤生长反而具有促进作用[7,8]。另外,来自于emd/merck公司研究开发的cilengitide是基于阻断整合素αvβ3和αvβ5胞外配体结合位点开发的新型治疗恶性胶质瘤的药物,但经大规模临床试验后并未达到预期效果[9]。这些发现增加了以整合素-配基结合为靶点药物的功能不确定性。
整合素可介导双向信号传导,并且整合素与胞外配基的结合受到整合素胞内序列的精确调控。整合素α/β亚基胞内序列较短(除β4外),自身也不具有酶活性,但其在整合素双向信号传导中起着重要作用,尤其是β亚基(β4和β8除外)胞内的保守序列,如两个nxxy/f区域[10],它们可分别识别结合多种胞内信号和细胞骨架蛋白分子。比如,talin可与β亚基胞内段近膜区npxy序列结合,是整合素激活的关键调控因子;另外kindlin蛋白家族分子可与整合素β亚基胞内区远膜端nxxy/f相互结合,并协同talin诱导整合素的激活[11-13]。此外,研究还发现整合素β3亚基胞内远膜端nxxy序列(nity)还能够识别结合β3-endonexin。
kindlin家族包含3个家族成员,分别是kindlin-1,kindlin-2和kindlin-3。它们在激活整合素中发挥重要作用,在不同的细胞中参与整合素介导的细胞迁移、黏附等多项生物学功能。kindlin蛋白表达异常还可以导致多种遗传疾病的发生,在相关人类疾病和试验小鼠模型中都得到验证[14]。β3-endonexin是一个含111个氨基酸的多肽,已知是β3型整合素胞内序列的结合因子,但并不与β1、β2型整合素胞内序列结合[15,16]。目前,β3-endonexin是否参与β3型整合素的激活调控尚不明确。kindlin与β3-endonexin均在血管内皮细胞中表达[17-21]。
我们的前期研究发现kindlin-2参与整合素αvβ3介导的血管内皮细胞的粘附与迁移,并且在斑马鱼与小鼠体中具有促进新生血管形成的功能[17,20]。有一项研究表明,低氧条件下β3-endonexin通过hif途径起到抑制血管新生的作用,过量表达β3-endonexin可降低低氧诱导的hif-1αmrna水平,抑制了hif的激活,进而抑制内皮细胞形成新生血管的过程[22]。因为kindlin-2与β3-endonexin都参与调控血管新生且均与β整合素c末端nxxy序列结合,所以我们推测包含整合素β胞内段c末端nxxy序列的多肽化合物可能具有调控新生血管形成的功能。据此,我们设计了6种含有不同整合素β亚基胞内保守序列的衍生穿膜多肽化合物(mβctps),每一种都包含一个整合素β亚基c末端的nxxy/f序列,并评估了其在体内和体外抗血管形成的能力,最终发现了有些整合素β亚基胞内功能序列可通过与β3-endonexin相互作用而抑制新生血管形成,从而揭示了开发新一代抗新生血管形成的新型靶位点。
技术实现要素:
本发明的目的之一在于提供了基于整合素β亚基胞内保守区域的功能多肽化合物氨基酸序列。
本发明的目的之二在于提供多肽衍生化合物(mβ3ctp,mβ5ctp,mβ6ctp)能够抑制体外人脐静脉内皮细胞形成血管状结构;抑制裸鼠皮下接种基质胶中血管的生成;并对裸鼠皮下接种实体瘤的生长有不同程度的抑制作用。并且,功能试验揭示这些具有抗新生血管形成功能的整合素β亚基胞内段序列可通过结合效应蛋白因子β3-endonexin而发挥作用。
为阐明上述目的,本发明采用如下技术方案:
三种基于整合素β亚基胞内保守序列的多肽化合物,其特征在于该多肽化合物为有seqidno:1、seqidno:2或seqidno:3所示的氨基酸序列。
上述的基于整合素β亚基胞内保守序列的多肽化合物在制备抗新生血管形成药物中的应用。
上述的基于整合素β亚基胞内保守序列的多肽化合物在制备抗肿瘤药物中的应用。
本发明的这三种小分子多肽化合物可以通过结合共同的效应信号蛋白分子来阻断新生血管的形成。其在偶联具有穿膜功能多肽后具有抑制实验小鼠体内实体肿瘤生长的作用,属于生物医学领域。本发明基于功能小分子多肽化合物及其效应蛋白分子能够抑制体外人脐静脉内皮细胞形成血管状结构,抑制裸鼠皮下接种基质胶中血管的生成,和抑制裸鼠皮下接种实体瘤的生长。我们的研究发现不仅提供了多种具有阻抗新生血管形成作用的先导化合物,而且还揭示了一个调控新生血管形成的新机制,从而为开发新一代抗新生血管形成和抗肿瘤药物提供新的靶位点。
附图说明
图1为本发明中小分子多肽化合物mβctp系列的氨基酸序列和组成以及mβctp系列选择性地抑制脐静脉血管内皮细胞(huvec)体外形成血管样小管效果对比图。(a)mβctp由两部分组成:一是穿膜多肽(cpp),为具有11个氨基酸的序列,可以介导与之偶联的目的多肽分子进入细胞内;二是目的多肽(βctp),为来自不同整合素β亚基胞内保守序列的多肽,其自身不具有穿膜功能。因此,mβctp系列多肽是穿膜多肽与目的多肽的偶联复合物,可穿越细胞膜进入细胞内发挥功能。(b)被fitc荧光标记后的mβ3ctp与huvec孵育后可检测到其具有穿膜的能力。(c-d)检测mβctp系列多肽抑制脐静脉血管内皮细胞(huvec)体外形成血管样小管的能力。
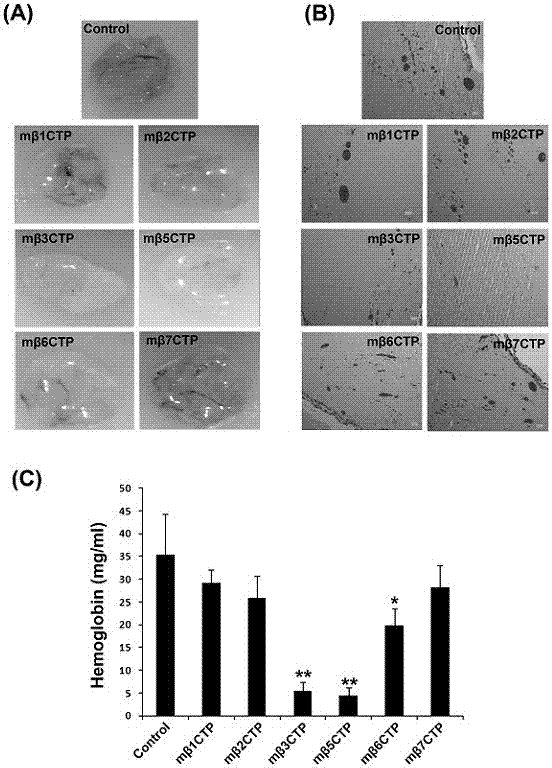
图2为本发明中小分子多肽化合物mβctp系列抑制皮下种植基质胶(matrigel)团块中血管形成的能力。(a)不同mβctp分别与液态基质胶混合后注射到小鼠皮下,基质胶在小鼠体内迅速固化并诱导新生血管的形成。7天后取出固态基质胶块观察血管形成的情况。(b)组织化学染色(he)观察基质胶内形成的血管。(c)测定基质胶内的血红蛋白量。
图3为本发明中小分子多肽化合物mβctp抑制裸鼠皮下实体瘤的生长及免疫组织化学分析肿瘤内血管分布情况。(a)小鼠皮下植瘤后分别用不同的mβctp处理并观察其对肿瘤生长的影响。(b-c)取出小鼠内瘤体并进行组化观察(cd31+)瘤内血管的形成情况和数量。
图4为本发明中鉴定mβ3ctp中目的多肽(β3ctp)的功能核心序列。(a)从β3ctp两端分别进行氨基酸序列的删减,构建含有不同氨基酸序列的mβ3ctp衍生多肽化合物。(b-c)huvec细胞种植在已铺好基质胶的24孔板中,并与(a)中所示多种mβ3ctp衍生多肽化合物(20μm)共孵育后观察形成血管管道样结构的能力。
图5为本发明中整合素β亚基胞内序列以及功能mβctp多肽化合物与β3-endonexin和kindlin-2相互作用的情况。(a)利用纯化的带有gst标签的整合素β亚基胞内序列与表达有外源egfp-β3-endonexin和内源kindlin-2的huvec细胞裂解液孵育,并测定不同β亚基胞内序列与egfp-β3-endonexin和kindlin-2的结合能力。(b)利用酵母双杂交系统测定不同整合素β亚基胞内序列与β3-endonexin和kindlin-2的结合能力。(c)利用竞争抑制实验测定功能mβ3ctp和mβ5ctp与β3-endonexin的直接结合作用。
图6为本发明中β3-endonexin调控脐静脉内皮细胞血管管道样结构形成并且促进小鼠皮下实体肿瘤生长的情况。(a-c)利用两种特异性sirna分别下调huvec中内源性β3-endonexin的表达并检测其对huvec形成血管样小管结构的影响。(d-f)利用慢病毒表达系统上调huvec中β3-endonexin的表达并检测其对huvec形成血管样小管结构的影响。(g-h)分别用可表达egfp-β3-endonexin和对照egfp的慢病毒局部注射小鼠体内肿瘤并观察其对小鼠体内肿瘤生长的影响。
具体实施方式
实施例一:合成并纯化mβctp系列多肽分子
含有目标多肽的mβctp系列衍生多肽分子命名和氨基酸序列参见图1(a)。该系列多肽合成于公司,采用手动固相fmoc法,以fmoc-gly-wang树脂为起始原料,从c端向n端方向合成。纯化采用hp1100型(美国安捷伦公司)反相高效液相色谱仪,其纯度达99.62%。该方法为小分子多肽常规合成方法。
实施例二:脐静脉血管内皮细胞(huvec)血管样管道形成实验研究mβctp系列多肽对新生血管形成的作用:
参见图1,体外培养的人脐静脉血管内皮细胞(huvec)在含生长因子的基底膜基质胶上能自行组装成类似血管的管道样结构。在细胞培养液中加入不同的mβctp(终浓度20μm),观察其抑制huvec细胞组装管道的能力。参见图1(c-d),结果显示,与无药处理组相比较,添加衍生多肽mβ3ctp、mβ5ctp、mβ6ctp能够有效地抑制管道的形成,说明这些多肽对huvec细胞体外形成血管样管道结构有显著的抑制作用。同时该实验结果也说明该抑制功能来自相应的整合素β胞内序列(βctp)而不是所偶联的穿膜多肽(cpp),因为同样具有cpp序列的mβ1ctp、mβ2ctp、mβ7ctp对huvec细胞形成管道样结构并无明显影响。同时,没有偶联穿膜多肽的βctp并不具有抑制功能,说明它们是在细胞内发挥作用的。
图1:mβctp系列多肽选择性地抑制脐静脉内皮细胞(huvec)血管管道样结构的形成。(a)mβctp系列多肽包含两部分:一是穿膜多肽(cpp);二是目标多肽,包含整合素β亚基胞内含c末端nxxy/f的序列(βctp)。βctp自身不具有穿膜能力,其与穿膜多肽cpp偶联后可穿越细胞膜进入细胞内发挥功能。(b)n端标记荧光素fitc的mβ3ctp与huvec共孵育,其穿膜特性通过荧光显微镜观察。(c)huvec铺在基质胶上,分别添加mβctp系列多肽药物(20μm);不添加组为对照。孵育12h后倒置显微镜下观察(5倍物镜)血管管道样结构的形成情况。(d)对形成管道样结构的数目进行统计,统计结果以均值±标准差(mean±sd)表示,实验独立样本均值采用独立样本t检验,p﹤0.01(**)说明数据在统计学分析中有显著差异。
实施例三:小鼠体内基底膜基质中血管形成实验:
参见图2,实验材料为裸鼠(balb/c),6周龄,雄性(每组7只裸鼠),基底膜基质胶(matrigel)。先将基底膜基质胶放在冰上融化为液态后,加入600ng/mlbfgf和100u/mlheparin以及不同的mβctp多肽(50μm)。然后在裸鼠皮下注射500μl的基底膜基质胶混合物。基底膜基质胶进入小鼠体内迅速固态化并诱导新生血管的生长,历时7天后,将固态matrigel块小心从小鼠皮下剥离取出,测定基底膜基质胶中血红蛋白的含量;同时对固定后的基底膜基质胶进行组织化学分析(he染色)。结果发现相同重量的基质中,mβ3ctp、mβ5ctp、mβ6ctp处理组相对于无药对照组所含血红蛋白含量明显降低。并且,mβ3ctp和mβ5ctp处理组的新生血管数量比无药处理的对照组显著减少。同时该实验结果也说明具有抑制功能的mβctp多肽中的效应序列来自相应的整合素β胞内序列(βctp)而不是所偶联的穿膜多肽(cpp),因为同样具有cpp序列的mβ1ctp、mβ2ctp、mβ7ctp对基质胶内血管的形成无明显影响。
图2:小鼠皮下种植基质胶实验检测mβctp系列多肽化合物抑制血管形成的能力。(a)裸鼠皮下注射基质胶matrigel(500μl)(含600ng/mlbfgf和100u/mlheparin),并同时添加mβctp(50μm)系列多肽药物;不加药组作为对照。胶块于7天后小心取出并拍照。(b)固定后的基质胶matrigel石蜡包埋后经he染色并显微观察。染深红色部分为血管(红细胞),浅粉色背景为基质胶matrigel染色。(c)matrigel样品中血红蛋白总含量的测定,统计结果以均值±标准差(mean±sd)表示,实验独立样本均值采用独立样本t检验,p﹤0.05(*)或p﹤0.01(**)说明数据在统计学分析中有显著差异。
实施例四:功能mβctp多肽对小鼠实体瘤生长的作用:
参见图3(a),实验材料为裸鼠(balb/c),6周龄,雄性,随机分成2组,对照组以及mβctp治疗组(每组6只)。每只皮下注射小鼠前列腺癌细胞rm1(1.2x106/只),并添加1%基质胶。荷瘤5天后,治疗组隔天皮下局部注射功能mβctp(50μm;100μlpbs溶液);对照组皮下注射等量pbs缓冲液,同时测量小鼠肿瘤大小(v)(v=l×w×0.52;其中l为肿瘤测量长度,w为肿瘤测量宽度)。由图3(a)可以看出,相对于对照组,mβ3ctp、mβ5ctp处理组的肿瘤体积明显较小;而mβ6ctp处理组对肿瘤的生长无明显影响。这种区别可能是因为目的多肽与其胞内效应蛋白分子的结合强弱造成的(见后面实例)。
图3(a):mβ3ctp,mβ5ctp及mβ6ctp抑制裸鼠体内肿瘤生长的情况。(a)裸鼠皮下注射rm1细胞,隔天皮下局部分别给药mβ3ctp、mβ5ctp以及mβ6ctp(50μm);不加药组作为对照。记录肿瘤长(l)与宽(w),并计算体积v(v=l*w*w*0.52)并绘制肿瘤生长曲线。统计结果以均值±标准差(mean±sd)表示,实验独立样本均值采用独立样本t检验,p﹤0.01(**)说明数据在统计学分析中有显著差异。
实施例五:利用免疫组织化学分析肿瘤组样,研究mβctp对实体瘤内血管的形成的影响:
参见图3(b-c),小鼠前列腺癌rm-1细胞接种裸鼠,经不同治疗后20天后取出形成的肿瘤,经pbs清洗,中性甲醛固定,然后制做石蜡切片并进行cd31免疫组化检测。处理后的组样用显微观察各组样本血管腔形成情况。无药物处理的对照组肿瘤组织内有明显的血管生成,并且多数已经形成完整的血管管道样结构;虽然mβ3ctp和mβ5ctp(图3,b)给药组的肿瘤组织经免疫组化有cd31阳性细胞,但形成的血管数目明显减少,且形成的血管管道不规整,其血管大小及形态与对照组相比有显著差异。该实验结果证明mβ3ctp和mβ5ctp对肿瘤内新生血管的形成有着显著的抑制作用,具有抑制固体肿瘤生长的作用。相比较而言,mβ6ctp对肿瘤内血管形成的抑制作用较弱。
图3(b-c):mβ3ctp,mβ5ctp及mβ6ctp抑制裸鼠体内肿瘤血管形成的情况。(b)裸鼠皮下注射rm1细胞,隔天皮下局部分别给药mβ3ctp、mβ5ctp以及mβ6ctp(50μm);不加药组作为对照。实体瘤取出后组化切片并进行cd31免疫染色(褐色部分)(c)各组肿瘤组织内形成的血管数量统计,统计结果以均值±标准差(mean±sd)表示,实验独立样本均值采用独立样本t检验,p﹤0.01(**)说明数据在统计学分析中有显著差异。
实施例六:鉴定mβ3ctp目的多肽中的核心功能序列:
参见图4,对功能多肽mβ3ctp中来自整合素β3胞内序列的目标多肽(βctp)中的氨基酸的序列分别从n-端和c-端进行截短并合成相应的衍生多肽见图4(a),然后用脐静脉血管内皮细胞(huvec)血管样管道形成实验来验证这些衍生多肽抗新生血管形成的能力。结果显示,mβ3ctp目标多肽中的nity序列及其n-端的至少2个氨基酸残基形成功能核心序列。
图-4:mβ3ctp中目的多肽内功能核心序列的鉴定。(a)从β3ctp两端分别进行氨基酸序列的删减,构建含有不同氨基酸序列的mβ3ctp衍生多肽化合物。(b-c)huvec细胞种植在已铺好基质胶的24孔板中,并与(a)中所示多种mβ3ctp衍生多肽化合物(20μm)共孵育;不添加多肽组为对照。倒置显微镜下观察(5倍物镜)拍照,并对形成的管道样结构进行统计,统计结果以均值±标准差(mean±sd)表示,实验独立样本均值采用独立样本t检验,p﹤0.01(**)说明数据在统计学分析中有显著差异。
实施例七:利用pulldown试验和酵母双杂交实验研究整合素β亚基胞内序列以及功能mβctp多肽与β3-endonexin和kindin-2结合的情况:
参见图5,首先,用pulldown鉴定整合素β亚基的胞内序列与β3-endonexin和kindin-2的相互作用。huvec细胞表达的外源efgp-β3-endonexin及内源kindlin-2分别与结合在介质上gst融合的整合素β亚基的胞内序列孵育。洗脱掉非特异性结合蛋白后,用westernblot实验鉴定结合上去的efgp-β3-endonexin及kindlin-2。图5(a)中结果显示,β3-endonexin与整合素β3,β5和β6的胞内多肽序列结合,但其中与β6的胞内多肽序列结合较弱。相比较,另一个胞内整合素结合蛋白kindlin-2与β1,β3和β7的胞内多肽序列结合。由此,β3-endonexin和kindlin-2结合整合素β亚基的胞内序列具有不同的选择性。然后,用酵母双杂交系统(matchermarkertmgold)进一步鉴定整合素β亚基的胞内序列与β3-endonexin及kindlin-2的相互作用。β3-endonexin及kindlin-2克隆在pgbdt7载体上,构建bd(dna结合结构域)融合蛋白;同时,β亚基的胞内段序列克隆在pgadt7载体上,构建ad(转录激活结构域)融合蛋白。如果两种蛋白具有相互作用,就可以形成有功能的转录因子(ad-bd),并激活下游报告基因的转录,导致酵母菌株可以在选择培养基(sd-3)上生长。如图5b所示,酵母双杂交的检测结果与pulldown实验结果一致。最后,我们用竞争实验进一步验证了mβ3ctp与mβ5ctp可与β3-endonexin特异性结合,见图5(c)。这些实验结果说明功能mβctp多肽对新生血管和肿瘤生长的抑制作用很可能是通过结合效应信号蛋白分子β3-endonexin来实现的。
图-5:整合素β亚基的胞内段与β3-endonexin和kindin-2相互作用的检测。(a)pulldown实验:huvec细胞表达的efgp-β3-endonexin及kindlin-2分别与结合在介质上gst融合的整合素β亚基的胞内序列孵育。洗脱掉非特异性结合蛋白后,用westernblot实验鉴定结合上去的efgp-β3-endonexin及kindlin-2。(b)酵母双杂交系统(matchermarkertmgoldyeasttwo-hybridsystem)进一步鉴定整合素β亚基的胞内序列与β3-endonexin及kindlin-2的相互作用。β3-endonexin及kindlin-2克隆在pgbdt7载体上,构建bd(dna结合结构域)融合蛋白;同时,β亚基的胞内段序列克隆在pgadt7载体上,构建ad(转录激活结构域)融合蛋白。如果两种蛋白具有相互作用,就可以形成有功能的转录因子(ad-bd),并激活下游报告基因的转录,导致酵母菌株可以在选择培养基上(sd-3)生长。(c)mβ3ctp与mβ5ctp能够与整合素β亚基的胞内段竞争结合efgp-β3-endonexin。huvec细胞表达的efgp-β3-endonexin与结合在介质上的gst融合的整合素β3亚基的胞内序列孵育,同时分别加入20μm的mβ3ctp与mβ5ctp。洗脱掉非特异性结合蛋白后,用westernblot实验鉴定结合上去的efgp-β3-endonexin。
实施例八:β3-endonexin可调控huvec细胞血管管道样结构的形成以及肿瘤的生长:
参见图6,我们通过向huvec细胞转染靶向β3-endonexin的sirna(001、002)来沉默内源性β3-endonexin的表达;同时用非靶向性sicontrol作为对照,结果显示下调内源β3-endonexin表达后huvec形成血管样结构的能力明显变差(见图6,a-c)。进而,我们用慢病毒表达系统在huvec细胞中过表达egfp-β3-endonexin,发现过表达egfp-β3-endonexin后huvec形成血管管道样结构的能力明显增强(见图6,d-f)。最后,我们对小鼠皮下实体瘤分别注射含有可表达egfp-β3-endonexin和对照egfp的慢病毒,发现高表达egfp-β3-endonexin可显著促进肿瘤的生长。这些实验结果说明β3-endonexin很可能是一种新生血管形成和肿瘤生长的促进因子。结合前面mβctp的功能以及其与β3-endonexin的结合能力,我们推断功能多肽mβctp的抗新生血管形成和抗肿瘤生长作用很可能是通过结合并阻断β3-endonexin的功能来实现的。
图-6:β3-endonexin可促进huvec细胞血管管道样结构的形成和体内肿瘤生长。(a)huvec细胞转染靶向β3-endonexin的sirna(001、002)来沉默内源性β3-endonexin的表达;同时用非靶向性sicontrol作为对照。转染sirna后48h收集细胞,并通过qrt-pcr检测huvec细胞中β3-endonexin的mrna表达水平。(b-c)转染sirna后,收集huvec细胞进行血管管道样结构形成实验,并对形成管道样结构的数目进行统计。(d)在huvec细胞中通过慢病毒系统感染表达外源egfp和egfp-β3-endonexin。48h后,收集感染后的huvec细胞,并通过westernblot实验来检测egfp表达水平。(e&f)表达egfp和egfp-β3-endonexin的huvec细胞形成血管管道样结构,并统计管道数量。(g&h)实验材料为裸鼠(balb/c),6周龄,雄性,随机分成2组,每组5只,每只皮下注射小鼠前列腺癌细胞rm1(1.2x106/只)。从第5天起两组分别注射分别表达egfp以及egfp-β3-endonexin的慢病毒(滴度=2x107iu/ml,一周注射2次,每次注射100μl/只)。15天后,取出肿瘤并测量。统计结果以均值±标准差(mean±sd)表示,实验独立样本均值采用独立样本t检验,p﹤0.01(**)说明数据在统计学分析中有显著差异。
参考文献
1.posey,j.a.,etal.,apilottrialofvitaxin,ahumanizedanti-vitronectinreceptor(antialphavbeta3)antibodyinpatientswithmetastaticcancer.cancerbiotherradiopharm,2001.16(2):p.125-32.
2.mcneel,d.g.,etal.,phaseitrialofamonoclonalantibodyspecificforalphavbeta3integrin(medi-522)inpatientswithadvancedmalignancies,includinganassessmentofeffectontumorperfusion.clincancerres,2005.11(21):p.7851-60.
3.macdonald,t.j.,etal.,preferentialsusceptibilityofbraintumorstotheantiangiogeniceffectsofanalpha(v)integrinantagonist.neurosurgery,2001.48(1):p.151-157.
4.gilbert,m.r.,etal.,cilengitideinpatientswithrecurrentglioblastoma:theresultsofnabtc03-02,aphaseiitrialwithmeasuresoftreatmentdelivery.jneurooncol,2012.106(1):p.147-53.
5.smith,j.w.,cilengitidemerck.curropininvestigdrugs,2003.4(6):p.741-5.
6.hodivala-dilke,k.m.,etal.,á3-integrin-deficientmiceareamodelforglanzmannthrombastheniashowingplacentaldefectsandreducedsurvival.j.clin.invest.,1999.103(2):p.229-238.
7.alghisi,g.c.,l.ponsonnet,andc.ruegg,theintegrinantagonistcilengitideactivatesalphavbeta3,disruptsve-cadherinlocalizationatcelljunctionsandenhancespermeabilityinendothelialcells.plos.one.,2009.4(2):p.e4449.
8.reynolds,a.r.,etal.,stimulationoftumorgrowthandangiogenesisbylowconcentrationsofrgd-mimeticintegrininhibitors.nat.med.,2009.15(4):p.392-400.
9.stupp,r.,etal.,cilengitidecombinedwithstandardtreatmentforpatientswithnewlydiagnosedglioblastomaandmethylatedo6-methylgluanine-dnamethyltransferase(mgmt)genepromoter:keyresultsofthemulticenter,randomized,open-label,controlled,phaseiiicentricstudy.journalofclinicaloncology,2013.31:p.suppl;abstrlba2009.
10.bihari-varga,m.,etal.,interactionoflipoproteinlp(a)andlowdensitylipoproteinwithglycosaminoglycansfromhumanaorta.arteriosclerosis,1988.8:p.851-857.
11.tadokoro,s.,etal.,talinbindingtointegrinbetatails:afinalcommonstepinintegrinactivation.science,2003.302(5642):p.103-6.
12.shi,x.,etal.,themig-2/integrininteractionstrengthenscell-matrixadhesionandmodulatescellmotility.jbiolchem,2007.282(28):p.20455-66.
13.ma,y.q.,etal.,kindlin-2(mig-2):aco-activatorofbeta3integrins.jcellbiol,2008.181(3):p.439-46.
14.rognoni,e.,r.ruppert,andr.fassler,thekindlinfamily:functions,signalingpropertiesandimplicationsforhumandisease.jcellsci.,2016.129(1):p.17-27.
15.shattil,s.j.,etal.,beta3-endonexin,anovelpolypeptidethatinteractsspecificallywiththecytoplasmictailoftheintegrinbeta3subunit.jcellbiol.,1995.131(3):p.807-816.
16.eigenthaler,m.,etal.,aconservedsequencemotifintheintegrinbeta3cytoplasmicdomainisrequiredforitsspecificinteractionwithbeta3-endonexin.journalofbiologicalchemistry,1997.272(12):p.7693-7698.
17.ma,y.q.,etal.,kindlin-2(mig-2):aco-activatorofbeta3integrins.journalofcellbiology,2008.181(3):p.439-446.
18.kracun,d.,etal.,thebeta3-integrinbindingproteinbeta3-endonexinisanovelnegativeregulatorofhypoxia-induciblefactor-1.antioxid.redox.signal.,2014.20(13):p.1964-1976.
19.bialkowska,k.,etal.,theintegrincoactivatorkindlin-3isexpressedandfunctionalinanon-hematopoieticcell,theendothelialcell.jbiol.chem.,2010.285:p.18640-18649.
20.pluskota,e.,etal.,theintegrincoactivatorkindlin-2playsacriticalroleinangiogenesisinmiceandzebrafish.blood,2011.117(18):p.4978-4987.
21.besta,f.,etal.,roleofbeta(3)-endonexinintheregulationofnf-kappab-dependentexpressionofurokinase-typeplasminogenactivatorreceptor.journalofcellscience,2002.115(pt20):p.3879-3888.
22.besta,f.,etal.,roleofbeta(3)-endonexinintheregulationofnf-kappab-dependentexpressionofurokinase-typeplasminogenactivatorreceptor.jcellsci,2002.115(pt20):p.3879-88.
<110>上海大学
<120>整合素胞内多肽序列在抑制新生血管形成中的应用
<160>3
<210>1
<211>12
<212>多肽
<213>氨基酸序列
<400>1
atstftnityrg12
<210>2
<211>20
<212>多肽
<213>氨基酸序列
<400>2
pisthtvdftfnkfnksyng20
<210>3
<211>12
<212>多肽
<213>氨基酸序列
<400>3
ststfknvtykh12
- 还没有人留言评论。精彩留言会获得点赞!