一种拟除虫菊酯类杀虫剂残留降解菌株及其应用的制作方法
本发明属于应用环境微生物和农业
技术领域:
。更具体地,涉及一种拟除虫菊酯类杀虫剂残留降解菌株及其生产的菌剂和最优降解工艺条件。
背景技术:
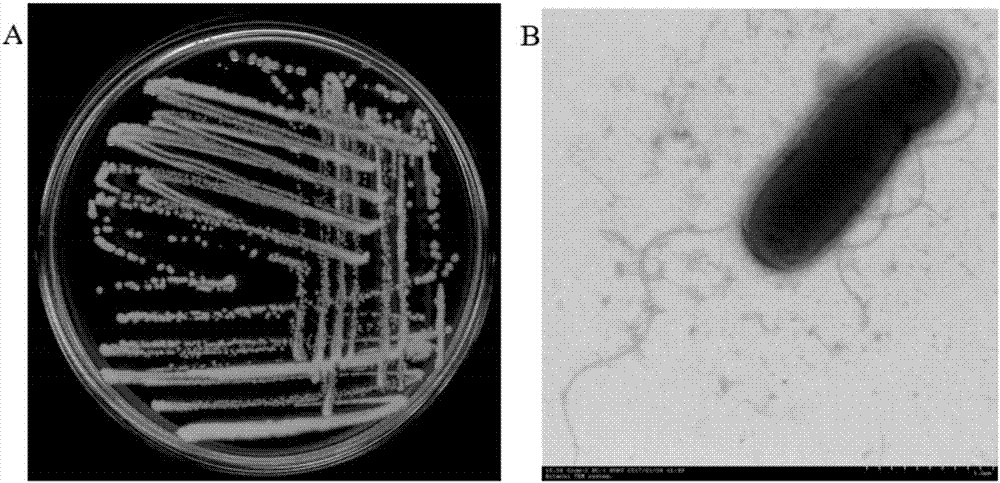
:拟除虫菊酯类农药是一类高疏水性仿生杀虫剂,具有广谱高效的杀虫活性,早在20世纪70年代就开始用于农业和住宅害虫控制,目前,拟除虫菊酯类农药是最重要的农作物杀虫剂,2015年拟除虫菊酯类杀虫剂的使用占农药市场份额的38%,未来,拟除虫菊酯的市场份额和使用面积还会持续增长。近年来,在农业区和非农业区均频繁检出拟除虫菊酯农药残留,已引起广泛关注。研究报道表明,人们认为安全的拟除虫菊酯类杀虫剂具有蓄积性,对神经系统、生殖系统、免疫系统、心血管等均具有毒性,长期接触即使低剂量也会引起各种疾病,甚至有致癌、致畸、致突变作用。上海新华医院最近研究表明某些拟除虫菊酯类杀虫剂使儿童患脑肿瘤风险系数提高3倍。此外,该类农药对家蚕、蜜蜂、赤眼蜂等农业有益昆虫和鱼类、蚌类和沼虾等水生生物具有很高的毒性,浓度达到10ng·l-1就足以杀死水体中全部的无脊椎动物。最近的研究发现,拟除虫菊酯类农药比传统杀虫剂对高等水生生物的毒性更高。拟除虫菊酯类农药残留地表水对淡水生物多样性和生态系统有巨大的潜在破坏。综上,拟除虫菊酯类农药残留已经成为人类健康和生态系统一个新兴的全球威胁。另一方面,农药残留已成为影响我国农产品出口创汇的最主要障碍因素,出口农产品中的拟除虫菊酯类农药残留量往往高于发达国家卫生与植物卫生协议的要求和菊酯类农药的最大残留限量标准,致使大量农产品被销毁或退货,给我国造成了巨大的经济损失。因此,如何消除环境和农产品中拟除虫菊酯类农药残留已成为科研工作者亟待解决的具有重大经济和社会意义的科研命题。利用微生物或其相关酶治理农药残留污染具有操作简便、经济实用、环境友好等优点,是目前的研究热点。由于拟除虫菊酯类农药残留污染属于面源污染,具有广泛性和顽固性,传统的物理、化学方法很难将其彻底消除。而自然界中微生物种类多、数量大,其降解有机污染物潜力巨大,几乎所有报道的农药都能被特定微生物分解、利用,而且干净彻底、无二次污染。国际上利用微生物治理有机物污染成功的例子很多,例如治理石油面源污染。国内的北京佳农新贸易发展有限公司已成功生产“比亚”降解酶制剂可用于去除有机磷类农药残留污染。实验室和实际应用都表明利用微生物治理有机物污染是可行的。但是,目前现有的降解菌资源库远远不能满足化学农药残留污染生物降解的实际需求。特别是目前还没有专门针对氯菊酯等拟除虫菊酯类农药的降解制剂产品。技术实现要素:本发明要解决的技术问题是克服现有拟除虫菊酯类农药降解菌剂的不足,提供一种高效降解拟除虫菊酯类杀虫剂残留的菌株及其生产的菌剂和最优降解工艺条件。应用时,将该菌株制备成液体制剂,生产成本低,使用方便。直接施用本菌剂短时间内可使水体或土壤中氯菊酯残留量降低85%以上,可解决农业生产中拟除虫菊酯类杀虫剂残留超标问题及环境污染问题,生产出无毒无公害的绿色农产品。本发明的目的是提供一株可降解拟除虫菊酯类杀虫剂残留的鲍曼不动杆菌(acinetobacterbaumannii)菌株zh-14。本发明的另一目的是提供所述菌株zh-14在制备拟除虫菊酯类杀虫剂的降解菌剂中的应用。本发明的再一目的是提供菌株zh-14制备的降解菌剂及其在降解拟除虫菊酯类杀虫剂、修复拟除虫菊酯类杀虫剂污染的水体或土壤等自然环境方面的应用。本发明的再一目的是提供所述降解菌剂的降解拟除虫菊酯类杀虫剂的最优降解工艺条件。本发明上述目的通过以下技术方案实现:一株可降解拟除虫菊酯类杀虫剂的鲍曼不动杆菌(acinetobacterbaumannii)菌株zh-14,已于2016年11月28日保藏于中国典型培养物保藏中心,保藏编号为cctccno:m2016689;保藏地址:中国武汉,武汉大学。该菌株从采集自新加坡污水处理池中的活性污泥中筛选分离获得,经形态学特征、生理生化特性、16srrna系统发育分析及biology系统鉴定为鲍曼不动杆菌(acinetobacterbaumannii)。菌株zh-14在lb固体平板中生长较快,富有运动性。菌落在lb固体平板中呈现淡黄色,圆形,凸起,有光泽。其主要生物学特性为:为革兰氏染色阴性菌,好氧,菌体为杆状,大小约13.0~24.0μm长,6.0~9.0μm宽,有鞭毛。接触酶、氧化酶、柠檬酸盐利用、溶血试验、赖氨酸脱羧酶试验阳性;明胶液化、硝酸盐还原试验、脲酶试验、吲哚试验、七叶苷水解、鸟氨酸脱羧酶试验阴性。该菌株可耐40℃和5%nacl生长,在ph5.0~10.0营养肉汤中生长良好。该菌株zh-14具有显著的降解拟除虫菊酯类杀虫剂残留的能力。因此,菌株zh-14在降解拟除虫菊酯类杀虫剂中的应用,以及在制备拟除虫菊酯类杀虫剂降解菌剂中的应用,均应在本发明的保护范围之内。优选地,所述拟除虫菊酯类杀虫剂为氯菊酯、溴氰菊酯、联苯菊酯、甲氰菊酯、氯氟氰菊酯或高效氯氰菊酯。更优选地,所述拟除虫菊酯类杀虫剂为氯菊酯。一种由上述菌株zh-14生产的可降解拟除虫菊酯类杀虫剂的降解菌剂,也在本发明的保护范围之内。具体地,所述降解菌剂包含菌株zh-14或其发酵液。优选地,所述降解菌剂是由菌株zh-14经过发酵所得培养液制成。更优选地,所述的降解菌剂由如下方法制备得到:s1.将菌株zh-14培养至对数生长期,得菌种;s2.将菌种按照体积比5%~10%的接种量接种入种子培养基培养得种子液;s3.将种子液按照体积比5~10%的接种量接种入发酵培养基培养,发酵完成后培养液制成菌剂剂型。其中,优选地,步骤s1所述培养所用培养基为lb培养基。优选地,步骤s2和步骤s3培养过程中通入无菌空气,无菌空气的通气量为0.45~1.0m3/min(优选为0.6~1.0m3/min),搅拌速度为180~240r/min,培养温度30℃,全流程培养时间为24~48h,发酵结束后菌体数量≥1.0×109cfu/ml。优选地,所述种子培养基和发酵培养基相同,培养基配方均为:酵母膏0.4~0.6%,蛋白胨0.8~1.2%,nacl0.8~1.2%,ph值为7.0~7.2。更优选地,所述种子培养基和发酵培养基的配方均为:酵母膏0.5%,蛋白胨1%,nacl1%,ph值为7.0~7.2。作为一种可优选的实施方案,所述的降解菌剂是通过以下方法生产而成:s1.将所述菌株zh-14试管种接种于lb培养基摇瓶中,振荡培养至对数期,获得菌种;s2.将s1的菌种按体积比5%~10%的接种量接种入含有种子培养基的种子罐,培养至对数生长期,获得种子液;s3.将获得的种子液按照5~10%的接种量接种入含有发酵培养基的生产发酵罐发酵培养,发酵完成后培养液出罐,直接用塑料包装桶或包装瓶分装成液体剂型或采用泥炭吸附用包装袋分装成固体菌剂剂型。另外,所述降解菌剂在降解水体或土壤中拟除虫菊酯类杀虫剂残留中的应用,以及在修复拟除虫菊酯类杀虫剂污染的自然环境方面的应用,也都在本发明的保护范围之内。优选地,所述自然环境为水体或土壤等。具体地,所述应用即为一种降解拟除虫菊酯类杀虫剂或修复拟除虫菊酯类杀虫剂污染的方法,是将所述降解菌剂稀释后喷洒到水体或土壤中,稀释后的降解菌剂中菌体的数量不低于1.0×108cfu/ml。更优选地,稀释后的降解菌剂中菌体的数量为1.0×106cfu/ml~1.0×1010cfu/ml。优选地,降解工艺条件为:降解温度25~35℃,ph6.0~8.0,降解菌剂接种量0.05~0.25g/l或0.05~0.25g/kg。更优选地,降解工艺条件为:降解温度30℃,ph7.0,降解菌剂接种量0.2g/l或0.2g/kg。本发明具有以下有益效果:本发明筛选获得一株农药残留高效降解菌株acinetobacterbaumanniizh-14,该菌株可以利用氯菊酯等拟除虫菊酯类杀虫剂作为唯一碳源生长,在短时间内可有效降解拟除虫菊酯类杀虫剂,48h内对氯菊酯的降解率达到92.4%,72h内可完全降解氯菊酯,具有较好的生物降解效果。该菌株可用于修复氯菊酯污染的水体、土壤等自然环境,直接施用可使水体和土壤中氯菊酯残留量降低85%以上,解决了农业生产中拟除虫菊酯类杀虫剂残留超标问题及环境污染问题,生产出无毒无公害的绿色农产品,保护生态环境和人类健康。本发明进一步提供了一种使用菌株zh-14生产制备得到的降解菌剂,具有生产成本低、使用方便、去除效果明显等优点,适合治理水体或土壤等自然环境中拟除虫菊酯类杀虫剂造成的残留污染。本发明进一步提供了一种该菌剂最优降解工艺条件,即采用响应曲面法box-behnken设计获得,最优降解工艺条件为:温度30℃,ph7.0和接种量0.2g/l,在此工艺条件下菌剂降解效果明显提高,具有非常重要的理论和应用价值。附图说明图1为菌株zh-14降解50mg/l氯菊酯的hplc色谱图,24h(a)和48h(b)。图2为菌株zh-14的菌落照片(a)和扫描电镜照片(b)。图3为菌株zh-14的16srrna系统进化分析。图4为菌株zh-14降解氯菊酯的响应曲面图。ph和温度交互影响菌株zh-14降解氯菊酯(a),ph和接种量交互影响菌株zh-14降解氯菊酯(b),接种量和温度交互影响菌株zh-14降解氯菊酯(c)。图5为菌株zh-14生长与降解氯菊酯的关系图;□:对照降解;●:菌株zh-14降解;▲:菌株zh-14生长。图6为菌株zh-14对拟除虫菊酯类杀虫剂的降解。图7为菌株zh-14降解氯菊酯的途径分析。具体实施方式以下结合说明书附图和具体实施例来进一步说明本发明。以下实施例为本发明较佳的实施方式,但并不对本发明的保护范围做任何形式的限定。本发明主要阐述所述菌株以及基于所述菌株的应用思想,实施方式中简单参数的替换不能一一在实施例中赘述,但并不因此限制本发明,其他的任何未背离本发明的精神实质与原理下所作的改变、修饰、替代、组合、简化,应被视为等效的置换方式,都应包含在本发明范围内。除非特别说明,本发明采用的试剂、方法和设备为本
技术领域:
常规试剂、方法和设备。除非特别说明,以下实施例所用试剂和材料均为市购。实施例1菌株zh-14的分离与鉴定1、菌株分离筛选(1)样品:采集自新加坡污水处理池中的活性污泥。(2)分离筛选方法采用富集培养法,具体如下:取活性污泥样品5g加入50ml基础培养基中,同时加入氯菌酯原药母液(丙酮或甲醇为溶剂),使氯菊酯最终质量浓度为50mg/l,于30℃、180r/min摇床下进行降解菌富集培养。培养7d后,按10%的接种量转接到第二批含100mg/l氯菊酯的基础培养基中。相同条件培养7d后,再按10%的接种量转接到含氯菊酯为200mg/l的基础培养基中,继续培养7d。以此类推,不断成倍增加氯菊酯的质量浓度,连续富集培养四次。最后取0.1ml基础培养基发酵液均匀涂抹到含氯菊酯的基础培养基固体平板中反复进行划线分离,直至得到单菌落,并使用高效液相色谱法(hplc)验证其降解效果。其中,所述基础培养基的配方为:(nh4)2so42g、mgso40.2g、cacl20.01g、feso40.005g、mncl20.002g、k2hpo410.5g、kh2po44.5g、水1000ml,ph7.2。hplc测定条件如下:hplc型号:2690型(waters,usa);色谱柱:c18反相柱(phenomenex,250nm×4.60mm,5μm);流速:1ml/min;柱温:常温(28±1℃);流动相:乙腈:水=85:15(含0.1%乙酸);检测波长:235nm;进样量:10μl。在上述条件下,氯菊酯峰形由两个峰组成,且峰尖锐、稳定,保留时间分别为6.3min和6.9min。(3)采用上述方法从环境样品中成功分离获得一株氯菊酯高效降解菌株,编号为zh-14,该菌株可以利用氯菊酯作为唯一碳源生长,48h内对氯菊酯的降解率达到92.4%,72h内可完全降解氯菊酯,具有较好的生物降解效果,hplc色谱图见图1。2、菌株鉴定(1)菌株zh-14在lb固体平板中生长较快,富有运动性。菌落在lb固体平板中呈现淡黄色,圆形,凸起,有光泽(图2a)。主要生物学特性为:该菌株属于革兰氏阴性菌,好氧,菌体为杆状,大小约13.0~24.0μm长,6.0~9.0μm宽,有鞭毛(图2b);接触酶、氧化酶、柠檬酸盐利用、溶血试验、赖氨酸脱羧酶试验阳性;明胶液化、硝酸盐还原试验、脲酶试验、吲哚试验、七叶苷水解、鸟氨酸脱羧酶试验阴性。菌株zh-14可耐40℃和5%nacl生长,在ph5.0~10.0营养肉汤中生长良好。(2)进一步设计pcr引物通过16srrna鉴定,该菌株基因序列与ncbi在线数据库中的不动杆菌属(acinetobacter)亲缘关系最近,其中与鲍曼不动杆菌(acinetobacterbaumannii)相似性达97.92%,菌株zh-14的16srrna系统进化分析见图3。(3)菌株zh-14进一步使用biolog鉴定系统进行鉴定。菌株zh-14培养16-24h后置于biolog微生物自动分析系统进行读数。biolog系统鉴定结果如表1所示。表1菌株biolog系统鉴定结果注:-:阴性反应;+:阳性反应。综上所述,经形态学特征、生理生化特性、16srrna系统发育分析及biolog系统鉴定该降解菌株zh-14属于鲍曼不动杆菌(acinetobacterbaumannii)。并已于2016年11月28日保藏于中国典型培养物保藏中心,保藏编号为cctccno:m2016689;保藏地址:中国武汉,武汉大学。实施例2菌株zh-14降解菌剂的制备1、使用上述菌株zh-14制备降解菌剂的生产工艺流程为:斜面种——摇瓶种子液——种子罐培养——生产罐发酵——产品(包装剂型为液体剂型或固体菌剂剂型)。2、具体方法如下:(1)将菌株zh-14的菌种在lb固体平板上活化,接种于lb试管斜面上备用。(2)将菌株zh-14的试管种接种于含250mllb培养基(培养基配方为:酵母膏0.5%,蛋白胨1%,nacl1%,ph值为7.0~7.2)的1000ml摇瓶中,30℃恒温振荡至对数期,获得的菌种接种于种子罐,种子罐中装有种子培养基,装液量为70%。投料完成后在1.1kg/cm3的压力下、121℃条件下高压湿热灭菌,冷却至30℃后,将上述培养好的摇瓶菌种按10%的接种量接种于装液量为70%的种子罐,无菌空气的通气量为0.6~1.0m3/min,搅拌速度为180~240r/min,培养至对数生长期备用。(3)将到达对数期的种子液按照10%的接种量投入装有发酵培养基的生产发酵罐(装液量为70%)发酵培养。投料后的生产罐,在1.1kg/cm3的压力下、121℃条件下高压湿热灭菌,冷却至30℃后,通无菌空气,通气量为0.6~1.0m3/min,搅拌速度为180~240r/min,培养温度控制为30℃,整个工艺培养流程时间为24~48h,发酵结束后菌体数量≥1.0×109cfu/ml,发酵完成后培养液出罐直接用塑料包装桶或包装瓶分装成液体剂型或采用泥炭吸附用包装袋分装成固体菌剂剂型。其中,种子培养基和发酵培养基的配方均为:酵母膏0.5%,蛋白胨1%,nacl1%,ph值为7.0~7.2。实施例3zh-14菌剂最优降解工艺条件1、将zh-14菌剂进行单因素降解试验,通过依次改变影响生长和降解的因素,如温度、ph值、接种量、装液量、振荡速率等,测定zh-14菌剂的降解率,确定影响zh-14菌剂降解率的关键因素。利用sas9.0统计软件根据响应曲面法box-behnken设计原则进行试验设计(表2),以影响菌株zh-14生长与降解的关键因子ph值(x1)、温度(x2)和接种量(x3)为自变量,以氯菊酯降解率为响应值(y1),建立多元二次回归方程。根据多元二次回归方程进行绘图分析,得到回归方程的响应曲面图。最后对多元二次回归方程求一阶偏导,通过解方程得到该模型的极值点,即zh-14菌剂最优降解工艺条件。通过sas统计软件分析,获得zh-14菌剂降解的多元二次回归方程如下:y1=478.1469-55.9875x1-17.7825x2-172.625x3+4.1125x12-0.125x1x2+3.0x1x3+0.3125x22+1.7x2x3+258.75x32表2响应曲面box-behnken设计试验结果2、统计分析结果表明,ph值(x1)、温度(x2)和接种量(x3)对菌株zh-14降解效果的一次效应均达到显著水平(p<0.05);其二次效应x12、x22和x32对菌株zh-14降解效果也达到显著水平(p<0.05)。为了能更直观的反映出各因素及其交互效应,利用sas软件程序作出响应曲面图,见图4。图4a表示ph和温度交互影响菌剂降解氯菊酯,图4b表示ph和接种量交互影响菌菌剂降解氯菊酯,图4c表示接种量和温度交互影响菌剂降解氯菊酯。为了获得zh-14菌剂降解工艺条件的最佳组合,对所得的多元二次回归模型方程求一阶偏导,通过解方程得到该模型的临界值,即菌剂最优降解工艺条件:温度30℃,ph7.0和接种量0.2g/l。实施例4实验室降解实验1、在基础培养基(同实施例1)中分别加入氯菊酯、溴氰菊酯、联苯菊酯、甲氰菊酯、氯氟氰菊酯、高效氯氰菊酯等拟除虫菊酯类杀虫剂,使其终浓度为50mg/l;接种浓度为1.0×108cfu/ml的zh-14菌剂,并设不接菌的培养基为对照,30℃培养72h,定期取样,应用hplc法测定农药的残留量,并计算降解率,同时绘制菌株zh-14对氯菊酯的降解-生长关系曲线。降解率计算方法如下:2、结果见图5、图1、图6及表3所示。表3菌株zh-14对拟除虫菊酯类杀虫剂的降解效果实验结果表明,菌株zh-14在短时间内快速降解各拟除虫菊酯类杀虫剂,24h内对50mg/l氯菊酯的降解率达到92.4%,72h内完全降解氯菊酯,具有较好的生物降解效果,菌株生长与降解氯菊酯的关系曲线图见图5。菌株zh-14降解氯菊酯的hplc色谱图见图1。菌株zh-14对其他拟除虫菊酯类杀虫剂也具有较好的生物降解效果,72h内对溴氰菊酯、联苯菊酯、甲氰菊酯、氯氟氰菊酯和高效氯氰菊酯的降解率分别达到87.9%、83.0%、82.2%、69.6%和63.8%(图6)。菌株zh-14对各拟除虫菊酯类杀虫剂的降解效果见表3。实施例5降解产物实验1、在基础培养基(同实施例1)中加入氯菊酯,使其终浓度为50mg/l;接种浓度为1.0×108cfu/ml的zh-14菌剂,并设不接菌的培养基为对照,30℃培养72h,定期取样,使用二氯甲烷萃取培养液,应用gc-ms法检测氯菊酯降解产物,并根据降解产物化学结构分析降解途径。gc-ms测定条件如下:gc-ms型号:6890n/5975型(agilent,usa);hp-5ms石英毛细管柱(30.0m×250μm×0.25μm);载气:氦气,纯度≥99.999%;流量1ml·min-1,不分流进样,进样量均为1μl;电离电压:70ev,全扫描模式,扫描范围30~500nm;离子源温度:230℃;四级杆温度:150℃;ms传输线温度:280℃;进样口温度:250℃;检测器温度:320℃;升温程序:初温90℃(2min),6℃每分钟升温至150℃(1min),10℃每分钟升温至180℃(4min),20℃每分钟升温至260℃(10min)。2、gc-ms分析结果表明,zh-14菌剂降解氯菊酯主要产生间苯氧基苯甲醇、间苯氧基苯甲醛及1,2-苯二甲酸酯,出峰保留时间分别为18.979、16.959和20.627min,其中间苯氧基苯甲醇和间苯氧基苯甲醛为主要中间产物。这些中间产物最终都被zh-14菌剂完全降解。72h后均检测不出氯菊酯及其中间产物。根据这些实验结果,对zh-14菌剂降解氯菊酯的途径进行分析,见图7。实施例6土壤修复实验1、供试土样农田表层土(0~20cm),取自华南农业大学教学农场试验田,属红壤土,超过5年未施用氯菊酯等化学农药。2、修复方法土壤样品取回后首先置于阴凉通风处自然风干,风干后碾磨,过2mm筛,分别取一定量的氯菊酯溶于丙酮中,然后浸泡硅藻土,使氯菊酯被完全吸附。浸泡后的硅藻土置于通风橱中吹干,将其拌入土壤中,使土壤中氯菊酯的浓度约为50mg/kg。每一种土样各取500g于30℃恒温恒湿培养箱中培养,按1.0×108cfu/g的接种量接入zh-14降解菌剂,以加蒸馏水的作为对照,土壤的持水量保持在40%。连续培养9天,并定期取样,hplc法测定氯菊酯残留量并计算降解率。降解率计算方法如实施例4。3、测定结果如表4。表4zh-14降解菌剂对土壤中氯菊酯的降解效果时间(d)对氯菊酯的降解率(%)19.6329.8547.0769.6986.4从表4可以得出,培养9d后,zh-14降解菌剂对土壤中的氯菊酯降解率达到86.4%。以上结果说明,zh-14降解菌剂在直接施入土壤中后,没有出现不降解或降解滞后效应现象,其降解性能稳定,这就为菌株zh-14对氯菊酯的土壤修复提供了科学依据。当前第1页12
相关技术
网友询问留言
已有0条留言
- 还没有人留言评论。精彩留言会获得点赞!
1