一种离子化的含有机自由基聚芴及其制备方法和应用与流程
本发明涉及有机高分子化合物,具体涉及具有共轭主链结构的聚芴。
背景技术:
分子影像学是运用影像学手段,在组织水平、细胞水平甚至分子水平对特定分子进行活体显像,以显示其生物学行为,并对特定分子进行定性、定量研究的学科。目前常用的分子影像技术主要有pet分子成像、ct分子成像、超声分子成像、mr分子成像和光学分子成像。由于自身灵敏度、选择性、分辨率及安全性等方面的缺陷,单一的分子影像技术不能满足临床诊断需求,亟需发展双模态甚至多模态分子影像技术。双模态分子影像技术融合了两种分子影像技术,克服了单一分子影像技术的局限性,使不同分子影像技术的优势得到互补,拓宽了分子影像技术的研究范围与应用前景。mr成像技术能提供高分辨率的组织信息和三维结构成像,具有安全无创、无放射性、高空间分辨率、多方位及多参数成像等特点;但是靶向性差、灵敏度低。光学成像技术具有操作简便、安全无创、灵敏度高、时间分辨率高、无射线辐射、可重复曝光等优点;但是存在空间分辨率较差,背景噪声高等缺点。因此,mr/光学双模态影像技术将mr成像技术和光学成像技术进行融合,即能提供高分辨率的结构组织学信息,同时又能实现高灵敏的功能学显像,最终达到功能学显像与结构组织显像的统一。
发展和应用mr/光学双模态分子影像技术的基础是构建mr/光学双模态探针。mr/光学双模态探针可以分为两类。(1)基于钆的mr/光学双模态探针。钆螯合物具有高t1弛豫率,是临床常用的mr探针。将荧光小分子染料和钆螯合物通过化学键结合可以制备出mr/光学双模态探针。如harrison等将gd(ⅲ)螯合物直接与近红外荧光染料ir-783化学偶联构建mr/光学双模态探针(j.am.chem.soc.,2015,137(28),9108~9116)。(2)基于纳米氧化铁的mr/光学双模态探针。纳米氧化铁具有较好的t2弛豫率,是获得临床应用的mr探针。与钆螯合物存在潜在肾毒性相比,纳米氧化铁具有更好的安全性。yen,s.k.等首先用两亲性聚乙烯马来酸酐共聚物改性近红外荧光染料ir-820,然后将其对纳米氧化铁表面进行修饰得到mr/光学双模态探针(acsnano,2013,7(8),6796~6805)。用于光学成像的探针以荧光小分子染料居多,存在荧光量子效率低、光稳定性差等缺点,影响其应用。
以2,2,6,6-四甲基哌啶-1-氧自由基(2,2,6,6-tetramethylpiperidinooxy,tempo)为代表的稳定有机自由基含有自旋单电子,具有超磁性,氧化还原性能、良好的光热稳定剂和生物活性,广泛应用在已应用为蛋白质、核酸类酯和药物分子的新型自旋标记物、不稳定自由基的俘获剂、醇类氧化剂和生物探针[anal.chem.1996,68(21),3815~3821]。因其自旋单电子生产的超磁性,tempo等有机自由基具有高t1弛豫性能,可以作为mri造影剂应用在细胞及分子水平的mri成像。如用tempo修饰多肽和dna,发现该类含有机自由基大分子显示出高的水质子弛豫时间[magn.reson.chem.2008,46(11),1055~1058]。许乙凯等设计合成了含tempo的丙炔胺衍生物和含聚乙二醇的丙炔胺衍生物,反应得到含tempo聚合物pa-tempo;采用叶酸和荧光素化学修饰含tempo聚合物,构建得到可视化含tempo聚炔衍生物,将其应用为mr/光学双模态探针(zl201410548407)。但是采用荧光素作为光学报告基团,存在光稳定差的缺点。
具有共轭主链结构的聚芴得到了广泛关注。聚芴显示出高荧光量子效应,良好的光稳定性,低细胞毒性和生物相容性好的优点,广泛应用为荧光探针和光学传感器.但是未见含有机自由基聚芴的设计合成及其mri/光学成像的报道。
技术实现要素:
本发明要解决的技术问题是提供一种离子化的含有机自由基聚芴,该聚芴具有良好的生物相容性和光稳定性,可作为荧光/mri双模态探针用于mr分子成像和光学分子成像。
本发明解决上述问题的技术方案是:
一种离子化的含有机自由基聚芴,该聚芴是由化学式(i)所示的重复结构单元构成的聚合物,其数均分子量(简称mn)为8000~17000,分散性指数(简称pdi)为2.00~3.00,
上述离子化的含有机自由基聚芴,其数均分子量较好为9000~11000,分散性指数较好为2.16~2.24。
一种离子化的含有机自由基聚芴的制备方法,该方法包括以下步骤:
(1)将化学式(ii)所示化合物和化学式(iii)所示的化合物进行suzuki偶合反应得含有机自由基聚芴,
(2)将含有机自由基聚芴在四氢呋喃︰三甲胺=7︰3体积比的混合溶液中离子化得到所述离子化的含有机自由基聚芴。
上述方法中,所述化学式(ii)所示化合物为已知化合物,其具体制备方法是将4-氨基-2,2,6,6-四甲基哌啶-1-氧自由基和2,5-二碘苯甲酸反应得到的。
上述方法中,所述化学式(iii)所示化合物为已知化合物,其具体制备方法是可按文献(acsmacrolett.2015,4,453~457)所述方法合成。
上述方法中,所述的suzuki偶合反应具体是,将1摩尔量的化学式(ii)所示化合物,1摩尔量的化学式(iii)所示化合物和适量pd(pph3)4,在适量甲苯和k2co3水溶液中,80℃下反应12~24h。
上述suzuki偶合反应的反应式如下述化学式(iv)所示,
上述离子化的反应式如下述化学式(v)所示,
上述方法中,步骤(2)所述离子化的反应条件为,室温反应3~7天。
本发明所述的离子化的含有机自由基聚芴可作为荧光/mri双模态探针用于mr分子成像和光学分子成像。
本发明所述离子化的含有机自由基聚芴具有π-π共轭主链,显示出良好的荧光特性和光稳定性,可以应用为光学成像;同时含有2,2,6,6-四甲基哌啶-1-氧自由基,该2,2,6,6-四甲基哌啶-1-氧自由基具有超顺磁性,因此可以应用为mri对比剂;本发明所述离子化的含有机自由基聚芴还具有良好的光稳定性和光学活性,低细胞毒性,高生物相容性和良好的t1弛豫率,可以应用为光学/mri双模态对比剂,对细胞和活体动物内进行荧光/mri双模态成像。
附图说明
图1为离子化的含有机自由基聚芴的荧光光谱和uv-vis光谱图。
图2为离子化的含有机自由基聚芴的t1wi图像(左图)及拟合的t1弛豫率曲线(右图)。
图3为离子化的含有机自由基聚芴作用于a549细胞24h存活率直方图。
图4为离子化的含有机自由基聚芴作用于a549细胞随时间变化的标准化荧光强度图。
图5为流式细胞仪检测离子化的含有机自由基聚芴作用于a549细胞的荧光强度对比图,其中左边空白组,右边为实验组。
图6为离子化的含有机自由基聚芴作用于a549细胞的t1wimr图像。
图7为离子化的含有机自由基聚芴作用于a549细胞的t1wimr的信号直方图。
图8为荷瘤裸鼠注射离子化的含有机自由基聚芴前后的mri成像效果图,其中,左边为t1wimr图像,右边为信号直方图。
具体实施方式
下面用具体实施例来进一步详细描述本发明的制备方法及其效果。
实施例1
(1)化学式(ii)所示化合物的制备
取4-氨基-2,2,6,6-四甲基哌啶-1-氧自由基(氨基tempo)(1.71g,10mmol),2,5-二碘苯甲酸(3.73g,10mmol)和nhs(1.15g,10mmol)加入50ml二氯甲烷中,搅拌均匀后加入edc.hcl(1.91g,10mmol),室温下反应过夜。有机溶剂相分别用酸、nahco3和盐水洗涤。干燥后过硅胶柱(etoac/hexane=2/1,v/v)得到红色固体3.16g。
化合物的表征
1hnmr(400mhz,dmso-d6)δ(ppm):8.29~8.31(d,1h),7.50(s,1h),7.48~7.49(d,1h),7.03~7.12(d,1h),1.81~1.84(d,1h),1.43~1.49(t,1h),1.13~1.15(t,12h).
13cnmr(100mhz,dmso-d6)δ(ppm):166.67,152.49,145.14,140.85,139.11,135.95,128.52,116.79,111.58,94.08,93.26,57.91,44.58,32.66,19.68.
hr-ms(esi):c16h21i2n2o2m/z,526.9692for[m+na]+:549.9581.
核磁测量条件为:加入2倍的苯肼,反应0.5h后测量。
以上数据证明上述制备的化合物为化学式(ii)所示化合物。
(2)含有机自由基聚芴的合成
在schlenk管中,将化学式(ii)所示化合物与化学式(iii)所示化合物(按acsmacrolett.2015,4,453~457所述方法合成)suzukicoupling反应。具体步骤如下:取1mmol化学式(ii)所示化合物、1mmol化学式(iii)所示化合物和适量pd(pph3)4加入schlenk管中,加入5ml甲苯和3mlk2co3水溶液(1m),80℃下反应16小时,反应液倒入甲醇中,沉淀过滤干燥至恒重。
1hnmr(400mhz,dmso-d6)δ(ppm)=7.26~8.54(m,9h),3.64~4.15(m,5h),1.78~1.97(m,10h),1.07~1.66(m,28h).
ir:3439.12,2975.86,2929.37,2854.23,1716.98,625.56,1462.10,1424.92,1362.97,1315.68,1232.02,1177.79,1140.61,1077.86,1002.71,885.73,822.98,785.02,751.71,685.09,634.73,563.46.核磁测量条件为:加入2倍的苯肼,反应0.5h后测量。
(3)离子化的含有机自由基聚芴的合成
取500mg含有机自由基聚芴溶解在14ml四氢呋喃中,室温搅拌混合均匀,加入6ml三甲胺,室温搅拌5天。反应后旋转蒸发除去溶剂,最后冷冻干燥得到如化学式(i)所示的离子化的含有机自由基聚芴,该化合物的核磁数据如下:
1hnmr(400mhz,dmso-d6)δ(ppm)=7.12~8.62(m,9h),3.51~4.33(m,23h),1.77~2.21(m,10h),0.98~1.63(m,28h)。
离子化的含有机自由基聚芴的重均分子量和数均分子量使用jascogulliversystem(pu-980,co-965,ri-930,anduv-1570)凝胶渗透色谱仪进行测定。配备聚苯乙烯凝胶柱(shodexcolumnsk804,k805,andj806),用thf作为洗脱剂,聚苯乙烯作为标准校正,30℃下测定。检测发现离子化的含有机自由基聚芴的mw=21312,mn=9867,pdi=2.16。
(4)离子化的含有机自由基聚芴的荧光发射光谱和紫外吸收光谱
在10ml容量瓶中将离子化的含有机自由基聚芴配置约成100μmol/l的储备液,并用移液枪取1ml转移至10ml烧瓶中,使用双蒸水稀释至刻度,得到样品溶液。制备后室温下放置8min后进行测定。紫外吸收光谱使用岛津uv-2450分光光度计于室温下进行检测;荧光发射光谱使用带有氙灯和1.0cm石英池的日立f-4500荧光分光光度计进行,选择365nm激发波长,激发和发射狭缝宽度均为1nm。
离子化的含有机自由基聚芴的光学特性如图1所示。从图1中可看出离子化的含有机自由基聚芴在420nm处显示出一强荧光发射峰,在365nm紫外光激发下显示蓝色荧光。
(5)离子化的含有机自由基聚芴的t1弛豫率
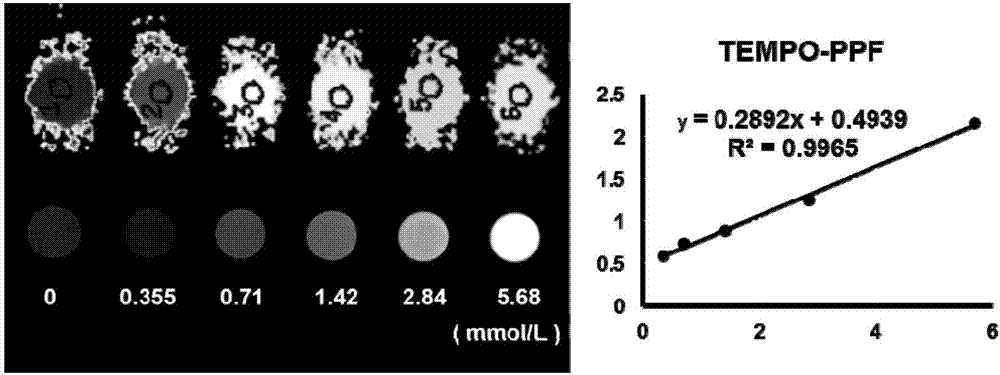
用超纯水将离子化的含有机自由基聚芴配成浓度分别为0、0.625、1.25、2.5、5.0、10.0mg/ml的溶液,分装在7个5ml的ep管中,每管2ml,采用philipsachieva3.0t磁共振,8通道头线圈进行扫描,扫描参数为:ir=50,75,100,150,200,250,300,400,500,600,700,800,900,1000ms,te=10ms,tr=3000ms,层厚:3mm,层间距:0.5mm,fov=120×100×60mm,nsa=2。
不同浓度离子化的含有机自由基聚芴溶液在tr=600ms时的t1wi图像和后处理伪彩图tempo如图2所示,随着离子化的含有机自由基聚芴溶液浓度升高,t1信号逐渐增强。结果显示含有机自由基聚芴具有良好的t1弛豫性能。
(6)离子化的含有机自由基聚芴的体外细胞毒性实验
采用标准的mtt法和a549细胞检测离子化的含有机自由基聚芴的体外细胞毒性。将离子化的含有机自由基聚芴溶于无菌pbs缓冲液中,并稀释得到6个浓度分别为0、0.355、0.71、1.42、2.84、5.68mmol/l的培养基悬液,每组设6个复孔;将a549细胞按6000个/孔接种于96孔细胞培养板上,培养24h后吸去培养液,加入上述不同浓度的培养基悬液,仅含完全培养基而无细胞孔作为调零孔。共培养24h后,加入mtt(5mg/ml)溶液10μl,继续培养4h后,吸去培养液,每孔加入150uldmso,置于平板震荡仪震荡15min,在酶标仪中测定波长为490nm的吸光度值(od值),并按照以下公式计算细胞存活率:细胞存活率(%)=(实验孔od值-调零孔od值)/(对照孔od值-调零孔od值)×100%。
离子化的含有机自由基聚芴溶液与a549细胞共孵育24h,细胞存活率如图3所示,随着聚合物浓度的增大,a549细胞的存活率有所下降,但在浓度高达5.68mmol/l的情况下,细胞存活率仍有80%以上,说明离子化的含有机自由基聚芴的细胞毒性低,生物安全性较好。
(7)离子化的含有机自由基聚芴的体外荧光成像
a549细胞和mg63细胞分别按1.5×105和1×105个/孔接种于共聚焦皿中,置于5%co2、37℃培养箱中培养24h至对数生长期。分为2组,分别为实验组和对照组。实验组加入离子化的含有机自由基聚芴的培养基悬液浓度为0.71mmol/l,各组加入液体1ml。共孵育4h后,吸去上清并用pbs缓冲液洗涤2遍,4%多聚甲醛1ml固定15min。固定结束后,用pbs缓冲液洗涤2遍置于共聚焦显微镜下观察。
离子化的含有机自由基聚芴溶液与a549、mg63细胞共孵育4h后的共聚焦显微镜图像显示与离子化的含有机自由基聚芴共孵育后的a549、mg63细胞形态正常,胞质内可见明显的蓝色荧光,而细胞核未见染色颗粒进入,核完整且形态良好。细胞的荧光成像结果表明离子化的含有机自由基聚芴具有良好的细胞穿透性和荧光成像效果。
(8)离子化的含有机自由基聚芴的体外荧光光稳定性检测
a549细胞按1.5×105个/孔接种于共聚焦皿中,置于5%co2、37℃培养箱中培养24h至对数生长期。加入浓度为0.71mmol/l的离子化的含有机自由基聚芴培养基悬液,共孵育4h后,吸去上清并用pbs缓冲液洗涤2遍后置于共聚焦显微镜下,激发波长和发射波长分别设置为:ex=405nm,em=570nm,对同一层面的细胞持续照射并每间隔60s拍摄1次,总照射时间为15min。获取图片后使用imagej软件对各个时间点拍摄的图片的荧光强度进行半定量分析。
离子化的含有机自由基聚芴的光稳定性使用共聚焦显微镜对染色细胞进行连续15min的照射来评价,如图4所示,经过15min的连续照射,荧光强度仍有75%以上,说明离子化的含有机自由基聚芴的光稳定性较好。
(9)流式细胞仪评价离子化的含有机自由基聚芴的体外细胞摄取
将a549细胞的单细胞悬液按2×105个/孔接种于6孔细胞培养板上,培养24h至对数生长期备用。分为2组,分别为实验组和空白组。实验组每孔加入浓度为0.71mmol/l的离子化的含有机自由基聚芴的培养基悬液1ml,空白组加入dmem完全培养液1ml,共孵育4h后,吸去上清并用pbs缓冲液洗涤2遍,加入胰酶消化3min左右至70~80%的细胞变圆时终止消化,分组离心收集细胞沉淀,细胞沉淀再用pbs重悬洗涤2遍,最后加入500μlpbs重悬细胞置于流式细胞仪下检测。
离子化的含有机自由基聚芴与a549细胞共孵育4h后流式细胞仪检测结果如图5所示,以细胞荧光强度来评价离子化的含有机自由基聚芴的标记成功率。空白组的荧光强度为119,实验组的荧光强度为6561,标记率约为98%,进一步证实了离子化的含有机自由基聚芴可被a549细胞摄取。
(10)磁共振评价离子化的含有机自由基聚芴的体外细胞磁共振成像效果
将a549细胞的单细胞悬液按1×106个/孔接种于大培养皿上,培养24h至对数生长期备用。分为2组,分别为实验组和空白组,每组设3个复孔。实验组每孔加入浓度为1.42mmol/l的离子化的含有机自由基聚芴的培养基悬液6ml,空白组加入dmem完全培养液6ml,共孵育4h后,吸去上清并用pbs缓冲液洗涤2遍,加入胰酶消化,分组离心收集细胞沉淀,细胞沉淀再用pbs重悬洗涤3遍,最后将细胞沉淀转移至1.5ml的ep管中,快速、均匀加入150μl浓度为1%的琼脂糖凝胶,并制备仅含有1%的琼脂糖凝胶的对照组以备用。
将上述制备好的ep管置于试管架中,并放在装有与ep管中琼脂糖液面水平的水槽中,使用philipsachieva3.0t磁共振、头颅8通道线圈进行扫描,扫描序列、方位以及参数如下:t1witse序列;冠状位;翻转角90°,tr=500ms,te=10ms,层厚4mm,层间距0,nsa=8。测量三个ep管同一层面中央区域的信号强度和背景噪声,按以下公式计算信噪比:
snr=si/noise,重复3次。使用spss20.0统计软件,采用one-wayanova进行统计学分析,两两比较根据方差齐性结果分别采用lsd法(方差齐)或snk法(方差不齐)进行比较。p<0.05认为差异有统计学差异。
各组的t1wi图像及信号强度统计图如图6和7所示,可以看出,空白组的snr低于纯琼脂糖组,而实验组的snr明显高于空白组及纯琼脂糖组,实验组与另外两组的差异存在统计学差异(p<0.05)。说明离子化的含有机自由基聚芴可以使被摄取的细胞的t1wi信号增强。上述结果说明离子化的含有机自由基聚芴在细胞内显示良好的mri成像性能。
(11)a549肺癌荷瘤裸鼠模型的建立
将含有1×107个/150μl的a549细胞悬液接种于4~6周龄的scid雄性裸鼠右侧肩背部皮下,共接种6只。正常饲养约30天待肿瘤最大直径达到1.0~1.5cm时,随机分为体内荧光实验组和体内mri成像组,每组3只,备用。
(12)离子化的含有机自由基聚芴的体内急性毒性实验
取4~6周龄的scid磁性裸鼠3只,将0.4~0.5ml浓度为2.84mmol/l的离子化的含有机自由基聚芴与生理盐水混合液经裸鼠尾静脉注入,随后正常喂养饲养1周,期间观察其皮毛、活动状态等健康状况是否存在异常。1周后,行颈椎脱臼法处死裸鼠,快速取出其主要脏器,如心、肺、肝、脾、肾,经he染色置于正置显微镜下观察各器官细胞的形态变化。
一般状态观察:注射离子化的含有机自由基聚芴的裸鼠健康状况良好,活动、进食正常,体重无减轻。
he染色观察:与空白组相比,注射离子化的含有机自由基聚芴的裸鼠各主要脏器(心、肝、脾、肺、肾)无明显损害,细胞形态基本正常,无明显变性、坏死,基本同空白组,说明离子化的含有机自由基聚芴对正常裸鼠无明显急性毒副作用。
(13)离子化的含有机自由基聚芴的瘤内荧光成像及荧光免疫病理学检测
取4~6周龄的scid雌性裸鼠3只,腹腔注射0.3~0.45ml0.3%的戊巴比妥钠溶液,待裸鼠麻醉后,行活体荧光成像扫描,扫描完成后快速用胰岛素针从裸鼠瘤内注入100~150μl浓度为2.84mmol/l的离子化的含有机自由基聚芴与生理盐水混悬液,并在注射后的60、120min行活体荧光成像扫描,以观察瘤内荧光强度的变化。活体荧光扫描部分参数设置如下:白光:曝光时间=0.175s,fov=138.0mm,ex=em=0;荧光:曝光时间=30s,fov=138.0mm,ex=410nm,em=523nm。
活体荧光实验后行颈椎脱臼法处死裸鼠,快速取出其肿瘤组织,放入-80℃冰箱进行速冻,并在适当避光的前提下行冰冻切片制片后置于正置荧光显微镜下观察。
荷瘤裸鼠经瘤内注射离子化的含有机自由基聚芴后,瘤内荧光信号逐渐增强,打药后荧光信号明显高于打药前,且冰冻切片亦见注射了离子化的含有机自由基聚芴的肿瘤区域内显著的蓝色荧光,而注射了生理盐水组几乎无蓝色荧光,说明离子化的含有机自由基聚芴在活体瘤内聚集时可在活体成像仪上显示差异。
(14)离子化的含有机自由基聚芴的瘤内mr成像
取4~6周龄的scid雌性裸鼠3只,腹腔注射0.3~0.45ml0.3%的戊巴比妥钠溶液,待裸鼠麻醉后,固定于磁共振上行mr扫描,扫描完成后快速用胰岛素针从裸鼠瘤内注入100~150μl浓度为2.84mmol/l的离子化的含有机自由基聚芴与生理盐水混悬液,并在注射后120min再次行mri扫描,以观察瘤内t1wi信号强度的变化。活体mr扫描部分参数设置如下:tr=500ms,te=10ms,fov=120×80×17mm,层数=8,层厚=2mm,层间距=0,nsa=3。扫描结束后,选择合适层面,使用imagej软件进行伪彩后处理,选取适宜中心部位画出roi,并测量肿瘤平扫和增强后同一层面roi的信号强度,使用spss20.0统计软件,采用两样本t检验进行统计学分析,p<0.05认为差异有统计学差异。
离子化的含有机自由基聚芴作用于荷瘤裸鼠的mri结果如图8所示,瘤内注射离子化的含有机自由基聚芴后,瘤内mrt1wi信号逐渐增强,经伪彩后处理的结果亦显示打药后瘤内信号高于打药前,两者差异具有统计学差异(p<0.05)。说明离子化的含有机自由基聚芴在活体瘤内聚集时可在磁共振上显示差异。
实施例2
(1)化学式(ii)所示化合物的制备
依据实施例1步骤1所述方法制备
(2)含有机自由基聚芴的合成
在schlenk管中,将化学式(ii)所示化合物与化学式(iii)所示化合物suzukicoupling反应。具体步骤如下:取1mmol化学式(ii)所示化合物、1mmol化学式(ii)所示化合物和适量pd(pph3)4加入schlenk管中,加入5ml甲苯和3mlk2co3水溶液(1m),80℃下反应20小时,反应液倒入甲醇中,沉淀过滤干燥至恒重。
(3)离子化的含有机自由基聚芴的合成
取200mg含有机自由基聚芴溶解在7ml四氢呋喃中,室温搅拌混合均匀,加入3ml三甲胺,室温搅拌7天。反应后旋转蒸发除去溶剂,最后冷冻干燥得到如化学式(i)所示的离子化的含有机自由基聚芴。
采用实施例1步骤(3)所述方法检测离子化的含有机自由基聚芴的分子量,其结果是离子化的含有机自由基聚芴的mw是36412,mn是12687,pdi是2.87。
(4)mtt法检测细胞生长活性
以hela细胞作为模型细胞,采用mtt法检测细胞生长活性。其步骤同实施例1步骤6。结果显示其细胞毒性低,生物相容性好。
(5)细胞培养和成像
以hela细胞作为模型细胞,考察步骤3制备的离子化的含有机自由基聚芴的荧光成像性能。其步骤同实施例1步骤7。细胞的荧光成像结果表明发现离子化的含有机自由基聚芴具有良好的细胞穿透性和荧光成像效果.
(6)离子化的含有机自由基聚芴的光稳定性
以hela细胞作为模型细胞,考察步骤3制备的离子化的含有机自由基聚芴的光稳定性。其步骤同实施例1步骤8。光稳定性结果显示离子化的含有机自由基聚芴具有较好的光稳定性。
(7)离子化的含有机自由基聚芴的hela细胞体外mr成像实验
以hela细胞作为模型细胞,考察步骤3制备的离子化的含有机自由基聚芴的mri成像性能。其步骤同实施例1步骤10。细胞的mri成像结果表明离子化的含有机自由基聚芴在细胞内显示良好的mri成像性能。
实施例3
(1)化学式(ii)所示化合物的制备
依据实施例1步骤1所述方法制备
(2)含有机自由基聚芴的合成
在schlenk管中,将化学式(ii)所示化合物与化学式(iii)所示化合物suzukicoupling反应。具体步骤如下:取1mmol化学式(ii)所示化合物、1mmol化学式(iii)所示化合物和适量pd(pph3)4加入schlenk管中,加入5ml甲苯和3mlk2co3水溶液(1m),80℃下反应18小时,反应液倒入甲醇中,沉淀过滤干燥至恒重。
(3)离子化的含有机自由基聚芴的合成
取200mg含有机自由基聚芴溶解在7ml四氢呋喃中,室温搅拌混合均匀,加入3ml三甲胺,室温搅拌5天。反应后旋转蒸发除去溶剂,最后冷冻干燥得到如化学式(i)所示的离子化的含有机自由基聚芴。
采用实施例1步骤3所述方法检测离子化的含有机自由基聚芴的分子量,其结果是离子化的含有机自由基聚芴的mw=24385,mn=10886,pdi=2.24。
(4)mtt法检测细胞生长活性
以pc3细胞作为模型细胞,采用mtt法检测细胞生长活性。其步骤同实施例1步骤6。结果显示其细胞毒性低,生物相容性好。
(5)细胞培养和成像
以pc3细胞作为模型细胞,考察步骤3制备的离子化的含有机自由基聚芴的荧光成像性能。其步骤同实施例1步骤7。细胞的荧光成像结果表明发现离子化的含有机自由基聚芴具有良好的细胞穿透性和荧光成像效果.
(6)离子化的含有机自由基聚芴的光稳定性
以pc3细胞作为模型细胞,考察步骤3制备的离子化的含有机自由基聚芴的光稳定性。其步骤同实施例1步骤8。光稳定性结果显示离子化的含有机自由基聚芴具有较好的光稳定性。
(7)离子化的含有机自由基聚芴的hela细胞体外mr成像实验
以pc3细胞作为模型细胞,考察步骤3制备的离子化的含有机自由基聚芴的mri成像性能。其步骤同实施例1步骤10。细胞的mri成像结果表明离子化的含有机自由基聚芴在细胞内显示良好的mri成像性能。
实施例4
(1)化学式(ii)所示化合物的制备
依据实施例1步骤1所述方法制备
(2)含有机自由基聚芴的合成
在schlenk管中,将化学式(ii)所示化合物与化学式(iii)所示化合物suzukicoupling反应。具体步骤如下:取1mmol化学式(ii)所示化合物、1mmol化学式(iii)所示化合物和适量pd(pph3)4加入schlenk管中,加入5ml甲苯和3mlk2co3水溶液(1m),80℃下反应24小时,反应液倒入甲醇中,沉淀过滤干燥至恒重。
(3)离子化的含有机自由基聚芴的合成
取200mg含有机自由基聚芴溶解在7ml四氢呋喃中,室温搅拌混合均匀,加入3ml三甲胺,室温搅拌4天。反应后旋转蒸发除去溶剂,最后冷冻干燥得到如化学式(i)所示的离子化的含有机自由基聚芴。
采用实施例1步骤3所述方法检测离子化的含有机自由基聚芴的分子量,其结果是离子化的含有机自由基聚芴的mw=50806,mn=16879,pdi=3.01。
(4)mtt法检测细胞生长活性
以ht55细胞作为模型细胞,采用mtt法检测细胞生长活性。其步骤同实施例1步骤6。结果显示其细胞毒性低,生物相容性好。
(5)细胞培养和成像
以ht55细胞作为模型细胞,考察步骤3制备的离子化的含有机自由基聚芴的荧光成像性能。其步骤同实施例1步骤7。细胞的荧光成像结果表明发现离子化的含有机自由基聚芴具有良好的细胞穿透性和荧光成像效果.
(6)离子化的含有机自由基聚芴的光稳定性
以ht55细胞作为模型细胞,考察步骤3制备的离子化的含有机自由基聚芴的光稳定性。其步骤同实施例1步骤8。光稳定性结果显示离子化的含有机自由基聚芴具有较好的光稳定性。
(7)离子化的含有机自由基聚芴的hela细胞体外mr成像实验
以ht55细胞作为模型细胞,考察步骤3制备的离子化的含有机自由基聚芴的mri成像性能。其步骤同实施例1步骤10。细胞的mri成像结果表明离子化的含有机自由基聚芴在细胞内显示良好的mri成像性能。
实施例5
(1)化学式(i)所示化合物的制备
依据实施例1步骤1所述方法制备
(2)含有机自由基聚芴的合成
在schlenk管中,将化学式(ii)所示化合物与化学式(iii)所示化合物suzukicoupling反应。具体步骤如下:取1mmol化学式(i)所示化合物、1mmol化学式(ii)所示化合物和适量pd(pph3)4加入schlenk管中,加入5ml甲苯和3mlk2co3水溶液(1m),80℃下反应12小时,反应液倒入甲醇中,沉淀过滤干燥至恒重。
(3)离子化的含有机自由基聚芴的合成
取200mg含有机自由基聚芴溶解在7ml四氢呋喃中,室温搅拌混合均匀,加入3ml三甲胺,室温搅拌3天。反应后旋转蒸发除去溶剂,最后冷冻干燥得到如化学式(i)所示的离子化的含有机自由基聚芴。
采用实施例1步骤3所述方法检测离子化的含有机自由基聚芴的分子量,其结果是离子化的含有机自由基聚芴的mw=16549,mn=8152,pdi=2.03。
(4)mtt法检测细胞生长活性
以lovo细胞作为模型细胞,采用mtt法检测细胞生长活性。其步骤同实施例1步骤6。结果显示其细胞毒性低,生物相容性好。
(5)细胞培养和成像
以lovo细胞作为模型细胞,考察步骤3制备的离子化的含有机自由基聚芴的荧光成像性能。其步骤同实施例1步骤7。细胞的荧光成像结果表明发现离子化的含有机自由基聚芴具有良好的细胞穿透性和荧光成像效果.
(6)离子化的含有机自由基聚芴的光稳定性
以lovo细胞作为模型细胞,考察步骤3制备的离子化的含有机自由基聚芴的光稳定性。其步骤同实施例1步骤8。光稳定性结果显示离子化的含有机自由基聚芴具有较好的光稳定性。
(7)离子化的含有机自由基聚芴的hela细胞体外mr成像实验
以lovo细胞作为模型细胞,考察步骤3制备的离子化的含有机自由基聚芴的mri成像性能。其步骤同实施例1步骤10。细胞的mri成像结果表明离子化的含有机自由基聚芴在细胞内显示良好的mri成像性能。
- 还没有人留言评论。精彩留言会获得点赞!