胰岛β细胞条件性敲除Tmem30a基因小鼠模型的构建方法及应用与流程
本发明涉及医学工程技术领域,特别涉及一种胰岛β细胞条件性敲除tmem30a基因小鼠模型的构建方法及应用。
背景技术:
真核细胞细胞膜上的磷脂分子分布是不对称的。一般情况下磷酸酰丝氨酸(phosphatidylserine,ps)和磷酸酰乙醇胺(phosphatidyetholanie,pe)分布在细胞的内膜,磷酸酰胆碱(phosphatidylcholine,pc)分步在外膜。真核细胞基因组编码14个p4型atpase内翻酶来维持这种脂质分子的不对称分布。ps和pe在细胞膜上不对称分布对重要细胞生理过程如膜稳定、血液凝聚反应调控、囊泡蛋白运输、清除凋亡细胞都至关重要。atp8b1,atp8a2和atp11c基因突变导致数种人类疾病,揭示了p型atp酶的重要性。atp8b1导致i型渐进式家族性肝内胆汁淤积(progressivefamilialintrahepaticcholestasistypei)和复发型肝内胆汁淤积。atp8a2突变导致小脑共济失调、智力发育迟缓和平衡缺乏综合症。atp11c缺失导致b细胞发育缺陷,贫血和肝内胆汁淤积。
p4型atp酶需要结合蛋白tmem30才能正确折叠和运输。tmem30和na-katp酶的β亚基作用相似,参与p4型atp酶的催化反应过程。真核生物基因组编码三个tmem30蛋白,所以一个tmem30蛋白需结合多个p4型atp酶。tmem30a广泛表达在多个组织,在视网膜感光细胞中也特异表达。tmem30a在人类染色体上定位于6号染色体短臂,由7个外显子组成,其转录本大小为2kb,编码的蛋白大小为44kd,各组织内普遍都有表达。
经序列分析,tmem30a在真核生物中高度保守,含有两个膜锚定区域,并具有糖基化位点。tmem30a的体内功能还不甚明了,对其研究尚处于初步阶段。有必要通过构建动物和细胞模型对其功能进行系统的研究。
糖尿病(diabetesmellitus,dm)发病率不断攀升,已成为严重危害人类健康的公共卫生问题。dm会引起病人多个器官并发症,不仅严重影响患者的生活质量,同时也可导致残障、死亡。目前对糖尿病的发病机制了解尚不清楚。合适的糖尿病动物模型,对阐明dm及其并发症的发病机制十分重要。
技术实现要素:
有鉴于此,本发明利用胰岛β细胞cre转基因鼠,构建了tmem30a胰岛β细胞特异敲除小鼠模型,以便研究其在胰岛里的功能。
因此,本发明一方面旨在提供一种胰岛β细胞条件性敲除tmem30a基因小鼠模型的构建方法。本发明另一方面旨在提供该胰岛β细胞条件性敲除tmem30a基因小鼠模型用于糖尿病研究。
在第一方面,本发明提供了一种胰岛β细胞条件性敲除tmem30a基因小鼠模型的构建方法,包括以下步骤:
1)将与小鼠tmem30a基因同源的5’臂、含有报告基因lacz的表达框、有neo抗性基因的表达框、两端有同向排列loxp位点的第3外显子和3’端臂克隆到bac载体以用于替换欲敲除的tmem30a基因第3个外显子;
2)利用dna同源重组技术将tmem30a基因中的第3个外显子替换,得到tmem30a基因条件性敲除的小鼠胚胎干细胞;
3)利用步骤2)得到的胚胎干细胞制备得到含tmem30a基因敲除细胞的嵌合体小鼠;
4)将步骤3)得到的嵌合体小鼠和野生型小鼠交配繁育,在后代中筛选出tmem30a基因敲除的杂合子小鼠;
5)将步骤4)得到的杂合子小鼠动物与转基因鼠flper鼠交配繁育,得到tmem30a基因条件性敲除杂合子小鼠;
6)将步骤5)得到的tmem30a基因条件性敲除杂合子小鼠相互交配繁育,得到tmem30a基因条件性敲除纯合子小鼠;
7)将步骤6)得到的tmem30a基因条件性敲除纯合子小鼠与胰岛β细胞特异的转基因鼠ins2-cre交配,得到胰岛β细胞条件性敲除tmem30a基因小鼠tmem30aloxp/loxp,ins2-cre。
进一步地,步骤2)中,利用tmem30a敲除的打靶载体tmem30atm1a(komp)wtsi转染小鼠胚胎干细胞,获得含有打靶序列的胚胎干细胞;所述打靶载体有如下特征:
5’端长臂为4201;3’端端长臂为5123bp。在tmem30a第二个内含子内放置有en2剪接接受位点(splicingaccepting),ires后面是lacz基因表明序列,ploya序列;
loxp位点后是人βactin启动子和新霉素(neomysin)编码序列,以便于药物筛选;
另外有两个frt位点在两端,以便使用flp工具书鼠删除报告基因;
第三个外显子两端有同方向的loxp序列,以便使用cre删除第三个外显子,建立组织特异的敲除小鼠模型(详见图1)。
进一步地,步骤3)中,具体制备方法是:将单个步骤2)获得的胚胎干细胞显微注射到小鼠胚囊中,并移植到假孕动物的子宫中,分娩出含tmem30a突变细胞的嵌合体动物。
进一步地,步骤4)中,整合到生殖系的嵌合体动物与野生型动物c57bl/6j交配后,得到的子一代代动物通过使用长距离pcr筛选得到tmem30a基因敲除杂合子个体;将tmem30a基因敲除杂合子与flper基因敲入小鼠交配,删除两个frt位点之间的报告基因,得到含有两个loxp位点的条件性敲除小鼠杂合子个体tmem30aloxp/+。
本发明人通过实验发现,tmem30a基因全身敲除纯合子小鼠死于胚胎期9.5-12.5天,成功分娩出的是含tmem30a基因敲除的杂合子小鼠tmem30ako/+。
根据本发明的部分步骤或全部步骤,本发明可以提供出tmem30a基因条件性敲除杂合子小鼠tmem30aloxp/+和纯合子小鼠tmem30aloxp/loxp,以及胰岛β细胞条件性敲除tmem30a基因小鼠tmem30aloxp/loxp,ins2-cre。
在另一方面,本发明提供了上述胰岛β细胞条件性敲除tmem30a基因小鼠模型的应用,该胰岛β细胞条件性敲除tmem30a基因小鼠模型用于作为糖尿病研究的模型。
发明人发现,胰岛β细胞条件性敲除tmem30a基因小鼠表现出葡萄糖不耐受,胰岛素敏感性差,可用作糖尿病研究模型。
附图说明
图1.tmem30a突变的打靶载体示意图。
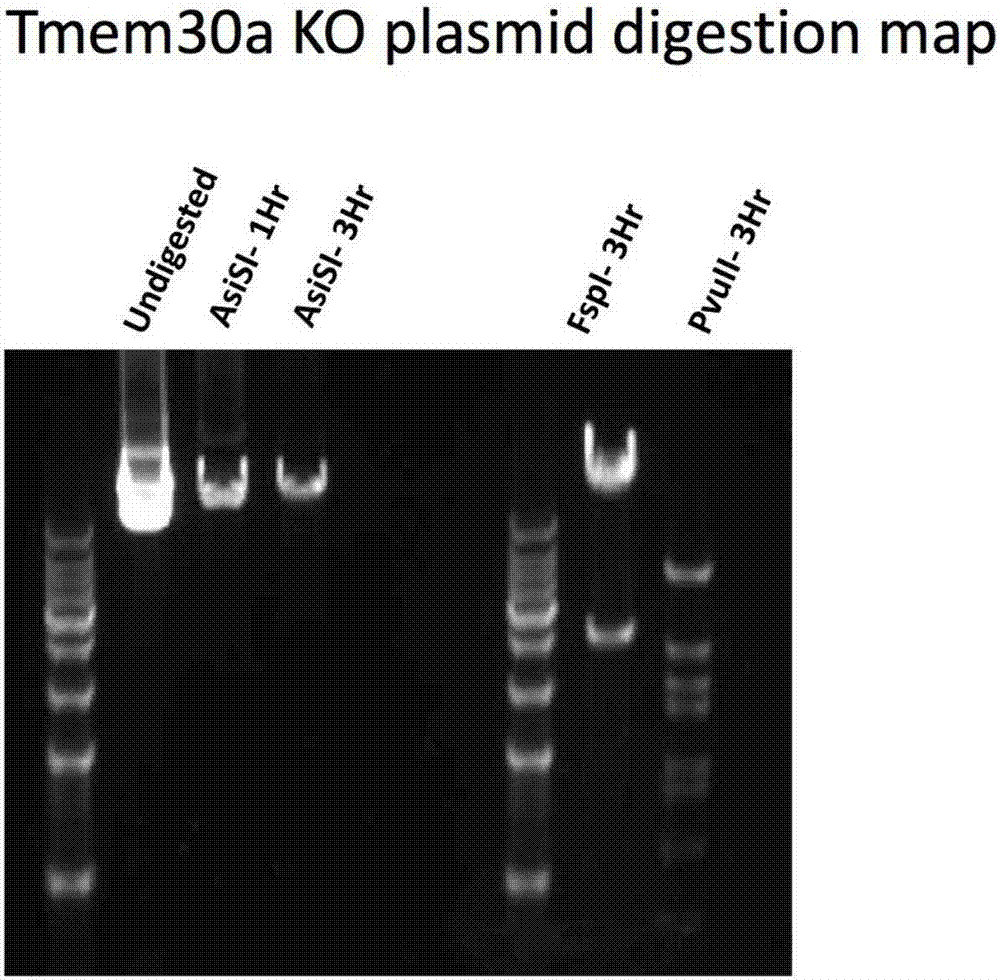
图2.tmem30a打靶载体酶切图谱,打靶载体仅有1个ascsi酶切位点,酶切后成为线性质粒。
图3.实施例1中长距离pcr扩增5’端长臂筛选转染的小鼠胚胎干细胞实验结果,使用引物对gf3和lar3,扩增产物为5.8kb。
图4.实施例1中长距离pcr扩增3’端长臂筛选转染的小鼠胚胎干细胞实验结果,使用引物对raf5和gr3,扩增产物为6.6kb。
图5.实施例2中长距离pcr鉴定阳性子一代鼠的实验结果,扩增5’端长臂使用引物对gf3和lar3,扩增产物为5.8kb;扩增3’端长臂使用引物对raf5和gr3,扩增产物为6.6kb;其中:204-1为阳性杂合子,204-2为野生型对照。
图6.实施例3中tmem30a条件性敲除模型的构建示意图。
图7.实施例3中tmem30a敲除杂合子基因型鉴定结果,其中:(a)是对第三外显子上游的loxp位点的pcr鉴定结果,扩增片段为220bp;(b)是对人βactin启动子上游的loxp位点的pcr鉴定结果,扩增片段为214bp;(c)是对第三外显子下游的loxp位点的pcr鉴定结果,突变型扩增片段为214bp,野生型扩增片段为179bp。
图8.实施例3中pcr鉴定tmem30a条件性敲除鼠的实验结果,对第三外显子下游的loxp位点做pcr鉴定,其中:野生型扩增的片段为179bp(泳道3);纯合子(loxp/loxp)扩增片段为214bp(泳道1和4);杂合子(loxp/+)扩增片段为两条:214bp和179bp(泳道2)。
图9.与胰岛β细胞特异的cre(ins2-cre)交配建立胰岛β细胞特异敲除动物模型(简称ins2-tmem30ako)。需要两次交配,才能得到胰岛β细胞特异敲除小鼠ins2tmem30ako。
图10.pcr鉴定胰岛β细胞特异敲除小鼠,ins2tmem30ako需要使用引物对tmem-loxp-f2:attccccttcaagatagctac;
tmem-loxp-r2:aatgatcaactgtaattcccc通过pcr反应对第三外显子下游的loxp位点做pcr鉴定。野生型扩增的片段为179bp(wt);纯合子(loxp/loxp)扩增片段为214bp;杂合子(loxp/+)扩增片段为两个:214bp和179bp。另外对ins2-cre转基因进行基因型鉴定,所使用的引物对是:cre-f,5’-atttgcctgcattaccggtc–3’;cre-r,5’-atcaacgttttcttttcgg-3’。扩增的pcr产物片段为350bp,野生型无扩增片段。
图11.显示ins2tmema30ako小鼠葡萄糖不耐受。
图12.显示ins2tmema30ako小鼠对胰岛素敏感性差。
图13.显示ins2tmema30ako小鼠肝脏脂肪积累。
具体实施方式
下面结合具体实施例进一步阐述本发明。应当理解,这些实施例仅用于说明本发明而不用于限制本发明的范围。下列实施例中未注明具体条件的实验方法和技术,通常按照所属领域的常规条件或按照制造厂商所建议的条件进行。
实施例1.tmem30a杂合子小鼠的获得
1)将打靶载体tmem30atm1a(komp)wtsi(从美国children'shospitaloaklandresearchinstitute购买)线性化之后,通过电击转染小鼠胚胎干细胞129sv,扩增培养胚胎干细胞,筛选500个克隆,得到两株包含有正确打靶序列的胚胎干细胞g6和a11。
tmem30a打靶载体tmem30atm1a(komp)wtsi结构如图1所示,5’端长臂为4201bp,3’端长臂为5123bp;在第二个内含子内放置有en2剪接接受位点(splicingaccepting,sa),ires后面是lacz基因编码序列,ploya序列(pa);loxp位点后是人βactin启动子和新霉素(neomysin)编码序列(neo),以便于药物筛选;另外有两个frt位点在两端,以便使用flp工具鼠删除报告基因;第三个外显子(e3)两端有同方向的loxp序列,以便使用cre删除第三个外显子,建立组织特异的基因敲除小鼠模型。
本实施例1以第三个外显子为具体实施例进行说明,本发明包括但不限于在第三个外两端加入同向排列的loxp位点以构建条件性基因敲除小鼠,本发明还可以在第1,2,4,5,6或7等其他外显子两端加入同向排列的loxp位点以构建条件性基因敲除小鼠。
将图1所示的打靶载体用asisi内切酶消化2小时进行线性化,如图2所示。
2)扩增步骤1)筛选的克隆g6,胰酶消化成单个细胞后,用显微囊胚注射的方法注入到c57bl/6j小鼠囊胚中,移植胚胎到假孕鼠子宫,得到整合tmem30a突变细胞的嵌合体雄小鼠。该嵌合体雄性小鼠与野生型雌性小鼠交配,得到的小鼠通过pcr筛选出tmem30a基因敲除(简称tmem30ako)杂合子小鼠,命名为tmem30atm1xzhu。
图3和图4是长距离pcr筛选转染的小鼠胚胎干细胞的结果。扩增5’端长臂使用引物对gf3和lar3,扩增产物为5.8kb片段(图3)。扩增3’端长臂使用引物对raf5和gr3,扩增产物为6.6kb(图4)。仅有第一个96孔板的d11和第二个96孔板的g6含有正确的5’端和3’端长臂。各引物序列如下:
gf3:5’-gaggaagcggaagtgtaagttaccaag-3’(seqidno:1);
lar3:5’-cacaacgggttcttctgttagtcc-3’(seqidno:2);
raf5:5’-cacacctccccctgaacctgaaac-3’(seqidno:3);
gr3:5’-gtgtgaagtcaacgtcattatcggagaatc-3’(seqidno:4)。
实施例2.tmem30a敲除小鼠纯合子死于胚胎期9.5-12.5天
选用c57bl/6/129sv杂合背景的小鼠作为实验用小鼠。
实施例1获得的tmem30ako杂合子小鼠与c57bl/6j小鼠交配,得到的c57bl/6/129sv杂合背景的tmem30ako杂合子小鼠可正常出生,且符合孟德尔规律。tmem30ako杂合子小鼠和野生型小鼠相比,无明显差异。我们对tmem30ako杂合子小鼠间交配产生的后代进行pcr等方法进行检测,结果参见图5,没有发现有存活的tmem30ako纯合子小鼠出生。接着我们对其后代进行统计,野生型和杂合子所占的比例分别是1/3和2/3(表1)。此结果符合纯合子胚胎致死后的孟德尔遗传规律。
表1.统计学分析tmem30ako杂合子小鼠间交配的后代
为了确定tmem30ako纯合子小鼠胚胎死亡的确切时间,我们分离了9.5-12.5天的胚胎。结合pcr等基因型检测手段,以及通过胚胎形态学观察发现,12.5天的胚胎中没有tmem30ako纯合子胚胎的存在;在9.5和10.5天的胚胎中,tmem30ako纯合子发育迟缓,个体比野生型和杂合子小鼠小,且随着天数的增加,个体差异更加明显。
实施例3.tmem30a条件性敲除小鼠构建
tmem30ako纯合子致死影响了对其功能的深入研究。为了能在各个组织中详细研究tmem30a的体内功能,需要建立tmem30a条件性敲除小鼠。
将tmem30ako杂合子与flpdeleter(美国杰克森实验室引进,品系名b6.129s4-gt(rosa)26sortm1(flp1)dym/rainj,又称flper)鼠交配,所生的后代基因组中两个frt之间的en2-ires-lacz-hact-neo序列将被删除,仅保留第3外显子两端的loxp位点(见图6)。此动物模型为tmem30a条件性敲除模型,命名为tmem30atm1.1xzhu,简称为tmem30aloxp。tmem30aloxp/+杂合子与c7bl/6j交配,可以扩大杂合子种群规模。tmem30aloxp/+杂合子交配,可以得到纯合子tmem30aloxp/loxp。
图7显示了tmem30ako杂合子基因型鉴定结果,其中:(a)运用pcr反应对tmem30a敲除杂合子进行检测,对第三外显子上游的loxp位点做pcr鉴定,需要使用如下引物对:
tmem-loxp-f1:5’-gtcgagaagttcctattccga-3’(seqidno:5);
tmem-loxp-r1:5’-tcttcaaatgtttgcccta-3’(seqidno:6);
扩增的片段220bp。
(b)运用pcr反应对人βactin启动子上游的loxp位点做pcr鉴定,需要使用如下引物对:
tmem-loxp-f3:5’-cactgcattctagttgtggtt-3’(seqidno:7);
tmem-loxp-r3:5’-ggacatctcttgggcactga-3’(seqidno:8);
扩增的片段214bp。
(c)运用pcr反应对第三外显子下游的loxp位点做pcr鉴定,需要使用如下引物对:
tmem-loxp-f2:5’-attccccttcaagatagctac-3’(seqidno:9);
tmem-loxp-r2:5’-aatgatcaactgtaattcccc-3’(seqidno:10);
突变子扩增的片段为214bp(mutant),野生型扩增的片段为179bp(wt)。
图8显示了tmem30a条件性敲除鼠的pcr鉴定结果,需要使用如下引物对:
tmem-loxp-f2:5’-attccccttcaagatagctac-3’(seqidno:9);
tmem-loxp-r2:5’-aatgatcaactgtaattcccc-3’(seqidno:10);
通过pcr反应对第三外显子下游的loxp位点做鉴定,其中第1,4道野生型扩增片段179bp(wt);第2道杂合子(flox/+)扩增片段为两条:214bp和179bp;第2道纯合子(loxp/loxp)扩增片段为214bp。
实施例4.tmem30a胰岛β细胞敲除小鼠的构建
tmem30aloxp/loxp纯合子与胰岛β细胞特异的转基因cre(b6.cg-tg(ins2-cre)25mgn/j,简称为ins2-cre)小鼠交配,可以得到tmem30aloxp/+,ins2-cre杂合子,将其再与tmem30aloxp/loxp纯合子交配,即可得到胰岛β细胞特异敲除的tmem30aloxp/loxp,ins2-cre小鼠,简称ins2-tmema30ako小鼠。
使用引物对tmem-loxp-f2和tmem-loxp-r2,通过pcr反应对第三外显子下游的loxp位点做pcr鉴定。如图9所示,野生型扩增的片段为179bp(wt);纯合子(loxp/loxp)扩增片段为214bp;杂合子(loxp/+)扩增片段为两个:214bp和179bp。
另外,对ins2-cre转基因进行基因型鉴定,所使用的引物对是:
cre-f:5’-atttgcctgcattaccggtc-3’(seqidno:11);
cre-r:5’-atcaacgttttcttttcgg-3’(seqidno:12)。
如图9所示,ins2-cre转基因扩增的pcr产物片段为350bp,野生型无扩增片段。
实施例5.tmem30a胰岛β细胞敲除小鼠(ins2-tmema30ako)体重异常,血糖代谢异常
与对照组(以wt表示,tmem30aloxp/loxp基因型)比较,tmem30a胰岛β细胞敲除小鼠敲除动物(以mut表示,tmem30aloxp/loxp,ins2-cre基因型)纯合子动物在3个月开始体重增加,7个月体重平均51克,比对照增加40%(图10)。葡萄糖耐受实验(glucosetolerancetest,gtt)证明,mut动物对葡萄糖不耐受,在注射葡萄糖后血糖迅速升高到33mmol/l,静脉血糖明显比对照组高(图11)。胰岛素耐受实验(insulintolerancetest,itt)证明,mut动物对对胰岛素不敏感,在注射胰岛素后血糖未能如对照组迅速降低,静脉血糖明显比对照组高(图12)。
实施例6.tmem30a胰岛β细胞敲除小鼠肝脏脂肪堆积,结构异常
我们对9个月的野生型和tmem30a胰岛β细胞敲除小鼠的肝脏固定切片后h&e染色观察。
肝脏固定并石蜡切片后he和masson染色,具体步骤如下:
1.组织经固定、脱水、浸蜡和包埋后切片;
2.然后再经脱蜡和补水后苏木素溶液或马苏染液染色约5-15min;
3.蒸馏水洗去多余染料;
4.加入稀释的盐酸酒精溶液中分色,边分色边镜检,至核呈红紫色,细胞质无色;
5.分色后用自来水碱化返兰;
6.再经伊红染液染色,以95%酒精对伊红分色,至胞浆,结缔组织等呈桃红色;
7.染色后的切片,浸入从70%到100%递升的乙醇溶液脱水;
8.浸入二甲苯透明剂,二次(各数分钟),取出切片滴中性树胶后加盖玻片封固。
结果发现,tmem30a胰岛β细胞敲除小鼠的肝脏脂肪积累,含有大量油滴颗粒(图13)。
上文所列出的一系列的详细说明仅仅是针对本发明的可行性实施例的具体说明,它们并非用以限制本发明的保护范围,凡未脱离本发明技艺精神所作的等效实施例或变更均应包含在本发明的保护范围之内。
sequencelisting
<110>朱献军
<120>胰岛β细胞条件性敲除tmem30a基因小鼠模型的构建方法及应用
<130>2017
<160>12
<170>patentinversion3.3
<210>1
<211>27
<212>dna
<213>人工序列
<400>1
gaggaagcggaagtgtaagttaccaag27
<210>2
<211>24
<212>dna
<213>人工序列
<400>2
cacaacgggttcttctgttagtcc24
<210>3
<211>24
<212>dna
<213>人工序列
<400>3
cacacctccccctgaacctgaaac24
<210>4
<211>30
<212>dna
<213>人工序列
<400>4
gtgtgaagtcaacgtcattatcggagaatc30
<210>5
<211>21
<212>dna
<213>人工序列
<400>5
gtcgagaagttcctattccga21
<210>6
<211>19
<212>dna
<213>人工序列
<400>6
tcttcaaatgtttgcccta19
<210>7
<211>21
<212>dna
<213>人工序列
<400>7
cactgcattctagttgtggtt21
<210>8
<211>20
<212>dna
<213>人工序列
<400>8
ggacatctcttgggcactga20
<210>9
<211>21
<212>dna
<213>人工序列
<400>9
attccccttcaagatagctac21
<210>10
<211>21
<212>dna
<213>人工序列
<400>10
aatgatcaactgtaattcccc21
<210>11
<211>20
<212>dna
<213>人工序列
<400>11
atttgcctgcattaccggtc20
<210>12
<211>19
<212>dna
<213>人工序列
<400>12
atcaacgttttcttttcgg19
- 还没有人留言评论。精彩留言会获得点赞!