一种基于侧链含有芳香基团的聚芴类共轭聚合物及其制备方法与应用与流程
本发明涉及有机光电材料技术领域,具体涉及一种基于侧链含有芳香基团的聚芴类共轭聚合物及其制备方法与应用。
背景技术:
在过去的三十年中,有机电子和光电子产业,包括有机/聚合物发光二极管,有机场效应晶体管,有机太阳能电池等领域得到了迅猛的发展,并逐渐实现产业化。有机电子产品具有价格低廉,体轻便携等优点。使其具有极大的市场潜力。因此开发具有市场吸引力的有机电子产品吸引了世界上众多研究机构和科研团队的关注,而在这其中,开发新型高效稳定的材料成为关键。
聚芴类材料被认为是最有应用前景的聚合物半导体材料之一。这主要是因为芴单元的全碳原子共轭结构,一方面载流子在单元中传输不受杂原子的影响,另一方面全碳共轭结构的第一激发单线态(s1)态均属于π,π*型,它们的吸收跃迁摩尔吸光系数ε大约为104数量级,比n→π*和n→σ*跃迁大两个数量级以上,相应的荧光跃迁几率高、强度大、量子效率高。此外,芴的c-9是sp3杂化,单元的共轭长度较小、能带隙较宽,使其作为发光材料的光谱较蓝,作为主体链段能够实现有效的能量传输,同时sp3杂化的c-9易于进行多功能化修饰和改性,满足多样化的实用需求。
本发明涉及侧链含有芳香基团的聚芴类共轭聚合物,可以通过调节芳香基团的含量,来诱导聚合物产生不β相。可以使发光器件不仅高效稳定,而且为更蓝的饱和蓝光,同时实现发光器件的发光效率提高,可以满足全彩显示的要求。所以在有机电子显示领域有巨大的发展潜力和前景。
技术实现要素:
本发明的目的在于针对目前聚芴类聚合物发光二极管(pled)面临的问题,提供一种基于侧链含有芳香基团的聚芴类共轭聚合物。该共轭聚合物可用作发光材料,且具有较好的溶解性,较高的荧光量子产率,适合于溶液加工和喷墨打印,具有良好的发展前景。
本发明的目的还在于提供所述一种基于侧链含有芳香基团的聚芴类共轭聚合物的制备方法。
本发明的目的还在于提供所述一种基于侧链含有芳香基团的聚芴类共轭聚合物在制备有机发光二极管的发光层中的应用。
本发明通过如下技术方案实现。
一种基于侧链含有芳香基团的聚芴类共轭聚合物,具有如下化学结构:
式中,r为芳基、三苯胺、碳原子数1-20的直链或支链烷基,或为碳原子数1-20的烷氧基;0≤x≤1;聚合度m=1-300;
ar1为如下结构中的任意一种:
其中,n=1-3;r1为碳原子数1-20的直链或者支链烷基,或为碳原子数1-20的烷氧基。
所述的一种基于侧链含有芳香基团的聚芴类共轭聚合物的制备方法,包括如下步骤:
在氩气氛围下,用烷基化方法将烷基化后的含ar1单元的芳香基团接在芴的c-9位,经过suzuki聚合反应,完成萘并茚芴单元与接枝含ar1单元芳香基团的芴的聚合,最后依次采用苯硼酸和溴苯进行封端反应,得到所述基于侧链含有芳香基团的聚芴类共轭聚合物。
进一步地,所述suzuki聚合反应的温度为80~100℃,时间为24~48小时。
进一步地,采用苯硼酸和溴苯进行封端反应的温度均为80~100℃,时间均为12~24小时。
所述的一种基于侧链含有芳香基团的聚芴类共轭聚合物应用于制备有机发光二极管的发光层,将所述基于侧链含有芳香基团的聚芴类共轭聚合物用有机溶剂溶解,再通过旋涂、喷墨打印或印刷成膜,得到所述有机发光二极管的发光层。
进一步地,所述有机溶剂包括氯苯。
与现有技术相比,本发明具有以下优点:
(1)本发明的基于侧链含有芳香基团的聚芴类共轭聚合物,由于其侧链含有芳香基团,可以诱导产生聚芴类聚合物的β相,有利于聚合物的发光效率的提高;
(2)本发明的基于侧链含有芳香基团的聚芴类共轭聚合物,具有较好的溶解性,基于该聚合物的发光层在制备电致发光器件时不用退火处理,使得制备工艺更简单。
附图说明
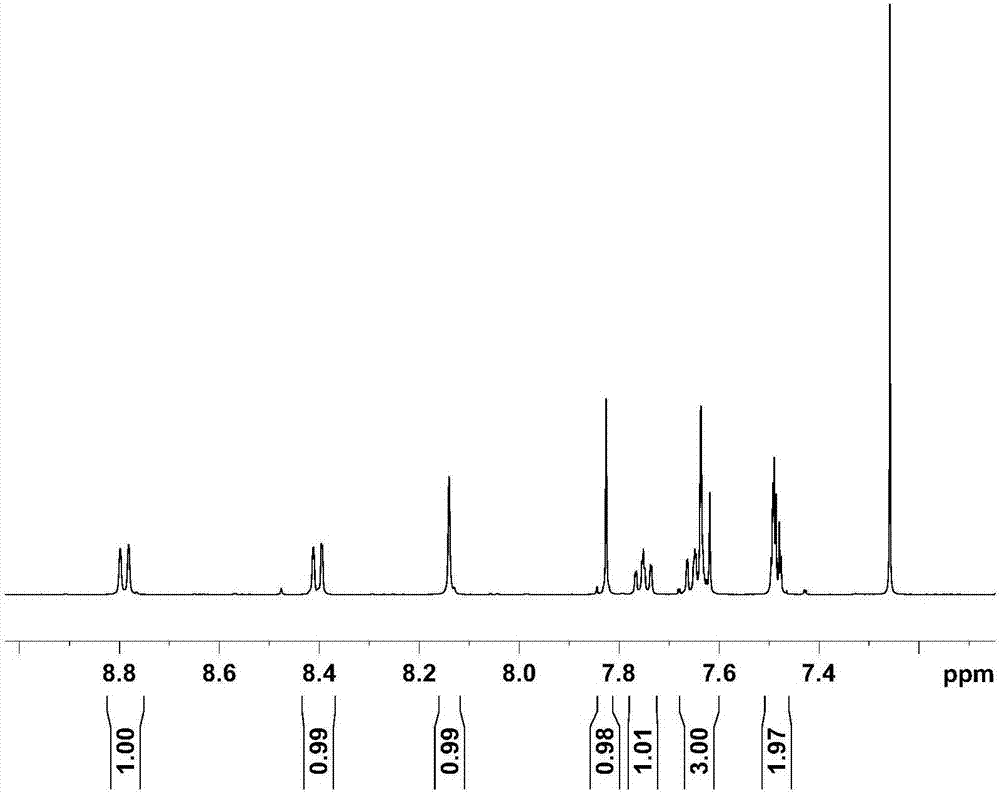
图1a为萘并茚芴的1hnmr谱图;
图1b为萘并茚芴的1hnmr谱图中芳环部分的化学位移的放大示意图;
图2为聚合物pnf-so在薄膜状态下的紫外-可见吸收光谱谱图;
图3为聚合物pnf-cz在薄膜状态下的紫外-可见吸收光谱谱图;
图4为聚合物pfo-fo在薄膜状态下的光致发光光谱谱图;
图5为基于聚合物pnf-fo的电致发光器件的电流密度-流明效率图。
具体实施方式
下面结合实施例,对本发明作进一步地详细说明,但本发明的实施方式不限于此。
实施例1
2-溴芴的制备
在250ml三口瓶中,加入芴(16.6g,0.1mol)、铁粉(88mg,1.57mmol)和三氯甲烷100ml;冰水浴冷却,滴加溴(17.6g,0.1mol)/三氯甲烷混合溶液35ml,滴加时瓶内温度不超过5℃;反应完毕,过滤、氯仿重结晶,得白色固体19.3g,产率84%。1hnmr、13cnmr、ms和元素分析结果表明所得到的化合物为目标产物。化学反应方程式如下所示:
实施例2
2-溴-9,9-二辛基芴的制备
在三口瓶中加入2-溴芴(7.4g,0.03mol)、苄基三乙基氯化铵(0.07g,0.3mmol)、二甲基亚砜90ml和45ml氢氧化钠水溶液(50wt%),室温下搅拌形成悬浮液;滴加1-溴正辛烷(12.5g,65mmol),继续搅拌3小时后,用乙醚萃取,用饱和氯化钠水溶液洗涤乙醚相,无水硫酸镁干燥;蒸去溶剂,产物用石油醚作洗脱剂柱层析提纯,得白色固体。1hnmr、13cnmr、ms和元素分析结果表明所得到的化合物为目标产物。化学反应方程式如下所示:
实施例3
2-硼酸酯-9,9-二辛基芴的制备
在氩气气氛下,将2-溴-9,9-二辛基芴(5g,10.65mmol)溶解于180ml精制的thf中,在-78℃下逐渐滴加1.6mol.l-1的正丁基锂28ml,反应2小时,然后加入2-异丙氧基-4,4,5,5-四甲基-1,3,2-二氧杂硼烷25ml,在-78℃下继续反应1小时,升温至室温反应24小时;将反应混合物倒入水中,用乙酸乙酯萃取,有机层用食盐水完全洗涤后,加无水硫酸镁干燥;溶液浓缩后,得到浅黄色粘稠状粗品,用硅胶柱层析提纯(洗脱剂选择石油醚/乙酸乙酯=20/1,v/v),产物长时间放置冰箱中得到白色固体,产率70%。1hnmr、13cnmr、ms和元素分析结果表明所得到的化合物为目标产物。化学反应方程式如下所示:
实施例4
1-溴二萘甲酸甲酯
在氩气气氛下,将1-溴-2-萘甲酸(10g,39.83mmol)加入两口瓶中,再加入100ml甲醇,然后逐滴加入浓硫酸(39.06mg,398.29umol),加热到110℃,反应18h;将反应混合物倒入水中,用乙酸乙酯萃取,有机层用食盐水完全洗涤后,加无水硫酸镁干燥;溶液浓缩后,得到白色固体粗品,用硅胶柱层析提纯(洗脱剂选择石油醚/二氯甲烷=3/1,v/v),产物长时间放置冰箱中得到白色固体,产率85%。1hnmr、13cnmr、ms和元素分析结果表明所得到的化合物为目标产物。化学反应方程式如下所示:
实施例5
化合物m1的制备
在氩气氛围下,将2-硼酸酯-9,9-二辛基芴(5g,9.68mmol)和1-溴二萘甲酸甲酯(2.69g,10.16mmol)加入到两口瓶中,再加入100ml甲苯进行完全溶解,再加入碳酸钠(5.13g,43.89mmol)和四丁基溴化铵(312.01mg,967.86umol),在110℃下反应18h;将反应混合物倒入水中,用乙酸乙酯萃取,有机层用食盐水完全洗涤后,加无水硫酸镁干燥;溶液浓缩后,用硅胶柱层析提纯(洗脱剂选择石油醚/二氯甲烷=5/1,v/v),最终得到白色固体,产率80%。1hnmr、13cnmr、ms和元素分析结果表明所得到的化合物为目标产物。化学反应方程式如下所示:
实施例6
化合物m2的制备
在氩气氛围下,将m1(5g,8.70mmol)加入单口瓶中,再加入50ml无水thf直到完全溶解;再将反应液在0℃下反应1h,再逐滴加入c8h17mgbr(正辛基溴化镁),混合液在室温下反应18h;将水加入到反应液中来淬灭反应,用乙酸乙酯萃取,有机层用食盐水完全洗涤后,加无水硫酸镁干燥;溶液浓缩后,用硅胶柱层析提纯(洗脱剂选择石油醚/二氯甲烷=3/1,v/v),产物长时间放置冰箱中得到白色固体,产率80%。1hnmr、13cnmr、ms和元素分析结果表明所得到的化合物为目标产物。化学反应方程式如下所示:
实施例7
化合物m3的制备
在氩气氛围下,将m2(5g,6.48mmol)溶于50ml二氯甲烷中,在室温下逐滴加入三氟化硼乙醚溶液(439.59mg,6.48mmol),反应18h;用乙酸乙酯萃取,有机层用食盐水完全洗涤后,加无水硫酸镁干燥;溶液浓缩后,用硅胶柱层析提纯(洗脱剂选择石油醚),产物长时间放置冰箱中得到白色固体,产率90%。1hnmr、13cnmr、ms和元素分析结果表明所得到的化合物为目标产物。化学反应方程式如下所示:
实施例8
萘并茚芴(nif)的制备
在氩气氛围下,将m3(5g,6.64mmol)溶于50ml二氯甲烷中,再加入铁粉(185.35mg,3.32mmol),再逐滴加入液溴(1.06g,6.64mmol),在室温下反应18h;用乙酸乙酯萃取,有机层用食盐水完全洗涤后,加无水硫酸镁干燥;溶液浓缩后,用硅胶柱层析提纯(洗脱剂选择石油醚),产率70%。1hnmr、13cnmr、ms和元素分析结果表明所得到的化合物为目标产物,其化学反应方程式如下所示:
制备的萘并茚芴的1hnmr谱图如图1a所示,图1a显示,1hnmr(500mhz,cdcl3)δ8.79(d,j=8.4hz,1h),8.40(dd,j=8.5,0.9hz,1h),8.14(s,1h),7.83(s,1h),7.75(ddd,j=8.3,6.9,1.2hz,1h),7.67–7.59(m,3h),7.49(dd,j=4.2,2.4hz,2h),2.18–1.99(m,8h),1.20–0.92(m,36h),0.75(dt,j=12.6,7.1hz,12h),0.61(ddd,j=51.1,13.2,7.0hz,8h);其中,芳环部分的化学位移的放大示意图如图1b所示。
实施例9
化合物m4的制备
在氩气气氛下,将萘并茚芴(5g,4.65mmol)溶解于180ml精制的thf中,在-78℃下逐渐滴加1.6mol.l-1的正丁基锂14ml,反应2小时,然后加入2-异丙氧基-4,4,5,5-四甲基-1,3,2-二氧杂硼烷25ml,在-78℃下继续反应1小时,升温至室温反应24小时;将反应混合物倒入水中,用乙酸乙酯萃取,有机层用食盐水完全洗涤后,加无水硫酸镁干燥;溶液浓缩后,得到浅黄色粘稠状粗品,用硅胶柱层析提纯(洗脱剂选择石油醚/乙酸乙酯=20/1,v/v),产物长时间放置冰箱中得到白色固体,产率70%。1hnmr、13cnmr、ms和元素分析结果表明所得到的化合物为目标产物。化学反应方程式如下所示:
实施例10
2-溴二苯并[b,d]噻吩
在氩气氛围下,二苯并[b,d]噻吩(11g,60mmol)和碘(0.17g,3mmol)加入到两口瓶中,加入氯仿进行完全溶解,冰浴下搅拌;液溴(3.1ml,60mmol)加入到混合体系中,室温下反应16小时;加入饱和的亚硫酸氢钠溶液淬灭反应,用乙酸乙酯萃取三次,有机层用食盐水完全洗涤后,加入无水硫酸镁干燥;溶剂浓缩之后,用硅胶柱层析提纯。产率80%。1hnmr(500mhz,cdcl3)δ(ppm)8.27(d,1h),8.10(m,1h),7.85(m,1h),7.70(d,1h),7.54(d,1h),7.24(m,2h)。化学反应方程式如下所示:
实施例11
2-(8-溴辛基)二苯并[b,d]噻吩
在氩气氛围下,2-溴二苯并[b,d]噻吩(3.3g,12.5mmol)溶解在无水thf中,在-78℃下搅拌20分钟,接着正丁基锂(3.3g,12.5mmol)加入到混合液中,在-78℃下搅拌2小时,1,8-二溴辛烷(11g,45mmol)加入到反应体系中,-78℃下搅拌1小时;向反应体系中加入水淬灭反应,用乙酸乙酯萃取三次,有机层用食盐水完全洗涤后,加入无水硫酸镁干燥;溶剂浓缩之后,用硅胶柱层析提纯。产率70%。1hnmr(500mhz,cdcl3)δ(ppm)8.18-8.12(m,1h),7.96(d,j=1.1hz,1h),7.89-7.82(m,1h),7.75(d,j=8.2hz,1h),7.48-7.42(m,2h),7.29(dd,j=8.2and1.7hz,1h),3.41(td,j=6.8and4.4hz,2h),2.86-2.74(m,2h),1.85(m,2h),1.71(m,2h),1.49-1.28(m,8h).13cnmr(125mhz,cdcl3)δ(ppm)139.97,139.36,136.83,135.83,135.66,127.79,126.67,124.34,123.00,122.63,121.63,121.29,36.12,34.07,32.95,31.99,29.47,29.30,28.72,28.19。化学反应方程式如下所示:
实施例12
2-(8-溴辛基)二苯并[b,d]噻吩-5,5-二氧(4)
在氩气氛围下,2-(8-溴辛基)二苯并[b,d]噻吩和40ml醋酸加入到反应体系中,再加入8ml双氧水,油浴升温至120℃,反应16小时;用乙酸乙酯萃取三次,有机层用食盐水完全洗涤后,加入无水硫酸镁干燥;溶剂浓缩之后,用硅胶柱层析提纯。产率70%。1hnmr(500mhz,cdcl3)δ(ppm)7.80(dd,j=12.1and7.6hz,2h),7.73(d,j=7.9hz,1h),7.63(td,j=7.6and1.1hz,1h),7.58(d,j=0.7hz,1h),7.52(td,j=7.6and0.9hz,1h),7.33(dd,j=7.9and1.2hz,1h),3.40(t,j=6.8hz,2h),2.77-2.69(m,2h),2.10(s,2h),1.93-1.80(m,2h),1.49-1.27(m,8h)。化学反应方程式如下所示:
实施例13
9-(8-溴辛基)-9h-咔唑(5)
在氩气氛围下,将9h-咔唑(5g,29.9mmol)和碳酸钾(20.66g,149.52,mmol)加入到两口瓶中,再加入60ml的n,n-二甲基甲酰胺进行完全溶解,混合液在室温下搅拌两个小时,1,8-二溴辛烷(24.40g,89.71mmol)加入到混合液中,油浴升温至110℃,反应12小时;用乙酸乙酯萃取三次,有机层用食盐水完全洗涤后,加入无水硫酸镁干燥;溶剂浓缩之后,用硅胶柱层析提纯。产率75%。1hnmr(500mhz,cdcl3)δ(ppm)8.11(d,j=7.7hz,2h),7.47(m,2h),7.41(d,j=8.2hz,2h),7.25-7.20(m,2h),4.31(t,j=7.2hz,2h),3.38(t,j=6.8hz,2h),1.94-1.73(m,4h),1.34(m,8h)。化学反应方程式如下所示:
实施例14
2-溴芴
在三口瓶中加入2-溴芴(9.7g,0.035mol)、苄基三乙基氯化铵(0.07g,0.35mmol)、二甲基亚砜90ml、45ml氢氧化钠水溶液(50wt%),室温下搅拌形成悬浮液;加入1-溴正辛烷(12.5g,65mmol),继续搅拌3小时后,用乙醚萃取;用饱和氯化钠水溶液洗涤乙醚相,无水硫酸镁干燥;蒸去溶剂,产物用石油醚作洗脱剂柱层析提纯,得白色固体。1hnmr、13cnmr、ms和元素分析结果表明所得到的化合物为目标产物。制备过程化学反应方程式如下所示:
实施例15
2-(溴辛基)-9,9-二辛基芴
在氩气氛围下,2-溴芴(3.3g,2.5mmol)溶解在无水thf中,在-78℃下搅拌20分钟,接着正丁基锂(3.3g,2.5mmol)加入到混合液中,在-78℃下搅拌2小时,1,8-二溴辛烷(11g,45mmol)加入到反应体系中,-78℃下搅拌1小时;向反应体系中加入水淬灭反应,用乙酸乙酯萃取三次,有机层用食盐水完全洗涤后,加入无水硫酸镁干燥;溶剂浓缩之后,用硅胶柱层析提纯。产率70%。1hnmr(500mhz,cdcl3)δ(ppm)7.64(dd,j=7.4,1.2hz,1h),7.58(dd,j=7.3,1.0hz,1h),7.33–7.27(m,3h),7.24(d,j=6.1hz,1h),7.14–7.08(m,2h),2.72–2.61(m,8h),0.81(m,32h),0.67–0.54(m,10h)。化学反应方程式如下所示:
实施例16
2,7-二溴-9-辛基-9h-芴
在氩气氛围下,2,7-二溴-9h-芴(10g,30.86mmol),氢氧化钾(860.80mg,15.43mmol)和正辛醇(19.94g,154.32mmol)加入到250ml两口瓶中,油浴升温至110℃,反应24小时;将混合液冷却至室温,用乙酸乙酯萃取三次,有机层用食盐水完全洗涤后,加入无水硫酸镁干燥;溶剂浓缩之后,用硅胶柱层析提纯。产率78%。1hnmr(500mhz,cdcl3)δ(ppm)7.81(d,2h),7.51(s,1h),7.42(s,1h),7.36(t,2h),4.03(t,1h),2.02-2.10(m,2h),1.22-1.41(m,12h),0.94(t,3h)。化学反应方程式如下所示:
实施例17
9-(8-(2,7-二溴-9-辛基-9h-芴)-9-基)辛基)-9h-咔唑(m5)
在氩气氛围下,将2,7-二溴-9-辛基-9h-芴(5g,11.46mmol),四丁基溴化铵(184.75mg,573.10umol)加入到两口瓶中,再加入50ml二甲基亚砜,进行完全溶解;接着加入氢氧化钠水溶液,室温下搅拌2小时;再加入9-(8-溴辛基)-9h-咔唑(4.11g,11.46mmol),室温下反应24小时;反应液用乙酸乙酯萃取三次,有机层用食盐水完全洗涤后,加入无水硫酸镁干燥;溶剂浓缩之后,用硅胶柱层析提纯。产率85%。1hnmr(500mhz,cdcl3)δ(ppm)8.12-8.08(m,2h),7.53(d,j=1.4hz,2h),7.43(m,8h),7.20(m,2h),4.28(t,j=7.3hz,2h),2.76(t,j=6.5hz,2h),2.08-1.96(m,2h),1.90-1.76(m,2h),1.40-1.05(m,22h),0.83(t,j=7.2hz,3h).13cnmr(125mhz,cdcl3)δ(ppm)148.55,140.56,138.66,132.10,127.39,125.69,122.94,122.19,121.40,120.47,118.81,108.80,87.71,63.70,43.21,40.10,31.91,30.01,29.83,29.47,29.31,29.24,29.09,27.42,25.90,23.39,22.74,14.22。化学反应方程式如下所示:
实施例18
2-(8-(2,7-二溴-9-辛基-9h-芴-9-基)辛基)二苯并[b,d]噻吩-5,5-二氧(m6)
在氩气氛围下,将2,7-二溴-9-辛基-9h-芴(5g,11.46mmol),四丁基溴化铵(184.75mg,573.10umol)加入到两口瓶中,再加入50ml二甲基亚砜,进行完全溶解;接着加入氢氧化钠水溶液,室温下搅拌2小时;再加入2-(8-溴辛基)二苯并[b,d]噻吩-5,5-二氧(4.67g,11.46mmol),室温下反应24小时;反应液用乙酸乙酯萃取三次,有机层用食盐水完全洗涤后,加入无水硫酸镁干燥;溶剂浓缩之后,用硅胶柱层析提纯。产率85%。1hnmr(500mhz,cdcl3)δ(ppm)7.81(d,j=7.6hz,1h),7.77(d,j=7.7hz,1h),7.71(d,j=7.9hz,1h),7.63(td,j=7.6and1.1hz,1h),7.55(d,j=0.8hz,1h),7.54-7.49(m,3h),7.46-7.42(m,4h),7.29(dd,j=7.9and1.3hz,1h),2.83-2.50(m,2h),1.95-1.84(m,4h),1.58(dd,j=15.4and7.8hz,2h),1.23(m,16h),0.83(t,j=7.2hz,5h),0.61-0.53(m,4h).13cnmr(125mhz,cdcl3)δ(ppm)152.66,150.04,139.23,138.42,135.31,133.85,131.99,130.68,130.35,130.32,126.30,122.30,122.20,121.62,121.57,121.30,55.83,40.31,40.21,36.32,31.90,31.25,29.99,29.86,29.34,29.31,29.29,29.12,23.75,23.67,22.74,14.21。化学反应方程式如下所示:
实施例19
化合物m7的制备
在氩气氛围下,将2,7-二溴-9-辛基-9h-芴(5g,11.46mmol),四丁基溴化铵(184.75mg,573.10umol)加入到两口瓶中,再加入50ml二甲基亚砜,进行完全溶解;接着加入氢氧化钠水溶液,室温下搅拌2小时;再加入2-(8-溴辛基)-9,9-二辛基芴(4.27g,11.46mmol),室温下反应24小时;反应液用乙酸乙酯萃取三次,有机层用食盐水完全洗涤后,加入无水硫酸镁干燥;溶剂浓缩之后,用硅胶柱层析提纯。产率85%。1hnmr(500mhz,cdcl3)δ7.64(d,j=7.2hz,1h),7.57(d,j=8.1hz,1h),7.51(d,j=7.9hz,2h),7.47–7.42(m,4h),7.32–7.27(m,2h),7.24(s,1h),7.09(d,j=7.0hz,2h),2.62(t,j=7.7hz,34h),0.82(dt,j=10.6,7.2hz,12h),0.59(d,j=5.2hz,8h)。化学反应方程式如下所示:
实施例20
聚合物pnf-so的合成
在氩气氛围下,将化合物m4(321.28mg,0.5mmol)萘并茚芴(268.73mg,0.49mmol)和m6(7.63mg,0.01mmol)加入到两口瓶中,再加入10ml甲苯进行完全溶解;加入醋酸钯(3.4mg,0.015mmol)和三环己基磷(8.4mg,0.03mmol),最后加入有机碱(et4noh)(20%aq,2ml),油浴升温至80℃,混合液反应36小时;随后加入苯硼酸(25mg),继续搅拌12h,以除去聚合物端基未反应完全的溴,然后加入溴苯(1ml),继续搅拌12h,以除去聚合物端基未反应完全的硼酸酯端基;冷却至室温后,将混合液倒入甲醇中沉降;过滤后得到灰色细纤维状固体,干燥后用甲苯作为洗脱液,以氧化铝为填料柱层析,得到的洗脱液浓缩后再次在甲醇中沉降,干燥,得到粉末状固体。再次溶于甲苯,在甲醇中沉降,过滤,干燥后得到粉末状固体。化学反应方程式如下所示:
聚合物pnf-so的薄膜状态下的紫外-可见吸收光谱谱图如图2所示,从图中可以看出,聚合物pnf-so在437nm的位置有一个特征吸收峰,这是β相的特征吸收峰,这表明在聚合物侧链引入so单元,有利于诱导产生β相。
实施例21
聚合物pnf-cz的合成
在氩气氛围下,将化合物m4(321.28mg,0.5mmol),萘并茚芴(268.73mg,0.49mmol)和m5(7.13mg,0.01mmol)加入到两口瓶中,再加入10ml甲苯进行完全溶解;加入醋酸钯(3.4mg,0.015mmol)和三环己基磷(8.4mg,0.03mmol),最后加入有机碱(et4noh)(20%aq,2ml),油浴升温至80℃,混合液反应36小时;随后加入苯硼酸(25mg),继续搅拌12h,以除去聚合物端基未反应完全的溴,然后加入溴苯(1ml),继续搅拌12h,以除去聚合物端基未反应完全的硼酸酯端基;冷却至室温后,将混合液倒入甲醇中沉降;过滤后得到灰色细纤维状固体,干燥后用甲苯作为洗脱液,以氧化铝为填料柱层析,得到的洗脱液浓缩后再次在甲醇中沉降,干燥,得到粉末状固体;再次溶于甲苯,在甲醇中沉降,过滤,干燥后得到粉末状固体。化学反应方程式如下所示:
聚合物pnf-cz的薄膜状态下的紫外-可见吸收光谱谱图,如图3所示,从图中可以看出,聚合物的最大吸收峰位于383nm。
实施例23
聚合物pnf-fo的合成
在氩气氛围下,将化合物m4(321.28mg,0.5mmol),萘并茚芴(268.73mg,0.49mmol)和m7(8.13mg,0.01mmol)加入到两口瓶中,再加入10ml甲苯进行完全溶解;加入醋酸钯(3.4mg,0.015mmol)和三环己基磷(8.4mg,0.03mmol),最后加入有机碱(et4noh)(20%aq,2ml),油浴升温至80℃,混合液反应36小时;随后加入苯硼酸(25mg),继续搅拌12h,以除去聚合物端基未反应完全的溴,然后加入溴苯(1ml),继续搅拌12h,以除去聚合物端基未反应完全的硼酸酯端基;冷却至室温后,将混合液倒入甲醇中沉降;过滤后得到灰色细纤维状固体,干燥后用甲苯作为洗脱液,以氧化铝为填料柱层析,得到的洗脱液浓缩后再次在甲醇中沉降,干燥,得到粉末状固体;再次溶于甲苯,在甲醇中沉降,过滤,干燥后得到粉末状固体。化学反应方程式如下所示:
聚合物pnf-fo的薄膜状态下的光致发光谱图,如图4所示,从图中可以看出,聚合物的发射峰位于438,462,497nm,这是β相的特征吸收峰,说明在聚合物侧链引入cz基团有利于诱导产生β相。
实施例24
基于聚合物的电致发光器件的制备
在预先做好的方块电阻为20ω/□的氧化铟锡(ito)玻璃上,先依次用丙酮,洗涤剂,去离子水和异丙醇超声清洗,等离子处理10分钟;在ito上旋涂参杂有聚苯乙烯磺酸的聚乙氧基噻吩(质量比pedot:pss=1:1)膜,厚度为150nm;pedot:pss膜在真空烘箱里80℃下干燥8小时;随后将聚合物发光材料pnf-so、pnf-cz和pno-fo的氯苯溶液(1wt%)分别旋涂在pedot:pss膜的表面,厚度为80nm,作为发光层;最后在发光层上依次蒸镀一薄层csf(1.5nm)和120nm厚的金属al层。
对得到的电致发光器件分别进行光电性能测试,结果如表1所示。
表1基于聚合物得到的电致发光器件的光电性能指标
由表可知,以聚合物pnf-so、pnf-cz和pnf-fo为发光层的电致发光器件,基于器件结构:ito/pedot/eml/csf/al的最大流明效率依次为2.25cd/a,0.61cd/a,1.4cd/a。
基于聚合物pnf-fo的电致发光器件的电流密度-流明效率谱图如图5所示,从图中可以看出,聚合物的最大流明效率依次为1.4cd/a。
上述实施例为本发明较佳的实施方式,但本发明的实施方式并不受上述实施例的限制,其它任何未背离本发明的精神实质与原理下所作的改变、修饰、替代、组合、简化均应为等效的置换方式,都包含在本发明的保护范围之内。
- 还没有人留言评论。精彩留言会获得点赞!