细胞穿透肽的亲脂性化合物偶联物及其在抗菌中的应用的制作方法
本发明涉及抗菌领域中一类细胞穿透肽的亲脂性化合物偶联物及其在抗菌中的应用。
背景技术:
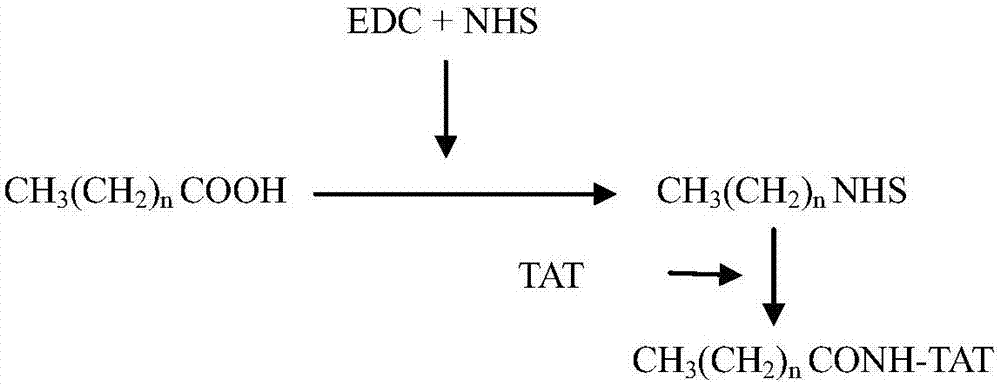
:抗生素一直是临床抗感染治疗的主要药物,上世纪40至70年代抗生素的巨大成功,降低了对抗菌药物研发的重视和投入,近40年来全球抗耐药菌药物研发缓慢,新化学骨架和新机理、新靶点的药物推出极少,已知有效的药物(或其衍生物)多年不断地重复使用甚至滥用,导致药效下降,产生耐药性。日益严重的细菌耐药性问题已经得到全球范围的广泛关注。由于各种抗菌药物的耐药菌株不断出现,多重耐药趋势逐渐扩大,对临床用药产生了深远影响,使得耐药问题成为卫生领域的一个新的难题。20世纪60年代,全世界每年死于感染性疾病的人数约700万,而本世纪初上升至2000万;死于败血症的人数上升了89%,其中大部分死于超级耐药的“超级细菌”带来的用药困难。who将2011年世界日的主题确立为“控制抗生素耐药性:今天不采取行动,明天就无药可用”,也再次佐证了细菌耐药的严重性。尤其是多耐药、泛耐药革兰氏阴性菌逐年增加,成为抗感染治疗中的难点。与革兰氏阳性菌相比,革兰氏阴性杆菌(gnb)因为易在抗生素选择性压力下获得或上调耐药相关基因而尤为引人关注。据美国国家医疗安全网络数据显示,gnb占医院获得性感染病原菌的30%以上,是呼吸相关性肺炎和尿路感染中最常见的病原菌。2010年在全球多个地区同时出现的导致广泛耐药的产新德里金属β-内酰胺酶ⅰ型(ndm-1)革兰氏阴性细菌又一次敲响了警钟。这些日益增加的细菌耐药问题及日趋复杂的耐药机制给相关疾病的治疗带来极大的困难,甚至已严重危害了患者的健康和生命。同时,以生物膜形式存在的细菌对抗菌药物、外界环境压力和宿主免疫系统的抵抗力明显增强,这也是导致细菌产生抗药性及感染性疾病难以治疗的重要原因之一。细菌生物膜是由细菌自身分泌的胞外多糖、蛋白质、核酸等组成的胞外基质包裹、相互粘连并附着于一定载体表面生长的高度组织化、系统化的细菌群落。生物膜可由一种或几种细菌混合生长而成。生物膜是细菌在生长过程中为适应生存环境而形成的一种与浮游细菌相对应的生长方式,从整体上表现出一系列与浮游状态细菌不同的新生物学特征,并具有更强的适应外界环境能力。生物膜细菌对抗生素的抗药性达到浮游细菌的1000倍以上,其抗药性多源于生物膜的多细胞结构。据美国国家卫生研究院(nih)初步统计,80%的细菌性疾病与细菌生物膜有关,人体内呼吸道、牙菌斑、体内短期或长期留置的人工装置(如导尿管、人工瓣膜、支架等)上均有细菌生物膜的广泛存在。因此,寻找能够同时针对耐药菌和耐药菌生物膜的抗耐药策略,成为对抗细菌尤其是革兰氏阴性菌耐药问题的主要突破口。抗生素及抗菌药物的使用是控制细菌生物膜感染最基本最常用的手段,但随着细菌耐药性的增加,在研发有效的新型抗菌药物的同时,一些不同于传统抗菌药物的新活性物质及新的治疗手段也开始运用在抗细菌生物膜研究领域。细胞穿透肽(cellpenetratingpeptides,cpps)是一类能够通过多种细胞膜进入细胞的短肽(一般少于35个氨基酸残基)。其发现源于1988年,有学者发现hiv-1的反式激活蛋白tat能跨膜转导至胞内,接着又有人发现果蝇转录蛋白也具有类似特性。学者们从这些转录因子中得到了转导所需要的最短的肽序列并发现它们能将其它大分子(如蛋白、核酸等)导入细胞。此后,其它许多cpp陆续被发现,表1列举了一些比较有代表性的cpp。表1其代表性的cpp临床常见革兰氏阳性致病细菌有:金黄色葡萄球菌(金葡菌,staphylococcusaureus)、表皮葡萄球菌(表葡菌,staphylococcusepidermidis)、化脓链球菌(streptococcuspyogenes)、肺炎链球菌(streptococcuspneumoniae)、粪肠球菌(enterococcusfaecalis)、屎肠球菌(enterococcusfaecium)、结核分枝杆菌(mycobacteriumtuberculosis,mtb)、枯草芽孢杆菌(bacillussubtilis)、短双歧杆菌(bifidobacteriumbreve)和长双歧杆菌(bifidobacteriumlongum)。其中,金黄色葡萄球菌包括耐甲氧西林金黄色葡萄球菌(methicillin-resistantstaphylococcusaureus,mrsa)和甲氧西林敏感金黄色葡萄球菌(methicillin-sensitivestaphylococcusaureus,mssa),肺炎链球菌包括耐青霉素肺炎链球菌(penicillin-resistantstreptococcuspneumonia,prsp)和青霉素敏感肺炎链球菌(penicillin-sensitivestreptococcuspneumoniae,pssp),粪肠球菌包括耐万古霉素粪肠球菌(vancomycin-resistantenterococcusfaecalis,vre)和万古霉素敏感粪肠球菌(vancomycin-sensitiveenterococcusfaecalis,vse),屎肠球菌包括耐万古霉素屎肠球菌(vancomycin-resistantenterococcusfaecium,vre)和万古霉素敏感屎肠球菌(vancomycin-sensitiveenterococcusfaecium,vse)。金黄色葡萄球菌和表皮葡萄球菌属于细菌界厚壁菌门(firmicutes)芽孢杆菌纲(bacilli)芽孢杆菌目(bacillales)葡萄球菌科葡萄球菌属(staphylococcus)。粪肠球菌和屎肠球菌属于细菌界厚壁菌门芽孢杆菌纲乳杆菌目(lactobacillales)肠球菌科(enterococcaceae)肠球菌属(enterococcus)。化脓链球菌和肺炎链球菌属于细菌界厚壁菌门芽孢杆菌纲乳杆菌目链球菌科(streptococcaceae)链球菌属(streptococcus)。结核分枝杆菌属于细菌界厚壁菌门裂殖菌纲(schizomycetes)放线菌目(actinomycetales)分枝杆菌科(mycobacteriaceae)分枝杆菌属(mycobacterium)。枯草芽孢杆菌属于细菌界厚壁菌门芽孢杆菌纲芽孢杆菌目芽孢杆菌科(bacillaceae)芽孢杆菌属(bacillus)。短双歧杆菌和长双歧杆菌属于细菌界放线菌门(actinobacteria)放线菌纲(actinobacteria)放线菌亚纲(actinobacteridae)双歧杆菌目(bifidobacteriales)双歧杆菌科(bifidobacteriaceae)双歧杆菌属(bifidobacterium)。临床常见革兰氏阴性致病细菌有:大肠埃希菌(escherichiacoli)、肺炎克雷伯杆菌(klebsiellapneumoniae)、鲍曼不动杆菌(acinetobacterbaumannii)、铜绿假单胞菌(pseudomonasaeruginosa)、嗜麦芽窄食单胞菌(stenotrophomonasmaltophilia)、阴沟肠杆菌(enterobactercloacae)、异型枸橼酸杆菌(citrobacterdiversus)、摩氏摩根菌(morganellamorganii)、流感嗜血杆菌(haemophilusinfluenzae)、副流感嗜血杆菌(haemophilusparainfluenzae)和嗜肺军团菌(legionellapneumophila)。其中,大肠埃希菌属于细菌界变形菌门(proteobacteria)γ-变形菌纲(gammaproteobacteria)肠杆菌目(enterobacteriales)肠杆菌科(enterobacteriaceae)埃希氏菌属(escherichia)。肺炎克雷伯杆菌属于细菌界变形菌门γ-变形菌纲肠杆菌目肠杆菌科克雷伯氏菌属(klebsiella)。鲍曼不动杆菌属于细菌界变形菌门γ-变形菌纲假单胞菌目(pseudomonadales)莫拉菌科(moraxellaceae)不动杆菌属(acinetobacter)。铜绿假单胞菌属于细菌界变形菌门γ-变形菌纲假单胞菌目假单胞菌科(pseudomonadaceae)假单胞菌属(pseudomonas)。嗜麦芽窄食单胞菌属于细菌界普罗特斯细菌门(phylumbx11.proteobacteria)gamma普罗特斯细菌纲(gammaproteobacteria)黄单胞菌目(xanthomonadales)黄单胞菌科(xanthomonadaceae)窄食单胞菌属(stenotrophomonas)。阴沟肠杆菌属于细菌界变形菌门γ-变形菌纲肠杆菌目肠杆菌科肠杆菌属(enterobacter)。异型枸橼酸杆菌属于细菌界变形菌门γ-变形菌纲肠杆菌目肠杆菌科枸橼酸杆菌属(citrobacter)。摩氏摩根菌属于细菌界变形菌门γ-变形菌纲肠杆菌目肠杆菌科摩根菌属(morganella)。流感嗜血杆菌属于细菌界变形菌门γ-变形菌纲巴斯德氏菌目(pasteurellales)巴斯德氏菌科(pasteurellaceae)嗜血杆菌属(haemophilus)。副流感嗜血杆菌属于细菌界变形菌门γ-变形菌纲巴斯德氏菌目巴斯德氏菌科嗜血杆菌属。嗜肺军团菌属于细菌界变形菌门γ-变形菌纲军团菌目军团菌科军团菌属(legionella)。临床常见致病真菌有:白色念珠菌(candidaalbicans)、热带念珠菌(candidatropicalis)、近平滑念珠菌(candidaparapsilosis)、黄曲霉(aspergillusflavus)和烟曲霉(aspergillusfumigatus)。其中,白色念珠菌、热带念珠菌和近平滑念珠菌属于真菌界真菌门半知菌亚门芽孢菌纲隐球酵母目隐球酵母科念珠菌属。黄曲霉和烟曲霉属于真菌界真菌门半知菌亚门半知菌纲壳霉目杯霉科曲霉属。技术实现要素:本发明所要解决的技术问题是如何增强抗菌药物的抗菌活性。为了解决以上技术问题,本发明提供了细胞穿透肽的亲脂性化合物偶联物(即脂肽)或其药用盐。本发明所提供的脂肽由细胞穿透肽,与所述细胞穿透肽的氨基末端或羧基末端相连的亲脂性化合物连接而成。上述脂肽中,所述细胞穿透肽为a)或b)的多肽:a)氨基酸序列为seqidno.1的多肽;b)将a)的多肽经过1至5个氨基酸残基的取代和/或缺失和/或添加得到的衍生多肽,所述衍生多肽具有杀菌活性和/或抑菌活性。上述脂肽中,所述亲脂性化合物可为脂肪酸或胆固醇、二氢鞘氨醇或维生素e等。上述脂肽中,所述脂肪酸可为f1、f2或f3:f1、所述脂肪酸为饱和脂肪酸或不饱和脂肪酸;f2、所述脂肪酸为含8到20个碳原子的饱和脂肪酸;f3、所述脂肪酸为辛酸(c8)、癸酸(c10)、月桂酸(c12)、豆蔻酸(c14)、棕榈酸(c16)、硬脂酸(c18)或花生酸(c20)。其中,氨基酸序列为seqidno.1的多肽是名称为tat的细胞穿透肽。所述脂肽具体可为名称为c8-tat、c12-tat、c14-tat、c16-tat和c20-tat的这5种脂肽,c8-tat由tat与tat的氨基末端相连的c8连接而成,c12-tat由tat与tat的氨基末端相连的c12连接而成,c14-tat由tat与tat的氨基末端相连的c14连接而成,c16-tat由tat与tat的氨基末端相连的c16连接而成,c20-tat由tat与tat的氨基末端相连的c20连接而成。上述脂肽中,所述细胞穿透肽中的所有氨基酸均为l型氨基酸。本发明的脂肽药用盐可以由阳离子如钠、钾、铝、钙、锂、锰和锌等所形成,也可由碱如氨、乙二胺、n-甲基-谷氨酰胺、赖氨酸、精氨酸、鸟氨酸、胆碱等所形成。上述脂肽的衍生物也属于本发明的保护范围。本发明所提供的脂肽的衍生物可为下述1)、2)或3):1)将所述脂肽的所述细胞穿透肽中的一个或多个氨基酸残基用构象为d-型的氨基酸残基、人工修饰的氨基酸残基和/或自然界存在的稀有氨基酸残基进行替换,得到的衍生多肽;2)在所述脂肽的所述细胞穿透肽的氨基末端连接氨基端保护基和/或在所述细胞穿透肽的羧基末端连接羧基端保护基得到的连接物;3)在1)所述的脂肽衍生物的氨基末端连接氨基端保护基和/或在1)所述的脂肽衍生物的羧基末端连接羧基端保护基得到的连接物。上述脂肽的衍生物中,d-型氨基酸是指与组成蛋白质的l-型氨基酸相对应的氨基酸;人工修饰的氨基酸指经过甲基化、磷酸化等修饰的组成蛋白质的常见l-型氨基酸;自然界存在的稀有氨基酸包括组成蛋白质的不常见氨基酸和不组成蛋白质的氨基酸,例如5-羟基赖氨酸、甲基组氨酸、γ氨基丁酸、高丝氨酸等。下述pm1或pm2的所述脂肽的多聚体也属于本发明的保护范围:pm1、由所述脂肽或所述脂肽的药用盐形成的多聚体;pm2、由所述脂肽的衍生物形成的多聚体。为了解决以上技术问题,本发明提供了所述脂肽或所述脂肽的药用盐或所述脂肽的衍生物或所述脂肽的多聚体在制备增强抗菌药物的杀菌活性和/或抑菌活性的产品(药物、抗菌材料或胶束纳米粒子)中的应用。上述应用中,所述抗菌药物为具有杀菌活性和/或抑菌活性的药物,包括各种抗生素、磺胺类、咪唑类、硝基咪唑类、喹诺酮类等化学合成药物,也包括由细菌、放线菌、真菌等微生物经培养而得到的某些产物,或用化学半合成法制造的相同或类似的物质。所述抗菌药物具体可为含有亚胺培南或/和克拉霉素的药物。上述应用中,所述抗菌药物的活性成分可为亚胺培南或/和克拉霉素,所述抗菌药物的活性成分还可含有除所述脂肽或所述脂肽的药用盐或所述脂肽的衍生物或所述脂肽的多聚体以外的其它成分,所述抗菌药物的其它活性成分本领域技术人员可根据抗菌效果确定。下述p1或p2也属于本发明的保护范围:p1、抗菌产品,其包含m1)和m2);所述m1)为m11)或/和m12)或/和m13);所述m11)为所述脂肽或所述脂肽的药用盐;所述m12)为所述脂肽的衍生物;所述m13)为所述脂肽的多聚体;所述m2)为所述抗菌药物;p2、抗菌产品,其包含p1中所述m1)。其中,p1所述抗菌产品和p2所述抗菌产品可为具有杀菌活性和/或抑菌活性的药物、具有杀菌活性和/或抑菌活性的涂层或具有杀菌活性和/或抑菌活性的材料。其中,所述具有杀菌活性和/或抑菌活性的涂层可为用于植入动物体的植入体表面的抗菌涂层。p1所述抗菌产品中,所述具有杀菌活性和/或抑菌活性的药物中,所述m1)和所述m2)可混合在一起,所述m1)和所述m2)也可以各自独立包装形成成套药物,所述m2)也可包载在所述m1)里形成胶束纳米粒子。所述具有杀菌活性和/或抑菌活性的药物中,所述m1)和所述m2)的质量比可为1:1—10:1(如1:1)。p1所述抗菌产品中,p1所述抗菌产品的活性成分可为所述m1)和所述m2),p1所述抗菌产品的活性成分还可含有其它成分,p1所述抗菌产品的其它活性成分本领域技术人员可根据抗菌效果确定。p2所述抗菌产品中,p2所述抗菌产品的活性成分可为所述m1),p2所述抗菌产品的活性成分还可含有其它成分,p2所述抗菌产品的其它活性成分本领域技术人员可根据抗菌效果确定。p1所述抗菌产品和p2所述抗菌产品还可含有药学上可接受的载体或辅料。所述载体材料包括但不限于水溶性载体材料(如聚乙二醇、聚乙烯吡咯烷酮、有机酸等)、难溶性载体材料(如乙基纤维素、胆固醇硬脂酸酯等)、肠溶性载体材料(如醋酸纤维素酞酸酯和羧甲基纤维素等)。所述m1)或所述m1)和所述m2)在制备所述p1或p2中的应用也属于本发明的保护范围。本文中,所述杀菌活性和/或抑菌活性为对下述为b1至b23所述病原菌具有杀灭和/或抑制作用:b1、革兰氏阳性细菌;b2、厚壁菌门细菌或放线菌门细菌;b3、芽孢杆菌纲细菌、裂殖菌纲细菌或放线菌纲细菌;b4、芽孢杆菌目细菌、乳杆菌目细菌、放线菌目细菌或双歧杆菌目细菌;b5、葡萄球菌科细菌、肠球菌科细菌、链球菌科细菌、分枝杆菌科细菌、芽孢杆菌科细菌或双歧杆菌科细菌;b6、葡萄球菌属细菌、肠球菌属细菌、链球菌属细菌、分枝杆菌属细菌、芽孢杆菌属细菌或双歧杆菌属细菌;b7、金黄色葡萄球菌、表皮葡萄球菌、化脓链球菌、肺炎链球菌、粪肠球菌、屎肠球菌、结核分枝杆菌、枯草芽孢杆菌、短双歧杆菌或长双歧杆菌;b8、耐甲氧西林金黄色葡萄球菌、甲氧西林敏感金黄色葡萄球菌、耐万古霉素粪肠球菌、万古霉素敏感粪肠球菌、耐万古霉素屎肠球菌、万古霉素敏感屎肠球菌、耐青霉素肺炎链球菌或青霉素敏感肺炎链球菌;b9、耐万古霉素、庆大霉素和链霉素的粪肠球菌,耐万古霉素和替考拉宁的屎肠球菌,耐头孢菌素和青霉素的肺炎链球菌;b10、革兰氏阴性细菌;b11、变形菌门细菌或普罗特斯细菌门细菌;b12、γ-变形菌纲细菌、普罗特斯细菌纲细菌;b13、肠杆菌目细菌、假单胞菌目细菌、黄单胞菌目细菌、巴斯德氏菌目细菌或军团菌目细菌;b14、肠杆菌科细菌、莫拉菌科细菌、假单胞菌科细菌、黄单胞菌科细菌、巴斯德氏菌科细菌或军团菌科细菌;b15、埃希氏菌属细菌、克雷伯氏菌属细菌、不动杆菌属细菌、假单胞菌属细菌、窄食单胞菌属细菌、肠杆菌属细菌、枸橼酸杆菌属细菌、摩根菌属细菌、嗜血杆菌属细菌或军团菌属细菌;b16、大肠埃希菌、肺炎克雷伯杆菌、鲍曼不动杆菌、铜绿假单胞菌、嗜麦芽窄食单胞菌、阴沟肠杆菌、异型枸橼酸杆菌、摩氏摩根菌、流感嗜血杆菌、副流感嗜血杆菌或嗜肺军团菌;b17、真菌;b18、半知菌亚门真菌;b19、芽孢菌纲真菌或半知菌纲真菌;b20、隐球酵母目真菌或壳霉目真菌;b21、隐球酵母科真菌或杯霉科真菌;b22、念珠菌属真菌或曲霉属真菌;b23、白色念珠菌、热带念珠菌、近平滑念珠菌、黄曲霉或烟曲霉。本发明还提供了药用化合物。本发明所提供的所述药用化合物为所述脂肽或所述脂肽的药用盐,或所述脂肽的衍生物;或所述脂肽的多聚体。所述药用化合物可为上述具有杀菌活性和/或抑菌活性的药物。本发明还提供了治疗或/和预防病原菌感染动物的方法,包括给受体动物施用所述m1)或所述p1或所述p2以抑制病原菌感染动物。所述病原菌为细菌和/或真菌,如所述b1至b23中任一种。在实际应用中,可以将本发明的脂肽或其药用盐,所述衍生物,所述多聚体,和所述药用化合物作为药物直接给予病人,或者与适宜的载体或赋形剂混合后制成抗菌药物给予病人,以达到治疗和/或预防病原菌感染的目的。实验证明,c8-tat、c12-tat、c14-tat、c16-tat和c20-tat,特别是c12-tat、c14-tat、c16-tat和c20-tat对革兰氏阳性细菌、革兰氏阴性细菌和真菌均有良好的抑制和杀灭作用,具有广谱抗菌效应。其中,c12-tat对耐甲氧西林金黄色葡萄球菌(mrsa)生物膜,c16-tat对铜绿假单胞菌(p.aeruginosa)生物膜均有良好的分散效果,具有抗细菌生物膜效应。在抑制耐甲氧西林金黄色葡萄球菌方面,c12-tat联合克拉霉素具有相加作用;c12-tat联合亚胺培南具有明显的协同作用。在抑制铜绿假单胞菌方面,c16-tat联合克拉霉素具有相加作用;c16-tat联合亚胺培南则具有明显的协同作用。c12-tat和c16-tat有良好的体内抗菌活性,同样剂量下与抗菌药物亚胺培南、克拉霉素的效果相当,或略优于抗菌药物的活性。c12-tat联合亚胺培南对耐甲氧西林金黄色葡萄球菌引起的肺部感染和皮肤感染的疗效,c16-tat联合亚胺培南对铜绿假单胞菌引起的肺部感染和皮肤感染的疗效,明显优于二者单独给药的疗效。表明c12-tat联合亚胺培南和c16-tat联合亚胺培南不仅在体外对耐药菌具有协同作用,在动物体内抗耐药菌感染方面也优于单独给药的疗效。附图说明图1为制备脂肽的反应式。具体实施方式下面结合具体实施方式对本发明进行进一步的详细描述,给出的实施例仅为了阐明本发明,而不是为了限制本发明的范围。下述实施例中的实验方法,如无特殊说明,均为常规方法。下述实施例中所用的材料、试剂等,如无特殊说明,均可从商业途径得到。实施例1、脂肽的制备本实施例制备了名称为c4-tat、c8-tat、c12-tat、c14-tat、c16-tat和c20-tat的6种脂肽,这6种脂肽均由名称为tat的细胞穿透肽(氨基酸序列为ygrkkrrqrrr即seqidno.1),与该细胞穿透肽的氨基末端相连的亲脂性化合物连接而成。c4-tat的结构式为:c4-ygrkkrrqrrr,其中,c4为丁酸;c8-tat的结构式为:c8-ygrkkrrqrrr,其中,c8为辛酸;c12-tat的结构式为:c12-ygrkkrrqrrr,其中,c12为月桂酸;c14-tat的结构式为:c14-ygrkkrrqrrr,其中,c14为豆蔻酸;c16-tat的结构式为:c16-ygrkkrrqrrr,其中,c16为棕榈酸;c20-tat的结构式为:c20-ygrkkrrqrrr,其中,c20为花生酸;c4-tat、c8-tat、c12-tat、c14-tat、c16-tat和c20-tat结构式中的ygrkkrrqrrr均为l-型氨基酸。其合成方法如下:将不同碳链长度的饱和脂肪酸分别溶于乙腈中,分别用edc和nhs活化,再分别于低温、避光条件下与tat(以1∶1摩尔比)反应,具体反应式如图1所示。该反应式中,ch3(ch2)ncooh代表丁酸、辛酸、月桂酸、豆蔻酸、棕榈酸或花生酸。产物旋转蒸发除去溶剂,用柱分离法除去未反应的原料及副产物,用hplc法测定反应转化率,用nmr、ms、ir对产物进行结构确证。结果表明得到了纯度均大于95%的结构式如上的c4-tat、c8-tat、c12-tat、c14-tat、c16-tat和c20-tat。实施例2、脂肽的抗菌作用1.最低抑菌浓度(mic)的测定采用平皿二倍稀释法进行药敏实验,测定实施例1中的c4-tat、c8-tat、c12-tat、c14-tat、c16-tat和c20-tat的最低抑菌浓度(mic),具体实验方法如下:试验菌(如表2所示)用mh肉汤培养基进行培养。药物(实施例1中的c4-tat、c8-tat、c12-tat、c14-tat、c16-tat和c20-tat)用mh肉汤培养基二倍稀释成各种所需浓度,分别加适量到平皿中,mh琼脂培养基溶化后定量注入含药液平皿内混匀,以多点接种器接种各种所测微生物,(接种量为104cfu/点)后置37℃培养箱中恒温培养18h后观察结果,无菌生长的平皿中所含药物最小的浓度即为最低抑菌浓度(minimalinhibitoryconcentration,mic)。结果如下:表2.tat和脂肽对各菌的mic值(μg/ml)结果表明,c8-tat、c12-tat、c14-tat、c16-tat和c20-tat,特别是c12-tat、c14-tat、c16-tat和c20-tat对革兰氏阳性细菌、革兰氏阴性细菌和真菌均有良好的抑制和杀灭作用,具有广谱抗菌效应。表2中,mrsa为耐甲氧西林金黄色葡萄球菌,vre为万古霉素耐药肠球菌,pssp为青霉素敏感肺炎链球菌,prsp为耐青霉素肺炎链球菌;粪肠球菌atcc51575对万古霉素、庆大霉素和链霉素耐药,屎肠球菌atcc700221对万古霉素和替考拉宁耐药,肺炎链球菌atcc51915对头孢菌素和青霉素耐药。2.体外抗生物膜效果评价2.1建立体外生物膜模型挑取金黄色葡萄球菌atcc33591(mrsa)或铜绿假单胞菌atcc27853菌落置于5mlmh培养液中,37℃恒温振荡培养。8小时后用比浊仪将菌液浓度调整为1.5×108cfu/ml,并稀释100倍。吸取2ml上述菌液,加入带有8×8mm玻片的24孔板中,37℃恒温培养,使形成成熟的生物膜。2.2结晶紫染色法定量检测生物膜生长状态在各孔内分别加入不同浓度的药物溶液(药物分别指实施例1中的tat、c12-tat和c16-tat,溶剂均为ph为7.2的pbs溶液),以加入等量的ph为7.2的pbs溶液作为空白对照,37℃恒温培养24小时、48小时。24小时和48小时后用pbs溶液轻轻漂洗24孔板,静置晾干。在孔板内加入1%结晶紫溶液,染色20分钟,以pbs溶液冲洗孔板3次,静置晾干。在孔板中加入95%乙醇,放置15分钟,将结晶紫洗脱,以酶标仪测定570nm波长处吸光度值(值越低代表生物膜拆分效果越好),以95%乙醇作为对照。并对数据进行统计学分析。结果如表3~6所示:表3.加药24h后的金黄色葡萄球菌atcc33591(mrsa)生物膜的分散情况(od570nm)表4.加药48h后的金黄色葡萄球菌atcc33591(mrsa)生物膜的分散情况(od570nm)浓度tatc12-tat4mic0.957±0.0250.500±0.0102mic1.008±0.0060.514±0.010mic0.963±0.0020.542±0.0131/2mic1.016±0.0100.574±0.0231/4mic1.029±0.0210.588±0.0111/8mic1.285±0.0370.611±0.0231/16mic1.373±0.0400.647±0.0071/32mic1.570±0.0750.628±0.0311/64mic1.600±0.0110.644±0.018空白对照1.000±0.1111.000±0.013表5.加药24h后的铜绿假单胞菌atcc27853生物膜的分散情况(od570nm)浓度tatc16-tat4mic0.961±0.0670.376±0.0352mic1.015±0.1190.424±0.098mic1.011±0.1080.547±0.0271/2mic0.976±0.1340.552±0.0671/4mic0.994±0.1860.490±0.0841/8mic1.030±0.1190.497±0.2361/16mic1.044±0.1170.626±0.1811/32mic1.176±0.1110.785±0.0781/64mic1.462±0.0471.023±0.048空白对照1.000±0.1131.000±0.134表6.加药48h后的铜绿假单胞菌atcc27853生物膜的分散情况(od570nm)本项试验表明,脂肽c12-tat对金黄色葡萄球菌(mrsa)生物膜,c16-tat对铜绿假单胞菌生物膜均有良好的分散效果,具有抗细菌生物膜效应。实施例3、脂肽与抗菌药物联合应用1、脂肽与抗菌药物联合应用对耐药菌的联合用药指数(fic)测定分别测定实施例1的脂肽c12-tat与抗菌药物联合应用对革兰氏阳性耐药菌金黄色葡萄球菌atcc33591(mrsa)的fic值,及实施例1的c16-tat与抗菌药物联合应用对革兰氏阴性耐药菌铜绿假单胞菌atcc27853的fic值。方法及结果如下:各抗菌药物(作为甲药)和脂肽(作为乙药)分别以各自的2mic为最高浓度,以无菌mh肉汤培养基倍比稀释成8个浓度,分别沿微孔培养板横轴、纵轴加入含有不同浓度两药的mh肉汤培养基50μl,然后分别加入菌液100μl,使最终菌浓度为5×104cfu/孔,37℃恒温培养18~24h,观察结果。记录两药联用时各自的mic,按下述公式计算fic值。fic=mic甲药联合/mic甲药单用+mic乙药联合/mic乙药单用判断标准:fic≤0.5,协同作用;0.5<fic≤1,相加作用;1﹤fic≤2,无关作用;fic>2,拮抗作用。测定结果如下:表7.c12-tat与抗菌药物联合应用对金黄色葡萄球菌atcc33591(mrsa)的fic值由上表结果可知,c12-tat联合万古霉素、博宁霉素为拮抗作用;c12-tat联合克拉霉素具有相加作用;c12-tat联合亚胺培南则具有明显的协同作用。表8.c16-tat与抗菌药物联合应用对铜绿假单胞菌atcc27853的fic值由上表结果可知,c16-tat联合多粘菌素、博宁霉素为拮抗作用;c16-tat联合克拉霉素具有相加作用;c16-tat联合亚胺培南则具有明显的协同作用。由上述试验结果可知,脂肽(c12-tat、c16-tat)不但自身具有良好的抗耐药菌活性,而且当将特定种类的脂肽与某些抗菌药物联合应用于抗耐药菌(具体为c12-tat+亚胺培南抗耐甲氧西林金黄色葡萄球菌atcc33591,c16-tat+亚胺培南抗铜绿假单胞菌atcc27853时,具有明显的协同作用。说明脂肽(c12-tat、c16-tat)与亚胺培南可以联合应用于抗耐甲氧西林金黄色葡萄球菌和铜绿假单胞菌的抗菌领域中。为进一步验证脂肽与抗菌药物联合应用对耐药菌(c12-tat+亚胺培南对mrsa,c16-tat+亚胺培南对p.aeruginosa)具有优于单独用药的作用,又进行了二者联合应用对动物体内耐药菌感染的疗效评价。2.脂肽与抗菌药物联合应用对动物体内耐药菌感染的疗效评价分别评价了脂肽与抗菌药物联合应用对金黄色葡萄球菌atcc33591(mrsa)或铜绿假单胞菌atcc27853皮肤感染及肺部感染的疗效(c12-tat+亚胺培南、c12-tat+克拉霉素对mrsa菌;c16-tat+亚胺培南、c16-tat+克拉霉素对铜绿假单胞菌atcc27853)。2.1实验分组及给药剂量c12-tat联合应用试验和c16-tat联合应用试验各分1个对照组(未给药)和10个给药组,给药组分别为:①c12-tat(30mg/kg)组,将c12-tat用pbs溶解后给药,c12-tat的给药剂量为30mg/kg体重;c16-tat(30mg/kg)组,将c16-tat用pbs溶解后给药,c16-tat的给药剂量为30mg/kg体重;②c12-tat(15mg/kg)组,将c12-tat用pbs溶解后给药,c12-tat的给药剂量为15mg/kg体重;c16-tat(15mg/kg)组,将c16-tat用pbs溶解后给药,c16-tat的给药剂量为15mg/kg体重;③亚胺培南(30mg/kg)组,将亚胺培南用pbs溶解后给药,亚胺培南的给药剂量为30mg/kg体重;④亚胺培南(15mg/kg)组,将亚胺培南用pbs溶解后给药,亚胺培南的给药剂量为15mg/kg体重;⑤c12-tat+亚胺培南联合用药(15mg/kg+15mg/kg)组,将c12-tat和亚胺培南按照1:1的质量比混合,用pbs溶解后给药,c12-tat的给药剂量为15mg/kg体重,亚胺培南的给药剂量为15mg/kg体重;c16-tat+亚胺培南联合用药(15mg/kg+15mg/kg)组,将c16-tat和亚胺培南按照1:1的质量比混合,用pbs溶解后给药,c16-tat的给药剂量为15mg/kg体重,亚胺培南的给药剂量为15mg/kg体重;⑥c12-tat+亚胺培南联合用药(7.5mg/kg+7.5mg/kg)组,将c12-tat和亚胺培南按照1:1的质量比混合,用pbs溶解后给药,c12-tat的给药剂量为7.5mg/kg体重,亚胺培南的给药剂量为7.5mg/kg体重;c16-tat+亚胺培南联合用药(7.5mg/kg+7.5mg/kg)组,将c16-tat和亚胺培南按照1:1的质量比混合,用pbs溶解后给药,c16-tat的给药剂量为7.5mg/kg体重,亚胺培南的给药剂量为7.5mg/kg体重;⑦克拉霉素(30mg/kg)组,将克拉霉素用pbs溶解后给药,克拉霉素的给药剂量为30mg/kg体重;⑧克拉霉素(15mg/kg)组,将克拉霉素用pbs溶解后给药,克拉霉素的给药剂量为15mg/kg体重;⑨c12-tat+克拉霉素联合用药(15mg/kg+15mg/kg)组,将c12-tat和克拉霉素按照1:1的质量比混合,用pbs溶解后给药,c12-tat的给药剂量为15mg/kg体重,克拉霉素的给药剂量为15mg/kg体重;c16-tat+克拉霉素联合用药(15mg/kg+15mg/kg)组,将c16-tat和克拉霉素按照1:1的质量比混合,用pbs溶解后给药,c16-tat的给药剂量为15mg/kg体重,克拉霉素的给药剂量为15mg/kg体重;⑩c12-tat+克拉霉素联合用药(7.5mg/kg+7.5mg/kg)组,将c12-tat和克拉霉素按照1:1的质量比混合,用pbs溶解后给药,c12-tat的给药剂量为7.5mg/kg体重,克拉霉素的给药剂量为7.5mg/kg体重;c16-tat+克拉霉素联合用药(7.5mg/kg+7.5mg/kg)组,c16-tat的给药剂量为7.5mg/kg体重,克拉霉素的给药剂量为7.5mg/kg体重。2.2细菌培养接种环挑取金黄色葡萄球菌atcc33591(mrsa)和铜绿假单胞菌atcc27853菌落接种于5mltsb培养基中,37℃恒温培养过夜,pbs洗涤重悬,涡旋混匀后用pbs稀释至1012cfu/ml,得到菌悬液,备用。2.3小鼠感染模型构建将110只雌雄各半的icr小鼠随机分成11组,每组各5只雄鼠和5只雌鼠。每只小鼠后背部进行2×2cm脱毛处理并消毒。对小鼠后背部皮肤进行烫伤处理:将带有刻度的两端无堵头且内径为0.6cm的中空塑料管垂直紧贴于小鼠后背部,往塑料管另一端快速注入沸水至2ml刻度处,接触25s后,倒出沸水。然后向烫伤后的小鼠后背部注射50μl备好的金黄色葡萄球菌atcc33591(mrsa)菌悬液或铜绿假单胞菌atcc27853菌悬液,24h后再向小鼠滴鼻注射50μl备好的金黄色葡萄球菌atcc33591(mrsa)菌悬液或铜绿假单胞菌atcc27853菌悬液。构建小鼠肺炎合并烫伤-生物膜感染模型。2.4给药治疗小鼠肺部感染处理24h后,以滴鼻吸入和后背部注射的方式分别给药50μl,连续给药治疗3天,各组的给药剂量如2.1,对照组给予相同剂量的pbs。2.5疗效评价给药治疗结束后,将小鼠断颈处死。无菌条件下进行解剖,分别取出局部肺组织和皮肤组织,将其研磨成匀浆,用pbs分别稀释105、107、1010倍,取100μl稀释液涂布于tbs平板上。37℃恒温培养过夜,进行肺部及皮肤组织菌落计数。结果如下:表9.各给药组对金黄色葡萄球菌atcc33591(mrsa)肺部感染模型的疗效评价(n=10)组别细菌总数(log10cfu/ml)对照组(未给药)12.64±1.65c12-tat(30mg/kg)5.75±1.67c12-tat(15mg/kg)8.73±2.66亚胺培南(30mg/kg)7.13±1.72亚胺培南(15mg/kg)11.06±1.08c12-tat+亚胺培南联合用药(15mg/kg+15mg/kg)3.37±1.72c12-tat+亚胺培南联合用药(7.5mg/kg+7.5mg/kg)8.06±1.56克拉霉素(30mg/kg)7.89±1.43克拉霉素(15mg/kg)10.38±2.07c12-tat+克拉霉素联合用药(15mg/kg+15mg/kg)4.48±1.56c12-tat+克拉霉素联合用药(7.5mg/kg+7.5mg/kg)8.55±1.32表10.各给药组对金黄色葡萄球菌atcc33591(mrsa)皮肤感染模型的疗效评价(n=10)表11.各给药组对铜绿假单胞菌atcc27853肺部感染模型的疗效评价(n=10)组别细菌总数(log10cfu/ml)对照组(未给药)22.89±0.40c16-tat(30mg/kg)19.05±0.93c16-tat(15mg/kg)20.58±0.83亚胺培南(30mg/kg)18.87±1.62亚胺培南(15mg/kg)21.21±1.73c16-tat+亚胺培南联合用药(15mg/kg+15mg/kg)8.07±4.20c16-tat+亚胺培南联合用药(7.5mg/kg+7.5mg/kg)19.04±2.82克拉霉素(30mg/kg)19.15±0.65克拉霉素(15mg/kg)20.37±0.88c16-tat+克拉霉素联合用药(15mg/kg+15mg/kg)10.78±1.67c16-tat+克拉霉素联合用药(7.5mg/kg+7.5mg/kg)19.63±1.32表12.各给药组对铜绿假单胞菌atcc27853皮肤感染模型的疗效评价(n=10)由上表可知,与未给药组相比,各给药组对金黄色葡萄球菌atcc33591(mrsa)和铜绿假单胞菌atcc27853感染小鼠均有治疗效果,肺部及皮肤细菌总数显著下降,且抑菌效果呈药物浓度依赖性。试验结果还表明,脂肽(c12-tat、c16-tat)有良好的体内抗菌活性,同样剂量下与抗菌药物亚胺培南、克拉霉素的效果相当,或略优于抗菌药物的活性。c12-tat+亚胺培南对金黄色葡萄球菌atcc33591(mrsa)引起的肺部感染和皮肤感染,c16-tat+亚胺培南对铜绿假单胞菌atcc27853引起的肺部感染和皮肤感染的疗效,明显优于二者单独给药的疗效。表明上述联合用药方案不仅在体外对耐药菌具有协同作用,在动物体内抗耐药菌感染方面也优于单独给药的疗效。<110>中国医学科学院医药生物技术研究所北京大学<120>细胞穿透肽的亲脂性化合物偶联物及其在抗菌中的应用<160>1<170>patentinversion3.5<210>1<211>11<212>prt<213>人工序列<220><223><400>1tyrglyarglyslysargargglnargargarg1510当前第1页12
相关技术
网友询问留言
已有0条留言
- 还没有人留言评论。精彩留言会获得点赞!
1