蛋白激酶抑制剂在抑制单倍体细胞二倍化中的用途的制作方法
本发明涉及细胞培养领域,更具体而言,本发明涉及体外培养或分化单倍体细胞中的单倍型维持方法。
背景技术
对于二倍体生物来说,单倍体具有单拷贝基因组,在遗传学研究具有大的优势。然而单倍体胚胎干细胞在体外培养或分化过程中会发生自发二倍化,要获得或保持单倍体胚胎干细胞就需要不断进行流式富集,这极大的增加了单倍体的排样成本,从而阻碍了其在基因筛选和修饰中的应用(elling等人,2011;leeb和wutz,2011;yang等人,2012;zhou等人,2016);同时,单倍体干细胞的倍性维持机制也是一个有意思的问题,该机制可能蕴含着胚胎干细胞独特的细胞周期调控机制。
近年来,研究显示孤雌单倍体胚胎干细胞在mek激酶抑制剂和gsk3β激酶抑制剂存在下相比于血清体系下更容易维持单倍体倍性(leeb等人,2012)。但是,尽管有报道称可以用酪氨酸激酶抑制剂有效地减慢孤雌单倍体胚胎干细胞体外培养的二倍化,此方法仍无法广泛有效地抑制单倍体胚胎干细胞二倍化,也无法获得啮齿类动物如小鼠单倍体体细胞(takahashi等人,2014)。sagi等报道人的孤雌单倍体胚胎干细胞能分化获得了三胚层体细胞(sagi等人,2016)。总之,目前仍然未能有效地控制单倍体胚胎干细胞在培养和分化过程中二倍化(特别是对于啮齿类动物单倍体体细胞),同时也无法有效获得单倍体细胞以进行遗传筛选。
技术实现要素:
为了解决上述技术问题,本发明的发明人基于对单倍体胚胎干细胞的细胞分裂过程中染色体的动态变化,对细胞周期的一些重要调控因子和检验点进行小分子筛选,发现一些蛋白酶抑制剂能有效地抑制单倍体二倍化。
因此,本发明的一个目的是提供蛋白酶抑制剂在抑制单倍体细胞二倍化中的用途。
基于该新发现,本发明的另一个目的是提供培养和/或分化单倍体细胞的组合物(例如培养基)与方法。
本发明的又一个目的是提供获得单倍体细胞的方法以及获得的单倍体体细胞。
本发明的还一个目的是提供获得的单倍体体细胞的用途。
本发明的技术方案如下。
一方面,本发明提供cdk1蛋白激酶抑制剂和/或rock蛋白激酶抑制剂在抑制单倍体细胞二倍化中的用途。
优选地,所述cdk1蛋白激酶抑制剂为ro3306;所述rock蛋白激酶抑制剂为y-27632;
优选地,所述单倍体细胞为哺乳动物、优选啮齿类动物的单倍体细胞,更优选为单倍体胚胎干细胞、单倍体神经干细胞、单倍体神经细胞、单倍体心肌细胞或单倍体内胚层祖细胞;
优选地,所述抑制是在单倍体细胞的培养和/或分化过程中抑制所述单倍体细胞二倍化。
在所述单倍体细胞的培养过程中,和/或在所述单倍体细胞向其他类型细胞分化的过程中,本发明提供的蛋白激酶抑制剂能够抑制单倍体细胞二倍化,维持单倍性,同时不影响细胞的正常生长和分化。
另一方面,本发明提供一种用于培养和/或分化单倍体细胞的组合物,所述组合物包含cdk1蛋白激酶抑制剂和/或rock蛋白激酶抑制剂。
优选地,所述cdk1蛋白激酶抑制剂为ro3306;所述rock蛋白激酶抑制剂为y-27632;
优选地,所述组合物为细胞培养基;
优选地,所述cdk1蛋白激酶抑制剂在所述组合物中的浓度为1.5-5μm,优选3-5μm,更优选4.5μm;所述rock蛋白激酶抑制剂在所述组合物中的浓度为5-40μm,优选10-40μm,更优选40μm;
优选地,所述单倍体细胞为哺乳动物、优选啮齿类动物的单倍体细胞,更优选为单倍体胚胎干细胞、单倍体神经干细胞、单倍体神经细胞、单倍体心肌细胞或单倍体内胚层祖细胞。
本发明提供的组合物不仅可用于单倍体细胞的培养或维持,还可以用于单倍体细胞的分化。在所述单倍体细胞的培养过程中,和/或在所述单倍体细胞向其他类型细胞分化的过程中,本发明提供的组合物中的蛋白激酶抑制剂能够抑制单倍体细胞二倍化,维持单倍性,同时不影响细胞的正常生长和分化。
又一方面,本发明提供一种用于培养和/或分化单倍体细胞的方法,所述方法包括,在cdk1蛋白激酶抑制剂和/或rock蛋白激酶抑制剂的存在下,培养和/或分化单倍体细胞。
优选地,所述cdk1蛋白激酶抑制剂为ro3306;所述rock蛋白激酶抑制剂为y-27632;
优选地,所述单倍体细胞为哺乳动物、优选啮齿类动物的单倍体细胞,更优选为单倍体胚胎干细胞、单倍体神经干细胞、单倍体神经细胞、单倍体心肌细胞或单倍体内胚层祖细胞;
优选地,所述方法包括,采用本发明提供的组合物培养和/或分化所述单倍体细胞。
在本发明提供的上述方法中,cdk1蛋白激酶抑制剂和/或rock蛋白激酶抑制剂不影响单倍体细胞的正常培养和/或分化,而是在其过程中抑制单倍体细胞二倍化,维持单倍性,同时不影响细胞的正常生长和分化。
还一方面,本发明提供一种获得单倍体细胞的方法,所述方法包括,采用cdk1蛋白激酶抑制剂和/或rock蛋白激酶抑制剂,抑制单倍体细胞二倍化。
优选地,所述cdk1蛋白激酶抑制剂为ro3306;所述rock蛋白激酶抑制剂为y-27632;
优选地,所述抑制是在单倍体细胞的培养和/或分化过程中抑制所述单倍体细胞二倍化;
优选地,所述单倍体细胞为哺乳动物、优选啮齿类动物的单倍体细胞,更优选为单倍体胚胎干细胞、单倍体神经干细胞、单倍体神经细胞、单倍体心肌细胞或单倍体内胚层祖细胞;
优选地,所述方法包括,采用本发明提供的组合物培养和/或分化所述单倍体细胞。
例如,本发明提供一种获得单倍体神经干细胞、单倍体神经细胞、单倍体心肌细胞或单倍体内胚层祖细胞的方法,所述方法包括,采用本发明提供的组合物培养和/或分化单倍体胚胎干细胞或其前体细胞。
再一方面,本发明还提供通过上述方法获得的各种单倍体细胞以及它们中任一种在遗传学研究中的用途。
例如,本发明提供通过上述方法获得的单倍体神经细胞及其在神经毒素及神经生理功能等遗传学研究中的用途。
与现有技术相比,本发明提供了蛋白激酶抑制剂具有抑制单倍体细胞二倍化的这一新发现。
本发明的发明人从细胞周期角度入手,采用h2b-gfp标记的单倍体胚胎干细胞,观察该单倍体胚胎干细胞分裂过程中染色体的动态变化,发现单倍体胚胎干细胞细胞分裂过程中异常,导致染色体加倍。基于此,本发明的发明人对细胞周期的一些重要调控因子和检验点进行小分子筛选,筛选出能够促进单倍体维持的小分子化合物。特别是发现了,cdk1蛋白激酶和rock蛋白激酶抑制剂能有效地抑制单倍体二倍化,而细胞周期检验点蛋白chk1抑制剂则显著降低单倍体干细胞的单倍体比例。
利用筛选的cdk1蛋白激酶和rock蛋白激酶抑制剂、特别是rock蛋白激酶抑制剂,可以广泛进行孤雄、孤雌单倍体胚胎干细胞的培养。这有助于单倍体胚胎干细胞的大量扩增,大大降低不断纯化单倍体的过程,简化培养方案、降低成本,推动了单倍体胚胎干细胞的应用。
利用筛选的cdk1蛋白激酶和rock蛋白激酶抑制剂,还可以广泛进行孤雄、孤雌单倍体胚胎干细胞的分化。本发明获得了单倍体神经干细胞、神经细胞、心肌细胞、胰岛祖细胞等单倍体体细胞,并提供了一种获得三胚层来源的单倍体体细胞的有效方法。由于单倍体单拷贝基因型的特点,所述方法以及获得的单倍体细胞为研究如神经发生与神经性疾病、心肌发育与心血管疾病等等特定生命过程提供了良好的高效遗传学模型。例如,本发明利用单倍体神经细胞筛选了提高神经细胞对神经毒性锰离子抗性的基因,为特定的毒性筛选实验提供新的载体。
综上,本发明的新发现与基于其的新的技术方案为基于单倍体基因组的研究与应用提供了基础。
附图说明
以下,结合附图来详细说明本发明的实施方案,其中:
图1示出了二倍体胚胎干细胞(对照)和单倍体胚胎干细胞分裂过程中的染色体的动态变化。
图2显示了cdk1和rock蛋白激酶抑制剂及其浓度对单倍体胚胎干细胞二倍化的抑制作用。
图3显示了rock蛋白激酶抑制剂在单倍体胚胎干细胞分化成单倍体神经干细胞过程中对二倍化的抑制作用。
图4显示了rock激酶抑制剂在单倍体神经干细胞分化成单倍体神经元过程中对二倍化的抑制作用。
图5显示了rock激酶抑制剂在单倍体胚胎干细胞分化成单倍体心肌细胞过程中对二倍化的抑制作用。
图6显示了rock激酶抑制剂在单倍体胚胎干细胞分化成单倍体内胚层祖细胞过程中对二倍化的抑制作用。
图7显示了获得的单倍体神经干细胞在神经毒性物质抗性遗传学筛选中的应用。
具体实施方式
以下参照具体的实施例来说明本发明。本领域技术人员能够理解,这些实施例仅用于说明本发明,其不以任何方式限制本发明的范围。
下述实施例中的实验方法,如无特殊说明,均为常规方法。下述实施例中所用的药材原料、试剂材料等,如无特殊说明,均为市售购买产品。
实施例1单倍体胚胎干细胞分裂过程中染色体的动态变化
从同一品系h2b-gfp转基因小鼠(从北京维通利华实验动物技术有限公司引进)分别建立受精卵来源的二倍体胚胎干细胞系和孤雄(孤雌)单倍体胚胎干细胞系。
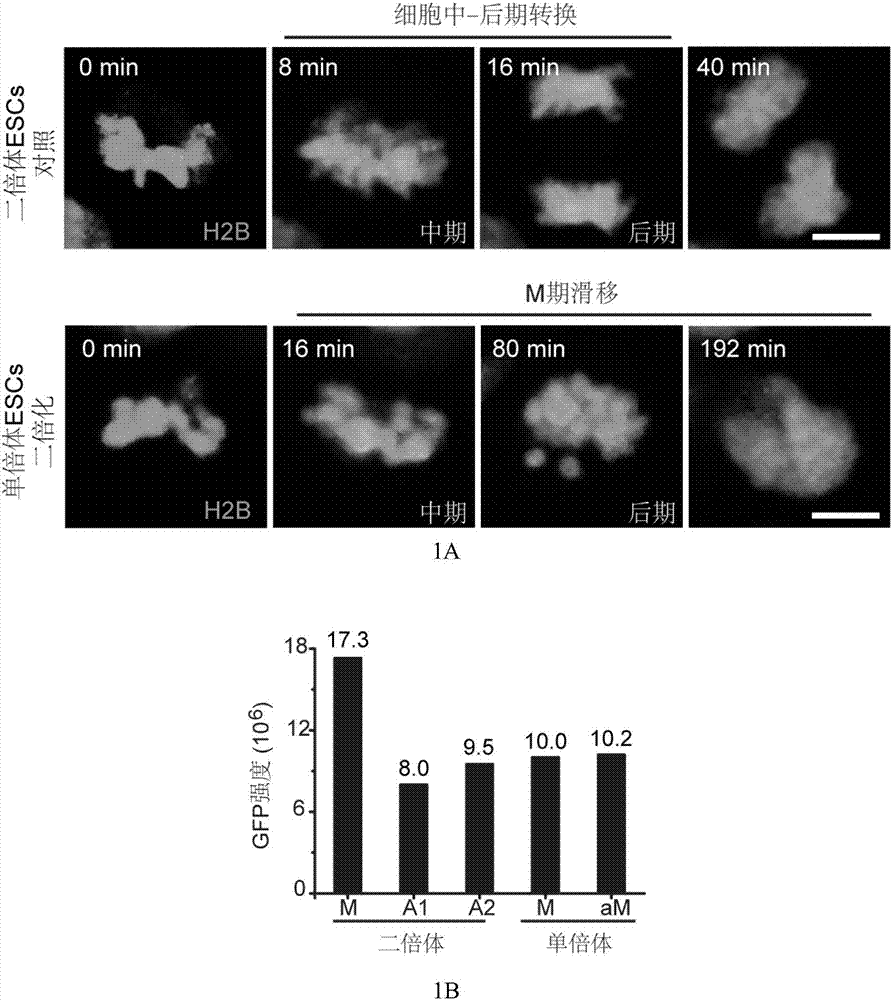
在12孔板中进行二倍体胚胎干细胞系和孤雄单倍体胚胎干细胞的培养。首先,将小鼠的饲养层细胞(丝裂霉素c(sigma,m0503)处理的小鼠e13.5天的胚胎成纤维细胞)接种于培养孔板,用成纤维细胞培养液(高糖dmem(gibco,c12430500bt),1×丙酮酸钠(100×,gibco,11360-070),1×非必需氨基酸(100×,gibco,11140-050),1×penicillin-streptomycin(gibco,15140163,100×)加10%胎牛血清(gibco,16000-044)培养备用。将孤雄(孤雌)单倍体胚胎干细胞利用活细胞染料2μg/mlhoechst33342(invitrogen,h3570)于37摄氏度染色15-20分钟,流式分选(流式分选仪器为mofloxdp高速多色流式细胞分选仪)收集1n峰,二倍体es作对照确定2n峰位置。将富集的单倍体胚胎干细胞平均种于铺好饲养层细胞的12孔板。利用小鼠胚胎干细胞培养液:n2b27基础培养基(dmem/f12(gibco,10565018)与neurobasal(gibco,21103-049)1比1混合,加入1×n2添加剂(100×,gibco,17502048),1×b27添加剂(50×,gibco,17504044),2%牛血清蛋白(1000×,sigma,a8022),1×β-巯基乙醇(1000×,gibco,21985023),1×glutamax(200×,gibco,35050-061),1μg/ml胰岛素(roche,11376497001)),加入10%血清替代物(gibco,10828028)和1×penicillin-streptomycin(gibco,15140163,100×),再加1微摩尔的pd0325901(stemgent,04-0006-10)、3微摩尔的chir99021(stemgent,04-0004-10)和1000u/ml的白血病抑制因子lif(millipore,esg2207)。流式纯化的单倍体h2b-gfp标记的胚胎干细胞利用活细胞工作站观察细胞进入m期分裂的情况,二倍化来源的二倍体h2b-gfp标记胚胎干细胞作为对照。图1a示出(上面一行)二倍体胚胎干细胞分裂进入分裂期染色体凝集(从左往右第1张图),中期染色体凝集排列到中期板(从左往右第2张图),大概16分钟后进入后期(从左往右第3张图),染色体被拉开走向两极,并伴随发生染色体解凝集(从左往右第4张图)。图1a还示出(下面一行)单倍体胚胎干细胞分裂进入分裂期染色体凝集,排列中期到中期板(从左往右第1张图),在1小时内都没有进入后期即染色体被拉开走向两极(从左往右第2-3张图),在发生m期阻滞3小时内后染色体没有观察到后期的进入,并伴随发生染色体解凝集进入末期或间期(从左往右第4张图),发生了m期的滑移(slippage)导致染色体加倍。图1b利用zen2011软件分别定量二倍体和单倍体染色体部分的gfp荧光强度(反映染色体的含量)。图1c显示二倍体和单倍体胚胎干细胞有丝分裂时,正常m期和异常m期比率。
大量的观察结果显示,对于二倍体细胞观察至少152个分裂相(进入m期染色体凝集),100%分裂相在进入中期后在半小时内均进入后期(染色体被拉开,拉向两极),进入后期后发生染色体解凝集。对于单倍体细胞观察至少160个分裂相(进入m期染色体凝集),接近10%分裂相在进入中期后有长达2小时以上的阻滞没有进入后期(染色体被拉开,拉向两极),直接发生染色体解凝集。
实施例2抑制单倍体细胞二倍化的蛋白激酶抑制剂及其浓度的筛选
(一)在12孔板中进行蛋白激酶抑制剂及其浓度的筛选。
首先,将小鼠的饲养层细胞(丝裂霉素c(sigma,m0503)处理的小鼠mef)接种于培养孔板,用成纤维细胞培养液(同实施例1)加10%胎牛血清(gibco,16000-044)培养备用。将孤雄(孤雌)单倍体胚胎干细胞利用活细胞染料2μg/mlhoechst33342(invitrogen,h3570)于37摄氏度染色15-20分钟,流式分选收集1n峰,二倍体es作对照确定2n峰位置。将富集的单倍体胚胎干细胞平均种于铺好饲养层细胞的12孔板。利用小鼠胚胎干细胞培养液(同实施例1),加入特定浓度、特定种类的蛋白激酶抑制剂。相同剂量的dmso作为对照。每种蛋白激酶抑制剂和dmso至少设置3个平行样。结果见下表1。
表1不同抑制剂对单倍体二倍化影响
(二)用cdk1蛋白激酶抑制剂、rock蛋白激酶抑制剂进行实验。
采用与上文第(一)部分相同的操作,将蛋白激酶抑制剂加入小鼠es培养液培养12-15天后,10μg/mlhoechst33342染色流式分析抑制剂组和dmso组的单倍体比率。
图2a示出4.5μm的cdk1抑制剂ro3306(biovision,2039-1)和任一的rock抑制剂如20-40μmy-27632(selleck,s1049)显著地抑制单倍体胚胎干细胞二倍化:纯的单倍体对照组dmso处理12天单倍体比率为10%,而实验组ro3306处理12天单倍体比率为80%;对照组dmso处理单倍体比率为16%,而y-27632(y-27)处理12天单倍体比率为92%。图2b示出药物处理后小鼠es细胞成经典的克隆形态。并且如图2c(免疫荧光染色成像在激光共聚焦显微镜zeisslsm780或leica双光子激光共聚焦显微镜tcssp8仪器上完成)所示,免疫荧光染色不影响多能性因子oct4(santacruz,sc-8628)、nanog(abcam,ab80892)、sox2(milipore,ab5603)和ssea1(millpore,mab4301)等表达。
如上所述分别用1.5、3和4.5μm的ro3306进行其浓度的筛选实验。图2d示出ro3306的浓度大于3μm时对单倍体二倍化抑制显著,而4.5μm时效果最佳,为最佳浓度,大于5μm严重影响细胞存活,结果至少三次生物学重复。后续实验采用最佳浓度4.5μm的ro3306进行大量的更严格独立重复实验(至少6株孤雄单倍体胚胎干细胞和3株孤雌单倍体胚胎干细胞),验证ro3306显著地抑制单倍体胚胎干细胞体外培养二倍化,如图2f所示。
如上所述分别用5、10、20和40μm的y-27632进行其浓度的筛选实验。图2e示出y-27632的浓度大于20μm时对单倍体二倍化抑制显著,而40μm时效果最佳,为最佳浓度,大于40μm严重影响es细胞形态,结果至少三次生物学重复。后续实验采用最佳浓度40μm的y-27632进行大量的更严格独立重复实验(至少3株孤雄单倍体胚胎干细胞和2株孤雌单倍体胚胎干细胞),验证y-27632显著地抑制单倍体胚胎干细胞体外培养二倍化,如图2g所示。图2d至图2g中的“before”表示实验前。
实施例3采用rock激酶抑制剂,由单倍体胚胎干细胞获得单倍体神经干细胞
获得流式纯化的孤雄(孤雌)单倍体胚胎干细胞,将5万个细胞种于具有饲养层细胞的3.5cm的培养皿,3-5天长出克隆,0.25%胰蛋白酶(gibco,25200-072)消化3-5min,10%fbs终止消化,1×pbs洗一遍,用无pd0325901、无chir99021和lif的小鼠胚胎干细胞培养液(同实施例1)悬浮培养单倍体es,悬浮培养2天后,将500个拟胚体球种于铺有多聚赖氨酸1mg/ml(sigma,p6407)和5ug/ml层粘连蛋白(invitrogen,23017-015)6cm的培养皿。16小时后换成神经干细胞培养液(n2b27基础培养液(同实施例1),加20ng/mlbfgf(r&d,233-fb-001mg)和20ng/mlegf(r&d,2028-eg-200))。加入任一rock抑制剂如20μmy-27632,相同剂量的dmso作为对照。贴壁分化3天后,消化,1:10传代种于铺有多聚赖氨酸1mg/ml(sigma,p6407)和5ug/ml层粘连蛋白(invitrogen,23017-015)6cm的培养皿。进一步分化,在分化第10天,流式分析并分选纯化单倍体。图3a示出从单倍体es开始(第0天)分化30天的分化过程。图3b示出分化10天的结果,dmso对照组单倍体几乎完全发生二倍化(单倍体比率为1.5%),y-27632组维持高的单倍体比率(单倍体比率大于90%)。图3c-3g为分化30天后的检测结果,其中图3c示出y-27632组进一步分化出现明显的神经干细胞形态;图3d示出y-27632组的核型分析发现分化的细胞大部分为20条染色体;图3e和3f示出免疫荧光染色鉴定经典的神经干细胞标记蛋白,y-27632组的细胞95%以上共表达nestin(anti-nestin,millipore,mab353)、sox2(anti-sox2,milipore,ab5603)、pax6(anti-pax6,abcam,ab5790)、cd133(anti-cd133,miltenyibiotec,130-105-226)等;图3g示出实时定量pcr鉴定神经干细胞标记蛋白nestin、sox2、n-cadherin和zfp521的mrna上调。
实施例4采用rock激酶抑制剂,由单倍体神经干细胞获得单倍体神经元
分化获得单倍体神经干细胞(同实施例3)。
采用分化培养基(n2b27基础培养基(同实施例1)加1%胎牛血清,并添加rock抑制剂20μmy-27632)进行分化培养。在随机分化第7天,免疫荧光染色神经元的标记蛋白tuj1,图4a左1图示出有大量的神经元形态,伸出长的轴突且表达tuj1蛋白(anti-tuj1,millipore,mab163);图4a右3图示出流式分析tuj1-fitc阳性的细胞比率为9%,tuj1阳性细胞大部分为单倍体,未分化的二倍体神经干细胞为阴性对照。
采用分化培养基(n2b27基础培养基(同实施例1)加3%胎牛血清,并添加rock抑制剂20μmy-27632)进行分化培养。在随机分化第14天,免疫荧光染色神经胶质细胞的标记蛋白gfap,图4b左1图示出有大量的神经胶质形态,且表达gfap(anti-gfap,dako,z033429);图4b右3图示出流式分析gfap-fitc阳性的细胞比率为19%,gfap阳性细胞大部分为单倍体,未分化的二倍体神经干为阴性对照。
将分化7天的神经元进一步纯化,培养基换成神经元成熟培养基(n2b27基础培养基(同实施例1)加入100μmcamp(sigma,d0627),20ng/ml脑源神经营养因子(nt-3,peprotech,450-02),20ng/mlnt-3(peprotech,450-03)和20ng/ml胶质细胞源性神经营养因子(peprotech,450-10)),并加入rock抑制剂20μmy-27632,成熟培养14天,免疫荧光染色神经元的标记蛋白tuj1和map-2,图4c示出接近100%的神经元表达tuj1和map-2(anti-map-2,abcam,ab32454)。图4d示出流式分析map-2阳性的细胞单倍体比率大于65%。图4e示出成熟神经元共表达tuj1和神经突触蛋白syn1(anti-syn1,millipore,ab1543p)。图4f示出膜片钳检测分化的单倍体神经元电生理功能,结果是有钠离子电流、钾离子电流和一定的动作电位。
实施例5采用rock激酶抑制剂,由单倍体胚胎干细胞获得单倍体心肌细胞
获得流式纯化的孤雄(孤雌)单倍体胚胎干细胞,将5万个细胞种于具有饲养层细胞的3.5cm的培养皿,3-5天长出克隆,0.25%胰蛋白酶(gibco,25200-072)消化3-5min,10%fbs终止消化,1×pbs洗一遍,用无pd0325901、无chir99021和lif的小鼠胚胎干细胞培养液(同实施例1)悬浮培养单倍体es,悬浮培养2天后,将500个拟胚体球种于铺有基质胶matrigelmatrix(bd,354277)6cm的培养皿。16小时后换成心肌诱导培养液(df12,1×b27添加剂(50×,gibco,17504044),10%血清替代物(1000×,sigma,a8022),1×β-巯基乙醇(1000×,gibco,21985023),1×glutamax(200×,gibco,35050-061)),加入1×penicillin-streptomycin(gibco,15140163,100×)和10ng/ml骨形态发生蛋白4(bmp4,r&d,5020-bp-010),10ng/mlactivina(r&d,338-ac-050/cf),6μmgsk3β抑制剂chir99021(stemgent,04-0004-10)。第五天,2μmiwr1替换gsk3β抑制剂chir99021再诱导2天后,在第七天撤掉bmp4和activina。换成心肌培养液进行培养过程中一直加入rock抑制剂20μmy-27632。图5a示出分化过程,心肌分化第12天,出现跳动的心肌,图5b示出免疫荧光染色鉴定分化出现心肌细胞特异的心肌肌钙蛋白t(anti-ctnt,abcam,ab8295)。未分化的小鼠胚胎干细胞作为阴性对照,图5c示出单倍体胚胎干细胞分化获得ctnt阳性心肌细胞,图5d示出ctnt阳性心肌细胞绝大部分为单倍体。
实施例6采用rock激酶抑制剂,由单倍体胚胎干细胞获得单倍体内胚层组细胞
获得流式纯化的孤雄(孤雌)单倍体胚胎干细胞,将5万个细胞种于具有饲养层细胞的3.5cm的培养皿,3-5天长出克隆,0.25%胰蛋白酶(gibco,25200-072)消化3-5min,10%fbs终止消化,1×pbs洗一遍,用无pd0325901、无chir99021和lif的小鼠胚胎干细胞培养液(同实施例1)悬浮培养单倍体es,悬浮培养2天后,将500个拟胚体球种于铺有纤维连接蛋白(fibronectin,millipore,fc010)6cm的培养皿。16小时后换成内胚层诱导培养液(df12,1×b27添加剂(50×,gibco,17504044),10%血清替代物(1000×,sigma,a8022),1×β-巯基乙醇(1000×,gibco,21985023),1×glutamax(200×,gibco,35050-061)),加入1×penicillin-streptomycin(gibco,15140163,100×)和100ng/mlactivina(r&d,338-ac-050/cf),3μmgsk3β抑制剂chir99021(stemgent,04-0004-10)。换成内胚层诱导培养液进行培养过程中一直加入rock抑制剂20μmy-27632。图6a示出分化过程。培养16天后染色胰岛祖细胞的特异蛋白pdx1。图6b示出免疫荧光染色鉴定分化出现心胰岛祖细胞的特异蛋白pdx1(anti-pdx1,abcam,ab47383)。未分化的小鼠胚胎干细胞作为阴性对照,图6c示出单倍体胚胎干细胞分化获得pdx1阳性胰岛细胞,图6d示出pdx1阳性的胰岛细胞大部分为单倍体。
实施例7单倍体神经干细胞在遗传学研究及毒性遗传学筛选中的应用
采用单倍体神经干细胞(来自实施例3)进行神经毒性物质抗性的遗传学筛选。
用1毫摩尔的氯化锰处理作为对照,实验过程如图7a所示。筛选4天后,对照组野生型单倍体神经干细胞几乎全部死亡,而基因捕获库里有少量细胞存活,如图7b所示(箭头示出活细胞)(独立重复3次)。
扩增活细胞,即氯化锰抗性的神经干细胞,图7c示出至少2次实验结果,氯化锰抗性的细胞高通量测序验证基因捕获位点基因富集在突触传递、膜电位、神经元投递等生物学过程中的基因,其中park2基因在至少两次实验捕获率较高。
利用crisper-cas9特异性敲除原代二倍体神经干细胞中的park2,以提高原代二倍体神经干细胞锰离子的抗性。图7d示出野生型二倍体和park敲除的原代二倍体神经干细胞用500μmmncl2分别处理3天后细胞形态图,图7e示出野生型和park敲除的原代二倍体神经干细胞用500微摩尔氯化锰分别处理3天后活细胞数统计。
以上对本发明具体实施方式的描述并不限制本发明,本领域技术人员可以根据本发明作出各种改变或变形,只要不脱离本发明的精神,均应属于本发明所附权利要求的范围。
参考文献
elling,u.,taubenschmid,j.,wirnsberger,g.,o'malley,r.,demers,s.-p.,vanhaelen,q.,shukalyuk,andreyi.,schmauss,g.,schramek,d.,schnuetgen,f.,etal.(2011).forwardandreversegeneticsthroughderivationofhaploidmouseembryonicstemcells.cellstemcell9,563-574.
leeb,m.,walker,r.,mansfield,b.,nichols,j.,smith,a.,andwutz,a.(2012).germlinepotentialofparthenogenetichaploidmouseembryonicstemcells.development139,3301-3305.
leeb,m.,andwutz,a.(2011).derivationofhaploidembryonicstemcellsfrommouseembryos.nature479,131-134.
sagi,i.,chia,g.,golan-lev,t.,peretz,m.,weissbein,u.,sui,l.,sauer,m.v.,yanuka,o.,egli,d.,andbenvenisty,n.(2016).derivationanddifferentiationofhaploidhumanembryonicstemcells.nature.
takahashi,s.,lee,j.,kohda,t.,matsuzawa,a.,kawasumi,m.,kanai-azuma,m.,kaneko-ishino,t.,andishino,f.(2014).inductionoftheg2/mtransitionstabilizeshaploidembryonicstemcells.development141,3842-3847.
yang,h.,shi,l.,wang,b.-a.,liang,d.,zhong,c.,liu,w.,nie,y.,liu,j.,zhao,j.,gao,x.,etal.(2012).generationofgeneticallymodifiedmicebyoocyteinjectionofandrogenetichaploidembryonicstemcells.cell149,605-617.
zhou,q.,wang,m.,yuan,y.,wang,x.,fu,r.,wan,h.,xie,m.,liu,m.,guo,x.,zheng,y.,etal.(2016).completemeiosisfromembryonicstemcell-derivedgermcellsinvitro.cellstemcell18,330-340.
- 还没有人留言评论。精彩留言会获得点赞!