一种检测染色体非整倍性的试剂盒及其制备方法和应用与流程
本发明涉及生物免疫检测
技术领域:
,具体涉及一种试剂盒及其制备方法和应用,尤其涉及一种检测染色体非整倍性的试剂盒及其制备方法和应用。
背景技术:
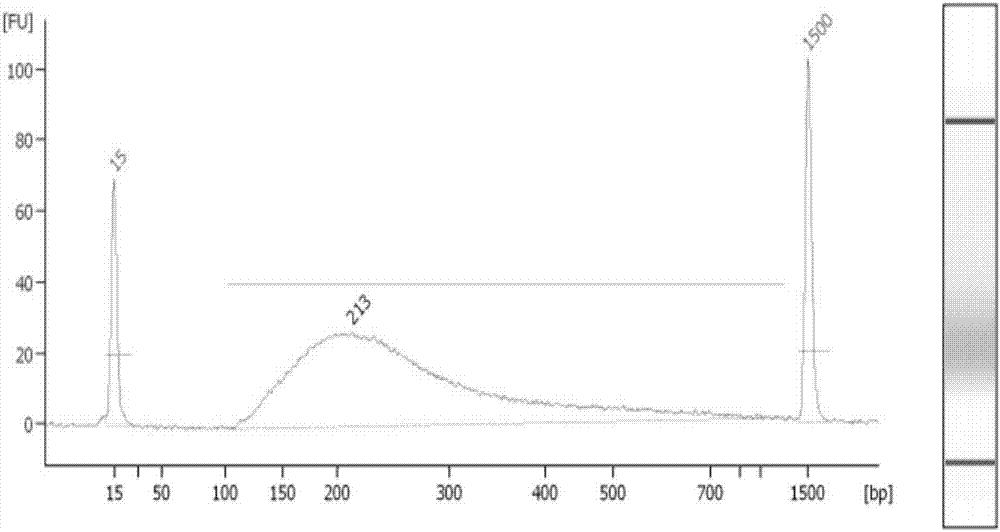
:在我国,不孕不育患者已超过5000万。习惯性流产的发病率也呈逐年上升趋势。临床上自然流产的发生率为15%~25%,而其中的80%以上为发生在妊娠12周前的早期流产。引起自然流产的因素包括免疫系统异常、易栓症、感染、遗传以及表观遗传学方面的异常和其他原因未明的因素。而在已知的诸多引发自然流产的因素中,自然流产的胚胎50%~60%为染色体异常,针对孕早期流产的最主要的两个原因胚胎染色体数目异常和结构异常,准确找到流产原因并有针对性的进行临床指导就显得尤为重要。通过流产组织染色体异常检测技术,对流产组织进行染色体分析,即可将导致胚胎异常的原因向前追溯,从而将有助于寻找到流产发生的根源所在,便可提示医生从更科学的角度合理的指导夫妇再次备孕,对优生优育具有极其重要的临床意义。随着分子生物技术的发展,流产组织染色体检测的方法也由传统的核型分析,发展到荧光原位杂交技术(fish)法、微阵列比较基因组杂交技术(array-cgh)和新一代基因测序(ngs)技术等。传统核型分析虽然认识染色体疾病诊断得金标准,但操作复杂,需要对流产组织、羊水细胞、绒毛组织等进行细胞培养,易发生细胞培养失败或漏检、误诊等情况。fish无需细胞培养,快速简便的优点,但仅能针对探针覆盖特定的染色体进行检查,并不能全面反映流产组织等的染色体情况。array-cgh虽然具有快速、特异性强、检测位点多的优势,但价格昂贵,未能广泛应用。然而,ngs技术的发展,不仅可以实现对全基因组的快速检测,且准确性高,通量大、灵敏度高和成本低的优势,已广泛应用于临床诊断等。技术实现要素:本发明的目的在于提供一种检测染色体非整倍性的试剂盒及其制备方法和应用,所述试剂盒通过流产组织样本构建dna文库来检测染色体异常的情况。为达到此发明的目的,本发明采用以下技术方案:第一方面,本发明提供了一种检测染色体非整倍性的试剂盒,所述试剂盒包括:试剂i、试剂iii和纯化磁珠或试剂ii、试剂iii和纯化磁珠;其中,所述试剂i包括打断修复缓冲液、打断修复酶、datp、dntp、dna聚合酶i和rtaq酶;所述试剂ii为打断修复缓冲液、打断修复酶、datp、dntp、克列诺酶和rtaq酶;所述试剂iii为t4dna连接酶,pnk缓冲液,接头。根据本发明,所述试剂i和试剂ii中的打断修复缓冲液为10×打断修复缓冲液。优选地,所述试剂i和试剂ii中的打断修复酶的活力单位为1-5u。根据本发明,所述试剂i中的datp包括10-15mm的datp和1-3mm的dntp。根据本发明,所述试剂ii中的datp包括10-15mm的datp和1-3mm的dntp。优选地,所述试剂i和试剂ii中的rtaq酶的活力单位为1-10u。根据本发明,所述试剂i中的dna聚合酶i的活力单位为1-10u。优选地,所述试剂ii中的克列诺酶的活力单位为1-10u。根据本发明,所述试剂i的ph为7.6-7.9。优选地,所述试剂ii的ph为7.6-7.9。根据本发明,所述试剂iii中的t4dna连接酶的活力单位为600u。优选地,所述试剂iii中的pnk缓冲液为10×pnk缓冲液。根据本发明,所述试剂iii的ph为7.6-7.9。根据本发明,所述磁珠为ampurexp磁珠和/或axygenxp磁珠。第二方面,本发明提供一种如第一方面所述的检测染色体非整倍性的试剂盒用于检测流产组织染色体异常的方法,所述方法包括以下步骤:(1)提取样本dna;(2)将所述样本dna与所述试剂i或试剂ii混合反应;(3)将反应后的dna样本3’端加上接头“a”;(4)将所述加上接头“a”的片段与试剂iii反应,得到两端加接头的dna片段;(5)采用磁珠纯化步骤(4)所述两端加接头的dna片段;(6)pcr扩增步骤(5)纯化后的片段,通过高温变性得到单链结构dna片段,再通过桥式寡核苷酸和t4连接酶将pcr单链环化,得到环状文库,并进行测序。第三方面,本发明提供如第一方面所述的检测染色体非整倍性的试剂盒用于检测动物、植物或微生物中的任意一种或至少两种的组合的染色体异常。与现有技术相比,本发明具有如下有益效果:本发明的试剂盒通过高效准确的建库方法来检测染色体异常,提高了比对率,减少gc的偏差,降低dup率,同时也能减小测序前10bp波动,不会存在at分离的情况;不仅如此,本发明可以应用在多个场景,包括检测动物,植物,微生物的染色体异常检测。附图说明图1为本发明建库流程示意图;图2为本发明pcr产物片段分布。具体实施方式为更进一步阐述本发明所采取的技术手段及其效果,以下结合本发明的优选实施例来进一步说明本发明的技术方案,但本发明并非局限在实施例范围内。实施例中未注明具体技术或条件者,按照本领域内的文献所描述的技术或条件,或者按照产品说明书进行。所用试剂或仪器未注明生产厂商者,均为可通过正规渠道商购获得的常规产品。实施例1:流产组织样本进行cnv变异检测所述建库流程如图1所示,包括如下步骤:1.样品收集及处理:取8个流产组织样本用qiaampdnabloodminikit(qiagen)提取dna,最后将dna溶于20μlte溶液。2.末端修复:按下表1配置体系。表1将10μl反应液(试剂i或试剂ii)加入均一化至20μl的dna溶液中,混匀,置于37℃孵育15min;65℃孵育15min,以0.1℃/秒的速率降温至4℃。3.接头连接:本方案中使用的接头序列如下(本实施例中的序列从左到右为5’端至3’端,“//”示修饰基团,“phos”示磷酸化,b10示10个碱基的标签序列)。长链:/5phos/agtcggaggccaagcggtcttaggaagacaa(b10)ca(seqidno:1);短链:ttgtcttcctaaggaacgacatggctacgatccgactt(seqidno:2)。接头混合液(10μm)按以下表3配方配制。表3组分用量长链(100μm)40μl短链(100μm)40μl氯化钠(5m)4μl三羟甲基氨基甲烷-盐酸(1m,ph7.8)4μl乙二胺四乙酸二钠(2mm)20μl无酶纯水292μl总体积400.0μl将1μl配制好的接头混合液(10μm)加入上一步骤产物中,充分混匀。按下表4配置体系。表4组分用量试剂iii49μl总体积49μl将连接反应体系(试剂iii)与接头和产物的混合液混匀,置于23℃孵育30min。反应完之后,加入20μlte缓冲液,再加入50μlampurexp磁珠(beckman公司)进行纯化,42μlte缓冲液溶解回收产物。需要说明:反应产物的纯化有多种方式,有磁珠法、柱纯化法、凝胶回收法等,均可用于替换。4.pcr(聚合酶链式反应)引物序列如下:(本实施例中的序列从左到右为5’端至3’端,“//”示修饰基团,“phos”示磷酸化)。引物1序列:/5phos/gaacgacatggctacga(seqidno:3);引物2序列:tgtgagccaaggagttg(seqidno:4)。按下表5配制体系。表5将上步骤23μl回收产物,加入到以上体系中,混匀后按下表条件进行反应,条件如表6。表6反应完成后使用50μlampurexp磁珠进行纯化,30μlte缓冲液溶解回收产物。取1μl回收产物,用qubitdsdnahs分析试剂盒(invitrogen公司)定量产物浓度,进行下一步反应。pcr产物片段分布2100结果如图2所示。5.单链环化:将8个带有不同标签序列的扩增产物各取20ng进行混合,用te配置成48μl体系,加入5μl20μm介导片段,混匀。将反应体系置于95℃孵育3min,立马置于冰上。其中介导片段具有相应互补序列用于连接单链两端,其序列如下:(本实施例中的序列从左到右为5’端至3’端)。gccatgtcgttctgtgagccaagg(seqidno:5)。配制如下表7的反应体系:表7组分用量环化反应缓冲液6.6μl环化酶0.2μl总体积6.8μl将表7反应体系加入纯化的产物中,混匀,置于37℃孵育30min。6.测序取构建的单链环状dna文库进行dna纳米球制备、bgiseq-500/50上机测序。测序过程严格按照bgiseq-500/50的标准操作流程进行上机操作。7.数据分析使用“流产组织非整倍体检测软件”进行信息分析。8.信息分析检测结果如下表8:表8申请人声明,本发明通过上述实施例来说明本发明的详细方法,但本发明并不局限于上述详细方法,即不意味着本发明必须依赖上述详细方法才能实施。所属
技术领域:
的技术人员应该明了,对本发明的任何改进,对本发明产品各原料的等效替换及辅助成分的添加、具体方式的选择等,均落在本发明的保护范围和公开范围之内。当前第1页12
相关技术
网友询问留言
已有0条留言
- 还没有人留言评论。精彩留言会获得点赞!
1