体外诱导多能干细胞分化为心室肌细胞的方法与流程
本发明是国际申请号pct/cn2013/079811的pct发明专利申请,优先权日为2012年7月23日,国家阶段申请号为2013800394581,发明名称为“体外诱导多能干细胞分化为心室肌细胞的方法”的中国专利申请的分案申请。
本发明涉及多能干细胞分化及细胞信号转导领域,具体地说,涉及体外诱导多能干细胞分化为心室肌细胞的方法。
背景技术:
对于人类和哺乳动物而言,心肌细胞在出生前具有分裂增殖的能力,而出生以后,这一能力迅速降低。成年人的心肌细胞几乎不具备分裂增殖的能力。在发生诸如心肌梗塞等心脏组织坏死性疾病时,由于成体心肌细胞已失去增殖分裂的能力,不能通过心肌细胞的再生来修复坏死的组织,所以这类疾病引起的心脏功能衰退是不可逆转的。虽然可以通过药物的使用增加心肌收缩力,提高心脏的泵血能力,但心脏负担的加重反而可能使病情恶化。用正常的心肌细胞移植替换已经坏死的细胞是从根本上治疗这类心脏病的方法之一。因为成体心肌细胞几乎已失去分裂增殖能力,寻找人心肌细胞的来源成为目前再生医学治疗心肌梗塞首要解决的问题。
多能性干细胞(pluripotentstemcells),如胚胎干细胞(embryonicstemcells)1、诱导的多能干细胞(inducedpluripotentstemcells,ipsc)2,3,不但具有较强的自我复制能力,而且还具有分化成心肌细胞的潜能。因此,例如胚胎干细胞的多能干细胞是目前最具潜力的心肌细胞来源,而建立高效的,心肌细胞定向分化方法是获得心肌细胞的关键。
利用多能干细胞如胚胎干细胞,诱导分化心肌细胞一般包括两种方法:一种是悬浮培养胚胎干细胞,使其形成胚状体(embryoidbody)进而继续分化成心肌细胞;另一种方法是直接诱导一般培养条件下的单层贴壁胚胎干细胞,使其向心肌细胞分化。已有文献报道多种细胞因子具有提高心肌分化效率的作用,其用量及作用时间因不同的诱导分化体系而异。
人的多能干细胞分化的心肌细胞主要分为三类:起搏细胞(nodalcell)、心室肌细胞(ventricularmyocytescell)和心房肌细胞(atrialmyocytecell)4。完全成熟的心肌细胞根据其功能属性又可分为工作心肌细胞和自律性的起搏心肌细胞两大类。工作心肌细胞的肌原纤维丰富,具有传导性和兴奋性,执行收缩功能。它们是心房和心室壁的主要构成部分,即心房肌细胞和心室肌细胞。具有自律性的起搏心肌细胞丧失了收缩性,但它们和工作心肌细胞一样具有传导性和兴奋性。而且它们还具有独特的自律性。心房肌细胞、心室肌细胞和起搏细胞这三类细胞的胞内肌原纤维的组成以及细胞膜上的离子通道蛋白表达有明显区别,这也就造成它们的动作电位和收缩的节律性有很大差别。对于心肌细胞移植而言,至关重要的是要移植适当种类且纯度较高的单一亚型的心肌细胞。例如,修复心室组织需要移植高纯度的心室肌细胞,这关系到其能否顺利整合到受体心脏、能否真正提高心脏功能和是否能够减少移植细胞所带来的心律不齐等副作用。如果移植细胞种类不匹配或纯度不高的心肌细胞,会造成心律不齐,损害受体的原有心脏功能。由于左心室主要负担全身的血液供给,其体积最大,细胞壁也最厚,泵血能力最强,而心肌梗死导致的心肌细胞坏死也多发于该区域。因此,对于三类心肌细胞来说,获得心室肌细胞对细胞移植治疗心肌梗死具有更为重要的意义5。
心脏是人体最重要的器官,获取大量的人心肌细胞对心脏病药物的研制和药物的安全性评估具有重要意义和应用价值。由于成年人的心肌细胞几乎没有分裂生长能力,不能进行体外培养扩增。因此,目前没有人的心肌细胞可以大量地用于实验研究。几乎所有的心脏毒理实验和心脏病药物的实验研究都是利用动物或原代分离的动物心肌细胞来完成。但是,由于动物心脏及其细胞与人心脏及心肌细胞的生理差异,利用动物或动物的心肌细胞来进行药物的毒理分析的准确率只有60%左右,因此目前的药物毒理分析方法还有待进一步改进和提高。利用干细胞或转分化而获得的人的心肌细胞可以为药物的心脏毒理分析提供一种有效的新工具。利用细胞工程获取的人的心肌细胞可以在细胞水平上建立人心脏的毒理分析方法,从而减少心脏毒理分析中动物的使用,提高分析的准确率,这是目前生物医药工业研究的一个热点。由于国际上药物注册的相关规定条款(ichs7b)要求药物的心脏毒理分析必须出具药物对心室,特别是对心室心率影响的数据,因此,利用细胞工程获取的心肌细胞中,心室肌细胞对发展利用人心肌细胞药物毒理分析方法具有最为重要的意义6。
综上,无论是利用干细胞分化的心肌细胞治疗进行细胞移植治疗心肌梗死,还是利用获取的心肌细胞进行药物的心脏毒理分析,都需要获得高纯度的人的心室肌细胞。因此,揭示心肌前体细胞向心室肌细胞分化过程中的调节机制不仅对高效诱导获得心室肌细胞具有重要的意义,而且还对细胞移植治疗心肌梗死和利用人干细胞分化的心肌细胞进行药物研发具有重要意义。
现已报道的利用干细胞分化心肌的各种方法主要存在以下缺陷:诱导心肌细胞分化的效率不高,且得到的心肌细胞是起搏细胞、心房肌细胞和心室肌细胞的混合细胞群体,不能实现不同心肌细胞的定向分化4。2007年,c.e.murry等利用单层培养的人类胚胎干细胞直接诱导分化心肌细胞用于小鼠的心脏移植,其平均的分化效率只有大约30%,即最后心肌细胞占总细胞数的30%7。经过密度梯度离心的分离纯化,最终可以获得纯度80%左右的心肌细胞群体。2008年,g.m.keller等利用悬浮培养类胚体进行分化,在分化第六天用流式细胞术分离出心肌的前体细胞继续培养分化,大幅提高了分化效率,最终分化效率可以达到50%以上8。但此法同样没能实现心房和心室肌细胞的定向分化。总之,上述的分化心肌细胞方法中均尚未述及分化过程对心房细胞和心室细胞发育的影响,最终的分化产物大多报道是含有三类心肌细胞的混合物,而且目前没有分离这三类心肌细胞的特异分离方法的相关报道。2007年,有报道利用慢病毒转染人类胚胎干细胞,构建心室细胞特异表达的mlc-2v基因一段保守的启动子所启动的绿色荧光蛋白(egfp)插入的细胞系,将其分化为表达绿色荧光蛋白的心肌细胞。该方法有利于心肌细胞的纯化,纯度能达到90%以上,但由于该类细胞需插入mlc-2v诱导的gfp或其他筛选基因的dna到干细胞的基因组中,因而这类具有转基因的心肌细胞并不适用于临床的细胞移植。2010年,中国科学院生物物理研究所马跃实验室的研究发现,在干细胞心肌分化的中期,即从中胚层细胞到心肌细胞的阶段(从干细胞到中胚层细胞的阶段为分化初期),利用维甲酸处理分化的细胞可以有效地将分化的干细胞诱导成心房肌细胞;于此同时抑制维甲酸通路则可以有效地将细胞分化成心室肌细胞9。虽然这一研究成果首次解释了干细胞心肌分化是诱导获得心房肌细胞和心室肌细胞的方法,但对于如何诱导心室肌的分化尚未找出明确的主动调节分子。
技术实现要素:
本发明的目的是提供体外诱导多能干细胞分化为心室肌细胞的方法。
为了实现本发明目的,本发明的体外诱导多能干细胞分化为心室肌细胞的方法是通过在体外维持、扩增、培养多能干细胞,并于多能干细胞分化的中期向培养基中加入可直接或间接激活smad1/5/8信号通路的物质,使其定向分化为心室肌细胞。其中,所述激活smad1/5/8信号通路是指使胞质中的smad1、smad5、smad8蛋白中的一种或几种磷酸化。所述多能干细胞分化的中期即由中胚层细胞或心肌前体细胞向心肌细胞分化的时期,具体指从细胞开始表达brachyury(t)基因和/或mesp1基因,到分化成能自主收缩的心肌细胞之前的一段时期。
前述方法中,所述的多能干细胞为胚胎干细胞(embryonicstemcells)、诱导的多能干细胞(inducedpluripotentstemcells)、胚胎生殖细胞或成人多能干细胞,且这些多能干细胞来自于哺乳动物。
前述方法中,所述可直接或间接激活smad1/5/8信号通路的物质为骨形态发生蛋白2(bonemorphogeneticprotein2,bmp2)和/或骨形态发生蛋白4(bonemorphogeneticprotein4,bmp4)等,其终浓度为0.01-1200ng/ml。
前述方法中,在多能干细胞分化的初期,即从干细胞分化成心肌前体细胞的时期,向培养基中加入具有促进心肌细胞分化的物质。所述具有促进心肌细胞分化的物质为bmp4、碱性成纤维细胞生长因子(bfgf)、激活素a(activina)、noggin、dorsomorphin、6-溴靛玉红-3'-肟(6-bromoindirubin-3′-oxime,bio)等中的至少一种。其中,添加的细胞生长因子的终浓度为0.01-1200ng/ml,其它小分子化合物的终浓度为0.001-100μm。
前述方法中,在多能干细胞分化的中期,还向培养基中添加具有抑制wnt信号通路的物质。所述具有抑制wnt信号通路的物质为dickkopf同源物1(dickkopfhomolog1,dkk1)、iwp、iwr(inhibitorsofwntresponse)等中的至少一种,添加的小分子化合物的终浓度为0.001-100μm,dkk1的终浓度为0.01-1200ng/ml。
前述方法中,在多能干细胞分化的中期,还包括i)当培养基中不含有维甲酸或其合成所需的底物时,向其中加入维甲酸受体γ(rarγ)的激活剂;或ii)当培养基中含有维甲酸或其合成所需的底物时,向其中加入维甲酸受体α(rarα)和/或维甲酸受体β(rarβ)的拮抗剂。i)中所述激活剂以及ii)中所述拮抗剂的终浓度为0.001-100μm。
具体地,本发明提供三套技术方案:
技术方案i:
(1)悬浮培养或单层培养实质上未分化的多能干细胞;
(2)在分化过程的初期加入具有促进心肌细胞分化的细胞因子,如bmp4、bfgf、activina、noggin等;或加入具有抑制bmp通路的小分子化合物,如dorsomorphin等;或加入能够激活wnt3a的小分子化合物,如bio、chir99021等;
(3)在分化过程的中期通过向培养基中添加例如dkk1、iwp或iwr等抑制wnt通路的蛋白生长因子或小分子化合物以抑制wnt信号通路,与此同时加入bmp2和/或bmp4等能够激活smad1/5/8磷酸化的信号分子,定向诱导细胞分化成为心室肌细胞。
技术方案ii:
(1)悬浮培养或单层培养实质上未分化的多能干细胞;
(2)在分化过程的初期加入具有促进心肌细胞分化的细胞因子,如bmp4、bfgf、activina、noggin等;或加入具有抑制bmp通路的小分子化合物,如dorsomorphin等;或加入能够激活wnt3a的小分子化合物,如bio等;
(3)在分化过程的中期通过向培养基中添加例如dkk1、iwp或iwr等抑制wnt通路的蛋白生长因子或小分子化合物以抑制wnt信号通路,与此同时加入能够刺激细胞表达分泌能激活smad1/5/8磷酸化的信号分子,例如,在不含有维甲酸或其合成所需的前体底物(如维生素a)的培养基中加入维甲酸受体rarγ的激活剂(如bms961)。利用这些步骤可以将干细胞分化的心肌细胞定向诱导成以心室肌为主的心肌细胞。
技术方案iii:
(1)悬浮培养或单层培养实质上未分化的多能干细胞;
(2)在分化过程的初期加入具有促进心肌细胞分化的细胞因子,如bmp4、bfgf、activina、noggin等;或加入具有抑制bmp通路的小分子化合物,如dorsomorphin等;或加入能够激活wnt3a的小分子化合物,如bio等;
(3)在分化过程的中期通过向培养基中添加例如dkk1、iwp或iwr等抑制wnt通路的蛋白生长因子或小分子化合物以抑制wnt信号通路,与此同时,在含有维甲酸或其合成底物的培养基中加入维甲酸受体rarα和/或rarβ的拮抗剂(如rarα的拮抗剂ro41-5253和rarβ的拮抗剂le135)。利用这些步骤可以将干细胞分化的心肌细胞定向诱导成以心室肌为主的心肌细胞。
分化过程从第14天以后,每3天更换一次无因子的培养基;培养60-90天后,利用膜片钳技术检测心肌细胞的动作电位,钙信号影像记录,mlc-2v和ctnt双染并进行流式细胞分析等方法确定分化的心室肌细胞及非心室肌的心肌细胞(包括心房肌细胞和起搏细胞)。
本发明进一步提供采用上述方法制备的心室肌细胞在筛选治疗心脏病药物及药物的心脏毒理检测中的应用。
本发明进一步提供采用上述方法制备的心室肌细胞在受损心脏的干细胞治疗中的应用。
本发明还提供了一套促进干细胞分化为心室肌细胞的方法,该方法包括激活中胚层细胞中的smad1/5/8信号通路;其中,所述中胚层细胞由干细胞分化而来。
前述方法中,所述干细胞为全能干细胞(totipotentstemcell)、多能干细胞(pluripotentstemcell)、专能干细胞(multipotentstemcell)、寡能干细胞(oligopotentstemcell)或单能干细胞(unipotentstemcell)。
前述方法中,所述干细胞为胚胎干细胞、诱导的多能干细胞。
前述方法中,所述干细胞为哺乳动物干细胞。
前述方法中,所述干细胞为诱导的人多能干细胞。
前述方法中,由干细胞分化成中胚层细胞是通过使未分化的干细胞与以下物质中的至少一种发生接触;所述物质为bfgf、骨形态发生蛋白2(bmp2)、bmp4、activina、bmp拮抗剂、bmp信号通路抑制剂、wnt3a信号通路激活剂等。
前述方法中,所述bmp拮抗剂为bmp4拮抗剂。
前述方法中,所述bmp拮抗剂为noggin。
前述方法中,所述bmp信号通路抑制剂为小分子bmp信号通路抑制剂。
前述方法中,所述小分子bmp信号通路抑制剂为dorsomorphin。
前述方法中,所述wnt3a信号通路激活剂为小分子wnt3a信号通路激活剂。
前述方法中,所述小分子wnt3a信号通路激活剂为gsk-3α/β的atp-竞争性抑制剂。
前述方法中,所述gsk-3α/β的atp-竞争性抑制剂为细胞渗透双吲哚并(靛玉红)化合物(cell-permeablebis-indolo(indirubin)compound)。
前述方法中,所述细胞渗透双吲哚并(靛玉红)化合物为bio。
前述方法中,所述bfgf、bmp2、bmp4、activina、bmp拮抗剂、bmp信号通路抑制剂、wnt3a信号通路激活剂等,添加的生长因子的终浓度为0.01-1200ng/ml,其它物质的终浓度为0.001-100μm。
前述方法中,使干细胞与bmp2和/或bmp4接触从而激活smad1/5/8信号通路。
前述方法中,bmp2和/或bmp4使用的终浓度为约0.01-1200ng/ml。
前述方法中,通过在不含有维甲酸或其前体的培养基中培养干细胞,并使干细胞与维甲酸受体γ(rarγ)激活剂发生接触,从而激活smad1/5/8信号通路。
前述方法中,所述维甲酸前体为维生素a。
前述方法中,所述rarγ激活剂为bms961、palovarotene或购自sigma-aldrich的cd437等。
前述方法中,rarγ激活剂使用的终浓度为约0.001-100μm。
前述方法中,使干细胞与维甲酸受体α(rarα)和/或维甲酸受体β(rarβ)拮抗剂发生接触,从而激活smad1/5/8信号通路。
前述方法中,所述rarα拮抗剂为ro41-5253、bms195614或er50891等,所述rarβ拮抗剂为le135等。
前述方法中,rarα和/或rarβ拮抗剂使用的终浓度为0.001-100μm。
前述方法中,进一步包括使所述干细胞与wnt抑制剂发生接触,从而使干细胞分化成心室肌细胞。
前述方法中,所述wnt抑制剂为dkk1、iwp、wntresponse抑制剂等中的至少一种。
前述方法中,wnt抑制剂dkk1使用的终浓度为0.01-1200ng/ml,其它抑制剂的终浓度为0.001-100μm。
本发明还提供按照上述方法制备得到的心室肌细胞。
前述的心室肌细胞,心室特异表达基因、心室肌动作电位(embryonicventricular-likeactionpotentials,ap)和/或心室肌细胞的代表性特征ca2+火花(ca2+spark)的表达水平或比率升高。
前述的心室肌细胞,所述心室特异表达基因为irx-4和/或mlc-2v。
本发明还提供一种组合物,其包括已分化成中胚层细胞的,且用能够激活干细胞中smad1/5/8信号通路的外源性物质处理的干细胞。
前述的组合物,所述能够激活干细胞中smad1/5/8信号通路的外源性物质为bmp2和/或bmp4等。
前述的组合物,所述能够激活干细胞中smad1/5/8信号通路的外源性物质为rarγ激活剂。
前述的组合物,所述能够激活干细胞中smad1/5/8信号通路的外源性物质为rarα和/或rarβ拮抗剂。
本发明还提供由干细胞生成心室肌细胞的方法,该方法包括:1)使干细胞与bfgf和bmp4接触,从而引发细胞分化;2)经bfgf和bmp4处理后的干细胞与activina接触,从而形成中胚层细胞;3)将已分化成中胚层细胞的干细胞与noggin接触,从而提高干细胞向心肌细胞分化的效率;4)激活经noggin处理后的干细胞中的smad1/5/8信号通路,从而促进心室肌细胞的形成;5)将经noggin处理后的干细胞与以下物质中的至少一种接触,使干细胞分化成心室肌细胞;所述物质为dkk1、iwp、iwr等中的至少一种。
前述方法中,通过使所述干细胞与bmp2和/或bmp4接触,从而激活smad1/5/8信号通路。
前述方法中,通过在不含有维甲酸或其前体维生素a的培养基中培养干细胞,并使干细胞与rarγ激活剂发生接触,以提高培养细胞中bmp2/4的表达水平,从而激活smad1/5/8信号通路。
前述方法中,通过使所述干细胞与rarα和/或rarβ拮抗剂接触,从而激活smad1/5/8信号通路。
本发明还提供按照上述方法制备得到的心室肌细胞。
本发明还提供用于治疗心脏受损或心脏病的药物组合物,其包括有效量的前述心室肌细胞以及药用载体或赋形剂。
本发明还提供治疗心脏受损或心脏病的方法,该方法包括对需要进行此类治疗的个体施以有效量的上述药物组合物。
前述方法中,所述个体为人类。
前述方法用于心脏受损的干细胞治疗。
本发明还提供前述心室肌细胞在制备用于治疗和/或预防心脏受损或心脏病的药物中的应用。
本发明还提供前述心室肌细胞在筛选和/或开发用于治疗和/或预防心脏受损或心脏病的药物中的应用。
本发明还提供前述心室肌细胞在药物的心脏毒理检测中的应用。
本发明进一步提供鉴定心室肌细胞调节因子的方法,该方法包括:1)使前述心室肌细胞与候选的调节因子接触,并测定该候选调节因子对心室肌细胞功能的影响;2)测定未与该候选调节因子接触的心室肌细胞的功能;如果与该候选调节因子接触的心室肌细胞的功能较未与该候选调节因子接触的心室肌细胞的功能不同,则确定该候选调节因子为所述心室肌细胞的功能调节因子。
本发明提供的体外诱导多能干细胞分化为心室肌细胞的方法,通过对干细胞的直接诱导,在干细胞心肌分化的中期,通过向培养体系中直接加入bmp2和/或bmp4等能够激活smad1/5/8信号通路的物质,可以使干细胞定向分化成以心室肌细胞为主的心肌细胞。在培养体系中,在含有维甲酸或其合成所需的前体(如维生素a)的条件下,添加bmp2和或bmp4等能够激活smad1/5/8信号通路的物质可以有效地抑制心肌前体细胞向心房肌细胞的分化,并诱导心室肌细胞的分化。在加入维甲酸或维生素a的同时加入bmp2和/或bmp4等能够激活smad1/5/8信号通路的物质,则分化的心肌细胞中心房肌细胞的比率随着加入bmp4浓度的增加而降低,而分化的心肌细胞中心室肌细胞的比率却随之增加。如果在干细胞心肌分化的中期,只加入bmp2/4,同时在培养基中去除维甲酸或其合成所需的前体,则可以使心肌前体细胞高效定向分化成心室肌细胞。在干细胞分化的中期,利用在培养基中添加维甲酸的受体rarα或rarβ的激活剂,可以有效地抑制心室肌细胞的分化,表现为心室肌细胞的早期标记基因irx-4的表达受到抑制。但是在无维甲酸或其前体维生素a的条件下,加入rarγ的激活剂可以有效地将干细胞诱导分化成心室肌细胞。另外,在含有维生素a或维甲酸的培养基中添加rarα和rarβ的拮抗剂也可以有效地提升irx-4的表达水平,诱导干细胞分化成心室肌细胞。
在本发明中,明确阐明了干细胞心肌分化时,bmp、smad1/5/8通路正向地调节心室肌细胞的分化,为后续利用干细胞分化获取高纯度的心室肌细胞奠定了基础。
本发明的优点在于:
利用本发明提供的体外诱导多能干细胞分化为心室肌细胞的方法,无需通过任何纯化步骤,即可成功获得高纯度的、具有生物学活性及功能的心室肌细胞,不仅为揭示心肌前体细胞向心室肌细胞分化过程中的调节机制奠定了坚实的理论基础,而且对于细胞移植治疗心肌梗死和利用人干细胞分化的心肌细胞进行药物研发具有重要意义。
附图说明
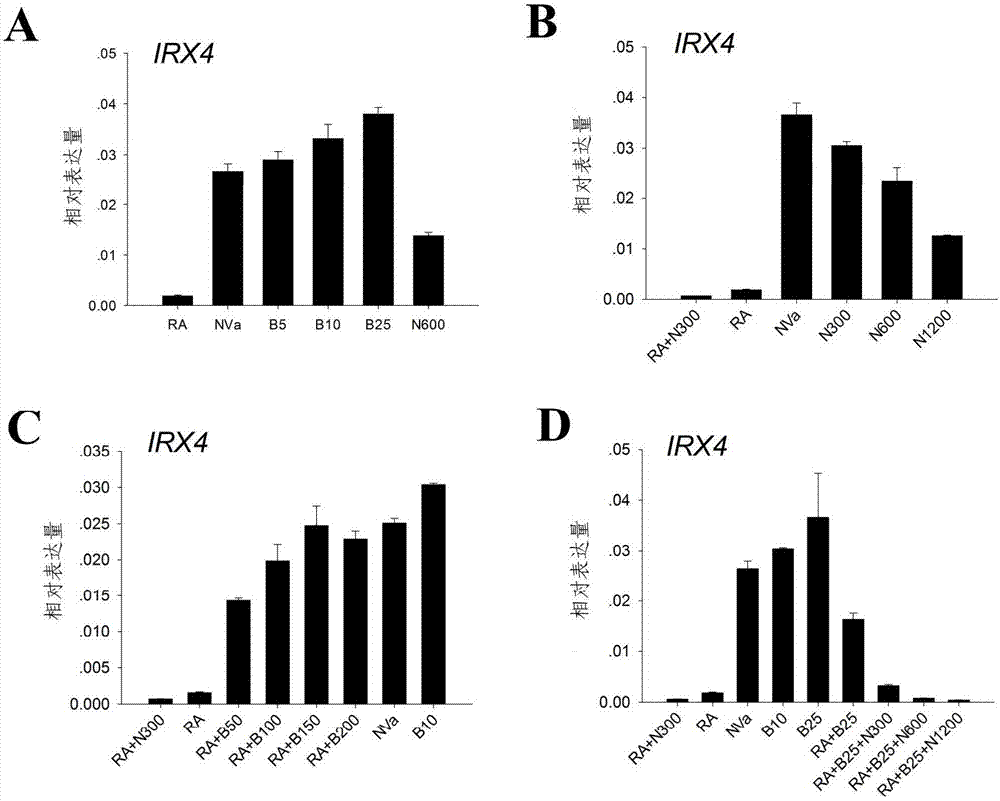
图1为在干细胞分化中期,bmp信号通路的表达及对心室肌细胞特异标记基因irx-4表达的作用;其中,a为在干细胞心肌分化的第5和第6天时利用rt-pcr技术检测bmp2、bmp4及其受体的表达;b为westenblot检测bmp通路的下游信号smad1/5/8被磷酸化激活的情况,p-smad1/5/8为磷酸化的smad1/5/8蛋白分子,t-smad1/5/8为总的smad1/5/8蛋白分子,β-肌动蛋白为内参蛋白;c中柱状图表示在分化的第14天定量rt-pcr检测irx-4基因表达水平的实验结果,该结果显示出在不同的时间段内向培养基中加入1μm的维甲酸和200ng/ml的bmp4时irx-4的表达水平,连线标记显示相应条件下干细胞心肌分化的效率;其中,n表示noggin,b表示bmp4,nva为不含有维生素a的培养基处理的分化细胞,ra表示维甲酸,数字表示浓度,bmp4的浓度单位为ng/ml,定量pcr的结果是与gadph表达量比较的相对值。
图2为定量pcr检测分化的第14天心室肌细胞早期特异表达基因irx-4在不同处理的分化干细胞中的表达水平;其中,a显示在培养基中加入不同浓度的bmp4后,irx-4的表达随着bmp的浓度增加而升高,但在加入bmp的拮抗剂noggin后表达水平下降;b为在不含维甲酸前体维生素a的培养基中加入不同剂量的noggin可以有效地降低irx-4的表达水平;c为在1μm维甲酸存在时,irx-4的表达水平随着加入bmp4的浓度的升高而增加;d显示bmp4在维甲酸存在时提高irx-4表达的现象随着向培养体系中加入noggin的浓度的增加而降低;其中,n表示noggin,b表示bmp4,nva为无维生素a培养基处理的分化细胞,ra表示维甲酸,数字表示浓度,单位为ng/ml。定量pcr的结果是与gadph表达量比较的相对值。
图3为定量rt-pcr分析irx-4基因在分化的第14天的表达水平,结果显示bmp家族的其他成员在干细胞心肌分化的第5-8天处理干细胞同样可以有效地拮抗维甲酸对心室肌细胞早期表达基因irx-4的抑制作用,而且拮抗作用随加入bmp家族生长因子的剂量的增加而加大。ra表示维甲酸,数字表示生长因子的浓度,单位为ng/ml,维甲酸的浓度为1μm。定量pcr的结果是与gadph表达量比较的相对值。
图4显示经过维甲酸、bmp4和noggin处理的干细胞分化为成熟的心室肌细胞时特异表达基因mlc-2v的表达;其中,a为利用westenblot检测经维甲酸、bmp4诱导的干细胞分化的心肌细胞在分化90天后mlc-2v的表达;b为经维甲酸、bmp4和noggin分别处理的分化90天后心肌细胞ctnt和mlc-2v双染的免疫荧光染色结果;其中,b表示bmp4,nva为无维生素a培养基处理的分化细胞,ra表示1μm维甲酸,数字表示浓度,单位为ng/ml。
图5为对分化的心肌细胞的钙活动进行共聚焦图像扫描和动作电位联用记录并利用各类心肌细胞特异钙活模式对分化的心肌细胞分类的结果;a显示具有心室肌动作电位(ventricular-likeactionpotential)的心肌细胞具有钙火花(ca2+spark),具有心房肌动作电位(atrial-likeactionpotential)的心肌细胞具有钙瞬变(ca2+transient)的特征,而具有起搏细胞动作电位(nodal-likeactionpotential)的心肌细胞具有钙震荡(ca2+oscillation)的特征;b为利用a中得到的不同亚型心肌细胞的钙信号模式,对不同处理组得到的心肌细胞进行分类所得到的各组中心肌细胞具有钙火花、钙瞬变和钙震荡的比率,纵坐标为检测到的心肌细胞中具有三种不同类型钙活动所占比率;ra表示1μm的维甲酸,b表示bmp4,nva表示无维生素a培养基,n表示noggin,数字表示浓度,单位为ng/ml。
图6为定量rt-pcr检测在细胞分化第6天时在经rarγ激活剂处理的细胞中bmp2的表达水平。其中,定量pcr的结果是与gadph表达量比较的相对值。nva表示无维生素a培养基。
图7为在干细胞心肌分化中期,向不含有维生素a的培养基中加入不同的维甲酸受体的激活剂或抑制剂等调节剂后,在分化的第14天定量rt-pcr分析心室肌特异基因irx-4在分化14天的表达水平。其中,ra表示维甲酸,rai表示维甲酸的抑制剂bms189453,nva表示培养基中不含有维生素a。rar-pan拮抗剂为bms493。定量pcr的结果是与ctnt表达量比较的相对值。
图8为对经不同诱导分化的心肌细胞的单细胞动作点位和成熟心室肌细胞特异标记基因mlc-2v的鉴定。a为经不同诱导条件分化的心肌细胞中具有心房肌、心室肌和起搏细胞动作电位的细胞的比率(n>30)。b为流式细胞分析仪检测经不同条件处理的90天分化细胞群体内心肌细胞(ctnt阳性细胞)中表达mlc-2v细胞的比率。ra表示1μm的维甲酸,b表示bmp4,nva表示无维生素a培养基,n表示noggin,数字表示浓度,单位为ng/ml。rarγ的浓度为0.1μm。
图9为本发明实施例2的体外诱导多能干细胞分化为心室肌细胞的过程。
图10为本发明实施例3中体外诱导多能干细胞分化为心室肌细胞的过程。
图11为本发明实施例4中体外诱导多能干细胞分化为心室肌细胞的过程。
图12为经维甲酸处理后分化的心肌细胞,作ctnt和mlc-2v免疫荧光共染色的结果。
图13为经维甲酸和200ng/mlbmp4处理后分化的心肌细胞,作ctnt和mlc-2v免疫荧光共染色的结果。
图14为经无维生素a的培养基及1200ng/mlnoggin处理后分化的心肌细胞,作ctnt和mlc-2v免疫荧光共染色的结果。
图15为实施例2中最终获得的分化的心肌细胞,作ctnt和mlc-2v免疫荧光共染色的结果。
图16为经无维生素a的培养基处理后分化的心肌细胞,作ctnt和mlc-2v免疫荧光共染色的结果。
图17为实施例3中最终获得的分化的心肌细胞,作ctnt和mlc-2v免疫荧光共染色的结果。
图12-图17中,带“*”标记的细胞为非心室肌心肌细胞,带“^”标记的细胞为表达mlc-2v的心室肌细胞。
具体实施方式
以下实施例用于说明本发明,但不用来限制本发明的范围。若未特别指明,实施例中所用的技术手段为本领域技术人员所熟知的常规手段,所用原料均为市售商品。
以下实施例中使用的人胚胎干细胞系h7购自wicellresearchinstitute,美国;b27培养基添加物和rpmi1640培养基,购自invitrogen;activina、bfgf、dkk1、bmp4及noggin均购自r&dsystems。
实施例1bmp/smad1/5/8信号通路在诱导心肌前体细胞向心室肌细胞分化中的作用
1研究发现,在干细胞心肌分化的过程中,在决定心肌细胞亚型分化时期,向培养基中加入维甲酸或其合成所需的底物如维生素a,可以将干细胞定向诱导成为心房肌细胞;若在此时向培养基中加入维甲酸的抑制剂或在培养基中去除维甲酸的合成底物维生素a,可以定向地将干细胞分化成心室肌细胞9。通过rt-pcr反应,分析分化的人胚胎干细胞在分化的中期表达bmp2/4及其相应的受体,结果如图1所示,bmp通路的配体和受体都存在于培养的细胞中。利用westernblot检测bmp2/4下游的信号分子磷酸化smad1/5/8,实验发现在添加维甲酸以及无维甲酸或无维生素a的培养条件下,分化细胞的smad1/5/8都被磷酸化(图1),证明bmp通路在干细胞心肌分化的中期被激活。这些实验结果显示在干细胞分化的第5至第8天bmp通路有可能参与调节新机前体细胞向心室肌细胞的分化。
2进一步检测bmp通路在干细胞心肌分化中心肌亚型定向分化的作用。已知irx-4是心室肌细胞分化过程中早期表达的标志性基因。因此本发明通过检测irx-4的表达水平来进一步研究bmp信号通路在心肌亚型决定时的作用。
实验发现,在干细胞分化的中期在无维生素a培养基分化的干细胞中加入bmp2/4通路的抑制剂noggin,可以有效地降低分化细胞中irx-4的表达,并且irx-4的表达水平随着noggin的用量加大(300ng/ml、600ng/ml和1200ng/ml)而降低,如图2所示。
3实验表明,在干细胞心肌分化的中期加入维甲酸可以抑制心室肌特异表达基因irx-4的表达。在干细胞心肌分化的中期,在加入维甲酸的同时加入不同剂量的bmp4,然后在第14天时利用定量pcr检测irx-4的表达。结果(图2)表明,在经维甲酸处理的干细胞心肌分化中加入bmp可以提高irx-4的表达,且随着添加bmp4量的提高,irx-4的表达水平亦随之增加。
bmp家族的其他成员也能够拮抗维甲酸对irx-4的抑制作用。bmp家族的成员多具有相似的功能,如图3所示,定量rt-pcr实验证明,在干细胞心肌分化的中期,在有1μm维甲酸的情况下,bmp家族的其他成员也能够不同程度地提高irx-4的表达水平,而且irx-4的表达水平随着加入生长因子的浓度的升高而升高。
综上所述,通过对心室肌细胞早期特异性表达基因irx-4的研究发现,bmp信号通路可以有效地提高分化的心肌细胞中irx-4的表达,从而揭示bmp信号通路参与了干细胞分化过程中心室肌细胞早期分化,促进心室肌细胞的分化。
4为了进一步验证bmp通路调节心室肌细胞的分化功能,本发明对分化60-90天的心肌细胞的钙活动进行了共聚焦图像扫描研究。心室肌细胞与心房肌细胞和起搏细胞的钙活动有着明显的区别。心室肌细胞的钙活动的成像频率较快,被称之为“钙火花(ca+sparks)”;而心房肌细胞的钙活动的成像显示其频率较慢,且信号较大,被称之为“钙瞬变(ca+transients)”;起搏细胞钙活动的成像显示其具有明显的周期性,被称之为“钙震荡”。首先通过单细胞膜片钳与共聚焦图像扫描连用,发现在膜片钳记录的具有心室肌动作电位的20个细胞的钙活动全部为钙火花;在膜片钳记录的具有心房肌动作电位的20个细胞全部具有钙瞬变;在膜片钳记录的具有起搏细胞动作电位的20个细胞全部具有钙震荡。因此,比较心肌细胞的钙活动的成像可以有效地区分心室肌细胞与心房肌细胞和起搏细胞。钙成像结果显示,经维甲酸处理的分化的心肌细胞中多数具有钙瞬变,且钙瞬变的比率随着加入bmp4浓度的增加而降低,相反地,分化的心肌细胞中具有钙火花的细胞比率随着添加bmp4浓度的增加而增加。该结果表明,激活bmp信号通路可以有效地诱导干细胞分化成心室肌细胞(图5)。
5如前所述,在心肌细胞分化的早期,irx-4是心室肌细胞分化的重要的特异表达基因。随着心肌细胞的成熟,心室肌细胞开始特异性地表达mlc-2v(肌球蛋白轻链2)基因。因此,本发明还检测了经不同生长因子处理的培养90天的分化细胞中mlc-2v的表达水平。westernblot显示,在分化90天的细胞中mlc-2v的蛋白表达水平也随着添加bmp4的浓度的增加而增加(图4);本发明还利用流式细胞仪检测了90天分化的细胞中表达mlc-2v的心室肌细胞占所分化的心肌细胞(表达ctnt的细胞)的比率。从图8的结果可以看出,在经维甲酸处理的分化的细胞中加入bmp处理可以有效地提高心肌细胞中表达mlc-2v细胞的比率,并且在单独用bmp4处理的条件下,表达mlc-2v细胞的比率达到最高。鉴别心肌细胞亚型最经典的方法是测量心肌细胞的动作点位。通过检测经过维甲酸和不同剂量的bmp4处理的分化的心肌细胞中具有心房、心室肌细胞和起搏细胞动作电位的比率发现(图8),在经维甲酸处理的分化细胞中,随着添加bmp4剂量的增加,具有心室肌动作点位的细胞的比率显著增加。在单独加入bmp4的分化细胞中90%以上的心肌细胞具有心室肌动作电位,即90%以上的心肌细胞为心室肌细胞。
6研究表明,在胚胎干细胞心肌分化的早期加入bmp2/4、activina、bfgf和/或noggin,并在分化的中期加入dkk1等生长因子可以将干细胞高效诱导分化成心肌细胞。定量rt-pcr实验结果显示在干细胞心肌分化的中期,在加入dkk1的同时,在不含维生素a的b27/rpmi1640培养基中,如果加入维甲酸受体rarα和rarβ的激活剂,可以降低心室特异表达基因irx-4的表达水平(图7);但是在加入dkk1的同时加入rarγ的激活剂,则可以诱导bmp2和irx-4的高表达(图6和7);另外在培养基中有维生素a的条件下,在加入dkk1时同时抑制维甲酸受体rarα和rarβ,则可以激活心室肌早期特异表达基因irx-4的表达,显示将干细胞诱导成为心室肌细胞。由于维甲酸共有三个rar受体,rarα、rarβ和rarγ,在有维生素a或维甲酸的情况下,同时抑制rarα和rarβ,与单独激活rarγ有相似的机制与效果。
流式细胞仪检测实验证明(图8),在经rarγ诱导的90天分化的心肌细胞中表达mlc-2v的心室肌细胞占所分化的心肌细胞(表达ctnt的细胞)的比率可以达到80%以上。另外对经rarγ诱导的90天分化的心肌细胞进行电生理动作电位的鉴别,显示分化细胞中92%的心肌细胞具有心室肌动作电位,是心室肌细胞。
实施例2体外诱导多能干细胞分化为心室肌细胞(技术方案一)
将人胚胎干细胞h7平铺于含明胶(gelatin)的培养皿中,加入含b27(1×浓度)的rpmi1640培养基在37℃co2细胞培养箱中培养。心肌分化的过程如图9所示,从第0天到第3天,向培养基中加入activina(10ng/ml),bmp4(6ng/ml)和bfgf(6ng/ml)。在第3天结束时更换培养基,同时加入bmp2/4的抑制剂noggin(300ng/ml)。在第5天结束时,将培养基更换为不添加维生素a的含b27的rpmi1640培养基。同时在培养基中加入wnt3a的抑制剂dkk1(300ng/ml)和bmp4(10ng/ml)。在分化的第8天结束时,将培养基更换为只含有300ng/mldkk1的培养基,在分化第10天结束时更换培养基,不添加任何生长因子。以后每3天更换一次添加b27的rpmi1640培养基。14天时可以观察到大量跳动的心肌细胞。方案流程见图9。
实施例3体外诱导多能干细胞分化为心室肌细胞(技术方案二)
将人胚胎干细胞h7平铺于含明胶(gelatin)的培养皿中,加入含b27(1×浓度)的rpmi1640培养基在37℃co2细胞培养箱中培养。心肌分化的过程如图10所示,从第0天到第3天,向培养基中加入activina(10ng/ml)、bmp4(6ng/ml)和bfgf(6ng/ml)。在第3天结束时,更换培养基,同时加入bmp2/4的抑制剂noggin(300ng/ml)。在第5天结束时,将培养基更换为不添加维生素a的含b27的rpmi1640培养基。同时在培养基中加入wnt3a的抑制剂dkk1(300ng/ml)和维甲酸受体rarγ的激活剂bms961(0.1μm,购自tocris)。在分化的第8天结束时,将培养基更换为只含有300ng/mldkk1的培养基,在分化第10天结束时更换培养基,不添加任何生长因子。以后每3天更换一次添加b27的rpmi1640培养基。14天时可以观察到大量的跳动心肌细胞。方案流程见图10。
实施例4体外诱导多能干细胞分化为心室肌细胞(技术方案三)
将人胚胎干细胞h7平铺于含明胶(gelatin)的培养皿中,加入含b27(1×浓度)的rpmi1640培养基在37℃co2细胞培养箱中培养。心肌分化的过程如图11所示,从第0天到第3天,向培养基中加入activina(10ng/ml)、bmp4(6ng/ml)和bfgf(6ng/ml)。在第3天结束时,更换培养基,同时加入bmp2/4的抑制剂noggin(300ng/ml)。在第5天结束时,使用含有维生素a的含b27的rpmi1640培养基。同时在培养基中加入wnt3a的抑制剂dkk1(300ng/ml)和维甲酸受体rarα和β的拮抗剂bms195614和le135(浓度分别为0.1μm和0.5μm)。在分化的第8天结束时,将培养基更换为只含有300ng/mldkk1的培养基,在分化第10天结束时更换培养基,不添加任何生长因子。以后每3天更换一次添加b27的rpmi1640培养基。14天时可以观察到大量跳动的心肌细胞。方案流程见图11。
图12为经维甲酸处理后分化的心肌细胞,作ctnt和mlc-2v免疫荧光共染色的结果。
图13为经维甲酸和200ng/mlbmp4处理后分化的心肌细胞,作ctnt和mlc-2v免疫荧光共染色的结果。
图14为经无维生素a的培养基及1200ng/mlnoggin处理后分化的心肌细胞,作ctnt和mlc-2v免疫荧光共染色的结果。
图15为实施例2中最终获得的分化的心肌细胞,作ctnt和mlc-2v免疫荧光共染色的结果。
图16为经无维生素a的培养基处理后分化的心肌细胞,作ctnt和mlc-2v免疫荧光共染色的结果。
图17为实施例3中最终获得的分化的心肌细胞,作ctnt和mlc-2v免疫荧光共染色的结果。
以上图12-图17中,带“*”标记的细胞为非心室肌心肌细胞,带“^”标记的细胞为表达mlc-2v的心室肌细胞。
对实施例2和3中分化60-90天的心肌细胞的钙活动进行了共聚焦图像扫描研究,钙成像结果如图5所示,从图5可以直接计算得出分化的心肌细胞中具有钙火花的细胞占分化细胞总数的比率。
以上实施例中涉及到的培养基中各添加物的终浓度,其有效范围为生长因子的终浓度在0.01-1200ng/ml,小分子化合物的浓度在0.001-100μm。
利用本发明方法,成功获得了具有生物学活性及功能的心室肌细胞,不仅揭示了心肌前体细胞向心室肌细胞分化过程中的调节机制,而且分化得到的人心室肌细胞对细胞移植治疗心肌梗死和心脏毒理分析及心脏相关药物的研发有广泛的应用。
虽然,上文中已经用一般性说明及具体实施方案对本发明作了详尽的描述,但在本发明基础上,可以对之作一些修改或改进,这对本领域技术人员而言是显而易见的。因此,在不偏离本发明精神的基础上所做的这些修改或改进,均属于本发明要求保护的范围。
参考文献
1.thomsonja,itskovitz-eldorj,shapiross,waknitzma,swiergieljj,marshallvs,jonesjm.embryonicstemcelllinesderivedfromhumanblastocysts.science.1998;282:1145-1147
2.yuj,vodyanikma,smuga-ottok,antosiewicz-bourgetj,franejl,tians,niej,jonsdottirga,ruottiv,stewartr,slukvin,ii,thomsonja.inducedpluripotentstemcelllinesderivedfromhumansomaticcells.science.2007;318:1917-1920
3.takahashik,tanabek,ohnukim,naritam,ichisakat,tomodak,yamanakas.inductionofpluripotentstemcellsfromadulthumanfibroblastsbydefinedfactors.cell.2007;131:861-872
4.hejq,may,leey,thomsonja,kamptj.humanembryonicstemcellsdevelopintomultipletypesofcardiacmyocytes:actionpotentialcharacterization.circres.2003;93:32-39
5.chenhs,kimc,mercolam.electrophysiologicalchallengesofcell-basedmyocardialrepair.circulation.2009;120:2496-2508
6.hartungt.toxicologyforthetwenty-firstcentury.nature.2009;460:208-212
7.laflammema,chenky,naumovaav,muskheliv,fugateja,duprassk,reineckeh,xuc,hassanipourm,polices,o'sullivanc,collinsl,cheny,minamie,gillea,uenos,yuanc,goldj,murryce.cardiomyocytesderivedfromhumanembryonicstemcellsinpro-survivalfactorsenhancefunctionofinfarctedrathearts.natbiotechnol.2007;25:1015-1024
8.yangl,soonpaamh,adlered,roepketk,kattmansj,kennedym,henckaertse,bonhamk,abbottgw,lindenrm,fieldlj,kellergm.humancardiovascularprogenitorcellsdevelopfromakdr+embryonic-stem-cell-derivedpopulation.nature.2008;453:524-528
9.zhangq,jiangj,hanp,yuanq,zhangj,zhangx,xuy,caoh,mengq,chenl,tiant,wangx,lip,heschelerj,jig,may.directdifferentiationofatrialandventricularmyocytesfromhumanembryonicstemcellsbyalternatingretinoidsignals.cellres.2011;21:579-587
- 还没有人留言评论。精彩留言会获得点赞!