用于革兰氏阳性菌检测和治疗的链球菌属细菌噬菌体溶素的制作方法
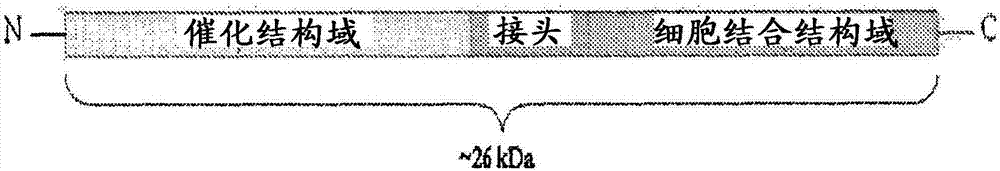
本申请是2012800272946的分案申请。发明领域本发明一般涉及对于革兰氏阳性菌和相关状况的预防和治疗性改善和治疗有用的方法、组合物和制造物品,所述革兰氏阳性菌包括链球菌属(streptococcus)和葡萄球菌属(staphylococcus)细菌菌株,包括致病性和抗生素抗性细菌。本发明涉及掺入分离的猪链球菌(streptococcussuis)细菌噬菌体溶素的组合物和制造物品,所述细菌噬菌体溶素包括plyss2和/或plyss1裂解酶及其变体,包括其截短物,并且涉及利用溶素多肽和组合物的方法。发明背景医学中的重大问题是随着更多的抗生素用于广泛多样的疾病及其他状况,抗药细菌的发展。医院感染是美国的第8大死亡主因,大部分是由于抗药性和新出现的病原体。例如,在美国每年存在超过500,000个金黄色葡萄球菌病例,并且超过65%的菌株是多重耐药的(mrsa)。更多抗生素的使用和显示抗性的细菌数目已促使更长的治疗时间。此外,广泛非特异抗生素目前正更频繁地使用,其中一些对患者具有有害作用。与这个增加的使用有关的问题是许多抗生素无法容易地渗入粘膜衬里。另外,对抗生素过敏的人数看起来是渐增的。因此,存在关于新抗菌方法尤其是经由新模式操作或提供杀死致病菌的新手段的那些的商业需要。革兰氏阳性菌由含有多肽和多糖的细胞壁包围。革兰氏阳性细胞壁作为宽的致密壁出现,所述壁是20-80nm厚的并且由众多互联肽聚糖层组成。60%-90%的革兰氏阳性细胞壁是肽聚糖,提供细胞形状、刚性结构和对渗透冲击的抗性。细胞壁不排除革兰氏染色剂结晶紫,允许细胞染成紫色,并且因此是“革兰氏阳性的”。革兰氏阳性菌包括但不限于放线菌素属(actinomyces)、芽孢杆菌属(bacillus)、李斯特菌属(listeria)、乳球菌属(lactococcus)、葡萄球菌属(staphylococcus)、链球菌属(streptococcus)、肠球菌属(enterococcus)、分枝杆菌属(mycobacterium)、棒状杆菌属(corynebacterium)和梭菌属(clostridium)。医学相关的物种包括化脓性链球菌(streptococcuspyogenes)、肺炎链球菌(streptococcuspneumoniae)、金黄色葡萄球菌(staphylococcusaureus)和粪肠球菌(enterococcusfaecalis)。产芽孢的芽孢杆菌属物种引起炭疽和胃肠炎。产芽孢的梭菌属物种负责食物中毒、破伤风、气性坏疽和假膜性结肠炎。棒状杆菌属物种引起白喉,并且李斯特菌属物种引起脑膜炎。抑制细胞壁合成的抗菌药例如青霉素和头孢菌素干扰肽聚糖的肽间连接,且减弱革兰氏阳性和革兰氏阴性菌的细胞壁。因为革兰氏阳性菌的肽聚糖是暴露的,所以革兰氏阳性菌对这些抗生素更敏感。有利地,真核细胞缺乏细胞壁并且对这些药物或其他细胞壁试剂不敏感。已作出通过使用细菌噬菌体治疗细菌病的尝试。然而,细菌噬菌体直接引入动物内以阻止或对抗疾病具有某些缺点。具体地,细菌和噬菌体必须处于正确和同步的生长周期中用于噬菌体附着。另外,必须存在正确数目的噬菌体以附着至细菌;如果存在太多或太少噬菌体,则将不存在裂解酶的附着或产生。噬菌体还必须足够活跃。噬菌体还受许多事物包括来自它准备攻击的生物体的细菌碎片抑制。使细菌噬菌体直接用于治疗细菌感染进一步复杂的是免疫反应的可能性,使得噬菌体无功能。新型抗微生物治疗方法包括基于酶的抗生素(“酶抗生素”),例如细菌噬菌体溶素。噬菌体使用这些溶素消化其细菌宿主的细胞壁,通过低渗裂解释放子代病毒。当纯化的重组溶素外部加入革兰氏阳性菌中时,相似结果产生。溶素针对革兰氏阳性病原体的高致死活性使得其成为作为治疗学开发的有吸引力的候选物。细菌噬菌体溶素最初提出用于根除致病性链球菌的鼻咽携带(loeffler,j.m.等人(2001)science294:2170-2172;nelson,d.等人(2001)procnatlacadsciusa98:4107-4112)。溶素是由双链dna(dsdna)噬菌体使用的以使宿主裂解与病毒装配完成协调的裂解机制的部分(wang,i.n.等人(2000)annurevmicrobiol54:799-825)。噬菌体编码在细菌膜中打开洞的两种穿孔素(holins)以及破坏细胞壁中的键的肽聚糖水解酶(称为溶素)[6]。在感染后期,溶素易位到细胞壁基质内,在其中它快速水解肽聚糖完整性必需的共价键,引起细菌裂解和伴随的子代噬菌体释放。溶素家族成员显示出其中催化结构域融合至特异性或结合结构域的调节设计(lopez,r.等人(1997)microbdrugresist3:199-211)。溶素可以由细菌基因组内的病毒原噬菌体序列克隆并且用于治疗(beres,s.b.等人(2007)plosone2(8):1-14)。当外部加入时,溶素能够接近革兰氏阳性细胞壁的键(图1)(fischetti,v.a.(2008)curropinionmicrobiol11:393-400)。溶素已显示证实针对众多革兰氏阳性病原体(尤其是它们由其克隆的细菌)的高致死活性,提出其作为治疗学开发的可能性(fischetti,v.a.(2008)curropinionmicrobiol11:393-400;nelson,d.l.等人(2001)procnatlacadsciusa98:4107-4112)。细菌噬菌体裂解酶已确定为通过多个施用途径在受试者中的多个感染类型的评价和特异性治疗中是有用的。例如,美国专利5,604,109(fischetti等人)涉及通过经由半纯化的c组链球菌噬菌体相关溶素酶的酶促消化,在临床样本中的a组链球菌的快速检测。这一酶工作变成另外研究的基础,导致治疗疾病的方法。fischetti和loomis专利(美国专利5,985,271、6,017,528和6,056,955)公开了通过由c1细菌噬菌体感染的c组链球菌细菌产生的溶素酶的用途。美国专利6,248,324(fischetti和loomis)公开了通过使用在适合于局部应用于皮肤组织的载体中的裂解酶用于皮肤病学感染的组合物。美国专利6,254,866(fischetti和loomis)公开了用于治疗消化道的细菌感染的方法,其包括施用对于感染细菌特异性的裂解酶。用于将至少一种裂解酶递送至消化道的载体选自栓剂灌肠剂、糖浆剂或肠溶丸剂。美国专利6,264,945(fischetti和loomis)公开了通过肠胃外引入(肌内、皮下或静脉内)至少一种裂解酶和用于将裂解酶递送到患者内的合适载体,用于治疗细菌感染的方法和组合物,所述裂解酶通过由对于那种细菌特异性的细菌噬菌体感染的细菌产生。噬菌体相关裂解酶已得到鉴定且从多个细菌噬菌体中克隆,各自显示在杀死特异性细菌菌株中是有效的。美国专利7,402,309、7,638,600和公开的pct申请wo2008/018854提供了作为用于治疗或减少炭疽杆菌(bacillusanthracis)感染的抗菌剂有用的独特噬菌体相关裂解酶。美国专利7,569,223描述了用于肺炎链球菌的裂解酶。对于肠球菌属(粪肠球菌(e.faecalis)和屎肠球菌(e.faecium),包括万古霉素抗性菌株)有用的溶素在美国专利7,582291中描述。us2008/0221035描述了在杀死b组链球菌中高度有效的突变型plygbs溶素。具有针对葡萄球菌细菌包括金黄色葡萄球菌的活性且指定为clys的嵌合溶素在wo2010/002959中详述。猪链球菌是全世界范围内感染猪的革兰氏阳性病原体。从猪到人的动物传染病传播报道是渐增的(sriskandans.等人(2006)plosmedicine3(5):585-567)。猪链球菌可能在未来数年在人群中发展出长久存在。人和猪已用青霉素或庆大霉素进行治疗,但存在对这些抗生素抗性的猪链球菌分离物(cantin,m.等人(1992)jvetdiagnosticinvestig4:170-174)。由与目前常规抗菌剂相关的缺陷和问题而显而易见的是,本领域仍存在关于另外的特异性细菌试剂以及更广谱的试剂的需要,所述试剂特别是不含获得抗性的高风险。值得注意的是迄今为止,没有溶素已显示证实针对致病性和临床相关细菌的多个不同物种的广泛裂解活性。本文参考文献的引用不应解释为这些是本发明的现有技术的承认。发明概述在其最广泛的方面,本发明提供了针对多种细菌具有广泛杀死活性的溶素,所述细菌特别是革兰氏阳性菌,包括葡萄球菌属、链球菌属、肠球菌属和李斯特菌属细菌菌株。本发明提供了能够杀死来自不同目的细菌的细菌噬菌体溶素。在一个方面,提供了能够杀死来自不同杆菌目,特别是芽孢杆菌目和乳杆菌目的一种或多种细菌的溶素多肽。本发明提供了能够且证实在体外和体内杀死来自两个不同目特别是芽孢杆菌目和乳杆菌目的细菌的溶素多肽。本发明的溶素能够杀死混合培养和体内混合感染中的芽孢杆菌目和乳杆菌目细菌。本发明因此考虑了细菌、培养物或感染或在这样的情况下的处理、去定殖和/或去污染,在所述情况下怀疑或存在超过一种革兰氏阳性菌,特别是葡萄球菌属、链球菌属、肠球菌属和李斯特菌属细菌中的一种或多种。特别地,本发明考虑了细菌、培养物或感染或在这样的情况下的处理、去定殖和/或去污染,在所述情况下怀疑、存在或可能存在超过一个类型的芽孢杆菌目细菌、超过一个类型的乳杆菌目细菌、或至少一个类型的芽孢杆菌目和一个类型的乳杆菌目细菌。依照本发明,提供了衍生自猪链球菌细菌的细菌噬菌体溶素。两个示例性不同和独特的溶素已得到分离和表征,特别是plyss1包括其活性截短物和plyss2。本发明的溶素多肽在证实针对多种细菌的广泛杀死活性中是独特的,所述细菌特别是革兰氏阳性菌,包括葡萄球菌属、链球菌属、肠球菌属和李斯特菌属细菌菌株。在一个此类方面,plyss2溶素能够杀死动物模型中的金黄色葡萄球菌菌株和细菌,如本文在小鼠中证实的。plyss2有效针对抗生素抗性金黄色葡萄球菌,例如甲氧西林抗性金黄色葡萄球菌(mrsa)、万古霉素中度敏感性金黄色葡萄球菌(visa)和万古霉素抗性金黄色葡萄球菌(vrsa)。在进一步的此类方面,plyss1溶素能够减少金黄色葡萄球菌菌株和细菌的生长,包括抗生素抗性金黄色葡萄球菌例如甲氧西林抗性金黄色葡萄球菌(mrsa)、万古霉素中度敏感性金黄色葡萄球菌(visa)或万古霉素抗性金黄色葡萄球菌(vrsa)。本发明包括包含溶素多肽的组合物和制造物品,以及预防和治疗细菌生长、定殖和感染的方法。在本发明的一个方面,提供了杀死革兰氏阳性菌的方法,其包括使细菌与包含一定量的有效杀死革兰氏阳性菌的分离溶素多肽的组合物接触的步骤,所述分离溶素多肽包含plyss2溶素多肽或其有效杀死革兰氏阳性菌的变体。因此,提供了杀死革兰氏阳性菌的方法,其包括使细菌与包含一定量的有效杀死革兰氏阳性菌的分离溶素多肽的组合物接触的步骤,所述分离溶素多肽包含seqidno:3的氨基酸序列,或其与seqidno:3的多肽具有至少80%同一性、85%同一性、90%同一性、95%同一性或99%同一性并且有效杀死革兰氏阳性菌的变体。在上述方法的另外方面,该组合物还包含有效量的包含seqidno:1的氨基酸序列的分离溶素多肽,所述分离溶素多肽包含seqidno:2的氨基酸序列,或其与seqidno:1或seqidno:2的多肽具有至少80%同一性并且有效杀死革兰氏阳性菌的变体。本发明提供了杀死革兰氏阳性菌的方法,其包括使细菌与包含一定量的有效杀死革兰氏阳性菌的分离溶素多肽的组合物接触的步骤,所述分离溶素多肽包含plyss1溶素多肽或其有效杀死革兰氏阳性菌的截短物或变体。在这种方法的一个方面,组合物包含有效量的包含seqidno:1的氨基酸序列的分离溶素多肽、包含seqidno:2的氨基酸序列的分离的截短溶素多肽、或其与seqidno:1或seqidno:2的多肽具有至少80%同一性、85%同一性、90%同一性、95%同一性或99%同一性并且有效杀死革兰氏阳性菌的变体。在上述杀死革兰氏阳性菌的方法的一个方面,该方法在体外或离体执行,以便使特别是预期用于通过人或在人中使用的溶液、材料或装置灭菌或去污染。本发明提供了用于减少革兰氏阳性菌群体的方法,其包括使细菌与包含一定量的有效杀死至少部分革兰氏阳性菌的分离多肽的组合物接触的步骤,所述分离多肽包含seqidno:3的氨基酸序列,或其与seqidno:3的多肽具有至少80%同一性并且有效杀死革兰氏阳性菌的变体。在这种方法的一个实施方案中,组合物还包含有效量的包含seqidno:1的氨基酸序列的分离溶素多肽、包含seqidno:2的氨基酸序列的分离溶素多肽、或其与seqidno:1或seqidno:2的多肽具有至少80%同一性并且有效杀死革兰氏阳性菌的变体。本发明还提供了用于减少革兰氏阳性菌群体的方法,其包括使细菌与包含一定量的有效杀死至少部分革兰氏阳性菌的分离多肽的组合物接触的步骤,所述分离多肽包含plyss1溶素多肽或其有效杀死革兰氏阳性菌的截短物或变体。在这种方法的一个方面,组合物包含有效量的包含seqidno:1的氨基酸序列的分离溶素多肽、包含seqidno:2的氨基酸序列的分离溶素多肽、或其与seqidno:1或seqidno:2的多肽具有至少80%同一性、85%同一性、90%同一性或95%同一性并且有效杀死革兰氏阳性菌的变体。在上述用于减少革兰氏阳性菌群体的方法的一个方面,该方法在体外或离体执行,以便使特别是预期用于通过人或在人中使用的溶液、材料或装置灭菌或去污染。本发明还提供了用于治疗人中的抗生素抗性金黄色葡萄球菌感染的方法,其包括给具有抗生素抗性金黄色葡萄球菌感染的人施用有效量的包含分离多肽的组合物的步骤,所述分离多肽包含seqidno:3的氨基酸序列或其与seqidno:3的多肽具有至少80%同一性、85%同一性、90%同一性或95%同一性并且有效杀死金黄色葡萄球菌的变体,由此人中的金黄色葡萄球菌数目减少并且感染受到控制。在这种方法的一个方面,组合物可以备选地或可以进一步包含有效量的包含seqidno:1的氨基酸序列的分离溶素多肽、包含seqidno:2的氨基酸序列的分离溶素多肽、或其与seqidno:1或seqidno:2的多肽具有至少80%同一性、85%同一性、90%同一性或95%同一性并且有效杀死金黄色葡萄球菌的变体。本发明的方法还包括用于治疗在人中由葡萄球菌属、链球菌属、肠球菌属或李斯特菌属细菌中的一种或多种引起的革兰氏阳性菌感染的方法,其包括给具有细菌感染的受试者施用有效量的包含分离多肽的组合物的步骤,所述分离多肽包含seqidno:3的氨基酸序列或其与seqidno:3的多肽具有至少80%同一性、85%同一性、90%同一性或95%同一性并且有效杀死革兰氏阳性菌的变体,由此人中的革兰氏阳性菌数目减少并且感染受到控制。在上述方法中使用的组合物可以备选地或可以进一步包含有效量的包含seqidno:1的氨基酸序列的分离溶素多肽、包含seqidno:2的氨基酸序列的分离溶素多肽、或其与seqidno:1或seqidno:2的多肽具有至少80%同一性、85%同一性、90%同一性或95%同一性并且有效杀死革兰氏阳性菌的变体。本发明另外包括用于治疗暴露于或处于暴露于致病性革兰氏阳性菌的危险中的人受试者的方法,其包括给受试者施用包含一定量的有效杀死革兰氏阳性菌的分离溶素多肽的组合物的步骤、包含seqidno:3的氨基酸序列的分离溶素多肽、或其与seqidno:3的多肽具有至少80%同一性、85%同一性、90%同一性或95%同一性并且有效杀死革兰氏阳性菌的变体。在这种方法的特定方面,其中受试者暴露于或处于下述之一或一种或多种的危险中:葡萄球菌属(例如金黄色葡萄球菌)、链球菌属(例如化脓性链球菌)、李斯特菌属(例如单核细胞增多性李斯特菌(l.monocytogenes))或肠球菌属(例如粪肠球菌)细菌。受试者可以是人。受试者可以是成人、儿童、婴儿或胎儿。在本发明的组合物和方法中使用的溶素多肽的变体可以基本上等同于本文例示的溶素多肽中的一种或多种,包括seqidno:1、2或3。与本文例示的溶素多肽包括seqidno:1、2或3相比较,在本发明的组合物和方法中使用的溶素多肽的变体可以在氨基酸序列中具有至少75%同一性、至少80%同一性、至少90%同一性、至少95%同一性。在任何此类上述一种或多种方法中,敏感的、杀死的或处理过的细菌可以选自金黄色葡萄球菌、单核细胞增多性李斯特菌、溶血性葡萄球菌(staphylococcussimulans)、猪链球菌、表皮葡萄球菌(staphylococcusepidermidis)、马链球菌(streptococcusequi)、马链球菌兽疫亚种(streptococcusequizoo)、无乳链球菌(streptococcusagalactiae)(gbs)、化脓性链球菌(gas)、血链球菌(streptococcussanguinis)、格氏链球菌(streptococcusgordonii)、停乳链球菌(streptococcusdysgalactiae)、g组链球菌、e组链球菌、粪肠球菌和肺炎链球菌。依照本发明的任何方法,敏感细菌或待处理或去定殖的细菌可以是抗生素抗性细菌。细菌可以是甲氧西林抗性金黄色葡萄球菌(mrsa)、万古霉素中度敏感性金黄色葡萄球菌(visa)或万古霉素抗性金黄色葡萄球菌(vrsa)。敏感细菌可以是特别是对于人的临床相关细菌或致病菌。在该方法的一个方面,溶素多肽有效杀死葡萄球菌属、链球菌属、肠球菌属和李斯特菌属细菌菌株。依照本发明的任何方法,其组合物还可包含载体,包括药学可接受的载体、添加剂或稀释剂。依照本发明的任何方法,其组合物还可包含用于将多肽递送至感染部位的合适媒介物。依照本发明的任何方法,其组合物还可包含一种或多种抗生素。本发明提供了包含本发明的一种或多种溶素多肽的组合物,包括治疗和药物组合物。本发明因此提供了用于杀死革兰氏阳性菌的包含分离溶素多肽的药物组合物,所述分离溶素多肽包含seqidno:3的氨基酸序列或其与seqidno:3的多肽具有至少80%同一性并且有效杀死革兰氏阳性菌的变体。在一个实施方案中,药物组合物可以备选地或可以进一步包含有效量的包含seqidno:1的氨基酸序列的分离溶素多肽、包含seqidno:2的氨基酸序列的分离溶素多肽、或其与seqidno:1或seqidno:2的多肽具有至少80%同一性并且有效杀死革兰氏阳性菌的变体。在本发明的一个方面,提供了用于杀死革兰氏阳性菌的包含至少两种分离溶素多肽的药物组合物,其中第一种分离多肽包含seqidno:3的氨基酸序列或其与seqidno:3的多肽具有至少80%同一性并且有效杀死革兰氏阳性菌的变体,并且第二种分离多肽包含seqidno:1的氨基酸序列、包含seqidno:2的氨基酸序列的分离溶素多肽、或其与seqidno:1或seqidno:2的多肽具有至少80%同一性并且有效杀死革兰氏阳性菌的变体。在其进一步方面,组合物包括治疗或药物组合物可以包含具有伴随修饰的seqidno:2的氨基酸序列的截短溶素,由此截短的溶素仅包含选自内肽酶结构域和氨基葡糖苷酶结构域的一个催化结构域。在组合物的另外方面,截短的溶素不包括seqidno:1的氨基葡糖苷酶结构域。截短的溶素可以特别具有seqidno:2的氨基酸序列,或其与seqidno:2的多肽具有至少80%同一性并且有效杀死革兰氏阳性菌的变体。本发明包括包含容器的制造物品,所述容器含有包含分离多肽的组合物,所述分离多肽包含seqidno:3的氨基酸序列,或其与seqidno:3的多肽具有至少80%同一性、85%同一性、90%同一性或95%同一性并且有效杀死革兰氏阳性菌的变体,和在暴露于或显示出与暴露于葡萄球菌属、链球菌属或李斯特菌属细菌一致的症状的患者治疗中使用组合物的说明书,其中使用组合物的说明书指示关于使用组合物的方法,该方法包括下述步骤:a)鉴定怀疑已暴露于葡萄球菌属、链球菌属或李斯特菌属细菌的患者;和b)给患者施用有效量的组合物。在本发明的物品的一个方面,组合物的分离多肽具有seqidno:3的氨基酸序列。在本发明的物品的另外方面,组合物备选地或进一步包含分离多肽,所述分离多肽包含seqidno:1的氨基酸序列、seqidno:2的氨基酸序列,或其与seqidno:1或seqidno:2的多肽具有至少80%同一性、85%同一性、90%同一性或95%同一性并且有效杀死革兰氏阳性菌的变体。本发明的组合物可以特别证实或具有针对一个或多个细菌菌株的杀死活性,所述细菌菌株特别选自金黄色葡萄球菌、单核细胞增多性李斯特菌、溶血性葡萄球菌、猪链球菌、表皮葡萄球菌、马链球菌、马链球菌兽疫亚种、无乳链球菌(gbs)、化脓性链球菌(gas)、血链球菌、格氏链球菌、停乳链球菌、g组链球菌、e组链球菌、粪肠球菌和肺炎链球菌。本发明还提供了编码本发明的溶素多肽的核酸。因此,提供了编码猪链球菌溶素plyss1、截短或完整的溶素和plyss2的核酸。示例性核酸序列在图3和图4中提供。本文提供了能够编码seqidno:1、seqidno:2或seqidno:3的多肽(包括其变体)的核酸。本发明还涉及编码猪链球菌溶素或溶素多肽的重组dna分子或克隆基因,或其简并变体;优选地,编码plyss1溶素多肽、截短或完整的溶素和/或plyss2溶素多肽的核酸分子,特别是重组dna分子或克隆基因,具有图3和图4中所示的核苷酸序列或与图3和图4中所示的dna序列互补。在本发明的进一步实施方案中,重组dna分子、克隆基因或编码本文的溶素多肽的核酸序列的全长dna序列可以与表达控制序列可操作地连接,所述表达控制序列可以引入合适宿主内。本发明因此延伸至由核酸序列、克隆基因或重组dna分子转化的单细胞宿主,包括细菌宿主,所述核酸序列、克隆基因或重组dna分子包含编码呈现的溶素多肽的dna序列,并且更具体地由上文以及图3和图4中所示的序列测定的完全dna序列。本发明自然考虑用于制备溶素多肽的几种方法,包括如本文举例说明的已知重组技术,并且本发明因此预期在其范围内涵盖此类合成制剂。本文公开的dna的分离和氨基酸序列促进溶素多肽通过此类重组技术的繁殖,并且相应地,本发明延伸至通过重组dna技术在宿主系统中表达的由公开的dna序列制备的表达载体,和所得到的经转化的宿主。根据本发明的特定实施方案的其他优选特征,提供了产生生物学活性的溶素多肽的重组表达系统。提供了用于制备多肽特别是本发明的一种或多种溶素多肽的过程,其包括培养含有表达载体的宿主细胞且回收多肽,所述表达载体编码本发明的一种或多种溶素多肽或能够表达本发明的溶素多肽。本发明的诊断效用延伸至呈现的溶素多肽在测定法中的用途,以筛选革兰氏阳性菌存在,以筛选敏感的革兰氏阳性菌的存在,或测定细菌对通过本发明的一种或多种溶素多肽杀死或裂解的敏感性。本发明延伸至针对溶素多肽或备选地针对溶素多肽的切割靶的抗体的开发,包括天然产生和重组制备的抗体。此类抗体可以包括通过已知遗传技术制备的多克隆和单克隆抗体,以及双特异性(嵌合)抗体,和包括与其调节溶素活性的能力结合的使其适合于另外诊断用途的其他功能性的抗体。本文考虑且提供了其为经修饰的且为嵌合或融合蛋白,或标记的溶素多肽。在嵌合或融合蛋白中,本发明的溶素多肽可以共价附着至可以提供另外的功能或增强溶素多肽的用途或应用的实体,其包括例如标签、标记、靶向部分或配体、细胞结合或细胞识别基序或试剂、抗菌剂、抗体、抗生素。示例性标记包括放射性标记,例如同位素3h、14c、32p、35s、36cl、51cr、57co、58co、59fe、90y、125i、131i和186re。标记可以是酶,并且标记溶素多肽的检测可以通过本领域已知的目前利用或公认的比色、分光光度计、荧光分光光度计、安培计或气体定量技术中的任何来完成。根据关于下述举例说明性附图进行的下述说明书的综述,其他目的和优点将变得对于技术人员显而易见。附图简述图1描述了裂解周期相对于溶素处理。重组表达且纯化的溶素能够只裂解细菌以及来自其宿主内的表达溶素的噬菌体。图2描述了plyss2结构域。催化结构域对应于残基8-146。存在16残基接头。结合结构域对应于残基162-228。图3提供了溶素plyss1的核苷酸和氨基酸序列以及蛋白质结构域分析。提供了全长plyss1(seqidno:1)和截短的plyss1(seqidno:2)的氨基酸序列。指出了内肽酶结构域(seqidno:6)、双重cpl-7结构域(seqidno:7)和氨基葡糖苷酶结构域(seqidno:8)。图4提供了溶素plyss2的核苷酸和氨基酸序列以及蛋白质结构域分析。plyss2的氨基酸序列对应于seqidno:3。plyss2溶素的chap结构域和sh-3结构域是有阴影的,其中chap结构域以lnn…开始并以…yit结束(seqidno:4),并且sh-3结构域以rsy…开始并以…vat结束(seqidno:5)。图5描述了pbad24载体。该序列以对于t7聚合酶的pbad阿拉伯糖诱导型启动子开始并以plyss2结束。氨苄西林充当选择标记以确保随着细胞生长的质粒保留。图6显示plyss2纯化。所有样品都在4-12%bis-tris凝胶上在200v下运行~40分钟,并且用考马斯染色。a.deae柱流通物含有在~26kda处的plyss2。b.由10l制备纯化的plyss2的六个代表性级分。c.在~26kda处的单个条带指示在所有级分合并在一起后的plyss2纯度。图7描述了plyss2表征的多个方面。a.为了测试关于plyss2活性的最佳ph,将50μl多个磷酸盐/柠檬酸盐缓冲液ph水平与195μl猪链球菌菌株7997细胞和5μl溶素混合。plyss2在ph8.0下具有最强活性。plyss2显示具有一直到ph9.7的急性活性。b.将195μl细胞、5μl溶素加入50μl多个nacl浓度中,以测定关于plyss2的最佳盐浓度。c.为了测定plyss2的温度稳定性,将它在多个温度下温育30分钟,冷却且随后加入在15mmna3po4,ph8.0中悬浮的245μl细胞中。d.将plyss2连同多个浓度的乙二胺四乙酸盐(edta)一起加入在15mmna3po4,ph8.0中悬浮的细胞,以测定它是否需要辅因子。在对照中,对于所有测试,ddh2o替换plyss2。图8描述了在一直到更高ph水平的bis-tris-丙烷(btp)缓冲液中针对猪链球菌菌株7997测定的plyss2的最佳ph。图9.在缓冲液中在37℃下贮存最高达48小时后,通过评估针对菌株7997的杀死有效性来测定纯化plyss2的稳定性。图10.在缓冲液中在-80℃下最高达7个月的溶素贮存后,在用plyss2溶素处理后,通过菌株7997的od600生长评价的杀死有效性。图11a和11b描述了δplyss1ph依赖性。(a)将宿主菌株7711的细胞悬浮于在4.6-8.0的ph值范围下的磷酸盐柠檬酸盐缓冲液(40/20mm)中。加入δplyss1(110μg/ml),并且在37℃下经过60分钟测量od600(横轴)。纵轴代表在每个时间点的处理过/未处理的od600比率。对于每个ph值,该曲线描述了3次独立实验的运行平均值。总之,活性在缓冲范围的上端是最大的。(b)此处,bis-tris-丙烷(40mm)用作具有7.0-9.7的ph范围的缓冲试剂;再次加入δplyss1至110μg/ml。每个曲线描述3次实验的运行平均值。最大活性在ph=9.0下观察到,尽管od减退的定量程度一般而言小于在磷酸盐-柠檬酸盐中。图12描述了δplyss1nacl依赖性。将猪链球菌7711细胞悬浮于磷酸盐-柠檬酸盐缓冲液ph=7.8(40/20mm)中。加入nacl至上述浓度,随后为以110μg/ml的δplyss1。在37℃下经过60分钟观察在600nm处的光密度。在这个图中,纵轴代表对3次独立实验平均的关于每个nacl浓度的处理过/未处理过的od600比率。图13a和13b提供了δplyss1dtt和edta敏感性的评价。(a)在加入7711细胞之前,使δplyss1与5mmdtt(大量摩尔过量)预温育1小时;活性未改变。(b)此处,在加入δplyss1(110μg/ml溶素)前,多个edta浓度包括在细胞的缓冲悬浮液中。对于两个图像,纵轴代表对3次独立实验平均的关于每个条件的处理过/未处理过的od600比率。图14a和14b显示了δplyss1温度稳定性。(a)δplyss1原液维持在上述温度各自下30分钟,随后加入7711细胞(270μg/ml最终酶浓度,最终温度=37℃,理想的缓冲条件)。这个图像中的曲线代表3次独立实验的运行平均值。在每种情况下,活性的完全丧失在45℃-50℃样品之间观察到。由于变性后的δplyss1絮凝,3个最热的样品显示比未处理过的对照略微更高的od600读数。(b)重复上述实验,但在测定前进行6小时热处理。在这个更长的温育时间下,45℃样品显示活性的一些尽管并非完全丧失。40℃样品维持基本上天然的活性。图15a和15b(a)plyss2具有在或超过8ug/ml下针对猪链球菌菌株7997的急性裂解活性。(b)plyss2的活性在体外针对猪链球菌菌株s735进行评价。图16a-16d提供了针对不同物种和菌株的plyss2活性。猪链球菌7997用作每个测试的阳性对照。a.针对猪链球菌菌株的plyss2活性。b.针对不同细菌物种和2个猪链球菌菌株的plyss2活性。c.链球菌属和葡萄球菌属对plyss2的敏感性。d.就对plyss2处理的敏感性测试的多个物种。图17a和17b显示了针对多个细菌物种、血清型和菌株的plyss2活性。在每种情况下,处理过/未处理的od600在条形图中描述。金黄色葡萄球菌菌株的条是红色着色的;对应于猪链球菌菌株的条是橙色的。细菌李斯特菌属和其他目的细菌的条以紫色显示。图18.plyss2通过标准mic分析就其杀死葡萄球菌属菌株的能力进行测试。在该测试中包括的是抗性葡萄球菌,例如万古霉素抗性(vrsa)、万古霉素中度(visa)和甲氧西林抗性(mrsa)葡萄球菌。测试的三个vrsa菌株代表所有已知分离物中的一半。图19提供了δplyss1溶菌活性。此处描述的是关于三个猪链球菌菌株的od下落曲线:7711,最初由其克隆plyss1的血清型7菌株(即宿主菌株);s735,其为该物种的典型株的血清型2分离物;和7997,剧毒的血清型9菌株。将细菌悬浮于20mm磷酸盐缓冲液ph7.8,2mmedta(定义为最佳条件)中。将δplyss1以一系列范围(通过插图指示)加入细胞中。对于每个样品,在37℃下经过1小时过程(横轴)测量在600nm处的光密度(横轴)。在这个图像中,所有曲线都代表3或4次独立实验的运行平均值。图20显示猪链球菌7711的δplyss1生长抑制。δplyss1以上述最终浓度加入在bhi肉汤中的猪链球菌菌株7711稀释悬浮液中。每个样品的光密度以96孔板形式连续测量过夜。总之,细菌生长以剂量依赖性方式延迟。然而,对于足以在缓冲溶液中诱导裂解的酶浓度(130和50μg/ml),效应在此处是非常小的。此外,上述δplyss1浓度无一完全抑制生长—因此,不能指定mic。对于所有处理过的样品,应注意到最终光密度实际上高于未处理过样品的那种。这是在裂解酶的存在下发生的聚集细菌碎片累积的假象。图21提供了δplyss1细菌菌株实验对象组。图19以及表3和4中提供的信息对于两个plyss1浓度130μg/ml和32.5μg/ml图解概括。在该图像中,猪链球菌菌株由双重红色星号指出,并且非猪链球菌由单个黑色星号指出。显示了在1小时后的光密度应答(处理过的相对于未处理过的od600比率)。关于猪链球菌菌株的血清型定义,读者请参考表3。图22提供了针对猪链球菌菌株7997和s735的plyss2溶菌活性的cfu杀死测定法结果。图23描述了与抗生素莫匹罗星相比较,针对plyss2的金黄色葡萄球菌和化脓性链球菌抗性测定法结果。在各自暴露于递增增加的plyss2浓度后,mrsa菌株mw2、mssa菌株8325和化脓性链球菌菌株5005无一发展针对plyss2的抗性。mw2和8325都发展针对阳性对照莫匹罗星的抗性。图24描述了经过10天具有mrsa菌血症的小鼠存活。plyss2清除来自测试的95%小鼠的菌血症。在对照中,仅5%存活。图25提供了针对不同物种和菌株的plyss2活性。使对数期培养物暴露于在磷酸盐缓冲液中的32μg/mlplyss2共60分钟。将处理过的样品的最终od600除以未处理过的样品的最终od600,以生成上述标准化值。多个葡萄球菌属(包括但不限于:mrsa、mssa和visa)、链球菌属、李斯特菌属、肠球菌属和杆菌属就对plyss2活性的敏感性进行测试。埃希氏杆菌属(escherichia)和假单胞菌属(pseudomonas)作为革兰氏阴性对照进行测试。图26描述了plyss2对多个菌株的杀菌作用。处理后60分钟128μg/mlplyss2的杀菌效应。cfu计数中的减少沿着对数标度呈现。特有地,plyss2具有针对mrsamw2的显著活性。值得注意的是,plyss2急剧减少无乳链球菌和单核细胞增多性李斯特菌。在阴性对照大肠杆菌(e.coli)数目中不存在减少。图27描述了plyss2对于多个革兰氏阳性菌的最小抑制浓度(mic)。如预期的,存在关于mrsamw2的低mic,并且关于化脓性链球菌5005的更高mic。plyss2的mic与裂解活性和杀菌测试关联。plyss2对于阴性对照大肠杆菌的mic因此是不可测量的。图28显示了plyss2保护小鼠不受由混合的mrsa和化脓性链球菌感染引起的死亡。fvb/nj小鼠用5%粘蛋白进行腹膜内注射,所述粘蛋白含有~5x105cfu的mrsa菌株mw2、~1x107化脓性链球菌菌株5005或以相同浓度来自上文接种物的两种细菌的组合(混合感染)。感染后三小时,所有感染组(a-c)中的小鼠都接受20mm磷酸盐缓冲液对照、1mgclys、1mgplyc、或用于混合感染的1mgclys加上1mgplyc组合的一次腹膜内注射。plyss2处理由用于mrsa感染(a)的1mg或用于化脓性链球菌的2mg和混合感染(b-c)组成。小鼠就存活监控经过十天。合并来自四次独立实验的结果,并且用卡普兰迈耶存活曲线标绘小鼠存活数据。图29描述了plyss2和万古霉素针对mrsa分离物的活性。图30提供了plyss2与clys的酶促结构域比对。比对链球菌属溶素plyss2和plyc(亚基a,genbank编号aap42310)的chap结构域。氨基酸同一性用下面的星号和突出显示指示。假定的催化残基(半胱氨酸和组氨酸,由其命名结构域)的位置用箭头指示。发明详述依照本发明存在可以采用的在领域技术内的常规分子生物学、微生物学和重组dna技术。此类技术在文献中充分说明。参见例如sambrook等人,"molecularcloning:alaboratorymanual"(1989);"currentprotocolsinmolecularbiology"第i-iii卷[ausubel,r.m.,编辑(1994)];"cellbiology:alaboratoryhandbook"第i-iii卷[j.e.celis,编辑(1994))];"currentprotocolsinimmunology"第i-iii卷[coligan,j.e.,编辑(1994)];"oligonucleotidesynthesis"(m.j.gait编辑1984);"nucleicacidhybridization"[b.d.hames&s.j.higgins编辑(1985)];"transcriptionandtranslation"[b.d.hames&s.j.higgins,编辑(1984)];"animalcellculture"[r.i.freshney,编辑(1986)];"immobilizedcellsandenzymes"[irlpress,(1986)];b.perbal,"apracticalguidetomolecularcloning"(1984)。因此,如果在本文中出现,则下述术语应具有与下文和这个部分中提供且阐述的定义。术语“猪链球菌溶素”、“plyss溶素”、“plyss1溶素”、“plyss1”、“完整的plyss1”、“截短的plyss1”、“δplyss1”、“plyss2溶素”、“plyss2”和任何未具体列出的变体在本文中可以互换使用,并且如本申请和权利要求自始至终使用的,指蛋白质性质的材料包括单个或多个蛋白质,并且延伸至具有本文描述且在图3和图4中呈现的氨基酸序列数据((seqidnos:1、2和/或3)、以及本文和权利要求中阐述的活性概况的那些蛋白质。相应地,同样考虑了展示基本上相等或改变活性的蛋白质。这些修饰可以是有意的,例如通过定点诱变获得的修饰,或可以是意外的,例如通过宿主中的突变获得的那些,所述宿主是复合物或其命名的亚基的生产者。此外,术语“猪链球菌溶素”、“plyss溶素”、“plyss1溶素”、“plyss1”、“完整的plyss1”、“截短的plyss1”、“δplyss1”、“plyss2溶素”、“plyss2”预期在其范围内包括本文具体叙述的蛋白质以及所有基本上同源的类似物、片段或截短物和等位基因变异。多肽和裂解酶“裂解酶”包括任何细菌细胞壁裂解酶,其在合适条件下和在相关时间段期间杀死一种或多种细菌。裂解酶的例子包括但不限于多种酰胺酶细胞壁裂解酶。“猪链球菌裂解酶”包括在合适条件下和在相关时间段期间能够杀死至少一种或多种猪链球菌细菌的裂解酶。“细菌噬菌体裂解酶”指从细菌噬菌体中提取或分离的裂解酶或维持裂解酶功能性的具有相似蛋白质结构的合成裂解酶。裂解酶能够特异性切割存在于细菌细胞的肽聚糖中的键,以破坏细菌细胞壁。目前还假定细菌细胞壁肽聚糖在大多数细菌中是高度保守的,并且仅少数键的切割可以破坏细菌细胞壁。细菌噬菌体裂解酶可以是酰胺酶,尽管其他类型的酶也是可能的。切割这些键的裂解酶的例子是多种酰胺酶,例如胞壁质酶、氨基葡糖苷酶、内肽酶或n-乙酰基-胞壁酰-l-丙氨酸酰胺酶。fischetti等人(1974)报道c1链球菌噬菌体溶素酶是酰胺酶。garcia等人(1987,1990)报道来自cp-1噬菌体的肺炎链球菌的cpl溶素是溶菌酶。caldentey和bamford(1992)报道来自phi6假单胞菌属噬菌体的裂解酶是内肽酶,分裂由melo-diaminopimilicacid和d-丙氨酸形成的肽桥。大肠杆菌t1和t6噬菌体裂解酶是酰胺酶,与来自李斯特菌属噬菌体的裂解酶(ply)(loessner等人,1996)一样。还存在本领域已知的其他裂解酶,其能够切割细菌细胞壁。“由细菌噬菌体遗传编码的裂解酶”包括例如通过具有针对宿主细菌的至少一些细胞壁裂解活性,能够杀死宿主细菌的多肽。多肽可以具有包含天然序列裂解酶及其变体的序列。多肽可以从多个来源例如细菌噬菌体(“噬菌体”)中分离,或通过重组或合成方法例如由garcia等人描述以及如本文提供的那些制备。多肽可以包含在羧基末端侧上的胆碱结合部分,并且可以通过在氨基末端侧上能够切割细胞壁肽聚糖的酶活性(例如作用于肽聚糖中的酰胺键的酰胺酶活性)表征。包括多重酶活性例如两个酶促结构域的裂解酶已得到描述,例如plygbs溶素。一般来说,裂解酶可以是分子量25,000-35,000道尔顿,并且包含单条多肽链;然而,这可以取决于酶链而改变。分子量最方便地通过在变性十二烷基硫酸钠凝胶电泳上的测定法和与分子量标记比较进行测定。“天然序列噬菌体相关裂解酶”包括具有与衍生自细菌的酶相同的氨基酸序列的多肽。此类天然序列酶可以是分离的或可以是通过重组或合成方法产生的。术语“天然序列酶”包含天然存在的酶形式(例如可变剪接或改变的形式)和天然存在的酶变体。在本发明的一个实施方案中,天然序列酶是成熟或全长多肽,其通过来自对于猪链球菌特异性的细菌噬菌体的基因遗传编码。当然,许多变体是可能和已知的,如出版物中公认的,所述出版物例如lopez等人,microbialdrugresistance3:199-211(1997);garcia等人,gene86:81-88(1990);garcia等人,proc.natl.acad.sci.usa85:914-918(1988);garcia等人,proc.natl.acad.sci.usa85:914-918(1988);garcia等人,streptococcalgenetics(j.j.ferretti和curtis编辑1987);lopez等人,femsmicrobiol.lett.100:439-448(1992);romero等人,j.bacteriol.172:5064-5070(1990);ronda等人,eur.j.biochem.164:621-624(1987)和sanchez等人,gene61:13-19(1987)。这些参考文献各自的内容,特别是序列表和比较序列的相关文本,包括关于序列同源性的陈述,通过引用以整体的形式特意地合并至本文。“变体序列裂解酶”包括特征在于多肽序列的裂解酶,所述多肽序列不同于裂解酶的那种,但保留功能活性。在一些实施方案中,裂解酶可以由对于猪链球菌特异性的细菌噬菌体遗传编码,与本文的裂解酶序列具有特定氨基酸序列同一性,所述裂解酶序列如图3和图4或seqidnos:1、2或3中的任何提供的。例如,在一些实施方案中,功能活性裂解酶可以通过破坏细菌的细胞壁而杀死猪链球菌细菌,及其他如本文提供的敏感细菌,包括如表1以及图9和10中显示的。活性裂解酶可以与关于这点的裂解酶序列具有60、65、70、75、80、85、90、95、97、98、99或99.5%氨基酸序列同一性,所述裂解酶序列如图3和图4或seqidnos:1、2或3中的任何提供的。此类噬菌体相关裂解酶变体包括例如裂解酶多肽,其中一个或多个氨基酸残基在关于这点的裂解酶序列的序列n或c末端上添加或缺失,所述裂解酶序列如图3和图4或seqidnos:1、2或3中的任何提供的。在特定方面,噬菌体相关裂解酶将与天然噬菌体相关裂解酶序列具有至少约80%或85%氨基酸序列同一性,特别是至少约90%(例如90%)氨基酸序列同一性。最特别地,噬菌体相关裂解酶变体将与关于这点的天然噬菌体相关裂解酶序列具有至少约95%(例如95%)氨基酸序列同一性,所述裂解酶序列如图3和图4或seqidnos:1、2或3中的任何提供的。就鉴定的噬菌体相关裂解酶序列而言的“氨基酸序列同一性百分比”在本文中定义为:在比对相同读码框中的序列和需要时引入缺口以达到最大序列同一性百分比后,并且不将任何保守置换视为序列同一性的部分,在候选序列中与噬菌体相关裂解酶序列中的氨基酸残基相同的氨基酸残基百分比。就本文鉴定的噬菌体相关裂解酶序列而言的“核酸序列同一性百分比”在本文中定义为:在比对序列和需要时引入缺口以达到最大序列同一性百分比后,在候选序列中与噬菌体相关裂解酶序列中的核苷酸相同的核苷酸百分比。为了测定两个核苷酸或氨基酸序列的同一性百分比,序列就最佳比较目的进行比对(例如缺口可以在第一个核苷酸序列的序列中引入)。随后比较在相应核苷酸或氨基酸位置上的核苷酸或氨基酸。当第一个序列中的位置由与第二个序列中的相应位置相同的核苷酸或氨基酸占据时,则该分子在那个位置上是相同的。在两个序列之间的同一性百分比是由序列共享的相同位置数目的函数(即%同一性=相同位置#/全部位置#乘以100)。两个序列之间的序列同一性的测定可以使用数学算法来完成。用于比较两个序列的数学算法的优选非限制性例子是karlin等人,proc.natl.acad.sci.usa,90:5873-5877(1993)的算法。此类算法掺入nblast程序内,所述nblast程序可以用于鉴定与本发明的核苷酸序列具有所需同一性的序列。为了获得用于比较目的的有缺口的比对,gappedblast可以如altschul等人,nucleicacidsres,25:3389-3402(1997)中所述利用。当利用blast和gappedblast程序时,可以使用各自程序(例如nblast)的缺省参数。参见由美国国家生物技术信息中心、国立医学图书馆、国立卫生研究院提供的程序。在一个实施方案中,用于序列比较的参数可以设为w=12。参数也可以是改变的(例如w=5或w=20)。值“w”测定多少连续核苷酸必须是等同的,以用于该程序将两个序列鉴定为含有同一性区域。“多肽”包括包含以线性方式连接的多个氨基酸的聚合物分子。在一些实施方案中,多肽可以对应于由天然存在的多核苷酸序列编码的分子。多肽可以包括保守置换,其中天然存在的氨基酸替换为具有相似性质的氨基酸,其中此类保守置换不改变多肽的功能(参见例如lewin"genesv"oxforduniversitypresschapter1,第9-13页1994)。术语“改变的裂解酶”包括改组和/或嵌合裂解酶。对于由特定噬菌体感染的细菌特异性的噬菌体裂解酶已发现有力且有效分解所讨论的细菌的细胞壁。裂解酶被认为缺乏蛋白水解酶酶促活性,并且因此当在细菌细胞壁的消化期间存在时,对哺乳动物蛋白质和组织是非破坏性的。如由loeffler等人,"rapidkillingofstreptococcuspneumoniaewithabacteriophagecellwallhydrolase,"science,294:2170-2172(dec.7,2001),和由science杂志在线出版的关于其的补充材料(其通过引用整体合并入本文)显示的,纯化的肺炎球菌细菌噬菌体裂解酶例如pal能够杀死多种肺炎球菌。loeffler等人已显示通过这些实验在接触后数秒内,裂解酶pal能够在体外杀死15个肺炎链球菌的临床菌株,包括最频繁分离的血清群和青霉素抗性菌株。用pal处理小鼠也能够以剂量依赖性方式消除或显著减少血清型14的鼻携带。此外,因为已发现pal的作用,如同其他噬菌体裂解酶,但不同于抗生素,对于靶病原体是相当特异性的,所以可能正常菌群将保持基本上完整的(通过引用合并入本文的m.j.loessner,g.wendlinger,s.scherer,molmicrobiol16,1231-41.(1995))。相比之下,本发明的溶素多肽具有显著广泛的和临床明显的细菌杀死概况。如本文证实的,例如,分离的猪链球菌溶素plyss2在杀死猪链球菌以及多种其他链球菌属菌株包括b组链球菌(gbs)、葡萄球菌属菌株(包括金黄色葡萄球菌)、肠球菌属和李斯特菌属中是有效的。本发明的溶素因此证实与先前报道或考虑的任何溶素不同的细菌细胞杀死宽度。在由特定细菌噬菌体感染后,本发明的裂解酶或多肽可以通过细菌生物体产生,作为用于使已暴露于具有感染症状的其他的那些不生病的预防处理,或作为用于已由于感染变得生病的那些的治疗处理。既然在本文中提供了溶素多肽序列和编码溶素多肽的核酸,裂解酶/多肽就可以经由来自噬菌体基因组的关于裂解酶的分离基因产生,将该基因置于转移载体内,并且将所述转移载体克隆到表达系统内,使用本领域的标准方法,包括如本文例示的方法。裂解酶或多肽可以是截短、嵌合、改组或“天然的”,并且可以是组合的。有关美国专利号5,604,109通过引用整体合并入本文。“改变的”裂解酶可以许多方式产生。在优选实施方案中,将关于来自噬菌体基因组的改变裂解酶的基因置于转移或可移动载体优选质粒内,并且将质粒克隆到表达载体或表达系统内。用于产生本发明的溶素多肽或酶的表达载体可以适合于大肠杆菌、芽孢杆菌属和许多其他合适的细菌。载体系统还可以是无细胞表达系统。表达基因或一组基因的所有这些方法是本领域已知的。裂解酶也可以通过用对于猪链球菌特异性的细菌噬菌体感染猪链球菌来产生,其中所述至少一种裂解酶专一地裂解所述猪链球菌的细胞壁,对存在的其他例如天然或共生细菌菌群具有最小的作用。“嵌合蛋白”或“融合蛋白”包含与异源多肽可操作地连接的本发明多肽的全部或(优选生物活性的)部分。嵌合蛋白或肽例如通过组合具有两个或更多个活性位点的两种或更多种蛋白质产生。嵌合蛋白和肽可以独立地作用于相同或不同分子,并且因此具有同时治疗两种或更多种不同细菌感染的潜力。嵌合蛋白和肽也可以通过在超过一个位置中切割细胞壁用于治疗细菌感染,从而潜在提供来自单个溶素分子或嵌合肽的更快速或有效(或协同)杀死。dna构建体或肽构建体的“异源”区是在较大的dna分子内可鉴定的dna区段或在较大的肽分子内的肽,其在自然界中未发现与较大的分子结合。因此,当异源区编码哺乳动物基因时,该基因通常侧面为在来源生物体的基因组中不侧接哺乳动物基因组dna的dna。异源编码序列的另一个例子是构建体,其中编码序列自身在自然界中未发现(例如其中基因组编码序列含有内含子的cdna,或具有不同于天然基因的密码子的合成序列)。等位基因变异或天然存在的突变事件不产生如本文定义的dna或肽的异源区。术语“可操作地连接的”意指公开内容的多肽和异源多肽在框内融合。异源多肽可以融合至公开内容的多肽的n末端或c末端。嵌合蛋白通过化学酶促合成产生或通过重组dna技术产生。许多嵌合裂解酶已得到产生且研究。对基因e-l(分别由细菌噬菌体phix174和ms2裂解蛋白质e和l构建的嵌合裂解)实施内部缺失,以产生一系列具有改变裂解或杀死性质的新e-l克隆。在这个研究中研究亲本基因e、l、e-l和内部截短形式的e-l的裂解活性,以基于不同跨膜结构域的结构中的差异表征不同裂解机制。电子显微镜检查和关于细胞质和周质空间的标记酶的释放揭示可以区分两个不同的裂解机制,取决于大肠杆菌的内膜或内和外膜的蛋白质渗透(femsmicrobiol.lett.(1998)164(1):159-67(通过引用合并入本文)。有用的融合蛋白的一个例子是gst融合蛋白,其中公开内容的多肽融合至gst序列的c末端。此类嵌合蛋白可以促进公开内容的重组多肽的纯化。在另一个实施方案中,嵌合蛋白或肽含有在其n末端上的异源信号序列。例如,公开内容的多肽的天然信号序列可以被去除且替换为来自另一种蛋白质的信号序列。例如,杆状病毒包膜蛋白质的gp67分泌序列可以用作异源信号序列(通过引用合并入本文的currentprotocolsinmolecularbiology,ausubel等人,编辑,johnwiley&sons,1992)。真核异源信号序列的其他例子包括蜂毒肽和人胎盘碱性磷酸酶的分泌序列(stratagene;lajolla,calif.)。在另外一个例子中,有用的原核异源信号序列包括phoa分泌信号(sambrook等人,同上)和蛋白a分泌信号(pharmaciabiotech;piscataway,n.j.)。融合蛋白可以组合溶素多肽与具有不同能力或提供另外能力或对溶素多肽添加特征的蛋白质或多肽。融合蛋白可以是免疫球蛋白融合蛋白,其中公开内容的多肽的全部或部分融合至衍生自免疫球蛋白蛋白质家族成员的序列。免疫球蛋白可以是抗体例如针对敏感或靶细菌的表面蛋白质或表位的抗体。免疫球蛋白融合蛋白可以掺入药物组合物内,并且施用于受试者以抑制配体(可溶或膜结合的)和细胞表面上的蛋白质(受体)之间的相互作用,从而在体内抑制信号转导。免疫球蛋白融合蛋白可以改变公开内容多肽的同源配体的生物利用度。配体/受体相互作用的抑制可以是治疗上有用的,用于治疗细菌相关疾病和病症,用于调节(即,促进或抑制)细胞存活。此外,公开内容的免疫球蛋白融合蛋白可以用作免疫原,以在受试者中产生针对公开内容的多肽的抗体,以纯化配体和在筛选测定法中鉴定抑制受体与配体的相互作用的分子。公开内容的嵌合和融合蛋白和肽可以通过标准重组dna技术产生。融合基因可以通过常规技术包括自动化dna合成仪合成。备选地,基因片段的pcr扩增可以使用在两个连续基因片段之间产生互补突出端的锚定引物执行,所述连续基因片段随后可以退火且再扩增,以生成嵌合基因序列(参见,即ausubel等人,同上)。此外,许多表达载体是商购可得的,其已编码融合部分(即gst多肽)。编码本发明的多肽的核酸可以克隆到此类表达载体内,使得融合部分在框内连接至本发明的多肽。如本文使用的,关于超过一种相关噬菌体蛋白质或蛋白质肽片段的改组蛋白质或肽、基因产物或肽已随机切割且再装配成更多活性或特异性的蛋白质。选择或筛选改组寡核苷酸、肽或肽片段分子,以鉴定具有所需功能性质的分子。这种方法例如在stemmer,美国专利号6,132,970.(改组多核苷酸的方法);kauffman,美国专利号5,976,862(经由基于密码子的合成的进化)和huse,美国专利号5,808,022(直接密码子合成)中描述。这些专利的内容通过引用合并入本文。改组可以用于产生比模板蛋白质更多活性例如最高达10-100倍更多活性的蛋白质。模板蛋白质选自溶素蛋白质的不同变种。改组蛋白质或肽构成例如一个或多个结合结构域和一个或多个催化结构域。每个结合或催化结构域衍生自相同或不同噬菌体或噬菌体蛋白质。改组结构域是作为基因或基因产物的基于寡核苷酸的分子,其单独或与其他基因或基因产物组合可翻译成肽片段,或它们是基于肽的分子。基因片段包括dna、rna、dna-rna杂交物、反义rna、核酶、ests、snips的任何分子及其他基于寡核苷酸的分子,其单独或与其他分子组合产生能够或不能翻译成肽的寡核苷酸分子。如本文公开的,修饰或改变形式的蛋白质或肽和肽片段包括化学合成的或通过重组dna技术制备的蛋白质或肽和肽片段或两者。这些技术包括例如嵌合和改组。当蛋白质或肽通过化学合成产生时,它优选基本上不含化学前体或其他化学制品,即它与涉及蛋白质合成的化学前体或其他化学制品分离。相应地,此类蛋白质制剂具有小于约30%、20%、10%、5%(按干重计)的除目的多肽外的化学前体或化合物。多肽的信号序列可以促进公开内容的蛋白质和肽和肽片段来往粘膜的跨膜移动,以及促进分泌蛋白质或其他目的蛋白质的分泌和分离。信号序列一般特征在于疏水性氨基酸的核,其一般在分泌期间在一个或多个切割事件中从成熟蛋白质中切割。此类信号肽含有加工位点,当信号序列经过分泌途径时,所述加工位点允许它们从成熟蛋白质中切割。因此,公开内容可以关于具有信号序列的所述多肽,以及信号序列自身和在不存在信号序列的情况下的多肽(即切割产物)。编码公开内容的信号序列的核酸序列可以在表达载体中可操作地连接至目的蛋白质,例如通常不分泌或另外难以分离的蛋白质。信号序列指导例如来自表达载体转化到其内的真核宿主的蛋白质分泌,并且随后或同时切割信号序列。蛋白质随后可以容易地通过领域公认的方法从细胞外介质中纯化。备选地,信号序列可以使用促进纯化的序列例如gst结构域连接至目的蛋白质。本发明还关于本发明的多肽的其他变体。此类变体可以具有改变的氨基酸序列,其可以充当激动剂(模拟物)或拮抗剂。变体可以通过诱变即不连续点突变或截短物而生成。激动剂可以保留天然存在的蛋白质形式的基本上相同的生物活性或生物活性子集。通过例如与包括目的蛋白质的细胞信号级联的下游或上游成员竞争结合,蛋白质的拮抗剂可以抑制天然存在的蛋白质形式的一种或多种活性。因此,特异性生物效应可以通过用功能有限的变体处理来引出。相对于用天然存在的蛋白质形式的治疗,用具有天然存在的蛋白质形式的生物活性子集的变体治疗受试者可以在受试者中具有更少的副作用。充当激动剂(模拟物)或拮抗剂的公开内容的蛋白质变体可以通过就激动剂或拮抗剂活性筛选公开内容的蛋白质突变体即截短突变体的组合文库进行鉴定。在一个实施方案中,多样化变体文库通过在核酸水平上的组合诱变生成并且由多样化基因文库编码。多样化变体文库可以通过例如将合成寡核苷酸的混合物酶促连接到基因序列内产生,使得潜在蛋白质序列的简并组可作为个别多肽表达,或备选地,作为一组较大的融合蛋白表达(即用于噬菌体展示)。存在可以用于由简并寡核苷酸序列产生公开内容多肽的潜在变体文库的多种方法。用于合成简并寡核苷酸的方法是本领域已知的(参见,即,narang(1983)tetrahedron39:3;itakura等人(1984)annu.rev.biochem.53:323;itakura等人(1984)science198:1056;ike等人(1983)nucleicacidres.11:477,都通过引用合并入本文)。此外,本公开内容的多肽编码序列的片段文库可以用于生成多样化多肽群体,用于变体、活性片段或截短物的筛选和后续选择。例如,编码序列片段文库可以通过下述生成:在其中切口仅对于每个分子发生大约一次的条件下用核酸酶处理目的编码序列的双链pcr片段,使双链dna变性,使dna复性以形成可以包括来自不同切口产物的有义/反义对的双链dna,通过用s1核酸酶处理从再形成的双链体中去除单链部分,并且将所得到的片段文库连接到表达载体内。通过这种方法,可以衍生表达文库,其编码目的蛋白质多个大小不同的n末端和内部片段。用于筛选通过点突变或截短制备的组合文库的基因产物,并且在cdna文库中筛选具有所选性质的基因产物的几种技术是本领域已知的。用于筛选大型基因文库的顺应高流通量分析的最广泛使用的技术,一般包括将基因文库克隆到可复制的表达载体内,用所得到的载体文库转化合适细胞,并且在其中所需活性的检测促进编码被检测产物的基因的载体分离的条件下表达组合基因。递归总体诱变(rem)是增强文库中的功能突变体频率的技术,其可以与筛选测定法组合使用,以鉴定公开内容的蛋白质变体(arkin和yourvan(1992)proc.natl.acad.sci.usa89:7811-7815;delgrave等人(1993)proteinengineering6(3):327-331)。蛋白质或肽片段的免疫学活性部分包括与识别噬菌体酶的抗体结合的区域。在这个背景下,根据实施方案最小的蛋白质(或编码蛋白质的核酸)部分是可识别为对于制备溶素蛋白质的噬菌体特异性的表位。相应地,可以预期结合靶或受体例如抗体,并且对于一些实施方案有用的最小多肽(和编码该多肽的相关核酸),可以是8、9、10、11、12、13、15、20、25、30、35、40、45、50、55、60、65、75、85或100个氨基酸长。尽管短至8、9、10、11、12或15个氨基酸长的小序列包含足够的结构,以充当靶或表位,但5、6或7氨基酸长的更短序列可以在一些条件下显示出靶或表位结构,并且在一个实施方案中具有价值。因此,本文提供的包括如图3和4以及seqidnos:1、2和/或3中所示的蛋白质或溶素多肽的最小部分,包括少至5、6、7、8、9、10、12、14或16个氨基酸长的多肽。如本文描述的实施方案的蛋白质或肽片段的生物学活性部分包括包含足够等同于或衍生自公开内容的噬菌体蛋白质的氨基酸序列的氨基酸序列,其包括比噬菌体蛋白质的全长蛋白质更少的氨基酸,并且显示出相应全长蛋白质的至少一种活性。一般地,生物学活性部分包含具有相应蛋白质的至少一种活性的结构域或基序。公开内容的蛋白质或蛋白质片段的生物学活性部分可以是长度少或多10、25、50、100个氨基酸的多肽。此外,其中蛋白质的其他区域缺失或添加的其他生物学活性部分可以通过重组技术进行制备,并且就实施方案多肽的天然形式的一种或多种功能活性进行评估。可以制备同源蛋白质和核酸,其与此类小蛋白质和/或核酸(或较大分子的蛋白质和/或核酸区)共享功能性,如技术人员应当理解的。可以特异性同源的此类小分子和较大分子的短区域预期作为实施方案。优选地,与本文提供的包括如图3和4以及seqidnos:1、2和/或3中所示的溶素多肽相比较,此类有价值区域的同源性是至少50%、65%、75%、80%、85%,并且优选至少90%、95%、97%、98%或至少99%。这些同源性百分比值不包括由于保守氨基酸置换的改变。当至少约70%的氨基酸残基(优选至少约80%、至少约85%且优选至少约90或95%)是相同的或代表保守置换时,两个氨基酸序列是“基本上同源的”。当溶素多肽的一个或多个或几个或最高达10%、或最高达15%或最高达20%的氨基酸由相似或保守氨基酸置换进行置换时,可比较的溶素例如可比较的plyss2溶素、或可比较的plyss1溶素的序列是基本上同源的,并且其中可比较的溶素具有本文公开的溶素例如plyss2和/或plyss1溶素的活性、抗菌效应和/或细菌特异性概况。本文描述的氨基酸残基优选是“l”异构形式。然而,“d”异构形式中的残基可以置换任何l-氨基酸残基,只要所需免疫球蛋白结合的功能性质由该多肽保留。nh2指在多肽的氨基末端上存在的游离氨基。cooh指在多肽的羧基末端上存在的游离羧基。与标准多肽命名法j.biol.chem.,243:3552-59(1969)一致,关于氨基酸残基缩写显示于下述对应表中:对应表应当指出所有氨基酸残基序列在本文中都通过其左和右方向在氨基末端到羧基末端的常规方向的式表示。此外,应当指出在氨基酸残基序列的开始或结束时的破折号指示与一个或多个氨基酸残基的进一步序列的肽键。呈现上表以关联在本文中可以交替出现的三字母和单字母记号。突变可以在氨基酸序列或编码本文的多肽和溶素的核酸序列中作出,所述序列包括在图3或图4中所示的溶素序列,或其活性片段或截短物,使得特定密码子变成编码不同氨基酸的密码子,氨基酸置换另一种氨基酸,或一种或多种氨基酸被缺失。此类突变一般通过尽可能地使得最少的氨基酸或核苷酸变化而进行制备。可以作出这类置换突变,以非保守方式(例如通过将来自属于具有特定大小或特征的氨基酸分组的氨基酸的密码子变成属于另一个分组的氨基酸)或保守方式(例如通过将来自属于具有特定大小或特征的氨基酸分组的氨基酸的密码子变成属于相同分组的氨基酸)改变所得到的蛋白质中的氨基酸。此类保守变化一般导致所得到的蛋白质的结构和功能的更少变化。非保守变化更可能改变所得到的蛋白质的结构、活性或功能。本发明应视为包括含有保守变化的序列,其不显著改变所得到的蛋白质的活性或结合特征。因此,基于本文提供的plyss1和plyss2溶素多肽的序列综述及其关于其他溶素多肽可获得的知识和公开信息,本领域技术人员可以在溶素多肽序列中作出氨基酸变化或置换。可以作出氨基酸变化以替换或置换本文提供的溶素序列中的一个或多个、一个或少数、一个或若干、一个到五个、一个到十个、或此类其他数目的氨基酸,以生成其突变体或变体。此类其突变体或变体可以预测功能或测试杀死细菌的功能或能力,和/或具有与本文提供的溶素可比较的活性,所述细菌包括葡萄球菌属、链球菌属、李斯特菌属或肠球菌属细菌。因此,例如通过修饰关于这点如图4中所示的氨基酸序列,可以对plyss2的序列作出变化,并且在序列中具有变化的突变体或变体可以使用本文包括实施例中描述和例示的测定法和方法进行测试。基于关于这点的溶素的结构域结构,本领域技术人员可以预测适合于置换或替换的一个或多个、一个或若干氨基酸,和/或不适合于置换或替换的一个或多个氨基酸,包括合理的保守或非保守置换。在这点上,并且示例性参考plyss2溶素,需指出,尽管plyss2多肽溶素代表分歧类别的原噬菌体裂解酶,但该溶素包含如图4中所述的n末端chap结构域(半胱氨酸-组氨酸酰胺基水解酶/肽酶)和c末端sh3-5型结构域。结构域在氨基酸序列中以独特有阴影的彩色区域描述,其中chap结构域对应于以lnn…开始的第一个有阴影的氨基酸序列区域,并且sh3-5型结构域对应于以rsy…开始的第二个有阴影的区域。chap结构域包括在几个先前表征的链球菌属和葡萄球菌属噬菌体溶素中。因此,本领域技术人员可以合理地制备且测试对plyss2的chap结构域和/或sh-3结构域的置换或替换。与genbank数据库的序列比较可以对于chap和/或sh-3结构域序列中的任一或两者或plyss2溶素全长氨基酸序列作出,例如以鉴定用于置换的氨基酸。在图30中,plyss2的chap结构域与良好表征的链球菌属plyc溶素的那种比对,证实保守催化残基,但总体仅适度的同一性水平(28%序列同一性)。在图30中,在chap结构域中的保守半胱氨酸和组氨酸氨基酸序列以箭头显示。合理预测例如保守的半胱氨酸和组氨酸残基应在plyss2的突变体或变体中维持,以便维持活性或能力。值得注意的是在图4和seqidno:3的plyss2序列中具有丙氨酸替换在缬氨酸氨基酸19上的缬氨酸的突变体或变体是活性的,并且能够以与图4和seqidno:3溶素类似且一样有效的方式杀死革兰氏阳性菌。下述是多个氨基酸分组的一个例子:具有非极性r基团的氨基酸丙氨酸、缬氨酸、亮氨酸、异亮氨酸、脯氨酸、苯丙氨酸、色氨酸、甲硫氨酸具有非荷电极性r基团的氨基酸甘氨酸、丝氨酸、苏氨酸、半胱氨酸、酪氨酸、天冬酰胺、谷氨酰胺具有荷电极性r基团的氨基酸(在ph6.0下带负电的)天冬氨酸、谷氨酸碱性氨基酸(在ph6.0下带正电的)赖氨酸、精氨酸、组氨酸(在ph6.0下)另一个分组可以是具有苯基的那些氨基酸:苯丙氨酸、色氨酸、酪氨酸另一个分组可以根据分子量(即,r基团的大小):特别优选的置换是:-lys置换arg,并且反之亦然,使得正电荷可以得到维持;-glu置换asp,并且反之亦然,使得负电荷可以得到维持;-ser置换thr,使得游离-oh可以得到维持;和-gln置换asn,使得游离nh2可以得到维持。示例性和优选的保守氨基酸置换包括下述中的任何:谷氨酰胺(q)置换谷氨酸(e),并且反之亦然;亮氨酸(l)置换缬氨酸(v),并且反之亦然;丝氨酸(s)置换苏氨酸(t),并且反之亦然;异亮氨酸(i)置换缬氨酸(v),并且反之亦然;赖氨酸(k)置换谷氨酰胺(q),并且反之亦然;异亮氨酸(i)置换甲硫氨酸(m),并且反之亦然;丝氨酸(s)置换天冬酰胺(n),并且反之亦然;亮氨酸(l)置换甲硫氨酸(m),并且反之亦然;赖氨酸(l)置换谷氨酸(e),并且反之亦然;丙氨酸(a)置换丝氨酸(s),并且反之亦然;酪氨酸(y)置换苯丙氨酸(f),并且反之亦然;谷氨酸(e)置换天冬氨酸(d),并且反之亦然;亮氨酸(l)置换异亮氨酸(i),并且反之亦然;赖氨酸(k)置换精氨酸(r),并且反之亦然。氨基酸置换也可以引入以置换具有特别优选的性质的氨基酸。例如,cys可以引入用于与另一个cys的二硫桥的潜在位点。his可以引入作为特别的“催化”位点(即,his可以充当酸或碱,并且是生物化学催化剂中最常见的氨基酸)。pro可以由于其特定平面结构而引入,其在蛋白质的结构中诱导β-转角。如本文描述的多肽或表位可以用于生成抗体,并且还可以用于检测与溶素或识别溶素蛋白质的分子的结合。另一个实施方案是分子例如抗体或其他特异性结合剂,其可以通过使用表位例如通过常规免疫接种或通过相展示方法进行制备,在所述相展示方法中表位可以用于在文库中筛选潜在结合剂。此类分子识别溶素蛋白质的一个或多个表位或编码溶素蛋白质的核酸。识别表位的抗体可以是单克隆抗体、人源化抗体、或抗体蛋白质的部分。期望地,识别表位的分子对于那个表位具有特异性结合,该特异性结合至少比该分子对于血清白蛋白的结合强10倍。特异性结合可以测量为亲和力(km)。更期望地,特异性结合是在相同条件下对于血清白蛋白那种的至少102、103、104、105、106、107、108或甚至更高。在期望的实施方案中,抗体或抗体片段以对于检测溶素蛋白质的存在,或备选地检测对溶素蛋白质敏感的细菌的存在有用的形式。在进一步的实施方案中,抗体可以与本发明的溶素多肽附着或另外结合,例如在嵌合或融合蛋白中,并且可以作用于将溶素导向细菌细胞或目的菌株或靶。备选地,溶素多肽可以例如在完全或部分裂解细菌细胞壁中作用于指导抗体或与抗体结合作用,使得抗体可以与其在细菌中或上的表面上或表面下的表位特异性结合。例如,本发明的溶素可以附着至抗链球菌属抗体且将抗体导向其表位。如由技术人员应当理解的,用于抗体合成的多种形式和方法是已知的。抗体可以与报道分子或原子例如氟、产生光学信号的酶、化学发光体、微粒或放射性原子缀合(共价复合)。抗体或抗体片段可以在动物免疫接种后在体内合成,例如抗体或抗体片段可以在遗传重组后经由细胞培养合成。抗体或抗体片段可以通过细胞合成和化学修饰的组合进行制备。“抗体”是结合特异性表位的任何免疫球蛋白,包括抗体及其片段。该术语包含多克隆、单克隆和嵌合抗体,最后提及的在美国专利号4,816,397和4,816,567中进一步详细描述。术语“抗体”描述无论是天然还是部分或全部合成产生的免疫球蛋白。该术语还涵盖具有结合结构域的任何多肽或蛋白质,所述结合结构域是抗体结合结构域或与抗体结合结构域同源。cdr移植抗体也由这个术语涵盖。“抗体”是结合特异性表位的任何免疫球蛋白,包括抗体及其片段。该术语包含多克隆、单克隆和嵌合抗体,最后提及的在美国专利号4,816,397和4,816,567中进一步详细描述。术语“抗体”包括野生型免疫球蛋白(ig)分子,一般包含四条全长多肽链,两条重(h)链和两条轻(l)链,或其等价ig同源物(例如骆驼科纳米抗体,其仅包含重链);包括其全长功能突变体、变体或衍生物,其保留ig分子的基本表位结合特征,并且包括双重特异性、双特异性、多特异性和双重可变结构域抗体;免疫球蛋白分子可以具有任何种类(例如igg、ige、igm、igd、iga和igy),或亚类(例如igg1、igg2、igg3、igg4、iga1和iga2)。在术语“抗体”的含义内还包括的是任何“抗体片段”。“抗体片段”意指包含并非全长的至少一条多肽链的分子,包括(i)fab片段,其为由可变轻(vl)、可变重(vh)、恒定轻(cl)和恒定重1(ch1)结构域组成的单价片段;(ii)f(ab')2片段,其为包含在铰链区通过二硫桥连接的两个fab片段的二价片段;(iii)fab(fd)片段的重链部分,其由vh和ch1结构域组成;(iv)可变片段(fv)片段,其由抗体单臂的vl和vh结构域组成,(v)结构域抗体(dab)片段,其包含单个可变结构域(ward,e.s.等人,nature341,544-546(1989));(vi)骆驼科抗体;(vii)分离的互补决定区(cdr);(viii)单链fv片段,其中vh结构域和vl结构域通过肽接头连接,所述肽接头允许两个结构域结合以形成抗原结合位点(bird等人,science,242,423-426,1988;huston等人,pnasusa,85,5879-5883,1988);(ix)双抗体,其为二价、双特异性抗体,其中vh和vl结构域在单条多肽链上表达,但使用太短而不允许相同链上的两个结构域之间配对的接头,由此迫使结构域与另一条链的互补结构域配对,并且产生两个抗原结合位点(wo94/13804;p.holliger等人proc.natl.acad.sci.usa906444-6448,(1993));和(x)线性抗体,其包含一对串联fv区段(vh-ch1-vh-ch1),其连同互补轻链多肽一起形成一对抗原结合区;(xi)多价抗体片段(scfv二聚体、三聚体和/或四聚体(power和hudson,jimmunol.methods242:193-2049(2000));和(xii)单独或以任何组合的其他重和/或轻链,或其突变体、变体或衍生物的非全长部分。因为抗体可以许多方式进行修饰,所以术语“抗体”应解释为涵盖具有所需特异性的结合结构域的任何特异性结合成员或物质。因此,这个术语涵盖抗体的抗体片段、衍生物、功能等价物和同源物,包括包含免疫球蛋白结合结构域的任何多肽,无论是天然还是全部或部分合成的。因此包括融合至另一种多肽的包含免疫球蛋白结合结构域或等价物的嵌合分子。嵌合抗体的克隆和表达在ep-a-0120694和ep-a-0125023以及美国专利号4,816,397和4,816,567中描述。“抗体组合位点”是由特异性结合抗原的轻链或重和轻链可变和高变区组成的抗体分子的结构部分。如本文使用的以其多种语法形式的短语“抗体分子”包含完整免疫球蛋白分子和免疫球蛋白分子的免疫学活性部分。示例性抗体分子是完整的免疫球蛋白分子、基本上完整的免疫球蛋白分子和含有互补位的免疫球蛋白分子的那些部分,包括本领域已知的那些部分如fab、fab'、f(ab')2和f(v),所述部分对于在本文描述的治疗方法中的使用是优选的。以其多种语法形式的短语“单克隆抗体”指仅具有能够与特定抗原免疫反应的一类抗体组合位点的抗体。单克隆抗体因此一般展示对于它与之免疫反应的任何抗原的单一结合亲和力。单克隆抗体因此可以含有具有多个各自对于不同抗原免疫特异性的抗体组合位点的抗体分子;例如双特异性(嵌合)单克隆抗体。术语“特异性”可以用于指其中特异性结合对的一个成员不显示与除其特异性结合配偶体外的分子特异性结合的情况。当例如抗原结合结构域对于由许多抗原携带的特定表位特异性时,也可应用该术语,在所述情况下携带抗原结合结构域的特异性结合成员将能够与携带表位的多个抗原结合。术语“包含”一般以包括的含义使用,即允许一个或多个特征或组分的存在。术语“基本上由……组成”指具有限定数目残基的产物,特别是肽序列,其不共价附着至较大产物。在关于这点的本发明肽的情况下,本领域技术人员应当理解仍可以考虑对肽的n或c末端的较小修饰,例如末端的化学修饰以添加保护基团等,例如c末端的酰胺化。术语“分离的”指其中本发明的溶素多肽或编码此类多肽的核酸将是依照本发明的状态。多肽和核酸将不含或基本上不含它们与之天然结合的材料,例如它们在其天然环境中与之一起发现的其他多肽或核酸,或当此类制备通过在体外或体内实践的重组dna技术时,它们在其中进行制备的环境(例如细胞培养)。多肽和核酸可以用稀释剂或佐剂配制,并且仍对于实用目的是分离的-例如多肽通常将与聚合物或粘膜粘着剂或其他载体混合,或当在诊断或治疗中使用时,将与药学可接受的载体或稀释剂混合。核酸能够编码本发明的猪链球菌溶素多肽的核酸在本文中提供且构成本发明的一个方面。在这个背景下的代表性核酸序列是编码图3和4中的任何的多肽,seqidno:1、seqidno:2和seqidno:3的多肽的多核苷酸序列,和在严格条件下与图3或4序列的互补dna序列杂交的序列。这些序列和与图中所示那些杂交的核酸序列的进一步变体被考虑用于在根据本公开内容的裂解酶产生中使用,包括可以获得的天然变体。编码噬菌体相关裂解酶的大量多样的分离核酸序列或cdna序列和与此类基因序列杂交的部分序列对于本发明的溶素酶或多肽的重组生产是有用的。“复制子”是充当体内dna复制的自主单位的任何遗传成分(例如质粒、染色体、病毒);即能够在其自身控制下复制。“载体”是另一个dna区段可以与之附着的复制子,例如质粒、噬菌体或粘粒,以便造成所附着区段的复制。“dna分子”指以其单链形式或双螺旋的聚合形式的脱氧核糖核苷酸(腺嘌呤、鸟嘌呤、胸腺嘧啶或胞嘧啶)。这个术语仅指分子的一级和二级结构,并且不使其限制于任何特定三级形式。因此,这个术语包括尤其在线性dna分子(例如限制性片段)、病毒、质粒和染色体中发现的双链dna。在讨论特定双链dna分子的结构中,序列可以根据标准常规在本文中描述,仅考虑沿着dna的非转录链(即,具有与mrna同源的序列的链)以5'至3'方向的序列。“复制起点”指参与dna合成的那些dna序列。dna“编码序列”是双链dna序列,当置于合适调节序列的控制下时,其在体内转录且翻译成多肽。编码序列的边界通过在5'(氨基)末端上的起始密码子和在3'(羧基)末端上的翻译终止子决定。编码序列可以包括但不限于原核序列、来自真核mrna的cdna、来自真核(例如哺乳动物)dna的基因组dna序列、和甚至合成的dna序列。多腺苷酸化信号和转录终止序列通常位于编码序列的3'。转录和翻译控制序列是dna调节序列,例如启动子、增强子、多腺苷酸化信号、终止子等,其提供编码序列在宿主细胞中的表达。“启动子序列”是能够结合细胞中的rna聚合酶且起始下游(3'方向)编码序列的转录的dna调节区。对于限定本发明的目的,启动子序列在其3'末端上由转录起始位点结合,且上游(5'方向)延伸以包括最小数目的碱基或以超过背景可检测的水平起始转录所需的元件。在启动子序列内将发现转录起始位点(方便地通过用核酸酶s1作图限定),以及负责rna聚合酶结合的蛋白质结合结构域(共有序列)。真核启动子通常但不一定含有“tata”框和“cat”框。原核启动子含有shine-dalgarno序列加上-10和-35共有序列。“表达控制序列”是控制且调节另一个dna序列的转录和翻译的dna序列。当rna聚合酶将编码序列转录成mrna,所述mrna随后翻译成由编码序列编码的蛋白质时,编码序列在细胞中处于转录和翻译控制序列的控制下。“信号序列”可以包括在编码序列之前。这个序列编码对于多肽n末端的信号肽,其与宿主细胞通讯,以将多肽导向细胞表面或将多肽分泌到培养基内,并且这个信号肽在蛋白质离开细胞前通过宿主细胞切割掉。信号序列可以发现与对于原核生物和真核生物天然的多种蛋白质结合。如本文在提及本发明的探针中使用的,术语“寡核苷酸”定义为由两个或更多个,优选超过三个核糖核苷酸组成的分子。它的确切大小将取决于许多因素,所述因素依次又取决于寡核苷酸的最终功能和用途。如本文使用的术语“引物”指无论是纯化的限制性消化中天然存在的还是合成产生的寡核苷酸,当置于其中诱导与核酸链互补的引物延伸产物合成的条件下,即在核苷酸和诱导剂例如dna聚合酶的存在下和在合适温度和ph下时,所述寡核苷酸能够充当合成起始点。引物可以是单链或双链的,并且必须足够长以在诱导剂的存在下引发所需延伸产物的合成。引物的确切长度将取决于许多因素,包括温度、引物来源和方法的使用。例如,对于诊断应用,取决于靶序列的复杂性,寡核苷酸引物一般含有15-25个或更多个核苷酸,尽管它可以含有更少的核苷酸。引物在本文中选择为与特定靶dna序列的不同链“基本上”互补。这意指引物必须足够互补以与其各自链杂交。因此,引物序列无需反映模板的确切序列。例如,非互补的核苷酸片段可以附着至引物的5'末端,其中引物序列的剩余部分与链互补。备选地,非互补碱基或更长的序列可以插入引物内,条件是引物序列和与之杂交的链的序列具有足够的互补性,并且因此形成用于合成延伸产物的模板。如本文使用的,术语“限制性核酸内切酶”和“限制性酶”指细菌酶,其各自在特异性核苷酸序列处或附近切割双链dna。当外源或异源dna已被引入细胞内时,细胞已通过所述外源或异源dna“转化”。转化dna可以整合或不整合(共价连接)到构成细胞基因组的染色体dna内。在例如原核生物、酵母和哺乳动物细胞中,转化dna可以维持在附加型元件例如质粒上。就真核细胞而言,稳定转化的细胞是其中转化dna已变得整合到染色体内的细胞,使得所述转化dna通过染色体复制由子细胞继承。这个稳定性通过真核细胞建立包含含有转化dna的子细胞群体的细胞系或克隆的能力证实。“克隆”是通过有丝分裂衍生自单细胞或共同祖先的细胞群体。“细胞系”是能够在体外稳定生长多代的原代细胞克隆。当至少约75%(优选至少约80%,且最优选至少约90或95%)的核苷酸在限定长度的dna序列上匹配时,两个dna序列是“基本上同源的”。基本上同源的序列可以通过下述进行鉴定:使用在序列数据库中可获得的标准软件比较序列,或在dna杂交实验中在例如如对于那个系统限定的严格条件下。限定合适的杂交条件在本领域技术内。参见例如,maniatis等人,同上;dnacloning,第i和ii卷,同上;nucleicacidhybridization,同上。本文考虑的变体dna分子中的许多包括通过标准dna诱变技术例如m13引物诱变产生的那些。这些技术的细节在sambrook等人(1989)于molecularcloning:alaboratorymanual,coldspringharbor,n.y.(通过引用合并入本文)中提供。通过使用此类技术,可以产生以较小方式不同于公开那些的变体。本公开内容涵盖了这样的dna分子和核苷酸序列,其为本文具体公开那些的衍生物,并且通过核苷酸的缺失、添加或置换而不同于公开的那些,同时仍编码具有溶素多肽的功能特征的蛋白质。还包括的是衍生自公开的dna分子的小dna分子。此类小dna分子包括适合于用作杂交探针或聚合酶链反应(pcr)引物的寡核苷酸。像这样,这些小dna分子将包含至少通过猪链球菌的细菌噬菌体遗传编码的裂解酶区段,并且对于pcr目的,将包含至少10-15核苷酸序列,并且更优选地,基因的15-30核苷酸序列。衍生自如上所述公开的dna分子的dna分子和核苷酸序列也可以定义为在严格条件下与公开的dna序列或其片段杂交的dna序列。对应于特定严格程度的杂交条件取决于选择的杂交方法的性质和使用的杂交dna的组成和长度而改变。一般地,杂交温度和杂交缓冲液的离子强度(尤其是钠离子浓度)将决定杂交的严格性。关于获得特定严格程度所需的杂交条件的计算由sambrook等人(1989)在molecularcloning:alaboratorymanual,coldspringharbor,n.y.,第9和11章(通过引用合并入本文)中讨论。此类计算的例子如下。杂交实验可以通过dna分子(例如由对于炭疽杆菌特异性的细菌噬菌体遗传编码的裂解酶的天然变异)与靶dna分子的杂交执行。靶dna可以是例如相应的cdna,其已在琼脂糖凝胶中电泳且通过dna印迹转移至硝酸纤维素膜(southern(1975).j.mol.biol.98:503),所述dna印迹是本领域众所周知的技术,且在sambrook等人(1989)于molecularcloning:alaboratorymanual,coldspringharbor,n.y.(通过引用合并入本文)中描述。用由同位素p32标记的dctp标记的靶探针的杂交在具有高离子强度例如6×ssc的溶液中在低于解链温度tm(下文定义)20-25摄氏度的温度下执行。对于其中dna印迹上的靶dna分子含有10ng或更多dna的此类dna杂交实验,杂交使用1-2ng/ml放射性标记的探针(具有等于109cpm/mug或更大的比活性)执行6-8小时。在杂交后,洗涤硝酸纤维素滤器以去除背景杂交。洗涤条件尽可能严格以去除背景杂交,同时保留特异性杂交信号。术语“tm”代表超过这一温度,在占优势的离子条件下,放射性标记的探针分子将不与其靶dna分子杂交。此类杂交物分子的tm可以由下式评估:tm=81.5℃-16.6(钠离子浓度的log10)+0.41(%g+c)-0.63(%甲酰胺)-(600/l),其中l=杂交物中的碱基对长度。这个等式对于在0.01m-0.4m范围中的钠离子浓度是有效的,并且它对于在具有更高钠离子浓度的溶液中的tm计算较不准确(bolton和mccarthy(1962).proc.natl.acad.sci.usa48:1390)(通过引用合并入本文)。该等式也对于具有在30%-75%内的g+c含量的dna是有效的,并且也应用于长度大于100个核苷酸的杂交物。寡核苷酸探针的行为在sambrook等人(1989)于inmolecularcloning:alaboratorymanual,coldspringharbor,n.y.(通过引用合并入本文)中的第11章中详细描述。此处描述的优选示例条件特别考虑用于在选择分解基因的变异中使用。在本公开内容的优选实施方案中,严格条件可以定义为在其下具有超过25%序列变异(也称为“错配”)的dna分子将不杂交的那些。在更优选的实施方案中,严格条件是在其下具有超过15%错配的dna分子将不杂交的那些,并且更加优选地,严格条件是在其下具有超过10%错配的dna序列将不杂交的那些。优选地,严格条件是在其下具有超过6%错配的dna序列将不杂交的那些。遗传密码的简并性进一步拓宽实施方案的范围,因为它允许dna分子的核苷酸序列中的重大变异,同时维持编码蛋白质的氨基酸序列。例如,代表性氨基酸残基是丙氨酸。这可以通过核苷酸密码子三联体gct在cdna中编码。由于遗传密码的简并性,三个其他核苷酸密码子三联体—gct、gcc和gca—也编码丙氨酸。因此,基因的核苷酸序列可以在这个位置上变成这三个密码子中的任何一个,而不影响所编码蛋白质的氨基酸组成或蛋白质的特征。关于特定氨基酸的遗传密码和核苷酸密码子中的变异是技术人员众所周知的。基于遗传密码的简并性,使用如上所述的标准dna诱变技术,或通过dna序列的合成,变体dna分子可以衍生自本文公开的cdna分子。在本文中由本公开内容包含这样的dna序列,由于基于遗传密码的简并性的序列变异,所述dna序列在严格条件不与公开的cdna序列杂交。因此,应当理解还在本发明的范围内的是编码本发明的溶素(包括plyss2和plyss1)的dna序列,所述序列编码具有与图3或4或seqidno:1、2或3中提供的相同氨基酸序列的多肽,但与其简并或与图3或4中提供的示例性核酸序列简并。“与……简并”意指不同的三字母密码子用于指定特定氨基酸。本领域众所周知的是下述密码子可互换使用,以编码每个特定氨基酸:苯丙氨酸(phe或f)uuu或uuc亮氨酸(leu或l)uua或uug或cuu或cuc或cua或cug异亮氨酸(ile或i)auu或auc或aua甲硫氨酸(met或m)aug缬氨酸(val或v)guu或guc或gua或gug丝氨酸(ser或s)ucu或ucc或uca或ucg或agu或agc脯氨酸(pro或p)ccu或ccc或cca或ccg苏氨酸(thr或t)acu或acc或aca或acg丙氨酸(ala或a)gcu或gcg或gca或gcg酪氨酸(tyr或y)uau或uac组氨酸(his或h)cau或cac谷氨酰胺(gln或q)caa或cag天冬酰胺(asn或n)aau或aac赖氨酸(lys或k)aaa或aag天冬氨酸(asp或d)gau或gac谷氨酸(glu或e)gaa或gag半胱氨酸(cys或c)ugu或ugc精氨酸(arg或r)cgu或cgc或cga或cgg或aga或agg甘氨酸(gly或g)ggu或ggc或gga或ggg色氨酸(trp或w)ugg终止密码子uaa(赭石)或uag(琥珀)或uga(蛋白石)应当理解上文指定的密码子用于rna序列。关于dna的相应密码子具有t代替u。本领域技术人员将认识到此处描述和本领域已知的dna诱变技术可以产生广泛多样的dna分子,其编码猪链球菌的细菌噬菌体溶素,仍维持本文描述和提供的裂解多肽的基本特征。还可以选择新的衍生蛋白质,以便获得对裂解多肽的特征的变异,如下文更充分地描述的。此类衍生物包括在氨基酸序列中具有变异包括较小缺失、添加和置换的那些。虽然用于引入氨基酸序列变异的位点可以是预定的,但突变本身无需是预定的。例如,为了使在给定位点上的突变性能最佳化,可以在靶密码子或区域上进行随机诱变,并且就所需活性的最佳组合筛选所表达的蛋白质变体。用于在如上所述具有已知序列的dna中的预定位点上制备置换突变的技术是众所周知的。氨基酸置换一般具有单个残基,或可以具有一个或多个、一个或少数、一个、二个、三个、四个、五个、六个或七个残基;插入通常将相当于约1-10个氨基酸残基;并且缺失将范围为约1-30个残基。缺失或插入可以以单一形式,但优选在相邻对中作出,即2个残基的缺失或2个残基的插入。可以合并置换、缺失、插入或其任何组合,以取得最终构建体。显而易见地,在编码蛋白质的dna中作出的突变必须不将序列置于读码框外,并且优选将不制备可以产生二级mrna结构的互补区(ep75,444a)。置换变体是其中氨基酸序列中的至少一个残基已去除并且不同残基在其位置上插入的那些。此类置换可以这样制备,以便对蛋白质特征不产生显著作用,或当希望细调蛋白质的特征时。可以置换蛋白质中的原始氨基酸且视为保守置换的氨基酸在上文描述,并且由本领域技术人员认识到。在功能或免疫学同一性中的实质改变可以通过选择更不保守的置换进行,例如通过选择在其对维持下述的作用中更显著不同的残基:(a)置换区域中的多肽主链的结构,例如作为片层或螺旋构象;(b)分子在靶位点上的电荷或疏水性;或(c)侧链的大小。一般而言预期产生蛋白质性质中的最大变化的置换将是这样的,其中:(a)亲水性残基例如丝氨酰或苏氨酰置换疏水性残基例如亮氨酰、异亮氨酰、苯丙氨酰、缬氨酰或丙氨酰(或被其置换);(b)半胱氨酸或脯氨酸置换任何其他残基(或被其置换);(c)具有正电性侧链的残基例如赖氨酰、精氨酰或组氨酰置换负电性残基例如谷氨酰或天冬氨酰(或被其置换);或(d)具有庞大侧链的残基例如苯丙氨酸置换不具有侧链的残基例如甘氨酸(或被其置换)。通过分析衍生物或变体蛋白质裂解或杀死敏感细菌的能力,或补足通过噬菌体在受感染细菌宿主中显示出的对dna交联剂的敏感性的能力,这些氨基酸置换或缺失或添加的效应可以对裂解多肽的衍生物或变体进行评价。这些测定法可以通过下述执行:将编码衍生物或变体蛋白质的dna分子转染到如上所述的细菌内,或使细菌与来自由编码衍生物或变体蛋白质的dna分子转染的宿主的表达蛋白质一起温育。虽然用于引入氨基酸序列变异的位点可以是预定的,但突变本身无需是预定的。例如,为了使在给定位点上的突变性能最佳化,可以在靶密码子或区域上进行随机诱变,并且就所需活性的最佳组合筛选所表达的蛋白质变体。用于具有在如上所述的已知序列的dna中的预定位点上制备置换突变的技术是众所周知的。本发明的另一个特征是本文公开的dna序列的表达。如本领域众所周知的,dna序列可以通过下述进行表达:将其可操作地连接至在合适表达载体中的表达控制序列,并且采用该表达载体以转化合适的单细胞宿主。如果并非已经是dna序列的部分,则本发明的dna序列与表达控制序列的此类可操作地连接当然包括在dna序列的正确读码框上游中起始密码子atg的提供。广泛多样的宿主/表达载体组合可以用于表达本发明的dna序列。有用的表达载体例如可以由染色体、非染色体和合成dna序列的区段组成。合适的载体包括sv40的衍生物和已知的细菌质粒例如大肠杆菌质粒colel、pcr1、pbr322、pmb9及其衍生物,质粒例如rp4;噬菌体dnas例如噬菌体λ的众多衍生物,例如nm989及其他噬菌体dna,例如m13和丝状单链噬菌体dna;酵母质粒例如2□质粒或其衍生物;在真核细胞中有用的载体,例如在昆虫或哺乳动物细胞中有用的载体;衍生自质粒和噬菌体dnas组合的载体,例如已经修饰为采用噬菌体dna或其他表达控制序列的质粒;等。广泛多样的表达控制序列中的任何一个--控制与之可操作地连接的dna序列的表达的序列--可以在这些载体中用于表达本发明的dna序列。此类有用的表达控制序列包括例如sv40、cmv、牛痘、多瘤或腺病毒、lac系统、trp系统、tac系统、trc系统、ltr系统的早期或晚期启动子,噬菌体λ的主要操纵子和启动子区,fd外壳蛋白质的控制区,关于3-磷酸甘油酸酯激酶或其他糖酵解酶的启动子,酸性磷酸酶的启动子(例如pho5),酵母交配因子的启动子,和已知控制原核或真核细胞或其病毒的基因表达的其他序列,及其多种组合。广泛多样的单细胞宿主细胞在表达本发明的dna序列中也是有用的。这些宿主可以包括众所周知的真核和原核宿主,例如大肠杆菌、假单胞菌属、芽孢杆菌属、链霉菌属,真菌例如酵母,和动物细胞例如cho、rl.l、b-w和l-m细胞、非洲绿猴肾细胞(例如cos1、cos7、bsc1、bsc40和bmt10),昆虫细胞(例如sf9),和组织培养中的人细胞和植物细胞。应当理解并非所有载体、表达控制序列和宿主将同样良好地起作用,以表达本发明的dna序列。所有宿主也并非同样良好地与相同表达系统起作用。然而,本领域技术人员将能够无需过度实验而选择适当的载体、表达控制序列和宿主,以完成所需表达而不背离本发明的范围。多肽编码序列的片段文库可以用于生成多样化多肽群体,用于变体的筛选和后续选择。例如,编码序列片段文库可以通过下述生成:在其中切口仅对于每个分子发生大约一次的条件下用核酸酶处理目的编码序列的双链pcr片段,使双链dna变性,使dna复性以形成可以包括来自不同切口产物的有义/反义对的双链dna,通过用s1核酸酶处理从再形成的双链体中去除单链部分,并且将所得到的片段文库连接到表达载体内。通过这种方法,可以衍生表达文库,其编码多个不同大小的目的蛋白质的n末端和内部片段。用于筛选通过点突变或截短制备的组合文库的基因产物,并且在cdna文库中筛选具有所选性质的基因产物的几种技术是本领域已知的。用于筛选大型基因文库的顺应高通量分析的最广泛使用的技术,一般包括将基因文库克隆到可复制的表达载体内,用所得到的载体文库转化合适细胞,并且在其中所需活性的检测有利于编码被检测产物的基因的载体分离的条件下表达组合基因。递归总体诱变(rem),增强文库中的功能突变体频率的技术,可以与筛选测定法组合使用,以鉴定公开内容的蛋白质变体(arkin和yourvan(1992)proc.natl.acad.sci.usa89:7811-7815;delgrave等人(1993)proteinengineering6(3):327-331)。组合物依照本发明提供了包含本发明的裂解酶和/或多肽的治疗或药物组合物,以及相关使用方法和制造方法。治疗或药物组合物可以包含一种或多种裂解多肽,并且任选包括天然、截短、嵌合或改组的裂解酶,任选与其他组分组合,所述其他组分例如载体、媒介物、多肽、多核苷酸、穿孔素蛋白质、一种或多种抗生素或合适的赋形剂、载体或媒介物。本发明提供了本发明的溶素(包括plyss2和/或plyss1(特别是δplyss1))的治疗组合物或药物组合物,用于在革兰氏阳性菌的杀死、减轻、去定殖、预防或治疗中使用,包括细菌感染或有关状况。本发明提供了本发明的溶素(包括plyss2和/或plyss1(特别是δplyss1))的治疗组合物或药物组合物,用于在治疗、减少或控制通过革兰氏阳性菌(特别包括猪链球菌)的污染和/或感染中使用,包括在外表面例如皮肤中的污染或感染或经由外表面例如皮肤的污染或感染。因此考虑且提供了用于对外部包括皮肤或其他外表面的局部或皮肤病学应用和一般施用的组合物。本文提供了包含plyss2或plyss1溶素(包括其截短物或变体)的组合物,用于在革兰氏阳性菌的杀死、减轻、去定殖、预防或治疗中使用,包括细菌感染或有关状况,所述革兰氏阳性菌特别是链球菌属、葡萄球菌属、肠球菌属或李斯特菌属,包括化脓性链球菌和抗生素抗性金黄色葡萄球菌。在治疗组合物中包括的酶或多肽可以是未改变的噬菌体相关裂解酶、截短的裂解多肽、变体裂解多肽、和嵌合和/或改组的裂解酶中的一种或多种或任何组合。另外,可以使用用于治疗相同细菌的由不同噬菌体遗传编码的不同裂解多肽。这些裂解酶也可以是“未改变的”裂解酶或多肽、截短的裂解多肽、变体裂解多肽、和嵌合和改组的裂解酶的任何组合。用于革兰氏阳性菌包括链球菌属、葡萄球菌属、肠球菌属和李斯特菌属的治疗或药物组合物中的裂解酶/多肽可以单独或与抗生素组合使用,或如果存在待治疗的其他侵入性细菌生物体,与对于待靶向的其他细菌特异性的其他噬菌体相关裂解酶组合。裂解酶、截短的酶、变体酶、嵌合酶和/或改组的裂解酶可以与穿孔素蛋白质结合使用。穿孔素蛋白质的量也可以是改变的。多种抗生素可以任选与酶或多肽一起包括在治疗组合物中,并且连同或不连同溶葡萄球菌酶的存在。超过一种裂解酶或多肽可以包括在治疗组合物中。治疗组合物还可以包括一种或多种改变的裂解酶,包括通过化学合成或dna重组技术产生的其同工酶、类似物或变体。特别地,改变的裂解蛋白质可以通过氨基酸置换、缺失、截短、嵌合化、改组或其组合来产生。药物组合物可以含有一种或多种天然裂解蛋白质和一种或多种截短的、变体、嵌合或改组的裂解蛋白质的组合。药物组合物还可以含有衍生自相同或不同细菌物种的至少一种裂解蛋白质的肽或肽片段,伴随一种或多种补充试剂的任选添加,和药学可接受的载体或稀释剂。本发明提供了包含具有细菌杀死活性的plyss溶素多肽变体的细菌溶素。本发明描述了plyss溶素截短突变体,其仅含有一个催化或酶促结构域,并且保留革兰氏阳性抗菌活性。本发明描述了例如示例性plyss溶素截短突变体,其仅含有选自预期的丙氨酸-酰胺酶结构域和预测的氨基葡糖苷酶结构域的一个结构域。在plyss1截短突变体中,例如c末端氨基葡糖苷酶结构域是缺失的,使得截短的溶素包含且含有n末端酶促结构域和细胞壁结合结构域。δplyss1截短物具有n末端254个氨基酸,而全长plyss1溶素具有452个氨基酸。因此,本发明提供了猪链球菌溶素突变体,特别是plyss1溶素突变体,其是仅含有一个催化结构域的截短突变体,并且保留针对猪链球菌和众多其他细菌菌株的杀死活性,所述其他细菌菌株包括其他链球菌属,以及如本文提供和证实的葡萄球菌属、李斯特菌属及其他细菌。本文提供了包含plyss突变型溶素,包括plyss1突变型溶素的组合物,与全长plyss溶素蛋白质(包括全长plyss1溶素蛋白质)相比较,具有相等或更大的针对链球菌属细胞(包括猪链球菌)的杀死活性,所述plyss突变型溶素具有seqidno:1的氨基酸序列的多肽变体,伴随选自下述的修饰:a)plyss突变体是仅含有选自内肽酶结构域和氨基葡糖苷酶结构域的一个催化结构域的截短的突变型溶素;b)plyss突变体是不含c末端酶促结构域的截短的突变型溶素;c)plyss突变体具有单个催化结构域和细胞壁结合结构域;和d)plyss突变体对应于seqidno:2,或其具有一个或多个保守置换的氨基酸变体。治疗组合物还可以包含穿孔素蛋白质。穿孔素蛋白质(或“穿孔素)是在细胞膜中产生孔的蛋白质。穿孔素蛋白质可以形成致命膜损伤,其终止细菌中的细胞呼吸。如同裂解蛋白质,穿孔素蛋白质由噬菌体编码且携带。事实上,穿孔素蛋白质的遗传密码紧靠或甚至在关于噬菌体裂解蛋白质的密码内是相当常见的。大多数穿孔素蛋白质序列很短,并且在性质方面总体是疏水性的,具有高度亲水性羧基末端结构域。在许多情况下,假定的穿孔素蛋白质在噬菌体的酶促活性结构域内的不同读码框上编码。在其他情况下,穿孔素蛋白质在紧靠或接近于编码细胞壁裂解蛋白质的dna的dna上编码。穿孔素蛋白质在噬菌体感染晚期过程中频繁合成且在它们在其中引起膜损伤的胞质膜中发现。穿孔素可以基于一级结构分析分组成两个一般种类。i类穿孔素通常是95个残基或更长,并且可以具有三个潜在跨膜结构域。ii类穿孔素通常更小,约65-95个残基,具有指示两个tm结构域的荷电和疏水性残基的分布(young,等人trendsinmicrobiologyv.8,no.4,march2000)。然而,至少对于革兰氏阳性宿主的噬菌体,双重组分裂解系统可能不是通用的。尽管穿孔素的存在已对于几个噬菌体显示或提出,但仍未发现编码用于所有噬菌体的假定穿孔素的基因。穿孔素已显示存在于几种细菌中,包括例如乳球菌细菌噬菌体tuc2009、乳球菌nlc3、肺炎球菌细菌噬菌体ej-1、格氏乳杆菌(lactobacillusgasseri)细菌噬菌体nadh、金黄色葡萄球菌细菌噬菌体twort、单核细胞增多性李斯特菌细菌噬菌体、肺炎球菌噬菌体cp-1、枯草芽孢杆菌(bacillussubtillis)噬菌体m29、德氏乳杆菌(lactobacillusdelbrueckki)细菌噬菌体ll-h溶素、和金黄色葡萄球菌的细菌噬菌体n11。(loessner,等人,journalofbacteriology,august1999,第4452-4460页)。例如,穿孔素蛋白质可以与裂解酶结合使用,以加速杀死细菌的速度和效率。穿孔素蛋白质也可以以嵌合和/或改组酶的形式。根据一些实施方案,穿孔素蛋白质也可以单独用于治疗细菌感染。药物组合物可以含有补充试剂,包括一种或多种抗微生物剂和/或一种或多种常规抗生素。为了加速感染的治疗,治疗剂还可包括至少一种补充试剂,其还可以加强裂解酶的杀菌活性。抗微生物剂主要通过干扰细菌细胞的结构或功能起作用,其通过抑制细胞壁合成、抑制细胞膜功能、和/或抑制代谢功能(包括蛋白质和dna合成)。抗生素可以广泛再分组成在革兰氏阳性菌中影响细胞壁肽聚糖生物合成的抗生素和影响dna或蛋白质合成的抗生素。细胞壁合成抑制剂包括青霉素和如同其的抗生素破坏刚性细胞外壁,使得相对无支持的细胞膨胀且最终破裂。影响细胞壁肽聚糖生物合成的抗生素包括:糖肽,其通过阻止n-乙酰胞壁酸(nam)和n-乙酰葡糖胺(nag)肽亚基掺入肽聚糖基质内抑制肽聚糖合成。可用的糖肽包括万古霉素和替考拉宁;青霉素,其通过抑制肽聚糖交联的形成起作用。青霉素的官能团β-内酰胺部分结合且抑制dd-转肽酶,其连接细菌中的肽聚糖分子。水解酶继续分解细胞壁,引起由于渗透压的细胞溶解或死亡。常见青霉素包括苯唑西林、氨苄西林和氯唑西林;和多肽,其干扰c55-异戊二烯基焦磷酸酯(在质膜外携带肽聚糖构建块的分子)的去磷酸化。细胞壁影响多肽是杆菌肽。补充试剂可以是抗生素,例如红霉素、克林霉素、阿奇霉素、罗红霉素、大环内酯家族的其他成员、青霉素、头孢菌素及其任何组合,其量有效协调增强裂解酶的治疗效应。基本上任何其他抗生素都可以与改变和/或未改变的裂解酶一起使用。类似地,其他裂解酶可以包括在载体中以治疗其他细菌感染。当治疗不同疾病时,抗生素补充剂可以用于基本上所有酶用途中。药物组合物还可以含有至少一种裂解蛋白质、一种穿孔素蛋白质、或至少一种穿孔素和一种裂解蛋白质的肽或肽片段,和合适的载体或稀释剂,所述裂解和穿孔素蛋白质各自衍生自相同或不同细菌物种,伴随补充试剂的任选添加。还提供的是含有核酸分子的组合物,所述核酸分子单独或与其他核酸分子组合能够在体内表达有效量的裂解多肽或裂解多肽的肽片段。还提供了含有这些核酸分子、多核苷酸、和携带且在体外或体内表达这些分子的载体的细胞培养物。治疗或药物组合物可以包含与多种载体组合的裂解多肽,以治疗由敏感的革兰氏阳性菌引起的疾病。载体适当地含有微量添加剂例如增强等渗性和化学稳定性的物质。此类材料在采用的剂量和浓度下对于接受者是无毒的,并且包括缓冲剂例如磷酸盐、柠檬酸盐、琥珀酸盐、乙酸及其他有机酸或其盐;抗氧化剂例如抗坏血酸;低分子量(小于约十个残基)多肽,例如聚精氨酸或三肽;蛋白质例如血清白蛋白、明胶或免疫球蛋白;亲水聚合物例如聚乙烯吡咯烷酮;甘氨酸;氨基酸例如谷氨酸、天冬氨酸、组氨酸或精氨酸;单糖、二糖及其他碳水化合物,包括纤维素及其衍生物、葡萄糖、甘露糖、海藻糖或糊精;螯合剂例如edta;糖醇例如甘露醇或山梨糖醇;抗衡离子例如钠;非离子型表面活性剂例如聚山梨醇酯、泊洛沙姆或聚乙二醇(peg);和/或中性盐,例如nacl、kcl、mgcl.sub.2、cacl.sub.2及其他。用于药物用途的丙三醇或甘油(1,2,3-丙三醇)是商购可得的。它可以在无菌注射用水、或氯化钠注射剂、或其他药学可接受的含水注射液中稀释,并且以0.1-100%(v/v),优选1.0-50%更优选约20%的浓度使用。dmso是具有增强许多局部应用的药物渗透的惊人能力的非质子溶剂。dmso可以在无菌注射用水、或氯化钠注射剂、或其他药学可接受的含水注射液中稀释,并且以0.1-100%(v/v)的浓度使用。特别当制备静脉内溶液时,载体媒介物还可以包括林格氏溶液、缓冲溶液和右旋糖溶液。用于裂解多肽的载体中的任一个都可以通过常规方法进行制造。然而,优选任何漱口水或相似类型的产品不含醇,以阻止多肽/酶的变性。类似地,当裂解多肽在制造过程期间置于止咳药片、胶质、糖果或止咳糖中时,此类放置应在止咳糖或糖果变硬前但在止咳药片或糖果已稍微冷却后进行,以避免酶的热变性。裂解多肽可以以液态形式或冻干状态加入这些物质中,因此当它遇到体液例如体液时它将溶解。多肽/酶也可以在微团或脂质体中。改变或未改变的裂解酶/多肽治疗感染的有效剂量率或量将部分取决于裂解酶/多肽是治疗还是预防使用,接受者暴露于传染性细菌的持续时间,个体的尺寸和重量等。关于含有酶/多肽的组合物使用的持续时间还取决于用途是否用于预防目的,其中使用可以是每小时、每天或每周,共短时间段,或用途是否用于治疗目的,其中可能需要组合物使用的更密集方案,使得使用可以持续数小时、数天或数周,和/或以每天为基础,或在一天过程中的定时间隔。采用的任何剂型应提供最小单位数目用于最小时间量。被认为提供酶的有效量或剂量的酶活性单位的浓度在鼻和口通道的湿润或潮湿环境中,可以在约100单位/ml-约500,000单位/ml液体的范围内,并且可能在约100单位/ml-约50,000单位/ml的范围中。更具体而言,对活性酶/多肽单位的暴露时间可以影响活性酶单位/ml的所需浓度。分类为“长”或“慢”释放载体的载体(例如特定鼻喷雾剂或止咳糖)可以具有或提供更低浓度的活性(酶)单位/ml,但经过更长的时间段,而“短”或“快速”释放载体(例如含漱剂)可以具有或提供高浓度的活性(酶)单位/ml,但经过更短的时间段。活性单位/ml的量和暴露时间的持续时间取决于感染的性质,治疗是预防还是治疗性的,和其他变量。存在其中必须具有高得多的单位/ml剂量或低得多的单位/ml剂量的情况。裂解酶/多肽应在具有允许裂解酶/多肽的活性的ph的环境中。例如,如果人个体已暴露于具有细菌上呼吸道病症的另一个人,则裂解酶/多肽将位于粘膜衬里中,并且阻止感染细菌的任何定殖。在改变的裂解酶置于载体系统或经口递送模式之前或之时,优选酶在稳定缓冲环境中用于维持约4.0-约9.0,更优选约5.5-约7.5的ph范围。稳定缓冲液可以允许裂解酶/多肽的最佳活性。缓冲液可以含有还原剂例如二硫苏糖醇。稳定缓冲液还可以是或包括金属螯合剂,例如乙二胺四乙酸二钠盐,或它还可含有磷酸盐或柠檬酸盐-磷酸盐缓冲液,或任何其他缓冲液。这些噬菌体和其他噬菌体的dna编码可以改变,以允许在超过两个位置中重组酶攻击一个细胞壁,以允许重组酶切割超过一个细菌物种的细胞壁,以允许重组酶攻击其他细菌,或其任何组合。对重组细菌噬菌体产生的酶的改变类型和数目是无法计数的。温和型表面活性剂可以包括在治疗或药物组合物中,其量有效加强组合物中可以使用的裂解酶/多肽的治疗效应。合适的温和型表面活性剂尤其包括聚氧化乙烯脱水山梨糖醇和脂肪酸的酯(tween系列)、辛基苯氧基聚乙氧基乙醇(triton-x系列)、正辛基-β-d-吡喃葡萄糖苷、正辛基-β-d-硫代吡喃葡萄糖苷、正癸基-β-d-吡喃葡萄糖苷、正十二烷基-β-d-吡喃葡萄糖苷,和生物学存在的表面活性剂,例如脂肪酸、甘油酯、甘油单酯、脱氧胆酸盐和脱氧胆酸盐的酯。防腐剂也可以用于本发明中,且优选包含按重量计约0.05%-0.5%的总组合物。防腐剂的使用确保如果产物受微生物污染,则制剂将阻止或减小微生物生长。在本发明中有用的一些防腐剂包括对羟基苯甲酸甲酯、对羟基苯甲酸丙酯、对羟基苯甲酸丁酯、氯二甲酚、苯甲酸钠、dmdm乙内酰脲、3-碘-2-丙基丁基氨基甲酸酯、山梨酸钾、二葡糖酸氯己定或其组合。用于在本发明的所有实施方案中使用的药物包括抗微生物剂、抗炎剂、抗病毒剂、局部麻醉剂、皮质类固醇、破坏性治疗剂、抗真菌剂和抗雄激素。在粉刺的治疗中,可以使用的活性药物包括抗微生物剂,尤其是具有抗炎性质的那些,例如氨苯砜、红霉素、米诺环素、四环素、克林霉素和其他抗微生物剂。关于抗微生物剂的优选重量百分比是0.5%-10%。局部麻醉药包括可卡因、盐酸可卡因、利多卡因、盐酸利多卡因、达克罗宁、盐酸达克罗宁、盐酸二甲异喹、二丁卡因、盐酸二丁卡因、苦味酸氯苯丁酯和盐酸普莫卡因。用于局部麻醉药的优选浓度是按重量计约0.025%-5%的总组合物。麻醉药例如苯佐卡因也可以按重量计约2%-25%的优选浓度使用。可以使用的皮质类固醇包括倍他米松二丙酸盐、肤轻松锕、戊酸倍他米松、曲安西龙锕、丙酸氯倍他索、去羟米松、双乙酸二氟拉松、安西奈德、丙酮缩氟氢羟龙、戊酸氢化可的松、丁酸氢化可的松和地奈德,推荐以按重量计约0.01%-1.0%的浓度使用。关于皮质类固醇例如氢化可的松或乙酸甲泼尼龙的优选浓度是按重量计约0.2%-约5.0%。另外,治疗组合物还可包含其他酶,例如溶葡萄球菌酶用于治疗连同敏感的革兰氏阳性菌一起存在的任何金黄色葡萄球菌细菌。粘液溶解肽例如溶葡萄球菌酶已提出在治疗人中的金黄色葡萄球菌感染中是有效的(schaffner等人,yalej.biol.&med.,39:230(1967)。溶葡萄球菌酶(溶血性葡萄球菌的基因产物)通过酶促降解细胞壁的聚甘氨酸交联对金黄色葡萄球菌发挥抑菌和杀菌作用(browder等人,res.comm.,19:393-400(1965))。美国专利号3,278,378描述了用于从后来重命名为溶血性葡萄球菌的s.staphylolyticus的培养基产生溶葡萄球菌酶的发酵方法。用于产生溶葡萄球菌酶的其他方法在美国专利号3,398,056和3,594,284中进一步描述。关于溶葡萄球菌酶的基因随后已得到克隆且测序(recsei等人,proc.natl.acad.sci.usa,84:1127-1131(1987))。重组粘液溶解杀菌蛋白质例如r-溶葡萄球菌酶可以潜在避免与目前抗生素治疗相关的问题,由于其靶向特异性、低毒性和生物活性残基的可能减少。此外,溶葡萄球菌酶也是针对非分裂细胞活性的,而大多数抗生素需要活跃分裂细胞以介导其效应(dixon等人,yalej.biology和medicine,41:62-68(1968))。与改变的裂解酶组合的溶葡萄球菌酶可以在抗生素的存在或不存在下使用。存在在相同治疗剂中使用溶葡萄球菌酶和溶素酶两者增加重要性的程度。频繁地,当人具有细菌感染时,通过一个细菌属的感染使人体衰弱,或改变机体的细菌菌群,允许其他潜在的致病菌感染机体。有时共感染机体的细菌之一是金黄色葡萄球菌。许多金黄色葡萄球菌菌株产生青霉素酶,使得葡萄球菌属、链球菌属和其他革兰氏阳性菌菌株不被标准抗生素杀死。因此,可能与抗生素组合的溶素和溶葡萄球菌酶的使用可以充当细菌感染的最快速和有效的治疗。治疗组合物还可以包括变溶菌素和溶菌酶。包含裂解酶/多肽的治疗组合物的应用方法包括但不限于直接、间接、载体和专门方式或方式的任何组合。裂解酶/多肽的直接应用可以通过任何合适的方法,以直接使多肽与感染或细菌定殖部位接触,例如对于鼻区域(例如鼻喷雾剂)、表皮或皮肤应用(例如局部软膏或制剂)、栓剂、棉塞应用等。鼻应用包括例如鼻喷雾剂、滴鼻剂、鼻软膏、鼻洗剂、鼻注射剂、鼻填塞、支气管喷雾剂和吹入器,或间接通过使用润喉片、漱口药或含漱液,或通过使用应用于鼻孔、或面部的软膏或这些的任何组合和相似应用方法。其中裂解酶可以施用的形式包括但不限于止咳糖、锭剂、糖果、注射剂、口香糖、片剂、粉剂、喷雾剂、液体、软膏和气溶胶。当天然和/或改变的裂解酶/多肽通过使用喷雾剂、滴剂、软膏、洗涤剂、注射剂、填塞和吹入器直接引入时,酶优选在液体或凝胶环境中,其中液体充当载体。改变酶的干燥无水形式可以通过吹入器和支气管喷雾剂施用,尽管液体形式的递送是优选的。用于治疗局部感染或污染的组合物包含有效量的根据本发明的至少一种裂解酶,包括plyss1和/或plyss2,和用于将至少一种裂解酶递送至伴侣动物或家畜的受感染或受污染皮肤、皮毛或外表面的载体。用于裂解酶的应用模式包括许多不同载体类型和组合,所述载体包括但不限于含水液体、醇基液体、水溶性凝胶、洗剂、软膏、非水液体基、矿物油基、矿物油和矿脂的掺和物、羊毛脂、脂质体、蛋白质载体例如血清白蛋白或明胶、粉状纤维素carmel及其组合。含有治疗剂的载体的递送模式包括但不限于涂片、喷雾剂、定时贴剂、液体吸收的拭纸及其组合。裂解酶可以直接或在其他载体之一中应用于绷带。绷带可以是潮湿或干燥出售的,其中酶以冻干形式在绷带上。这种应用方法对于受感染皮肤的治疗是最有效的。局部组合物的载体可以包含半固体和凝胶样媒介物,其包括聚合物增稠剂、水、防腐剂、活性表面活性剂或乳化剂、抗氧化剂、防晒剂和溶剂或混合溶剂系统。美国专利号5,863,560(osborne)讨论了许多不同载体组合,其可以帮助皮肤暴露于药物。可以使用的聚合物增稠剂包括本领域技术人员已知的那些,例如在化妆品和医药工业中频繁使用的亲水性和水醇胶凝剂。carbopolrtm是众多交联丙烯酸聚合物之一,其给予一般采用的名称卡波姆。这些聚合物溶解于水中,并且在用腐蚀性材料例如氢氧化钠、氢氧化钾、三乙醇胺或其他胺基中和后,形成澄清或轻微混浊的凝胶。klucelrtm是在水中分散且在完全水合后形成均匀凝胶的纤维素聚合物。其他优选的胶凝聚合物包括羟乙基纤维素、纤维素胶、mve/ma癸二烯交联聚合物、pvm/ma共聚物或其组合。包含裂解酶/多肽的组合物可以以糖果、口香糖、止咳糖、锭剂、片剂、粉末、气溶胶、液体、液体喷雾剂或牙膏的形式施用,用于预防或治疗与上呼吸道疾病相关的细菌感染。裂解酶/多肽加入其内的止咳糖、片剂或胶质可以含有糖、玉米糖浆、多种染料、非糖增甜剂、调味料、任何粘合剂或其组合。类似地,任何基于胶质的产物都可以含有阿拉伯胶、巴西棕榈蜡、柠檬酸、玉米淀粉、食物着色剂、调味料、非糖增甜剂、明胶、葡萄糖、丙三醇、胶基、紫草茸、糖精钠、糖、水、白蜡、纤维素、其他粘合剂及其组合。止咳糖还可含有蔗糖、玉米淀粉、阿拉伯胶、黄蓍胶、茴香脑、亚麻籽、含油树脂、矿物油和纤维素、其他粘合剂及其组合。糖代用品也可用于代替右旋糖、蔗糖或其他糖。包含裂解酶或其肽片段的组合物可以导向粘膜衬里,其中在居住期间,它们杀死定殖疾病细菌。如本文公开且描述的,粘膜衬里包括例如上和下呼吸道、眼、口腔、鼻、直肠、阴道、牙周袋、肠和结肠。由于粘膜组织的天然消除或清洁机制,常规剂型在应用部位不保留任何显著时间长度。具有显示出与粘膜组织的粘附的材料可以是有利的,所述材料与一种或多种噬菌体酶或其他补充试剂一起经过一段时间施用。具有控制释放能力的材料是特别期望的,并且持续释放粘膜粘着剂的使用已受到显著程度的关注。j.r.robinson(通过引用合并入本文的美国专利号4,615,697)提供了在粘膜药物递送中多种控制释放聚合组合物的良好综述。该专利描述了控制释放处理组合物,其包括生物粘着剂和有效量的处理试剂。生物粘着剂是水可膨胀的,但水不溶性纤维性、交联、羧基功能聚合物,其含有(a)多个重复单位,其中至少约80%含有至少一个羧基功能性,和(b)基本上不含聚链烯基聚醚的约0.05-约1.5%交联剂。虽然robinson聚合物是水可膨胀但不溶性的,但作为本申请的共聚物系统,它们是交联的非热塑性材料,并且不能容易与活性剂一起配制且配制成多种剂型。微团和多层微团也可以用于控制酶的释放。涉及其为亲水性和疏水性材料的组合的粘膜粘着剂的其他方法是已知的。来自e.r.squibb&co的orahesive.rtm.是其为在胶粘烃聚合物中的果胶、明胶和羧甲基纤维素钠的组合的粘着剂,用于附着至口腔粘膜。然而,此类亲水性和疏水性组分的物理混合物最后崩溃。相比之下,本申请中的亲水性和疏水性结构域产生不溶性共聚物。同样通过引用合并的美国专利号4,948,580描述了生物粘着剂经口药物递送系统。组合物包括冷冻干燥的聚合物混合物,其由在软膏基质中分散的共聚物聚(甲基乙烯基醚/马来酸酐)和明胶形成,所述软膏基质例如含有分散的聚乙烯的矿物油。美国专利号5,413,792(通过引用合并入本文)公开了糊剂样制剂,其包含(a)包含优选以3:6-6:3的重量比存在的聚硅氧烷和水溶性聚合材料的糊剂样基质,和(b)活性成分。美国专利号5,554,380请求保护固体或半固体生物粘着剂经口可摄取药物递送系统,其含有具有至少两个相的水包油系统。一个相包含按体积计约25%-约75%的内部亲水相,并且另一个相包含按体积计约23%-约75%的外部疏水相,其中外部疏水相由三种组分组成:(a)乳化剂、(b)甘油酯和(c)蜡材料。通过引用合并的美国专利号5,942,243描述了对于施用抗菌剂有用的一些代表性释放材料。治疗或药物组合物还可以含有聚合粘膜粘着剂,包括包含亲水性主链和疏水性接枝链的接枝共聚物,以用于生物活性剂的控制释放。接枝共聚物是下述的反应产物:(1)具有烯属不饱和官能团的聚苯乙烯大分子单体,和(2)具有烯属不饱和官能团的至少一种亲水性酸性单体。接枝链基本上由聚苯乙烯和亲水性单体部分的主要聚合物链组成,所述亲水性单体部分中的一些具有酸性功能性。在接枝共聚物中的聚苯乙烯大分子单体的重量百分比是约1-约20%,并且在接枝共聚物中的总亲水性单体的重量百分比是80-99%,并且其中所述总亲水性单体的至少10%是酸性的,所述接枝共聚物当完全水合时具有至少90%的平衡含水量。含有共聚物的组合物通过在应用部位处组织液的吸附而逐步水合,以获得显示出与粘膜表面粘附的非常柔软的胶状物样团块。在组合物附着至粘膜表面的时间段过程中,它提供药理学活性剂的持续释放,其通过粘膜组织吸收。本申请的组合物可以任选含有其他聚合材料,例如聚(丙烯酸)、聚(乙烯吡咯烷酮)和羧甲基纤维素钠塑化剂、和其他药学可接受的赋形剂,其量不引起对组合物的粘膜粘着性的有害作用。本发明的组合物的剂型可以通过常规方法进行制备。在其中肌内注射是所选施用模式的情况下,优选使用等渗制剂。一般地,用于等渗性的添加剂可以包括氯化钠、右旋糖、甘露醇、山梨糖醇和乳糖。在一些情况下,等渗溶液例如磷酸盐缓冲盐水是优选的。稳定剂包括明胶和白蛋白。血管收缩剂可以加入制剂中。根据本申请提供的是无菌和无热原的药物制剂。本发明的裂解酶/多肽还可以通过任何药学可应用或可接受的方法施用,包括局部、经口或肠胃外。例如,裂解酶/多肽可以肌内、鞘内、皮肤下、皮下或静脉内施用,以治疗通过革兰氏阳性菌的感染。在其中肠胃外注射是所选施用模式的情况下,优选使用等渗制剂。一般地,用于等渗性的添加剂可以包括氯化钠、右旋糖、甘露醇、山梨糖醇和乳糖。在一些情况下,等渗溶液例如磷酸盐缓冲盐水是优选的。稳定剂包括明胶和白蛋白。血管收缩剂可以加入制剂中。根据本申请提供的是无菌和无热原的药物制剂。对于任何化合物,治疗有效剂量可以最初在细胞培养测定法或动物模型中进行评估,所述动物模型通常为小鼠、兔、犬或猪。动物模型也用于完成期望的浓度范围和施用途径。此类信息随后可以用于测定用于在人中施用的有用的剂量和途径。确切剂量通过个别医生考虑到待治疗的患者进行选择。调整剂量和施用以提供足够水平的活性部分或维持所需效应。可以加以考虑的另外因素包括疾病状态的严重性,患者的年龄、重量和性别;饮食,治疗所需持续时间,施用方法,施用时间和频率,药物组合,反应灵敏度,和对治疗的耐受/应答。长效药物组合物可以每3-4天、每周、或两周施用一次,取决于特定制剂的半衰期和清除率。肠胃外施用的裂解酶/多肽的有效剂量率或量和治疗持续时间将部分取决于感染的严重性,患者特别是人的重量,接受者暴露于传染性细菌的持续时间,受感染的皮肤或组织的平方厘米数,感染深度,感染严重性,和多种许多其他变量。组合物可以从每天一次到数次的任何应用,并且可以应用于短或长时间段。使用可以持续数天或数周。采用的任何剂型应提供最小单位数目用于最小时间量。被认为提供有效量或剂量的酶的酶活性单位的浓度可以适当地加以选择。活性单位/ml的量和暴露时间的持续时间取决于感染性质,和载体允许裂解酶/多肽具有的接触量。方法和测定法由本发明的溶素多肽显示出的细菌杀死能力和事实上显著广泛范围的细菌杀死,提供了基于本发明多肽的抗菌有效性的多种方法。因此,本发明考虑了抗菌方法,包括用于杀死革兰氏阳性菌,用于减少革兰氏阳性菌群体,用于治疗或减轻细菌感染,用于治疗暴露于致病菌的人受试者,和用于治疗处于此类暴露的危险中的人受试者的方法。敏感细菌在本文中证实包括本发明的噬菌体酶最初由其衍生的细菌,猪链球菌,以及多种其他链球菌属、葡萄球菌属、肠球菌和李斯特菌属细菌菌株。还提供了治疗多种状况的方法,包括链球菌属、葡萄球菌属、肠球菌属或李斯特菌属感染的预防处理,链球菌属、葡萄球菌属、肠球菌属或李斯特菌属感染的治疗,减少链球菌属、葡萄球菌属、肠球菌属或李斯特菌属群体或携带,治疗下呼吸道感染,治疗耳感染,治疗中耳炎,治疗心内膜炎,和治疗或预防其他局部或全身感染或状况的方法。本发明的溶素证实了其惊人的杀死细菌的能力和针对细菌的有效性,所述细菌来自多个物种例如多个链球菌属或葡萄球菌属物种,跨越不同物种群的细菌例如来自链球菌属、葡萄球菌属、肠球菌属和/或李斯特菌属各自的细菌,和来自不同目的细菌。细菌分类学杆菌纲包括两个目,芽孢杆菌目和乳杆菌目。芽孢杆菌目包括葡萄球菌属、李斯特菌属以及芽孢杆菌属。乳杆菌目包括链球菌属、肠球菌属、乳杆菌属和乳球菌属。本发明的溶素证实抗菌活性和杀死来自不同细菌目的细菌,特别是来自不同杆菌目细菌的能力。本文提供的溶素能够杀死来自芽孢杆菌目以及乳杆菌目的细菌。plyss2溶素在本文中证实在体外和体内杀死来自两个不同目,特别是芽孢杆菌目和乳杆菌目的细菌。本发明的溶素能够杀死混合培养和体内混合感染中的芽孢杆菌目和乳杆菌目细菌。本发明因此考虑了细菌、培养物或感染或在这样的情况下的处理、去定殖和/或去污染,在所述情况下怀疑或存在超过一种革兰氏阳性菌。特别地,本发明考虑了细菌、培养物或感染或在这样的情况下的处理、去定殖和/或去污染,在所述情况下怀疑、存在或可能存在超过一个类型的芽孢杆菌目细菌、超过一个类型的乳杆菌目细菌、或至少一个类型的芽孢杆菌目和一个类型的乳杆菌目细菌。本发明还可以用于治疗特别是人中的败血病。对于败血病感染例如对于肺炎或细菌性脑膜炎的治疗,应存在治疗剂进入血流内的连续静脉内流动。用于治疗败血病的酶浓度取决于血液中的细菌计数和血容量。还提供的是用于治疗链球菌属、葡萄球菌属、肠球菌属或李斯特菌属感染、携带或群体的方法,其包括用包含有效量的本发明的至少一种裂解酶/多肽特别是plyss2和/或plyss1特别是plyss2的治疗剂治疗感染。更具体而言,能够裂解链球菌属、葡萄球菌属、肠球菌属或李斯特菌属细菌菌株的细胞壁的裂解酶/多肽由对于猪链球菌特异性的细菌噬菌体的遗传材料产生。在本发明的方法中,本发明的溶素多肽包括plyss2和/或plyss1,特别是plyss2,在针对革兰氏阳性菌特别是链球菌属、葡萄球菌属、肠球菌属或李斯特菌属感染或细菌定殖的预防和治疗方法中是有用和有能力的。作为本发明的方法中的靶敏感和有关的细菌菌株包括且可以选自金黄色葡萄球菌、单核细胞增多性李斯特菌、溶血性葡萄球菌、猪链球菌、表皮葡萄球菌、马链球菌、马链球菌兽疫亚种、无乳链球菌(gbs)、化脓性链球菌(gas)、血链球菌、格氏链球菌、停乳链球菌、g组链球菌、e组链球菌、粪肠球菌和肺炎链球菌。本发明包括治疗或减轻链球菌属包括化脓性链球菌和/或葡萄球菌属包括金黄色葡萄球菌相关感染或状况的方法,所述金黄色葡萄球菌包括抗生素抗性金黄色葡萄球菌,特别包括mrsa,其中细菌或由特定细菌感染或暴露于特定细菌,或怀疑暴露于或处于危险中的人受试者,与本发明的分离溶素多肽接触或施用本发明的分离溶素多肽,其量有效杀死特定细菌。因此,plyss2和/或plyss1中的一种或多种,包括其截短物或变体,包括如本文在图3和4以及seqidnos:1、2或3中提供的此类多肽这样接触或施用,以便有效杀死有关细菌或另外减轻或治疗细菌感染。术语‘试剂’意指任何分子,包括多肽、抗体、多核苷酸、化学化合物和小分子。特别地,术语试剂包括化合物例如测试化合物、添加的另外化合物或溶素酶化合物。术语‘激动剂’指在最广泛的含义中刺激配体与之结合的受体的配体。术语‘测定法’意指用于测量化合物的特性的任何过程。‘筛选测定法’意指基于其活性用于从化合物集合中表征或选择化合物的过程。术语‘阻止’指受试者中处于获得或发展的疾病或病症的危险中的减少(即促使疾病的临床症状中的至少一种不发展),所述受试者可以在疾病发作事先暴露于病因剂,或易感染该疾病。术语‘预防’与术语‘阻止’有关且在术语‘阻止’中包含,并且指目的是阻止而不是治疗或治愈疾病的措施或程序。预防措施的非限制性例子可以包括疫苗的施用;低分子量肝素对由于例如固定而处于血栓形成的危险中的住院患者的施用;对其中疟疾是流行病或接触疟疾的危险很高的地理区域访问前,抗疟疾剂例如氯喹的施用。‘治疗有效量’意指药物、化合物、抗微生物剂、抗体、多肽或药物试剂的量,其将引发由内科医生或其他临床医生寻求的受试者的生物或医学应答。特别地,就革兰氏阳性菌感染和革兰氏阳性菌的生长而言,术语“有效量”预期包括有效量的化合物或试剂,其造成革兰氏阳性菌感染量或程度的生物学意义的降低,包括具有杀菌和/或抑菌效应。短语“治疗有效量”在本文中用于意指足以阻止,且优选减少至少约30%、更优选至少50%、最优选至少90%革兰氏阳性菌生长或量中临床显著变化,或如可以注意到其存在和活性的其他病理学特征例如高烧或白细胞计数的量。在一个实施方案中,术语任何疾病或感染的‘治疗’指疾病或感染的改善(即阻止传染剂或细菌的疾病或生长或减少其临床症状中的至少一种的表现、程度或严重性)。在另一个实施方案中,‘治疗’指改善可能未由受试者辨别的至少一个身体参数。在另外一个实施方案中,‘治疗’指身体(例如可辨别症状的稳定)、生理学(例如身体参数的稳定)或两者调节疾病或感染。在进一步的实施方案中,‘治疗’涉及减慢疾病的进展或减少感染。短语“药学可接受的”指这样的分子实体和组合物,当施用于人时,其是生理学耐受且一般不产生变应性或相似的不利反应,例如胃不适、眩晕等。应当指出在体内执行的治疗方法或依照本申请和权利要求的医学和临床治疗方法的背景下,术语受试者、患者或个体预期指人。术语“革兰氏阳性菌”、“革兰氏阳性细菌”、“革兰氏阳性”和任何未具体列出的变体在本文中可以互换使用,并且如本申请和权利要求自始至终使用的,指这样的革兰氏阳性菌,其是已知的和/或可以通过特定细胞壁的存在和/或细胞膜特征和/或通过用革兰氏染剂染色进行鉴定。革兰氏阳性菌是已知的,并且可以容易地鉴定且可以选自但不限于李斯特菌属、葡萄球菌属、链球菌属、肠球菌属、分枝杆菌属、棒状杆菌属和梭菌属,并且包括其任何和所有识别或未识别的物种或菌株。在本发明的一个方面,plys溶素敏感的革兰氏阳性菌包括选自李斯特菌属、葡萄球菌属、链球菌属和肠球菌属中的一种或多种的细菌。术语“杀菌的”指能够杀死细菌细胞。术语“抑菌的”指能够抑制细菌生长,包括抑制生长的细菌细胞。短语“药学可接受的”指这样的分子实体和组合物,当施用于人时,其是生理学耐受且一般不产生变应性或相似的不利反应,例如胃不适、眩晕等。短语“治疗有效量”在本文中用于意指足以阻止,且优选减少至少约30%、更优选至少50%、最优选至少90%靶细胞群的s期活性的临床显著变化,或如可以注意到其存在和活性的其他病理学特征例如血压升高、发烧或白细胞计数的量。用于治疗由链球菌属或葡萄球菌属细菌引起的全身或组织细菌感染的一种方法包括用治疗剂肠胃外治疗感染,所述治疗剂包含有效量的本发明的一种或多种溶素多肽(特别是plyss2和/或plyss1,包括其截短物或变体,包括如本文在图3和4以及seqidnos:1、2或3中提供的此类多肽)和合适载体。许多其他不同方法可以用于引入裂解酶/多肽。这些方法包括静脉内、肌内、皮下、鞘内和皮肤下引入裂解酶/多肽。考虑到涉及或怀疑的细菌状况的性质和程度和细菌菌株或类型,本领域技术人员包括医护人员将能够评估且识别最合适的施用模式或方式。例如,一种或多种裂解多肽的鞘内使用和施用对于细菌性脑膜炎的治疗将是最有利的。感染还可以通过将治疗剂注射到人患者的受感染组织内进行治疗,所述治疗剂包含合适的裂解酶/多肽和关于酶的载体。载体可以由蒸馏水、盐水溶液、白蛋白、血清或其任何组合组成。更具体而言,用于输注或注射的溶液可以以常规方式制备,例如伴随防腐剂例如对羟基苯甲酸酯或稳定剂例如乙二胺四乙酸的碱金属盐的添加,所述溶液随后可以转移到融合容器、注射小瓶或安瓿内。备选地,用于注射的化合物可以连同或不连同其他成分一起冻干,并且在使用时适当地溶解于缓冲溶液或蒸馏水中。非含水媒介物例如不挥发性油、脂质体和油酸乙酯在本文中也是有用的。其他噬菌体相关裂解酶,连同穿孔素蛋白质,可以包括在组合物中。提供关于使用如本文例示的裂解酶/多肽例如plyss2和plyss1的多种治疗方法,作为用于消除或减少敏感细菌的携带的预防治疗,预防已暴露于具有感染症状的其他人的那些人不生病,或作为用于已由于感染变得生病的那些的治疗处理。类似地,特别通过使用酶的支气管喷雾剂或静脉内施用,裂解酶/多肽可以用于治疗例如下呼吸道疾病。例如,裂解酶可以用于眼感染例如结膜炎的预防和治疗性处理。治疗方法包括施用滴眼剂或眼洗剂,其包含有效量的本发明的至少一种裂解多肽和能够安全应用于眼的载体,其中载体含有裂解酶。滴眼剂或眼洗剂优选以等渗溶液的形式。溶液的ph应这样调整,使得不存在眼的刺激,所述刺激依次又导致通过其他生物体的可能感染,和可能的对眼的损害。虽然ph范围应在与其他裂解酶相同的范围中,但最佳ph将在如本文证实且提供的范围中。类似地,还应使用上文对于其他裂解酶描述的缓冲液分类。适合于在滴眼剂中使用的其他抗生素可以加入含有酶的组合物中。还可以添加杀菌和抑菌化合物。溶液中的酶浓度可以在约100单位/ml-约500,000单位/ml的范围中,具有约100-约5,000单位/ml,和约100-约50,000单位/ml的更优选范围。浓度可以高于或低于提供的范围。本发明的裂解多肽也可以用于隐形眼镜溶液中,用于隐形眼镜的浸泡和清洁。这种溶液通常是等渗溶液,除了酶之外,还可以含有氯化钠、甘露醇和其他糖醇、硼酸盐、防腐剂等。本发明的裂解酶/多肽也可以施用于患者的耳。因此,例如,本发明的裂解多肽可以用于治疗例如通过肺炎链球菌引起的耳感染。中耳炎是特征在于诸如耳痛、听力损失和发热的症状的中耳炎症。这些症状的主因之一是液体(渗出液)在中耳中的积累。并发症包括永久性听力损失、鼓膜穿破、获得性胆脂瘤、乳突炎和粘连性中耳炎。在生命第一年中发展中耳炎的儿童处于复发性急性或慢性疾病的危险中。中耳炎的主因之一是肺炎链球菌。裂解酶/多肽可以通过将在合适载体中的酶递送至耳道而应用于受感染的耳。载体可以包含无菌含水或油性溶液或悬浮液。裂解酶可以加入载体中,所述载体还可以含有合适的防腐剂,且优选表面活性试剂。优选包括在滴剂中的杀菌剂和杀真菌剂是硝酸或乙酸苯汞(0.002%)、苯扎氯铵(0.01%)和乙酸氯己定(0.01%)。用于制备油性溶液的合适溶剂包括甘油、稀乙醇和丙二醇。另外,可以使用任何数目的其他滴耳剂载体。用于治疗中耳炎和其他相似耳感染的浓度和防腐剂与上文对于眼感染讨论的相同,并且酶进入其内的载体与用于治疗眼感染的载体相似或相同。另外,载体一般可以包括维生素、矿物质、碳水化合物、糖、氨基酸、蛋白质性质材料、脂肪酸、磷脂、抗氧化剂、苯酚化合物、等渗溶液、基于油的溶液、基于油的悬浮液及其组合。通过本发明的溶素多肽的识别和分离产生的诊断、预防和治疗可能性和应用,衍生自本发明的多肽引起敏感细菌中的直接和特异性效应(例如杀死)的事实。因此,本发明的多肽可以用于消除、表征或鉴定有关和敏感的细菌。因此,本发明的诊断方法可以包括检查细胞样品或培养基用于测定下述的目的:它是否含有敏感细菌,或借助于包括有效量的一种或多种溶素多肽和用于表征样品中的一种或多种细胞的工具的测定法,样品或培养基中的细菌是否是敏感,或用于测定细胞裂解是已发生还是正在发生。能够获益于这种方法的患者包括患有未确定的感染、识别的细菌感染、或怀疑暴露于或携带特定细菌的那些。针对敏感细菌,可以检查与受试者或患者接触的液体、食物、医学装置、组合物或其他此类样品或可以消除有关细菌。在一个此类方面,通过与本发明的一种或多种裂解多肽一起温育或暴露于本发明的一种或多种裂解多肽,液体、食物、医学装置、组合物或其他此类样品可以是灭菌的或另外处理的,以消除或去除任何潜在的有关细菌。程序及其应用都是本领域技术人员熟悉的,并且相应地可以用于本发明的范围内。在一种情况下,本发明的裂解多肽与样品中的有关或敏感细菌复合或另外结合或相关,并且复合物的一个成员由可检测标记进行标记。复合物已形成的事实和需要时其量可以通过可应用于检测标记的已知方法进行测定。最通常用于这些研究的标记是放射性元素、酶、当暴露于紫外线时发荧光的化学制品及其他。许多荧光材料是已知的且可以用作标记。这些包括例如荧光素、罗丹明、金胺、德克萨斯红、amca蓝和萤光黄。放射性标记可以通过目前可用的计数程序中的任何进行检测。优选的同位素可以选自3h、14c、32p、35s、36cl、51cr、57co、58co、59fe、90y、125i、131i和186re。酶标记同样是有用的,并且可以通过目前利用的比色、分光光度计、荧光分光光度计、安培计或气体定量技术中的任何进行检测。酶通过与桥接分子例如碳化二亚胺类、二异氰酸酯、戊二醛等反应缀合至所选颗粒。可以在这些程序中使用的许多酶是已知的并且可以利用。优选的是过氧化物酶、β-葡糖苷酸酶、β-d-葡糖苷酶、β-d-半乳糖苷酶、尿素酶、葡萄糖氧化酶加上过氧化物酶和碱性磷酸酶。美国专利号3,654,090;3,850,752;和4,016,043例如就其可替代标记材料和方法的公开内容而提及。本发明通过参考下述非限制性实施例可以得到更佳理解,所述实施例提供作为本发明的例示。呈现下述实施例,以便更充分地举例说明本发明的优选实施方案,然而,决不应解释为限制本发明的广泛范围。实施例1来自猪链球菌的噬菌体溶素的克隆和表征猪链球菌是全世界范围内感染猪的革兰氏阳性病原体。从猪到人的动物传染病传播报道是渐增的(sriskandans.等人(2006)plosmedicine3(5):585-567)。猪链球菌可能在未来数年在人群中发展出稳定存在。人和猪已用青霉素或庆大霉素进行治疗,但存在对这些抗生素抗性的猪链球菌分离物(cantin,m.等人(1992)jvetdiagnosticinvestig4:170-174)。我们纯化且表征了来自猪链球菌菌株的两种噬菌体溶素(plyss1和plyss2),并且证实其针对多个猪链球菌菌株的体外活性。此外,猪链球菌溶素特别是plyss2溶素显示在体外杀死多个其他和不同的链球菌属菌株包括b组链球菌。plyss2溶素在杀死众多其他细菌方面也是有效的,所述其他细菌包括其他致病和临床上显著的细菌,特别是葡萄球菌属,包括金黄色葡萄球菌,甚至抗生素抗性金黄色葡萄球菌例如mrsa,肠球菌属(包括粪肠球菌)和李斯特菌属。结果plyss1经由使用猪链球菌原噬菌体基因组dna的功能基因组筛选进行分离且克隆,并且plyss2通过猪链球菌原噬菌体基因组序列的序列分析进行鉴定并且随后分离且克隆。plyss1溶素通过猪链球菌7711(血清型7菌株)的基因组的功能鸟枪法筛选进行克隆。对微克数量的基因组dna(gdna)简短地实施用tsp509i(neb)的限制性消化。经由琼脂糖凝胶电泳分离长度1.5-4kb的片段,并且连接到ecori线性化的pbad24质粒内。这种质粒赋予氨苄西林抗性且允许重组插入物的阿拉伯糖诱导。为了鉴定溶素编码克隆,对文库实施新型筛选技术,其依赖邻近编码的穿孔素蛋白质的毒性(schmitzj.e.等人(2010)advenvironmicrobiol76(21):7181-7187)。简言之,将大肠杆菌top10转化体铺平板到补充有氨苄西林和绵羊血的lb琼脂上。在增殖至肉眼可见的菌落后,使平板暴露于阿拉伯糖薄雾,以诱导重组体转录。毒性克隆通过周围的溶血环发展而揭示。将这些克隆鉴定,再繁殖且实施二次筛选,其中将它们用热杀死的细菌覆盖(以直接测定裂解酶的产生)。对于获得plyss1溶素的猪链球菌菌株(7711),对~3,500个克隆实施原始溶血筛选;选择这些中的100个用于二次筛选,其中2个编码裂解酶。对于理论翻译的蛋白质,假定的酶促和结合结构域分配经由pfam分析(pfam.sanger.ac.uk)作出。基于这个信息,设计引物用于合成截短的构建体(下文称为plyss1),具有在c末端氨基葡糖苷酶结构域前插入的终止密码子。全长plyss1溶素的核酸和氨基酸序列以及截短的酶的氨基酸序列在图3中提供。对于plyss2的鉴定和克隆,就整合的原噬菌体内的溶素编码基因的存在检查猪链球菌的8个测序分离物的基因组。这些菌株是:05zyh33(ncbigenomeproject#17153);98hah33(#17155);bm407(#32237);gz1(#18737);p1/7(#352);sc84(#32239);05has6805hah33(#17157);和89/1591(#12417)。对于每个基因组,就潜在的原噬菌体区域人工检查拓扑排列的注释orfs列表。如果怀疑原噬菌体,则实施该区域中的每个orf的理论翻译,并且基于预测的酶促和结合结构域的组合指定假定的溶素状态。以这种方式鉴定的唯一溶素基因(来自菌株89/1591的plyss2)由基因组dna进行pcr克隆,并且克隆到pbad24大肠杆菌表达质粒(参见下文)内。plyss2溶素的核苷酸和氨基酸序列在图4中提供。如上所述,通过公开的猪链球菌基因组的功能重组筛选和计算分析的组合,两个猪链球菌溶素已得到鉴定且克隆。这些溶素已得到克隆且命名为plyss1和plyss2。如同其他溶素,猪链球菌溶素特别是plyss2具有n末端催化结构域和c末端细胞结合结构域(plyss2中的sh-35型结合结构域)(图2)。事实上,如由猪链球菌菌株7711克隆的plyss1的天然结构含有结合结构域下游的另外第二个催化结构域(非典型的溶素排列),然而,这个结构域被重组消除(如上所述)以符合标准结构。沿着猪链球菌血清型2菌株89/1591的测序基因组(ncbigenomeproject#12417,genbank登记zp_03625529)(lucas,s.等人,usdoejointgenomeinstitute,直接提交)溶素编码基因plyss2在整合的原噬菌体基因组内发现。plyss2由来自菌株89/1591的基因组dna进行pcr克隆,使用下述引物:aatgctagcctgatacacagttagagacc—正向(seqidno:9)和cctaagcttcttttcacaaatcataatccccag—反向(seqidno:10)。引物包括限制位点(nhei和hindiii)用于克隆到pbad24内。正向引物对应于基因起点上游≈60bp的位置,因为几个框内atg三联体彼此接近地位于5'-末端。这允许天然核糖体结合位点(代替pbad24的改造rbs)以指导转录。plyss2从猪链球菌中的原噬菌体基因组中克隆到pbad24载体(pbad24_plyss2,图5)内,并且将其转化到大肠杆菌top10细胞内。pbad24编码β-内酰胺酶,允许紧密转录控制,并且通过廉价的阿拉伯糖诱导。载体转化的大肠杆菌在含有悬浮于软琼脂中的假单胞菌属肽聚糖晕圈的不透明平板上生长(wang,y等人(2009)currmicrobiol58(6):609-615)。透明带在大肠杆菌菌落周围出现,指示水解软琼脂内的肽聚糖的活性plyss2的表达。plyss2的结构非常不同于lysmp的那种。它编码预测的n末端chap结构域(半胱氨酸-组氨酸酰胺基水解酶/肽酶,pf05257)和c末端sh3-5型结构域(pf08460)(图4)。n末端测序证实作为“mttvnea…”的起始。溶素蛋白质生产含有pbad24_plyss2质粒的大肠杆菌在37℃下在10llbamp100中生长,并且用0.2%阿拉伯糖在od600~0.8处诱导过夜表达。培养物以10,722rcf旋转20分钟。将团块重悬浮于100ml15mmna3po4,ph7.4中,并且与蛋白酶抑制剂混合物片剂混合。将这种混合物匀浆化,并且将匀浆物以1,723rcf旋转20分钟。将上清液以30,000rpm超速离心1小时。将足够的15mmna3po4,ph8.0加入上清液中,以使ph达到7.4。将蛋白质运行经过阴离子hitrapfastflowdeae柱(15mmna3po4(pb),ph7.4),无plyss2结合(图6a)。将硫酸铵加入流通物中至40%浓度。将沉淀物离心且重悬浮于200ml15mmna3po4,ph6.7中。将蛋白质用20μm管道在15mmna3po4,ph6.7中透析过夜。将透析物运行经过阳离子hitrapfastflowcm柱,其中plyss2在流通物的肩(shoulder)中以及在70mmnacl,15mmna3po4,ph6.7处干净洗脱(图6b)。合并显示纯plyss2的所有级分(图6c)。值得注意的是在plyss2前的框内存在三个起始密码子:“atgatgcgtggaaaggagaagcctatgacaacagtaaatgaagcatta…”(对应于:“mmrgkekpmttvneal…”)。将纯蛋白质样品提交用于蛋白质测序,以证实起始是“mttvneal…”。为了表达plyss1,使克隆在powerbroth+lb-booster(athenaenzymesystem)中生长至od600≈1.0,并且用0.2%阿拉伯糖诱导。将培养物在37℃下振荡4小时(包含体将在更长时间时形成)。将表达细胞形成团块,重悬浮于15mm磷酸盐缓冲液ph6.2中,并且通过三次经过emulsiflexc-5匀浆器进行裂解。残留碎片通过离心(1小时,35,000xg)去除,并且加入以225g/l的硫酸铵(40%饱和)。将沉淀的蛋白质形成团块且再溶解于15mm磷酸盐ph7.4中,并且针对这种缓冲液透析过夜。接下来将透析液经过针对相同缓冲液平衡的deae阴离子交换柱(快速流动树脂,generalelectric)。上述制备在仅两个色谱法步骤中导致高纯溶素制剂(图6)。具有预测的pi9.01,plyss2在ph=7.4下直接流通deae柱,留下依附deae柱的大量污染蛋白质。plyss2在流通物的肩中以及在17mmnacl处干净洗脱,从快速流通cm树脂的蛋白质纯化。这种制备获得以≈1.5mg/ml的≈60mg蛋白质/升大肠杆菌培养物,具有>99%纯度。当cm柱步骤放弃时,得率增加至以≈2.0mg/ml的≈150mg/升大肠杆菌培养物,具有>90%纯度。需要时,将后面一种产物:透析(到5mmpb,15mmnacl内);冻干;重构(以10%的原始体积);离心;且过滤灭菌(以去除任何不溶性材料)。这生成以≈20mg/ml的plyss2可溶溶液,其保留较低浓度原材料的浓度调整活性。plyss2可以比许多公开的溶素更有效和以更高浓度产生(daniela等人(2010)antimicrobagentschemother54(4):1602-1612;wang,y.等人(2009)currmicrobiol58(6):609-615;nelson,d等人(2006)procnatlacadsciusa103(28):10765-10770)。plyss2的生物化学表征将猪链球菌溶素进一步表征且测试,以测定生物化学条件包括最适ph、最适盐度、温度稳定性和edta效应。通过添加以32μg/ml的plyss2后的猪链球菌7997浊度减少(od600)程度来测定活性。简言之,将5ml脑心浸液(bhi)猪链球菌7997过夜培养物接种到45mlbhi内,并且在37℃下生长2小时。将50ml培养物以1,789rcf离心10分钟。将50ml猪链球菌7997培养物离心。将团块用50ml双蒸h2o(ddh2o)洗涤用于ph测试,或用25ml15mmna3po4,ph8.0洗涤用于其他测试,且再次离心。随后将团块重悬浮于足够的ddh2o或15mmna3po4,ph8.0中,以使最终od600至~1.0以用于每个测试条件。在所有对照中,pb替换plyss2。经过一小时每分钟在od600处获得每个样品的分光光度计读数。关于最适ph、最适盐度、温度稳定性和edta效应的总体结果在图7a-7d中描述。酶的ph依赖性首先使用具有相邻ph范围的两个缓冲液组解决:柠檬酸盐/磷酸盐:4.6-8.0;和bis-tris-丙烷(btp):7.0-9.7。nacl、edta和dtt也变成用于plyss2活性的测试条件。为了测定最适ph,plyss2活性针对猪链球菌菌株7997在磷酸盐/柠檬酸盐缓冲液中在多个ph水平下进行测试(图7a)。plyss2在ph8.0下具有最强活性。我们观察到在最高ph值下扩展的裂解谱。最适ph类似地针对猪链球菌菌株7997进行测定,这次使用bis-tris-丙烷(btp)缓冲液,其允许一直到更高ph水平的评价(图8)。plyss2显示具有一直到ph9.7的急性活性。在btp中,裂解在最高ph9.7下是最大的,但这不是用于活细胞的合适缓冲液。裂解还在btp,ph7.0-8.0中发生;然而,在相称的ph值下,od-下落量级在柠檬酸盐/磷酸盐(用于测试培养物生长的更生理学缓冲液)中显著得多。存在有意义的下至ph6.0的活性,因为血液的ph是大约7.4。为了测定最佳盐浓度,在195μl细胞中,将5μl溶素加入50μl多个nacl浓度中(图7b)。plyss2在0mmnacl中具有最大活性。细胞对在更低渗溶液内的裂解更敏感。盐不增强plyss2诱导的裂解。在恒定酶浓度时,细菌裂解从0-1000mmnacl下降。因此,0mmnacl是最佳的,因为细胞对在更低渗溶液内的裂解更敏感。为了测定溶素的温度稳定性,将它在多个温度下温育30分钟,冷却且随后加入在15mmna3po4,ph8.0中悬浮的245μl细胞中(图7c)。plyss2暴露于过量dtt对活性没有影响(正面或负面)(数据未显示)。用edta处理阻碍plyss2诱导的猪链球菌裂解。将溶素连同多个浓度的乙二胺四乙酸盐(edta)一起加入在15mmna3po4,ph8.0中悬浮的细胞,以测定它是否需要辅因子。在对照中,对于所有测试,ddh2o替换赖氨酸(plyss2)。极低浓度的乙二胺四乙酸盐(edta)减少plyss2活性(图7d)。这表明plyss2需要辅因子或一些其他改性剂。溶素(plyss2)在极低浓度下用edta进行测试,以测定哪个水平将允许一些残留活性。在那个水平(4um-200umedta)下,加入少(5-50um)量的不同二价阳离子(ca2+、fe2+、mg2+、mn2+、ni2+、zn2+)以测定辅因子。当在下述温育时测定plyss2的稳定性:不同温度30分钟;37℃数小时;4℃数天;和-80℃数月。每个等分试样(以32μg/ml)针对猪链球菌7997的活性如上所述进行分光光度计测定。plyss2也在一到十次连续的室温至-80℃冻融后进行测试。当在22℃-85℃温育30分钟时,plyss2活性原则上通过显著温度范围包括55℃不受影响;在60℃下,plyss2活性完全取消。在37℃下温育24小时后,plyss2保留完全活性;但在48小时37℃温育后,plyss2显示减少的活性。在4℃温育15天后不存在活性中可观察的降低。此外,plyss2在-80℃下持续经过7个月,而无活性中的减少。溶素可以承受10次连续的室温至-80℃冻融,而对其活性没有任何可观察到的作用。纯化的plyss2溶素的稳定性在缓冲液中在37℃维持最高达48小时后进行测定。定期测定针对猪链球菌菌株7997的杀死有效性,如图9中所示。plyss2溶素一直到24小时是>90%稳定的,并且在48小时后维持至少50%活性。plyss2溶素的稳定性在-80℃下在冷藏库贮存后进行评估。plyss2溶素在-80℃下在缓冲液中贮存最高达至少7个月后维持基本上100%活性(图10)。已进行测定通过plyss2溶素催化的键的研究。使plyss2与纯化的剥离脂磷壁酸和碳水化合物的猪链球菌肽聚糖一起在37℃下温育过夜,并且将产物提交用于质谱法。数据暗示切割是n-乙酰基胞壁酰-l-丙氨酸酰胺酶。plyss1的生物化学表征原噬菌体裂解酶由猪链球菌菌株7711(源自荷兰的血清型7分离物)的功能基因组的筛选进行克隆。完整的plyss1溶素基因编码452残基蛋白质:pfam分析预测在n末端上的5型丙氨酸-酰胺酶结构域(pf05832),随后为中心区中的双重cpl-7细胞壁结合结构域(pf08230),和在c末端上的第二个氨基葡糖苷酶结构域(pf01832)。结构上,克隆溶素的结构域排列是高度非典型的。革兰氏阳性溶素一般由n末端酶促结构域和c末端结合结构域组成。虽然偶然可见具有两个n末端裂解结构域的溶素,但第二个酶促官能团在结合结构域后编码是罕见的。一个例子是无乳链球菌的lambdasa2溶素(pritcharddg等人(2007)applenvironmicrobiol73(22):7150-7154)。用lambdasa2工作,donovan和foster-frey惊讶地观察到在c末端氨基葡糖苷酶结构域去除后增加的酶促活性(donovandm和foster-freyj(2008)femsmicrobiollett287(1):22-33)。由于这个动机,我们改造了仅具有n末端酶促和中心结合结构域的克隆溶素的截短构建体。将这个截短构建体表达且纯化用于后续功能分析;本文描述的活性和表征研究基于截短的plyss1;此处它被称为截短的plyss1或δplyss1。如上所述,全长和截短的plyss1溶素的结构和氨基酸序列在图3中描述。关于plyss1的最佳生物化学条件针对编码猪链球菌菌株(7711)的活细胞进行测定。对于这些实验,通过在溶素添加后含水细菌悬浮液的浊度减少(od600)程度来测量活性。酶的ph依赖性首先使用具有相邻ph范围的两个缓冲液组解决:柠檬酸盐/磷酸盐:4.6-8.0;和bis-tris-丙烷(btp):7.0-9.7。从5.4-9.4观察到扩展的裂解谱(图11a)。在btp中,裂解从8.2-9.0是最大的;然而,在相称的ph值下,od-下落量级在柠檬酸盐/磷酸盐中略微更显著(图11b)。同样考虑了盐浓度的作用,尽管它不会极大地影响plyss1诱导的裂解。在恒定酶浓度时,细菌裂解从0-1000mmnacl很少改变,在大多数低渗条件下仅具有小数目的增加(图12)。plyss1暴露于过量dtt或edta不会负面影响活性,指示该酶不依赖分子内二硫桥或可螯合阳离子作为辅因子(图13a和13b)。plyss1的热稳定性通过在使用前在多个升高温度下温育酶进行检查(od下降实验自身总是在37℃下进行)。当在35℃-60℃下保持30分钟时,溶素活性直到50℃基本上不受影响,在所述点下它是完全abolished(图14a)。对于6小时温育,在45℃下观察到活性中的部分降低,而40℃样品不受影响(图14b)。后者对应于典型的猪体温。为了测定plyss1的酶促结构域的键特异性,对纯化的猪链球菌细胞壁(来自典型株s735)实施用hewl(胞壁酸酶)和plyss1的双重消化。两个占优势的峰是m/z=718和m/z=734。这确切对应于glcnac-murnac-lala-d-gln的[na-m]+和[k-m]+加合物(adducts)的预测质量。这暗示plyss1具有γ内肽酶活性,切割作为γ-d-谷氨酰胺酰-l-赖氨酸内肽酶特征的在d-gln和l-lys之间的肽聚糖茎。当质谱得自未消化的细胞壁时,上述两个峰不存在。实施例2溶素特异性活性的体外测试plyss2活性为了测定针对不同细胞类型的plyss2溶素活性,将5μl1.6μg/μl(8μg)plyss2加入微量滴定孔中的245μl细胞(在15mmna3po4,ph8.0中悬浮)中。在作为对照的相应孔中,将5μlddh2o加入245μl细胞中。经过一小时每分钟在分光光度计中对于每个孔获得读数(od600)。od密度指示在微量滴定孔中的细菌细胞生长的量。这个活性测试首先使用多个plyss2浓度对于致病性猪链球菌菌株7997进行测定(图15a)。纯化的plyss2溶素的特异性活性也在体外针对猪链球菌菌株s735进行评价(图15b)。这个测试随后使用32ug/mlplyss2执行,以测定针对其他细菌物种的plyss2活性(基于裂解测定法发现这是用于在体外针对其他生物体的杀死研究的良好浓度)(图16a直到16d)。进一步的菌株杀死结果显示于图17a和17b中。另外的结果在下表1中制表。如上文结果证实且描述的,plyss2溶素酶具有不仅针对猪链球菌,还针对其他病原体的广泛活性杀死,所述其他病原体特别包括金黄色葡萄球菌、化脓性链球菌、李斯特菌属和b组链球菌。显示的结果证实甲氧西林抗性金黄色葡萄球菌菌株(mrsa)的生长减少和杀死。在可比较的体外测试中,plyss2另外且类似地有效针对万古霉素中度敏感性金黄色葡萄球菌(visa)和万古霉素抗性金黄色葡萄球菌(vrsa)菌株(图18)。猪链球菌溶素在其快速杀死致病菌的能力方面类似于先前鉴定且表征的菌株。然而,它在其针对大多数病原体的广泛活性方面是罕见和惊人的。还值得注意的是溶素可以如上所示容易地产生且纯化,并且它在多个有关温度、ph和盐度下是稳定的,使得它成为有吸引力的候选治疗酶。表1不同细菌的生长(光密度)的plyss2减少plyss1活性截短的plyss1(δplyss1)溶素活性针对不同细胞类型进行测定。考虑到上文实验,下述最佳缓冲条件用于所有使用δplyss1的进一步体外实验:20mm磷酸盐缓冲液,ph=7.8,2mmedta。将6.5-130μg/ml的一系列溶素浓度引入在这个缓冲液中的活猪链球菌细胞中。三个菌株视为特别有关的:7711,编码plyss1的血清型7菌株;s735,血清型2参照株;和7997,高剧毒血清型9菌株。对于这些菌株的每一个,在多个plyss1剂量下的时间依赖性od600应答在图19中给出。就细菌活力而言,仅最高的plyss1浓度(130μg/ml)导致在1小时处理后对于7711、s735和7997的cfus的>90%降低(表2)。溶素也针对肉汤培养中的活跃分裂细胞(菌株7711)进行测试(图20)。尽管它以剂量依赖性方式延迟细菌增殖,但这些效应一般是轻度的并且δplyss1不能完全抑制猪链球菌生长。表2菌株7711、s735和7997的cfu分析strain13μg/ml130μg/mls735(st2)80.4%-92.6%95.4%-99.5%7997(st9)16.8%-30.3%89.9%-93.9%7711(st7)0%-35.6%95.3%-99.2%对于两个δplyss1浓度(130和13μg/ml),对1小时处理(最佳缓冲条件)后的猪链球菌菌株s735、7997和7711进行cfu分析。在每个实验中,对于处理过的样品相对于未处理过的测定cfus的降低百分比。此处对于每个菌株报道观察到的值范围(跨越3次独立实验)。每个菌株的血清型在圆括号中指示。δplyss1针对19个不同血清型的其他猪链球菌菌株以及其他革兰氏阳性菌物种的实验对象组进行进一步测试。使用与上文相同的溶素浓度。对于每个剂量,在1小时后观察到的裂解值在表3和表4中列出,并且信息在图21中图解概括。表3其他猪链球菌菌株的分析st12参见下文标题****使多个猪链球菌分离物暴露于(在最佳缓冲条件下)上述浓度的△plyss1。这些细菌中的大多数是所示血清型未命名的临床分离物(例如st1,st2等等…)。对于命名的菌株,血清型在圆括号中给出。对于每个△plyss1浓度(代表单次实验)给出1小时处理过/未处理过的od600-比率,并且菌株以敏感性降低的次序列出。对于菌株st12,不可能进行od分析。在△plyss1(所有上述浓度)添加后,细胞将快速自粘且从悬浮液中沉降。这个现象对于未处理过的st12细胞未观察到。表4其他革兰氏阳性菌的分析所有猪链球菌菌株都证实一定程度的敏感性。有利的是,许多非猪链球菌(和甚至一些非链球菌)也在相称的酶浓度下裂解。如上文结果证实且描述的,plyss1溶素酶具有不仅针对猪链球菌,还针对众多链球菌属菌株包括b组链球菌和另外针对其他病原体的广泛和等价的杀死活性,所述其他病原体特别包括金黄色葡萄球菌、肠球菌属、芽孢杆菌属和李斯特菌属。通常,当从其宿主物种内到其外部时,噬菌体溶素证实活性的显著降低。然而,此处,广泛范围的敏感性在非猪链球菌细菌中可见,其中一些证实与猪链球菌自身相同的裂解。实施例3cfu杀死测定法当暴露于在15mmpb,ph8.0中的32ug/mlplyss2共60分钟时,测定猪链球菌s735和7997的特异性杀死和菌落形成单位(cfu’s)的下降(图22)。实施例4抗性的评价为了测试敏感细菌中对猪链球菌溶素的抗性的发展,使葡萄球菌属金黄色葡萄球菌菌株mw2和8325以及化脓性链球菌菌株5005各自暴露于渐增浓度的plyss2。金黄色葡萄球菌菌株无一在研究过程期间发展抗性(图23)。根据用于发展莫匹罗星抗性菌株的确定方案(rouse,m.s.等人(2005)antimicrobagentschemother49(8):3187-3191;pastagiam等人(2011)antimicrobagentschemother55(2):738-44),金黄色葡萄球菌菌株mw2和8325以及化脓性链球菌5005菌株在plyss2的存在下生长。plyss2的浓度从plyss2针对每个菌株的最小抑制浓度(mic)的1/32开始每天倍增经过8天时期至其4×mic。最初,以5×108cfu/ml的细菌细胞在1/32×micplyss2的存在下在mhb中在37℃下生长过夜。这些细胞以900rcf离心10分钟,并且分成两个等分试样。一个等分试样10倍稀释到新鲜的mhb培养基中,具有plyss2先前浓度的两倍;另一个等分试样的部分在含有plyss2的mic的mha平板表面上铺展,以筛选抗性克隆。每个菌株的分开培养物在莫匹罗星的存在下以与阳性对照相同的方式生长。在这个实验中,通过检测在圆形聚苯乙烯平板孔底部中的团块形成来测定mics。每天,来自每个培养物的1.0μl样品在含有mic的每个培养物暴露于其的各自药物的选择性平板上铺展。通过如上所述对于每次连续传代的微量稀释,每天就4个菌落/培养物进行测试plyss2或莫匹罗星的mic(wiegard,i等人(2008)natprotoc3(2):163-175),以测定抗性(定义为mic中的4倍增加)克隆是否已出现。该程序用莫匹罗星和每个菌株作为阳性对照进行重复。实施例6口腔微生物群研究使用大鼠口腔微生物群研究来评价猪链球菌溶素对天然细菌菌群的作用。血琼脂平板用来自两只大鼠的口腔的拭子进行划线培养。培养物通过两个传代循环从每块平板中分离,并且在bhi肉汤中生长过夜。第二天,将1ml每个培养物在干bhi琼脂平板上铺平板,导致这些培养物在琼脂上的菌苔。在它们干燥后,将10μlplyss2置于作为对照的中心10μlddh2o滴的任一侧上。在6个培养物中,在plyss2滴周围的清除区仅在一个培养物上出现(数据未显示)。这个培养物发送且证实为金黄色葡萄球菌。对来自harlan的3只大鼠、4只charlesriver和来自charlesriver的2只分开大鼠各自的口腔进行擦拭。黄色菌落在用来自每只大鼠的拭子划线培养的每块甘露醇盐平板上生长,指示它们都在口中含有金黄色葡萄球菌(数据未显示)。实施例7mrsa小鼠脓毒病模型针对金黄色葡萄球菌的plyss2溶素活性已在mrsa小鼠脓毒病模型中进一步评估。在mrsa小鼠脓毒病模型中,敏感小鼠(fvb/nj小鼠,重量范围15-20g)用在溶于pbs中的5%猪胃粘蛋白中的500μl5×105(approxld100)mrsa细胞/ml进行腹膜内(ip)注射。在3小时后,所有小鼠都在其器官(包括脾、肝、肾和心脏/血液)中是具有mrsa菌血症的。为了测定这个模型中的plyss2活性,在注射mrsa后3小时ip注射2mg/ml的500μlplyss2。这导致在每只测试小鼠的血流内的~1mg/mlplyss2。对照小鼠用500μlpbs注射。经过十天评估存活。对照小鼠在18-20小时内死亡。这个研究获得有希望的结果,显示用plyss2处理的小鼠的惊人存活(图25)。实施例8伤口感染模型猪链球菌溶素在大鼠中的mrsa伤口感染模型中进行测试。在这个模型中,沿着大鼠的背侧制备3厘米切口。随后,在脊斜肌内切割长1cm、深1cm的切口。随后将以1×108cfu’s/ml(总共5×106cfu’s)的50μlmrsa接种到伤口内。在3-5分钟后,测试大鼠用以10mg/ml的500μlplyss2处理。在另外3-5分钟后,将伤口用缝合钉关闭,并且将100μlplyss2以10mg/ml加入伤口外部。多加小心以确保当伤口用缝合钉密封时,细菌和溶素无一逃出伤口。在10天后,在感染部位内检查mrsa的cfus。在前2轮测试中,plyss2显示对背侧伤口中的mrsa具有有害作用,与对照大鼠相比较,在plyss2处理的大鼠中mrsa的cfu’s下降3-4对数。动物实验通过测定在大鼠伤口中引起感染所需的mrsa的感染剂量起始动物实验。我们发现即使在最高达109cfus的剂量下,也未发生感染。然而,当我们添加异物(无菌玻璃珠)时,感染在<108cfus下发生。具体地,在大鼠背部作出切口(长度5-6cm),并且在下面的组织中作出2-3mm切口。向其中加入100mg无菌砂和50μlmrsa。将伤口用缝合钉关闭,并且动物跟踪10天,并且将伤口打开且检查肉眼变化且获得组织样品用于细菌检查。结果仅接受无菌砂的对照动物显示无罕见特征和无细菌污染的正常愈合。接受mrsa的动物显示透明脓肿形成,坏死组织和脓液。得自打开伤口的样品(称重且匀浆化的组织)获得约107cfumrsa/克组织。这个模型是非常重现性的,在至少10只动物中获得相同结果。处理我们使用如上所述的模型以用plyss2溶素处理,以测定处理的效应。在这种情况下,在mrsa给药后10分钟,接受mrsa和砂的一半动物用在50ul磷酸盐缓冲液(pb)中的10mgplyss2处理,对照动物接受pb代替。动物跟踪10天。在这时,动物就肉眼变化和微生物学进行分析。对照动物中的伤口显示出粘液、坏死和愈合不良。这与用单个剂量的plyss2处理的动物形成鲜明对比。这些伤口不显示出脓液或坏死且显示出更佳愈合。结果如表5中可见的,用缓冲液单独处理的大鼠伤口显示出4.27x106cfu/克组织mrsa的平均值,而用plyss2处理的动物具有1.41x102cfu/克组织的平均值,mrsa>4对数的减少。这个数字低于4对数,因为大多数plyss2处理的伤口低于我们的可检测极限。表5在用plyss2或缓冲液处理后的大鼠mrsa伤口感染plyss2cfu/克缓冲液cfu/克p1<5.00e+01b11.80e+05p2<5.00e+01b21.18e+06p33.20e+02b32.05e+05p43.20e+02b47.25e+06p5<5.00e+01b53.20e+05p6<5.00e+01b61.40e+07p79.10e+01b75.80e+05p8<5.00e+01b83.00e+05p95.00e+01b99.60e+06p10<5.00e+01b104.40e+06p11<5.00e+01b112.94e+06p128.40e+02b124.81e+06p13<5.00e+01b135.83e+06p14<5.00e+01b142.82e+06p15<5.00e+01b159.63e+06平均值*1.41e+02平均值4.27e+06相对于对照的cfu减少3.02e+04<=cfu低于检测水平在平板上无生长*并非真实平均值,因为<实际#实施例19mrsa的体内鼻去定殖mssa和mrsa在人鼻前孔中的携带是金黄色葡萄球菌感染的主要储库。研究已显示大致80%的群体可以由金黄色葡萄球菌鼻定殖,并且定殖可以是发展其他更严重的金黄色葡萄球菌感染的增加的危险因素(kluytmans,j.,a.vanbelkum(1997)clinmicrobiolrev10(3):505-520)。事实上,鼻定殖的评价在美国医院中的重症护理设置入院时进行研究。在社区或医院设置中的鼻携带的消除因此可能可以减少感染危险,并且减慢药物抗性金黄色葡萄球菌的传播。为了研究猪链球菌溶素减少鼻粘膜的mrsa定殖的能力,c57bl/6j小鼠用~2x107自发链霉素抗性mrsa菌株(191-smr)进行鼻内接种。感染后二十四小时,小鼠每小时将磷酸盐缓冲盐水(对照)或plyss溶素的三个剂量(1mg)施用到鼻道内。末次处理后一小时,将小鼠处死且在spectramrsa琼脂上(开发的选择性生色培养基,以诊断检测mrsa鼻定殖)和哥伦比亚血琼脂计数细菌菌落。执行三次独立实验,以评估关于每个处理组的至少10只小鼠。测定在用猪链球菌溶素处理后在鼻粘膜上的平均cfu中的显著减少。参考文献1.beres,s.b.,j.m.musser.contributionofexogenousgeneticelementstothegroupastreptococcusmetagenome.plosone,2007.2(8):1-14.2.cantin,m.,j.harel,r.higgins,m.gottschalk.antimicrobialresistancepatternsandplasmidprofilesofstreptococcussuisisolates.journalofveterinarydiagnosticinvestigation,1992.4:170-174.3.fischetti,v.a.bacteriophagelysinsaseffectiveantibacterials.currentopinioninmicrobiology,2008.11:393-400.4.nelson,d.,l.loomis,v.a.fischetti.preventionandeliminationofupperrespiratorycolonizationofmicebygroupastreptococcibyusingabacteriophagelyticenzyme.proceedingsofthenationalacademyofsciencesoftheunitedstatesofamerica,2001.98:4107-4112.5.sriskandan,s.,j.d.slater,invasivediseaseandtoxicshockduetozoonoticstreptococcussuis:anemerginginfectionintheeast?plosmedicine,2006.3(5):585-587.6.wang,i.n.,d.l.smith,r.young,holins:theproteinclocksofbacteriophageinfections.annualreviewofmicrobiology,2000.54:799-825.实施例20具有广泛裂解活性的细菌噬菌体溶素plyss2保护不受混合的甲氧西林抗性金黄色葡萄球菌和化脓性链球菌感染甲氧西林抗性金黄色葡萄球菌(mrsa)和化脓性链球菌(a组链球菌-gras)引起几种严重的人疾病。这些细菌病原体在已建立对主要抗生素的抗性的许多革兰氏阳性病原体中。存在对抗这些传染原的可替代疗法的需要。我们已开发具有针对下述的活性的新型细菌噬菌体(噬菌体)溶素:mrsa、万古霉素中度金黄色葡萄球菌、猪链球菌、李斯特菌属、溶血性葡萄球菌、表皮葡萄球菌、马链球菌、无乳链球菌、化脓性链球菌、血链球菌、g组链球菌、e组链球菌和肺炎链球菌。来自猪链球菌的这种噬菌体溶素命名为plyss2。与先前的外源溶素一致,plyss2不展示针对任何革兰氏阴性菌(例如埃希氏杆菌属、芽孢杆菌属或假单胞菌属)的活性。plyss2具有n末端半胱氨酸组氨酸氨肽酶(chap)结构域和c末端sh3b结合结构域。plyss2在50℃下30分钟、37℃24小时、4℃15天和-80℃>8个月是稳定的。它在10次冻融后维持完全活性。在128μg/ml时,plyss2能够使mrsa和化脓性链球菌的菌落形成单位(cfus)分别减少5对数和3对数。plyss2的最小抑制浓度(mic)对于mrsa是16μg/ml。单个2mg剂量的plyss2在混合mrsa和化脓性链球菌感染的小鼠败血病模型中保护24只小鼠中的22只。在连续增加暴露于plyss2后,mrsa和化脓性链球菌都不建立对plyss2的抗性,与mrsa对莫匹罗星那样。溶素仍未显示此类有效的广泛裂解活性;稳定性;和针对主要人细菌病原体的功效。plyss2是用于mrsa、化脓性链球菌和许多其他病原体的有希望的治疗学,而无抗性的发生。存在全世界引起疾病和感染的许多革兰氏阳性病原体,包括:化脓性链球菌、金黄色葡萄球菌、无乳链球菌、李斯特菌属及其他。它们引起多种疾病,并且存在对目前治疗的限制。超过30%的人群可能由化脓性链球菌在上呼吸道中定殖-唯一已知的良性定殖部位[1]。定殖的个体比严重患病的个人传播疾病的可能性小得多[1]。化脓性链球菌(a组链球菌-gras)每年感染超过750,000,000人[2-4]。每年,在≈650,000个进展至严重感染的病例中存在25%死亡率[2]。化脓性链球菌引起在上呼吸道中的咽头炎,和在人宿主的皮肤内的脓疱病[5]。由化脓性链球菌感染出现猩红热、丹毒、蜂窝织炎、坏死性筋膜炎和中毒性休克综合征及其他疾病。死亡率对于这些感染可以是极高的,包括对于坏死性筋膜炎的20%和对于中毒性休克综合征的50%[6]。风湿热、急性肾小球肾炎和强迫性障碍形式是与化脓性链球菌相关的非化脓性后遗症[7]。风湿热爆发自从二十世纪八十年代后已可见全世界的升高[8]。虽然罕见,但风湿热可以进展至严重疾病,如果它进入软组织深层[4]。在所有革兰氏阳性病原体中,金黄色葡萄球菌已变得最难以治疗。金黄色葡萄球菌是革兰氏阳性兼性厌氧菌,其引起人中的大多数葡萄球菌属感染。人鼻前孔(鼻孔)一般是金黄色葡萄球菌定殖的主要部位,连同身体上充当用于进入的另外部位的其他潮湿开口[9-12]。金黄色葡萄球菌通常引起免疫妥协个体中的严重继发感染,以及引起在其他方面健康的个体中的疾病。除了皮肤和软组织感染(sstis)外,它可以引起败血症、中毒性休克综合征和坏死性肺炎、坏死性筋膜炎和脓性肌炎、心内膜炎和脓疱病。这些感染通常用甲氧西林、莫匹罗星或万古霉素进行治疗。许多金黄色葡萄球菌菌株例如甲氧西林抗性金黄色葡萄球菌(mrsa)和万古霉素抗性金黄色葡萄球菌(vrsa)已进化出针对用作标准治疗的一种或多种抗生素的抗性[13],使得它们甚至更难以用可获得的抗微生物剂治疗[13]。关于众多医院内感染的成因病原体,mrsa占超过50%引起肺炎和败血病的金黄色葡萄球菌医院分离物[14]。进一步使该问题恶化,mrsa容易在医院中的患者之间传播[15]。加护病房中的所有菌血症病例中的接近一半通过mrsa引起,具有30-40%的死亡率[16,17]。它是下呼吸道感染、手术部位感染的主因,并且在美国单独具有≈19,000例死亡/年[14,18]。虽然健康护理相关的mrsa感染敏感患者,但社区相关的mrsa(ca-mrsa)感染在健康个体中出现[19,20]。ca-mrsa菌株看起来在人和动物模型中比常规mrsa菌株更有毒力和易传染,引起更严重的疾病[21-24]。ca-mrsa的不同菌株在欧洲、北美洲、大洋洲及其他地区是流行病[20,25,26]。mw2菌株(脉冲场类型usa400)是原型ca-mrsa,已促成ca-mrsa在美国的初始爆发,从而导致流行病[19,27]。β溶血性革兰氏阳性链球菌属,无乳链球菌(b组链球菌-gbs)含有抗吞噬荚膜作为其主要毒力因子[28,29]。无乳链球菌可以存在于人胃肠系统中,偶然定殖次级部位如在超过33%女性的阴道中[30,31]。定殖无乳链球菌可以在出生过程中感染新生婴儿,导致细菌性败血病,使得早期发作的无乳链球菌成为过去四十年新生儿中的死亡主因[32-34],[35]。目前实践标准使母亲暴露于进一步抗性可能性的抗生素。近期革兰氏阳性病原体爆发涉及李斯特菌属,并且在美国如从2011年7月到11月杀死29人-在美国自从二十世纪七十年代后最致命的食源性疾病爆发[36]。大多数个体在消费污染的食物后接触李斯特菌病,即使用抗生素疗法也面临20-30%的死亡率[37,38]。李斯特菌属在食物加工系统和人胃肠道中良好存活,容易适应ph、盐度和温度中的快速变化[37,39,40]。存在许多其他革兰氏阳性人病原体,包括:血链球菌(牙菌斑和龋齿);血链球菌(心内膜炎);g组链球菌;e组链球菌;和肺炎球菌(肺炎、中耳炎、脑膜炎、菌血症、败血症、心内膜炎、腹膜炎和蜂窝织炎)。动物传染性革兰氏阳性病原体包括:马链球菌(在马科例如马中的腺疫-上呼吸道感染);和猪链球菌(在猪和人中的败血症和脑膜炎)。致病性猪链球菌血清型9菌株7997已与渐增的从猪到人的动物传染病传播报道相关[41]。人和猪已用青霉素或庆大霉素进行治疗,但存在对这些抗生素抗性的猪链球菌分离物[42]。猪链球菌可能在未来数年在人群中发展出稳定存在。在所有这些革兰氏阳性微生物中存在抗生素抗性的急剧增加。因此,必须开发可替代疗法以治疗细菌病原体。新型抗微生物剂来源包括基于酶的抗生素(“酶抗生素”),例如噬菌体裂解酶(也称为内溶素或“溶素”)。作为新型抗微生物剂,溶素近期已获得许多关注(在[18,43,44]中综述)。在细菌噬菌体病毒在宿主内复制后,它们的子代必须逃跑。噬菌体编码在细菌膜中打开孔的穿孔素和破坏细菌壁中的键被称为溶素的肽聚糖水解酶[45]。因为革兰氏阳性菌对其环境是低渗的,所以细胞壁的破坏导致细菌的渗透性裂解和子代病毒的释放[18]。这些肽聚糖水解酶(催化多种特定键)由基本上所有双链dna噬菌体编码。溶素可以由细菌基因组内的病毒原噬菌体序列克隆,在大肠杆菌中重组表达,纯化且用于治疗[46]。当外源应用时,这些蛋白质能够接近革兰氏阳性细菌的细胞壁的键,因为这些物种的肽聚糖与细胞外间隙是连续的[18]。溶素比任何已知的非化学试剂生物化合物更快速地杀死细菌[47-49]。溶素已显示证实针对众多革兰氏阳性病原体的高致死活性-一般地,编码噬菌体感染的物种或紧密相关的生物体[18,47]。已提出作为潜在的enzybiotic试剂,溶素因其针对特定细菌证实的效力和特异性而值得注意[47,48,50,51]。像这样,与更广谱作用的抗生素相比较,它们应对宿主中的正常非致病性菌群具有更不显著的影响[18]。迄今为止,没有溶素已显示针对多个细菌病原体物种的广泛体内活性。已开发针对mrsa的溶素,包括clys(先前在我们实验室开发的葡萄球菌属特异性嵌合溶素)[50]。溶素已通过病毒在亿万年感染细菌的进化斗争中进化。因此,对于它们存在选择对于正常细菌功能必需的特征的进化压力-并且因此,不太可能改变。两种感染猪链球菌的噬菌体先前已得到分离和研究。harel等人由血清型2菌株89-999的基因组诱导长尾病毒原噬菌体,尽管其溶素身份有待确定[52]。最近以来,ma和lu分离来自健康猪的鼻拭子的裂解性噬菌体,测序其36kb基因组[53]。称为smp的这种噬菌体证实有限的宿主范围,仅感染在血清型2内的2/24个猪链球菌菌株。相同团队以后pcr克隆且重组表达smp溶素(lysmp);该酶证实在体外针对几个猪链球菌血清型的细菌裂解活性。lysmp作为重组蛋白质,无法单独正确折叠且仅在还原剂的存在下是活性的,这可能限制其用于体内试验的潜力[54]。在ncbi数据库中存在超过11个完成的猪链球菌基因组。分析猪链球菌菌株的序列,以鉴定在原噬菌体区域内的候选潜在噬菌体溶素,并且最终鉴定,分离,克隆且表征来自猪链球菌的新噬菌体溶素(称为plyss2)(参见上文实施例)。现在提供另外的表征包括plyss2针对mrsa和化脓性链球菌的急性活性。材料与方法细菌菌株:所有菌株都贮存于-80℃(表6)下。葡萄球菌属、链球菌属、李斯特菌属、肠球菌属、假单胞菌属、芽孢杆菌属物种在脑心浸液(bhi)培养基中培养。大肠杆菌在luriabertain(lb)培养基中生长。所有培养基都得自becton,dickinson,andcompany(sparks,md),除非另有说明。细菌维持在37℃下。过夜培养物在37℃下生长,并且需要时以200rpm振荡。表6菌株列表a1,therockefelleruniversitycollection;2,olafschneewind,universityofchicago,chicago,il;3,barrykreiswirth,publichealthresearchinstitute,newjersey;4,alexandertomasz,therockefelleruniversity;5,atcc;6,jaapa.wagenaar,utrechtuniversity,utrecht,荷兰.cfu研究。将对数期细菌在缓冲液a中重悬浮至od6000.1(=0.5mcfarland≈108cfu/ml)。plyss2以128μg/ml对于每个测试生物体一式三份地加入聚丙烯微量滴定板(costar)中。将平板密封且在37℃伴随每5分钟振荡温育1小时。在1小时温育后,将细胞以10倍增量连续稀释,并且在bhi上铺平板。关于每个菌株的一式三份对照用缓冲液b替换plyss2执行。mic研究。遵循wiegand,等人测定最小抑制浓度的方案,伴随下文详述的调整[57]。在无菌过滤的溶素或媒介物以合适浓度加入后,产生在mhb(或对于化脓性链球菌的bhi)中≈5×105细胞/ml的最终悬浮液[57]。这些测试在96孔微量滴定板内分布。在这个实验中通过检测在圆形聚苯乙烯平板孔底部中的团块形成来测定mic’s。它们也用比色确认。体内鼠模型。rockefelleruniversity’sinstitutionalanimalcareandusecommittee批准所有体内方案。在daniel,a.等人中所述的全身感染模型用于测试plyss2针对多种革兰氏阳性菌的体内功效[50]。简言之,4-5周龄的雌性fvb/nj小鼠(重量范围15-20g)得自thejacksonlaboratory(barharbor,me)。在适应期后,小鼠用由在盐水中的5%猪胃粘蛋白(sigma)稀释的0.5ml对数中期(od6000.5)细菌进行腹膜内(ip)注射。细菌悬浮液含有~5x105cfu/mlmw2、pvl毒素编码mrsa菌株、~1x107mgas5005、在人和小鼠(musser)中剧毒的化脓性链球菌的m1血清型、或同时以上述浓度的两种细菌的组合用于混合感染实验。实际细菌接种滴度通过对于每个实验的系列稀释和铺平板至哥伦比亚血琼脂平板进行计算。小鼠在一至三小时内变得菌血症,并且在其器官(包括脾、肝、肾和心脏/血液)中含有mrsa和/或化脓性链球菌([50],和未公开的观察)。感染后三小时,将动物分成4-5个处理组,并且腹膜内施用0.5ml20mm磷酸盐缓冲液、2mg/ml链球菌属溶素plyc[59]、2mg/mlclys[50]、2-4mg/mlplyss2、或2mg/mlplyc和2mg/mlclys的组合。对于前24小时每12小时监控关于每个实验组的存活率,随后每24小时一直到感染后10天。数据通过卡普兰迈耶存活曲线进行统计分析,并且使用prism计算机程序(graphpadsoftware;lajolla,ca)对于95%置信区间执行logrank检验。结果plyss2的广泛裂解活性。所有测试的金黄色葡萄球菌菌株都对plyss2裂解高度敏感(图25)。这包括对甲氧西林、万古霉素、达托霉素、莫匹罗星和溶葡萄球菌酶抗性的菌株。针对万古霉素中度金黄色葡萄球菌(visa)和newman菌株的plyss2活性比针对其他菌株更不严重,但仍是强壮的。除了金黄色葡萄球菌外,其他葡萄球菌属物种(表皮葡萄球菌和溶血性葡萄球菌)同样是敏感的。plyss2显示出针对其天然物种猪链球菌的常规活性。两个李斯特菌属菌株显示出来自plyss2的显著裂解,但其他李斯特菌属菌株对plyss2处理是不受影响的。在较小程度上,plyss2具有针对马链球菌兽疫亚种、马链球菌、无乳链球菌ii型(被膜包裹的)和无乳链球菌090r的活性。值得注意的是,plyss2还具有针对所有化脓性链球菌菌株的活性。这包括血清型m1、m3、m4、m6、m18、m49和无m蛋白质的变体。非被膜包裹的、有荚膜的和类粘蛋白菌株化脓性链球菌都展示可比较的对plyss2的敏感性。存在展示比上文那些更少的裂解的许多物种。它们是血链球菌、g组链球菌、e组链球菌、粪肠球菌和一个肺炎链球菌菌株。格氏链球菌是唯一plyss2针对其具有大量活性的共栖体。如预期的,革兰氏阴性肽聚糖周围的外膜阻止plyss2展示针对埃希氏杆菌属、芽孢杆菌属或假单胞菌属的活性。plyss2的活性在使用相同细胞批的同时、平行测试中与clys的那种相当(数据未显示)。各自的活性是可比较的,但plyss2明显更易于处理;我们继续追踪plyss2作为针对mrsa的治疗学。常规地,噬菌体溶素证实针对在其宿主物种外的样本的活性的显著降低。然而,此处,广泛范围的敏感性在非猪链球菌细菌中可见,其中一些证实比猪链球菌更敏感。plyss2针对革兰氏阳性病原体的功效。plyss2展示减少单核细胞增多性李斯特菌、无乳链球菌、金黄色葡萄球菌和化脓性链球菌数目中的显著活性(图26)。它减少所有测试的无乳链球菌和单核细胞增多性李斯特菌菌株超过化脓性链球菌5005。阴性对照大肠杆菌在plyss2处理后在数目中未减少。plyss2关于病原体的micplyss2的mic对于单核细胞增多性李斯特菌和金黄色葡萄球菌相对很低(图27)。化脓性链球菌和无乳链球菌登记相似的plyss2的mics。关于阴性对照大肠杆菌的mic太高而无法计算。鼠混合mrsa和化脓性链球菌败血病模型。为了测定plyss2的广泛裂解活性是否可以提供不受单独或作为混合感染的革兰氏阳性病原体感染的体内保护,fvb/nj小鼠用~5x105cfumrsa菌株mw2、~1x107化脓性链球菌菌株mgas5005和/或两种细菌同时以上述浓度进行腹膜内注射。三小时后,将小鼠分成5个处理组,并且用20mm磷酸盐缓冲液,1mg对照葡萄球菌属溶素;clys,1mg对照链球菌属溶素;plyc,1mgclys+1mgplyc或plyss2(分别地,对于mrsa感染1mg或对于链球菌属和混合感染2mg)进行ip注射。小鼠随后就存活监控经过十天。合并来自4次独立实验的结果,并且用卡普兰迈耶存活曲线标绘小鼠存活数据(图28)。在单独mrsa感染二十四小时内,17/18只缓冲液对照小鼠和10/12只plyc链球菌属溶素处理的小鼠死于遍及其器官(包括脾、肝、肾和心脏/血液)的细菌性败血症。仅2/18只plyss2处理的小鼠在四十八小时死亡,剩余plyss2处理的小鼠存活经过10天实验过程,其中小鼠结果可与葡萄球菌属特异性溶素比较:clys(24/28,86%)相对于plyss2(16/18,88%)(图28a)。用化脓性链球菌单独感染的小鼠趋于以更慢的速率死亡,14/15只缓冲液处理的小鼠和12/12只clys葡萄球菌属特异性溶素处理的小鼠分别到第三和四天时死亡。相反,仅1/16只plyss2小鼠到第三天时死亡,剩余部分存活(15/16,94%),以给出与链球菌属特异性溶素plyc(12/12,100%)可比较的结果(图28b)。为了模拟混合细菌感染,小鼠用来自上文细菌接种物的mrsa和化脓性链球菌的混合物进行ip注射。用缓冲液或单个特异性溶素对照的处理不显著延长小鼠存活。大多数plyc(15/18)和缓冲液(21/23)处理的小鼠分别在24和48小时内死亡(图28c)。虽然用clys处理的混合感染动物更慢死亡,其中14/16只到第4天时死亡,类似于仅由化脓性链球菌感染的小鼠。与对照形成对比,大多数plyss2处理的小鼠幸免于混合感染(22/24,92%),并且与同时用clys+plyc处理的小鼠(16/20,80%)则是可比较的(如果并非优于它)(图28c)。plyss2证实在mrsa菌株中相对于抗生素的快速杀死都证实对于plyss2的相似mic值(约32μg/ml)的几个mrsa菌株(菌株245、223、926和932)通过在plyss2和万古霉素抗生素(1μg/ml)之间的比较就对数杀死进行测试。约5x105细菌的培养物在mhb培养基中在50ml锥形管中在37℃振荡225rpms下生长最高达6小时,与单独的plyss2、单独的万古霉素或无添加物组合。在多个时间点(15分钟、30分钟、1小时、2小时、3小时、4小时、5小时和6小时)取出等分试样样品(约300μl)。通过将活性炭溶液加入所有等分试样样品中灭活裂解酶或抗生素。将样品稀释且在琼脂平板上铺平板,以测定活细菌细胞计数。cfu中的对数减少在图29中描绘。plyss2提供快速和有效的杀死,相对于护理标准抗生素万古霉素对测试且描绘的所有mrsa菌株具有增强的活性。讨论新型天然猪链球菌溶素plyss2在本文中证实在体内展示针对多个革兰氏阳性病原体包括化脓性链球菌和金黄色葡萄球菌的广泛裂解活性。这种溶素首先展示此类混杂活性;所有先前表征的溶素都展示针对窄谱物种的活性[48,50,61-64]。clys已显示清除败血病mrsa感染[50],然而,迄今为止,没有溶素已显示清除超过一种败血病感染,并且无一已清除任何种类的混合感染。plyss2清除葡萄球菌属和链球菌属的混合感染的能力来自其广泛裂解活性。尽管plyss2的体外活性针对mrsa比化脓性链球菌更强,但本文提供的体内数据证实其作为针对两种细菌的有效治疗学的功效。这可能是由于与影响底物可接近性的化脓性链球菌相比较,金黄色葡萄球菌细胞壁的结构或组成的差异。plyss2针对其具有活性的所有革兰氏阳性病原体已发展针对常规抗生素的抗性。化脓性链球菌和mrsa都不能建立对plyss2的抗性。许多溶素(包括plyss2)的强度是其特异性。抗生素非特异性作用,杀死共栖微生物连同靶病原体。这导致许多负面副作用(例如腹泻),并且抗生素可以允许机会致病菌(例如难辨梭菌(clostridiumdifficile))引起全新的感染。溶素可以用于治疗单一病原体而不破坏整个细菌菌群[18]。许多先前描述的溶素的特异性也可以是局限性,因为将需要多种溶素以治疗多种病原体。我们的发现提供可以用于治疗许多病原体同时保留特异性程度的单一溶素。plyss2针对多种革兰氏阳性病原体是活性的,留下革兰氏阴性细菌不受影响。plyss2可以充当用于由金黄色葡萄球菌和/或化脓性链球菌引起的感染的可行治疗,例如:猩红热;丹毒;蜂窝织炎;坏死性筋膜炎;心内膜炎;菌血症/败血症;多种形成脓肿和不形成脓肿的sstis;和脓疱病。针对新生儿败血病和食源性疾病的治疗也是可应用的,因为它展示针对无乳链球菌和单核细胞增多性李斯特菌比它针对化脓性链球菌5005更多的体外活性(图25-27)。作为溶素,plyss2快速杀死其靶,比抗生素快速得多(图29)。plyss2仅必须接触外部细胞壁的键以介导其效应;常规抗生素必须以高浓度保留延长时期,导致许多副作用。这个特征已允许噬菌体溶素在过去治疗全身感染[48,61]。如本文证实的,plyss2能够使用单个剂量的plyss2清除来自高百分比小鼠的败血病mrsa和化脓性链球菌感染。此外,与关于对照的~4%清除率相比较,用单个剂量的plyss2从~92%的小鼠中清除混合败血病mrsa和化脓性链球菌感染。进一步增强的杀死或清除率可以起于增加或重复的剂量。plyss2比先前开发的溶素更易于处理和稳定。plyss2制备是直接的,在少数步骤中获得大数量。此外,高度可溶的溶素是必需的,因为它允许以高浓度直接使用。值得注意的是,plyss2在超过20mg/ml的浓度中保持可溶(数据未显示),其是比在数分钟左右产生靶生物体的对数倍数杀死所需的更浓缩的数量级。plyss2还在开发为评估溶素的多个体外测定法中表现良好。可以对它实施长时间段的高或低温,即使当反复冻融时对其活性也具有很少影响。plyss2的稳定性高度适合于作为治疗学的生产和分配。对plyss2活性具有作用的dtt的缺乏指示[1]溶素不依赖二硫桥,和[2]它在重组表达和纯化后正确折叠。考虑到lysmp必须在使用前用还原剂处理,后面一点是有意义的[54]。关于两个同源溶素之间的这个差异的原因仍不明了,尽管它可能涉及在蛋白质之间的许多可变半胱氨酸残基。edta诱导的plyss2抑制暗示它可能依赖二价阳离子作为辅因子。两种溶素先前已显示具有针对多个物种的裂解活性,但溶素无一在体内针对超过一个物种进行测试[65,66],并且每种溶素保持针对它由其克隆的物种(肠球菌属或炭疽杆菌)的更多活性,而plyss2具有针对金黄色葡萄球菌比猪链球菌更多的活性。与其新型广泛裂解活性一致,plyss2代表分歧类别的原噬菌体裂解酶结构。chap结构域包括在几种先前表征的链球菌属[59,67]和葡萄球菌属[50,68]噬菌体溶素中。然而,在一级序列水平上,plyss2的chap结构域与其他数据库chap结构域更分歧(所有配对e值>10-15)。在图30中,plyss2的chap结构域与良好表征的链球菌属plyc溶素的那种比对,证实保守催化残基,但总体仅适度的同一性水平(28%序列同一性,e值=10-8)[59]。chap结构域是催化多样的,并且取决于特定溶素,可以具有丙氨酸酰胺酶[47]或横桥内肽酶活性[50]。进一步地,在猪链球菌中的肽聚糖横桥的分子性质可以在菌株之间改变[69]。chap结构域介导plyss2的催化活性,但可能不完全赋予特异性。已认为噬菌体溶素结合结构域决定溶素特异性[70,71]。溶葡萄球菌酶含有sh3样结合结构域,其推测结合细菌细胞壁肽聚糖中的横桥[71]。sh3结构域在病毒和细菌细胞壁结合蛋白质中是常见的,尽管确切分子靶仍未知[72]。sh3b(sh3结构域的细菌同源物)已显示结合金属和多肽[73,74]。蜡状芽孢杆菌内肽酶的sh3b结构域已显示结合肽聚糖茎中的n末端丙氨酸的游离胺基团[75],并且这个胺基团是关于plyss2sh3b结构域的可能底物。横桥在所有plyss2敏感样本中极大改变,因此它不太可能是关于plyss2sh3结合结构域的靶。这些横桥可以获得导致溶葡萄球菌酶抗性的变异,然而,plyss2显著地展示针对溶葡萄球菌酶敏感和溶葡萄球菌酶抗性(lyra)金黄色葡萄球菌菌株的活性。plyss2具有针对两个不同系统发育目的活性:芽孢杆菌目(葡萄球菌属、李斯特菌属等)和乳杆菌目(链球菌属、肠球菌属等)。肽聚糖茎在这两个目之间是相似的,但它们的横桥在组成和长度中广泛改变[76,77]。噬菌体溶素先前未展示对不同科或属的活性(且依赖不同物种)[50]。天然噬菌体溶素通常显示针对天然噬菌体感染的物种的物种特异性[48,61]。测试的所有金黄色葡萄球菌菌株包括对甲氧西林(mrsa)、万古霉素(visa)、莫匹罗星、达托霉素和溶葡萄球菌酶抗性的菌株都对plyss2诱导的裂解敏感。plyss2以相似功效裂解致病性猪链球菌7997。仅裂解测试的6个菌株中的2个,针对李斯特菌属的plyss2活性较不确定。plyss2针对溶血性葡萄球菌、马链球菌兽疫亚种和马链球菌(staphylococcusequi)的活性提供关于结合结构域的底物存在于横桥外的进一步证据。围绕无乳链球菌的多糖荚膜增强其毒力。ii型无乳链球菌具有比大多数更厚的荚膜,并且具有相应更高的毒力水平[28]。具有更薄荚膜的无乳链球菌菌株具有更少毒力[29,78]。plyss2具有针对含和不含荚膜的这些可比较的活性:无乳链球菌_ii型、无乳链球菌090r。对于化脓性链球菌存在超过200个m类型[4]。值得注意的是,plyss2具有针对我们针对其测试的所有m类型的活性。针对血链球菌的plyss2活性指示其治疗牙菌斑的潜力。尽管plyss2展示针对格氏链球菌的活性,但它展示针对共栖菌丛口腔链球菌和变异链球菌的更少活性。存在针对g组链球菌、e组链球菌、粪肠球菌、肺炎链球菌、大鼠链球菌和远缘链球菌的适量活性。其他肺炎链球菌菌株较不敏感。plyss2针对多重耐药mrsa、重度荚膜化脓性链球菌和众多其他剧毒病原体阵列的活性使得它成为关键的治疗候选物。值得注意的是,plyss2能够减少多个菌株的cfu’s,所述菌株在抗药性、荚膜化和生物薄膜产生方面不同。plyss2针对类粘蛋白化脓性链球菌m4的活性比对于测试的任何其他化脓性链球菌观察到的更强。进一步地,plyss2具有针对无乳链球菌和单核细胞增多性李斯特菌比化脓性链球菌更大的活性(由此它能够保护败血病小鼠)。考虑到plyss2针对化脓性链球菌的功效,plyss2可以充当针对这些其他病原体中的任何的治疗剂。mic结果证实cfu发现。在鼠研究中,单一感染的动物证实plyss2可以独立地保护不受多个物种的细菌感染。在混合感染中,特异性溶素对照(plyc和clys)显示plyss2保护小鼠不受混合或双重感染中的两种生物体。使用plyc或clys治疗混合模型中的传染性病原体中的仅一种仍导致动物的死亡。进一步地,动物在与单一感染的未处理对照相同的时帧中死亡。金黄色葡萄球菌和化脓性链球菌在人中引起具有相似病理学和感染部位的疾病。健康护理提供者有时起初不确定哪种生物体引起疾病,其可以是严重创伤情况下的混合感染。严重侵入性化脓性链球菌感染不容易用抗生素治疗[82]。在一些情况下,它们需要外科手术[82]。在我们的败血病模型中使用的m1血清型是在全世界发现引起链球菌属咽头炎和侵入性疾病的主要临床分离物之一[83,84]。化脓性链球菌能够跨越上皮表面,产生侵入性菌血症[83]。这个及其他严重的内部感染导致在19%病例中少于一周内的死亡[85]。在许多情况下,不知道是金黄色葡萄球菌还是化脓性链球菌是在sstis或脓疱病后面的成因病原体。致病性靶(mrsa和化脓性链球菌)不能建立对plyss2的抗性与对于其他溶素包括plyg发现的一致[61]。迄今为止,可以外源分解溶素的分子仍未得到鉴定。考虑到肽聚糖的性质,病原体能够快速改变靶部位是不太可能的。极低的抗性概率使得plyss2成为引人注目的治疗学。一般给予莫匹罗星和多链丝霉素以治疗金黄色葡萄球菌,但它可以发展针对各自的抗性。它们是给予减少粘膜上的定殖致病菌的唯一抗感染药[86]。plyss2可以用于预防清除对抗生素抗性的致病菌的人粘膜储库。青霉素可以用于治疗化脓性链球菌,其仍是急性敏感的;但如果脓疱病由mrsa引起,则青霉素可能是无效的。近期研究已指示由肺炎链球菌、化脓性链球菌和mrsa引起的继发感染占流感流行的>90%死亡[92,93]。相同病原体在接近30%的2010年h1n1大范围流行病例中引起并发症[94]。预防使用可以降低这些死亡率。plyss2可以治疗原发感染且预防降低继发感染的可能性。在病原体鉴定前,考虑感染的性质和环境,护理标准是治疗最可能的候选物[95,96]。这些病原体中的许多尤其是mrsa快速发展针对常规和新型抗生素尤其是β-内酰胺的抗性。mrsa也针对最新的试剂、糖肽、噁唑烷酮是抗性的[97,98]。plyss2具有针对革兰氏阳性的特异性,但可以广泛治疗化脓性链球菌、mrsa及其他占优势的病原体。作为治疗,plyss2将靶向病原体,而不伤害革兰氏阴性细菌。这个新型能力位于分歧的chap结构域和独特的sh3结合结构域中。抗生素杀死许多物种加上靶病原体。先前,溶素仅可以针对一个致病性物种使用。plyss2在刚性溶素特异性和非选择性抗生素活性之间的谱中占据主要空间。理想地,治疗学具有针对所有主要病原体的活性,而不影响共栖体;plyss2首先指示溶素可以发挥该功能。plyss2是具有针对下述的广泛裂解活性的溶素:mrsa、visa、猪链球菌、李斯特菌属、溶血性葡萄球菌、马链球菌兽疫亚种、马链球菌、无乳链球菌、化脓性链球菌、血链球菌、格氏链球菌、g组链球菌、e组链球菌、粪肠球菌和肺炎链球菌。plyss2易于生产、易处理且非常稳定。plyss2保护败血病小鼠不受mrsa和化脓性链球菌的混合感染,并且这些病原体无一能够建立对plyss2的抗性。参考文献1.mandell,g.l.,等人mandell,douglas,andbennett'sprinciplesandpracticeofinfectiousdiseases.[bookreview(e-streams)]2005;6th:[availablefrom:e-streams.com/es0806_7/es0867_4196.html.2.carapetis,j.r.,等人,theglobalburdenofgroupastreptococcaldiseases.thelancetinfectiousdiseases,2005.5(11):第685-694页。3.cunningham,m.w.,pathogenesisofgroupastreptococcalinfections.clinmicrobiolrev,2000.13(3):第470-511页。4.bessen,d.e.,等人,wholegenomeassociationstudyontissuetropismphenotypesingroupastreptococcus.journalofbacteriology,2011:第jb.05263-11v1页。5.parker,m.t.,a.j.tomlinson,andr.e.williams,impetigocontagiosa;theassociationofcertaintypesofstaphylococcusaureusandofstreptococcuspyogeneswithsuperficialskininfections.jhyg(lond),1955.53(4):第458-73页。6.bisno,a.l.,m.o.brito,andc.m.collins,molecularbasisofgroupastreptococcalvirulence.lancetinfectdis,2003.3(4):第191-200页。7.swedo,s.e.,等人,identificationofchildrenwithpediatricautoimmuneneuropsychiatricdisordersassociatedwithstreptococcalinfectionsbyamarkerassociatedwithrheumaticfever.amjpsychiatry,1997.154(1):第110-2页。8.kavey,r.ande.l.kaplan,resurgenceofacuterheumaticfever.pediatrics,1989.84(3):第585页。9.white,a.andj.smith,nasalreservoirasthesourceofextranasalstaphylococci.antimicrobagentschemother(bethesda),1963.161:第679-83页。10.kluytmans,j.,a.vanbelkum,andh.verbrugh,nasalcarriageofstaphylococcusaureus:epidemiology,underlyingmechanisms,andassociatedrisks.clinmicrobiolrev,1997.10(3):第505-20页。11.voneiff,c.,等人,nasalcarriageasasourceofstaphylococcusaureusbacteremia.newenglandjournalofmedicine,2001.344(1):第11-16页。12.wertheim,h.f.l.,等人,theroleofnasalcarriageinstaphylococcusaureusinfections.lancetinfectiousdiseases,2005.5(12):第751-762页。13.howden,b.p.,等人,reducedvancomycinsusceptibilityinstaphylococcusaureus,includingvancomycin-intermediateandheterogeneousvancomycin-intermediatestrains:resistancemechanisms,laboratorydetection,andclinicalimplications.clinmicrobiolrev,2010.23(1):第99-139页。14.klein,e.,d.l.smith,andr.laxminarayan,hospitalizationsanddeathscausedbymethicillin-resistantstaphylococcusaureus,unitedstates,1999-2005.emerginfectdis,2007.13(12):第1840-6页。15.coates,t.,r.bax,anda.coates,nasaldecolonizationofstaphylococcusaureuswithmupirocin:strengths,weaknessesandfutureprospects.jantimicrobchemother,2009.64(1):第9-15页。16.tiemersma,e.w.,等人,methicillin-resistantstaphylococcusaureusineurope,2002.emerginfectdis,2004.10(9):第1627-34页。17.laupland,k.b.,t.ross,andd.b.gregson,staphylococcusaureusbloodstreaminfections:riskfactors,outcomes,andtheinfluenceofmethicillinresistanceincalgary,canada,2006.journalofinfectiousdiseases,2008.198(3):第336页。18.fischetti,v.a.,bacteriophagelysinsaseffectiveantibacterials.curropinmicrobiol,2008.11(5):第393-400页。19.fromthecentersfordiseasecontrolandprevention.fourpediatricdeathsfromcommunity-acquiredmethicillin-resistantstaphylococcusaureus--minnesotaandnorthdakota,1997-1999.jama,1999.282(12):第1123-5页。20.herold,b.c.,等人,community-acquiredmethicillin-resistantstaphylococcusaureusinchildrenwithnoidentifiedpredisposingrisk.jama:thejournaloftheamericanmedicalassociation,1998.279(8):第593-598页。21.adem,p.v.,等人,staphylococcusaureussepsisandthewaterhouse-friderichsensyndromeinchildren.nengljmed,2005.353(12):第1245-51页。22.miller,l.g.,等人,necrotizingfasciitiscausedbycommunity-associatedmethicillin-resistantstaphylococcusaureusinlosangeles.nengljmed,2005.352(14):第1445-53页。23.li,m.,等人,evolutionofvirulenceinepidemiccommunity-associatedmethicillin-resistantstaphylococcusaureus.procnatlacadsciusa,2009.106(14):第5883-8页。24.voyich,j.m.,等人,insightsintomechanismsusedbystaphylococcusaureustoavoiddestructionbyhumanneutrophils.jimmunol,2005.175(6):第3907-19页。25.vandenesch,f.,等人,community-acquiredmethicillin-resistantstaphylococcusaureuscarryingpanton-valentineleukocidingenes:worldwideemergence.emerginfectdis,2003.9(8):第978-84页。26.tristan,a.,等人,globaldistributionofpanton-valentineleukocidin--positivemethicillin-resistantstaphylococcusaureus,2006.emerginfectdis,2007.13(4):第594-600页。27.deleo,f.r.,等人,community-associatedmeticillin-resistantstaphylococcusaureus.lancet,2010.375(9725):第1557-68页。28.yeung,m.ands.mattingly,biosyntheticcapacityfortype-specificantigensynthesisdeterminesthevirulenceofserotypeiiistrainsofgroupbstreptococci.infectionandimmunity,1984.44(2):第217页。29.rubens,c.,等人,transposonmutagenesisoftypeiiigroupbstreptococcus:correlationofcapsuleexpressionwithvirulence.proceedingsofthenationalacademyofsciences,1987.84(20):第7208页。30.boyer,k.m.,等人,selectiveintrapartumchemoprophylaxisofneonatalgroupbstreptococcalearly-onsetdisease.ii.predictivevalueofprenatalcultures.journalofinfectiousdiseases,1983.148(5):第802页。31.meyn,l.a.,m.a.krohn,ands.l.hillier,rectalcolonizationbygroupbstreptococcusasapredictorofvaginalcolonization.americanjournalofobstetricsandgynecology,2009.201(1):第76.e1-76.e7页。32.lancefield,r.c.andr.hare,theserologicaldifferentiationofpathogenicandnon-pathogenicstrainsofhemolyticstreptococcifromparturientwomen.thejournalofexperimentalmedicine,1935.61(3):第335页。33.fry,r.m.,preventionandcontrolofpuerperalsepsis:bacteriologicalaspects.brmedj,1938.2(4049):第340-2页。34.hare,r.andl.colebrook,thebiochemicalreactionsofstreptococcifromthevaginaoffebeileandafebeileparturientwomen.thejournalofpathologyandbacteriology,1934.39(2):第429-442页。35.zangwill,k.,a.schuchat,andj.wenger,groupbstreptococcaldiseaseintheunitedstates,1990:reportfromamultistateactivesurveillancesystem.mmwr.cdcsurveillancesummaries:morbidityandmortalityweeklyreport.cdcsurveillancesummaries/centersfordiseasecontrol,1992.41(6):第25页。36.baertlein,l.,deathtollfromlisteriaoutbreakrisesto29,c.johnston,editor2011,reuters页。37.schuppler,m.andm.j.loessner,theopportunisticpathogenlisteriamonocytogenes:pathogenicityandinteractionwiththemucosalimmunesystem.intjinflam,2010.2010:第704321页。38.hof,h.,k.szabo,andb.becker,epidemiologyoflisteriosisingermany:achangingbutignoredpattern].deutschemedizinischewochenschrift(1946),2007.132(24):第1343页。39.ramaswamy,v.,等人,listeria--reviewofepidemiologyandpathogenesis.jmicrobiolimmunolinfect,2007.40(1):第4-13页。40.dieterich,g.,等人,leger:knowledgedatabaseandvisualizationtoolforcomparativegenomicsofpathogenicandnon-pathogeniclisteriaspecies.nucleicacidsresearch,2006.34(suppl1):第d402页。41.sriskandan,s.andj.d.slater,invasivediseaseandtoxicshockduetozoonoticstreptococcussuis:anemerginginfectionintheeast?plosmed,2006.3(5):第e187页。42.cantin,m.,等人,antimicrobialresistancepatternsandplasmidprofilesofstreptococcussuisisolates.jvetdiagninvest,1992.4(2):第170-4页。43.o'flaherty,s.,r.p.ross,anda.coffey,bacteriophageandtheirlysinsforeliminationofinfectiousbacteria.femsmicrobiolrev,2009.33(4):第801-19页。44.gonzálezvilla,t.andp.veiga-crespo,enzybiotics:antibioticenzymesasdrugsandtherapeutics2010,hoboken,n.j.:johnwiley&sons.x,284p.45.wang,i.n.,d.l.smith,andr.young,holins:theproteinclocksofbacteriophageinfections.annurevmicrobiol,2000.54:第799-825页。46.beres,s.b.andj.m.musser,contributionofexogenousgeneticelementstothegroupastreptococcusmetagenome.plosone,2007.2(8):第e800页。47.nelson,d.,l.loomis,andv.a.fischetti,preventionandeliminationofupperrespiratorycolonizationofmicebygroupastreptococcibyusingabacteriophagelyticenzyme.procnatlacadsciusa,2001.98(7):第4107-12页。48.loeffler,j.m.,d.nelson,andv.a.fischetti,rapidkillingofstreptococcuspneumoniaewithabacteriophagecellwallhydrolase.science,2001.294(5549):第2170-2页。49.fischetti,v.a.,bacteriophagelyticenzymes:novelanti-infectives.trendsmicrobiol,2005.13(10):第491-6页。50.daniel,a.,等人,synergismbetweenanovelchimericlysinandoxacillinprotectsagainstinfectionbymethicillin-resistantstaphylococcusaureus.antimicrobagentschemother,2010.54(4):第1603-12页。51.cheng,q.,等人,removalofgroupbstreptococcicolonizingthevaginaandoropharynxofmicewithabacteriophagelyticenzyme.antimicrobagentschemother,2005.49(1):第111-7页。52.harel,j.,等人,identificationofaninduciblebacteriophageinavirulentstrainofstreptococcussuisserotype2.infectimmun,2003.71(10):第6104-8页。53.ma,y.l.andc.p.lu,isolationandidentificationofabacteriophagecapableofinfectingstreptococcussuistype2strains.vetmicrobiol,2008.132(3-4):第340-7页。54.wang,y.,j.h.sun,andc.p.lu,purifiedrecombinantphagelysinlysmp:anextensivespectrumoflyticactivityforswinestreptococci.currmicrobiol,2009.58(6):第609-15页。55.holden,m.t.,等人,rapidevolutionofvirulenceanddrugresistanceintheemergingzoonoticpathogenstreptococcussuis.plosone,2009.4(7):第e6072页。56.chen,c.,等人,aglimpseofstreptococcaltoxicshocksyndromefromcomparativegenomicsofs.suis2chineseisolates.plosone,2007.2(3):第e315页。57.wiegand,i.,k.hilpert,andr.e.hancock,agarandbrothdilutionmethodstodeterminetheminimalinhibitoryconcentration(mic)ofantimicrobialsubstances.natprotoc,2008.3(2):第163-75页。58.rouse,m.s.,等人,invitroandinvivoevaluationsoftheactivitiesoflauricacidmonoesterformulationsagainststaphylococcusaureus.antimicrobagentschemother,2005.49(8):第3187-91页。59.nelson,d.,等人,plyc:amultimericbacteriophagelysin.procnatlacadsciusa,2006.103(28):第10765-70页。60.lucas,s.,a.copeland,a.lapidus,等人,sequencingofthedraftgenomeandassemblyofstreptococcussuis89/1591,inunpublished2004.61.schuch,r.,d.nelson,andv.a.fischetti,abacteriolyticagentthatdetectsandkillsbacillusanthracis.nature,2002.418(6900):第884-9页。62.o'flaherty,s.,等人,therecombinantphagelysinlyskhasabroadspectrumoflyticactivityagainstclinicallyrelevantstaphylococci,includingmethicillin-resistantstaphylococcusaureus.journalofbacteriology,2005.187(20):第7161-4页。63.zimmer,m.,等人,themureinhydrolaseofthebacteriophagephi3626duallysissystemisactiveagainstalltestedclostridiumperfringensstrains.applenvironmicrobiol,2002.68(11):第5311-7页。64.loessner,m.j.,等人,threebacilluscereusbacteriophageendolysinsareunrelatedbutrevealhighhomologytocellwallhydrolasesfromdifferentbacilli.jbacteriol,1997.179(9):第2845-51页。65.yoong,p.,等人,identificationofabroadlyactivephagelyticenzymewithlethalactivityagainstantibiotic-resistantenterococcusfaecalisandenterococcusfaecium.jbacteriol,2004.186(14):第4808-12页。66.yoong,p.,等人,plyph,abacteriolyticenzymewithabroadphrangeofactivityandlyticactionagainstbacillusanthracis.jbacteriol,2006.188(7):第2711-4页。67.baker,j.r.,等人,endopeptidaseandglycosidaseactivitiesofthebacteriophageb30lysin.applenvironmicrobiol,2006.72(10):第6825-8页。68.becker,s.c.,等人,lyskchapendopeptidasedomainisrequiredforlysisoflivestaphylococcalcells.femsmicrobiollett,2009.294(1):第52-60页。69.kilpperbalz,r.andk.h.schleifer,streptococcus-suissp-nov,nom-rev.internationaljournalofsystematicbacteriology,1987.37(2):第160-162页。70.hermoso,j.a.,等人,structuralbasisforselectiverecognitionofpneumococcalcellwallbymodularendolysinfromphagecp-1.structure,2003.11(10):第1239-49页。71.grundling,a.ando.schneewind,cross-linkedpeptidoglycanmediateslysostaphinbindingtothecellwallenvelopeofstaphylococcusaureus.journalofbacteriology,2006.188(7):第2463-72页。72.xu,q.,等人,structuralbasisofmureinpeptidespecificityofagamma-d-glutamyl-l-diaminoacidendopeptidase.structure,2009.17(2):第303-13页。73.pohl,e.,r.k.holmes,andw.g.hol,crystalstructureofacobalt-activateddiphtheriatoxinrepressor-dnacomplexrevealsametal-bindingsh3-likedomain.jmolbiol,1999.292(3):第653-67页。74.wylie,g.p.,等人,prolylpeptidebindingbytheprokaryoticsh3-likedomainofthediphtheriatoxinrepressor:aregulatoryswitch.biochemistry,2005.44(1):第40-51页。75.xu,q.,等人,structureofthegamma-d-glutamyl-l-diaminoacidendopeptidaseykfcfrombacilluscereusincomplexwithl-ala-gamma-d-glu:insightsintosubstraterecognitionbynlpc/p60cysteinepeptidases.actacrystallogrsectfstructbiolcrystcommun,2010.66(pt10):第1354-64页。76.vollmer,w.,d.blanot,andm.a.depedro,peptidoglycanstructureandarchitecture.femsmicrobiolrev,2008.32(2):第149-67页。77.schleifer,k.h.ando.kandler,peptidoglycantypesofbacterialcellwallsandtheirtaxonomicimplications.bacteriolrev,1972.36(4):第407-77页。78.wessels,m.r.,等人,definitionofabacterialvirulencefactor:sialylationofthegroupbstreptococcalcapsule.procnatlacadsciusa,1989.86(22):第8983-7页。79.robinson,j.m.,j.k.hardman,andg.l.sloan,relationshipbetweenlysostaphinendopeptidaseproductionandcellwallcompositioninstaphylococcusstaphylolyticus.jbacteriol,1979.137(3):第1158-64页。80.gargis,s.r.,等人,inhibitionoftheactivityofbothdomainsoflysostaphinthroughpeptidoglycanmodificationbythelysostaphinimmunityprotein.applenvironmicrobiol,2010.76(20):第6944-6页。81.rashel,m.,等人,efficienteliminationofmultidrug-resistantstaphylococcusaureusbyclonedlysinderivedfrombacteriophagephimr11.jinfectdis,2007.196(8):第1237-47页。82.young,m.h.,d.m.aronoff,andn.c.engleberg,necrotizingfasciitis:pathogenesisandtreatment.expertrevantiinfectther,2005.3(2):第279-94页。83.cole,j.n.,等人,molecularinsightintoinvasivegroupastreptococcaldisease.natrevmicrobiol,2011.9(10):第724-36页。84.steer,a.c.,等人,globalemmtypedistributionofgroupastreptococci:systematicreviewandimplicationsforvaccinedevelopment.lancetinfectdis,2009.9(10):第611-6页。85.lamagni,t.l.,等人,epidemiologyofseverestreptococcuspyogenesdiseaseineurope.jclinmicrobiol,2008.46(7):第2359-67页。86.hudson,i.r.,theefficacyofintranasalmupirocininthepreventionofstaphylococcalinfections:areviewofrecentexperience.jhospinfect,1994.27(2):第81-98页。87.loeffler,j.m.,s.djurkovic,andv.a.fischetti,phagelyticenzymecpl-1asanovelantimicrobialforpneumococcalbacteremia.infectimmun,2003.71(11):第6199-204页。88.loessner,m.j.,等人,c-terminaldomainsoflisteriamonocytogenesbacteriophagemureinhydrolasesdeterminespecificrecognitionandhigh-affinitybindingtobacterialcellwallcarbohydrates.molmicrobiol,2002.44(2):第335-49页。89.jado,i.,等人,phagelyticenzymesastherapyforantibiotic-resistantstreptococcuspneumoniaeinfectioninamurinesepsismodel.jantimicrobchemother,2003.52(6):第967-73页。90.grandgirard,d.,等人,phagelyticenzymecpl-1forantibacterialtherapyinexperimentalpneumococcalmeningitis.jinfectdis,2008.197(11):第1519-22页。91.witzenrath,m.,等人,systemicuseoftheendolysincpl-1rescuesmicewithfatalpneumococcalpneumonia.critcaremed,2009.37(2):第642-9页。92.morens,d.m.,j.k.taubenberger,anda.s.fauci,thepersistentlegacyofthe1918influenzavirus.nengljmed,2009.361(3):第225-9页。93.brundage,j.f.andg.d.shanks,whatreallyhappenedduringthe1918influenzapandemic?theimportanceofbacterialsecondaryinfections.jinfectdis,2007.196(11):第1717-8页;作者答复1718-9.94.bacterialcoinfectionsinlungtissuespecimensfromfatalcasesof2009pandemicinfluenzaa(h1n1)-unitedstates,may-august2009.mmwrmorbmortalwklyrep,2009.58(38):第1071-4页。95.cunha,b.a.,sepsisandsepticshock:selectionofempiricantimicrobialtherapy.critcareclin,2008.24(2):第313-34页,ix.96.dellinger,r.p.,等人,survivingsepsiscampaignguidelinesformanagementofseveresepsisandsepticshock.critcaremed,2004.32(3):第858-73页。97.wilson,p.,等人,linezolidresistanceinclinicalisolatesofstaphylococcusaureus.jantimicrobchemother,2003.51(1):第186-8页。98.huang,y.t.,等人,bacteremiaandinfectiveendocarditiscausedbyanon-daptomycin-susceptible,vancomycin-intermediate,andmethicillin-resistantstaphylococcusaureusstrainintaiwan.jclinmicrobiol,2008.46(3):第1132-6页。99.zhang,a.,yang,m.,hu,p.,wu,j.,chen,b.,hua,y.,yu,j.,chen,h.,xiao,j.andjin,m.comparativegenomicanalysisofstreptococcussuisrevealssignificantgenomicdiversityamongdifferentserotypebmcgenomics12,523(2011).本发明可以其他形式体现或以其他方式执行,而不背离其精神或基本特征。本公开内容因此在所有方面视为举例说明而不是限制性的,本发明的范围由附加权利要求指示,并且在等价含义和范围内的所有变化预期包含在其中。本说明书自始至终引用多个参考文献,其各自通过引用整体合并入本文。当前第1页12
相关技术
网友询问留言
已有0条留言
- 还没有人留言评论。精彩留言会获得点赞!
1