一种基于数字PCR定量检测病毒的方法与流程
本发明涉及生物技术领域,具体涉及一种基于数字pcr定量检测病毒的方法。
背景技术:
在核酸的体外检测领域,荧光定量pcr(qpcr)方法无疑是最主要的分子检测手段之一,其中包括了对病毒分子的定性和定量分析。
在对病毒核酸进行定量的过程中,病毒核酸的提取和纯化是非常关键的步骤,该步骤的主要目的之一为将病毒的核酸分子从蛋白类的衣壳内释放出来,满足下游检测的需要;目的之二为去除样品中对下游pcr反应有抑制作用的各种pcr抑制剂。
但在实际操作过程中,不同的纯化方法及核酸提取试剂盒在上述两方面的表现是不尽相同的。正由于此,qpcr对于病毒的定量结果往往与真实值存在差异且实验室间结果的一致性较差(inter-laboratoryvariability)。因此,针对某些病毒专门制备了完整病毒的标准品(whole-virusreferencematerials)。利用这类标准品可以用来归一化核酸制备前处理过程及qpcr检测体系的差异,从而提高病毒分子检测结果的可比性。目前这类标准品的载量还是通过qpcr的方法进行测定,对多个实验室得到的qpcr结果取平均值获得,单位一般为:dnacopies(cp)/ml或者iu/ml。但这种定标方法依然需要进行标准品中核酸提取,所以理论上还是不能明确标准品中病毒核酸的含量。
1999年vogelstein首次提出了“数字pcr”的概念,“数字pcr”以其极高的敏感性、绝对计算能力和无需定标等特性疾病诊断工作中得到了广泛应用。数字pcr是通过对样本进行微小单元化处理,可确定低至单拷贝的待检靶分子的绝对数目,且数字pcr不依靠任何校准物或外标便可直接计数目标分子数,为绝对定量pcr技术。因此数字pcr(digitalpcr)特别适用于依靠ct值不能很好分辨的应用领域:拷贝数变异、突变检测、基因相对表达研究(如等位基因不平衡表达)、二代测序结果验证、mirna表达分析、单细胞基因表达分析等。
目前,应用较多的是采用美国伯乐生命医学产品有限公司的微滴式数字pcr仪进行数字pcr分析,其微滴数字pcr仪具体的结构如cn103429331,该发明公开了形成乳液的系统,此套系统使每个经核酸提取的样品形成20000个液滴,根据检测分析原理,液滴分得越多,检测结果准确度越高,因此,采用这套仪器进行数字pcr技术检测的准确度有待进一步提高。
技术实现要素:
本发明为了克服现有技术的上述不足,提供了一种基于数字pcr定量检测病毒的方法,大大节约成本,并提高了检测的精确性和灵敏度。
为了实现上述目的,本发明是通过以下技术方案实现的:
一种基于数字pcr定量检测病毒的方法,该方法包括以下步骤:
步骤一:待检样本前处理;
步骤二:微滴制备:
配制pcr水相,pcr水相包括1.6%~2%上游引物、1.6%~2%下游引物、0.2%~0.4%pcr模板、20%~30%pcrmix仪次均匀混合,滴加70%~80%双蒸水后将溶液体系作为反应水相备用;
配制pcr油相,将65%-68%的甘油、5%-10.5%的tritionx-100、5%-10.5%的司盘60、10%-20%的辛癸酸甘油酯依次均匀混合,获得的溶液作为反应油相备用;
分别取水相pcr和油相pcr油相按流量比为1:3.5~1:1.5的比例在线混合,混合的同时在摇床上涡旋搅拌并反应,得到油包水微滴;
步骤三:pcr扩增反应,将上述充分乳化的油水体系分装,手动转移到96孔pcr板上,孔板用锡箱热封后设定pcr反应条件进行pcr扩增;
步骤四:检测微滴,pcr反应后,将96孔pcr板置于qx100液滴分析仪中,依次吸取每个样本中的微滴并逐一通过检测器,有荧光信号的微滴为阳性,无荧光信号的微滴为阴性。
进一步地,所述步骤二中混合液在摇床上涡旋搅拌的时间为10~14min。
进一步地,所述的步骤二中得到的油包水微滴的粒径为100nm~1μm。
进一步地,所述步骤三中pcr反应条件为:
反转录:温度50℃,10min,1个循环;
预变性:温度95℃,10min,1个循环;
变性:温度94℃,30s,退火;温度58℃,60s,共40个循环;
结束反应:温度98℃,10min,1个循环。
进一步地,所述步骤三中取出反应后的pcr溶液,如果出现微弱的分层现象则涡旋数秒。
本发明的有益效果:(1)本发明公开的一种基于数字pcr定量检测病毒的方法,无需在pcr检测之前对核酸进行提取,避免了病毒核酸在提取过程中的损失,更加准确的测定出病毒含量;(2)本发明公开的一种基于数字pcr定量检测病毒的方法,在微滴制备时将配制好的pcr水相和pcr油相同时放料,分别瞬时控制pcr水相和pcr油相的流量,且混合的同时在摇床上涡旋搅拌并反应得到的油包水微滴的粒径为100nm-1μm,平均粒径小,微滴大小均一稳定,每个样品形成的液滴个数显著增加,检测结果的准确度大大提高;(2)本发明公开的基于数字pcr定量检测病毒的方法,操作简单,大大降低了检测成本。
附图说明
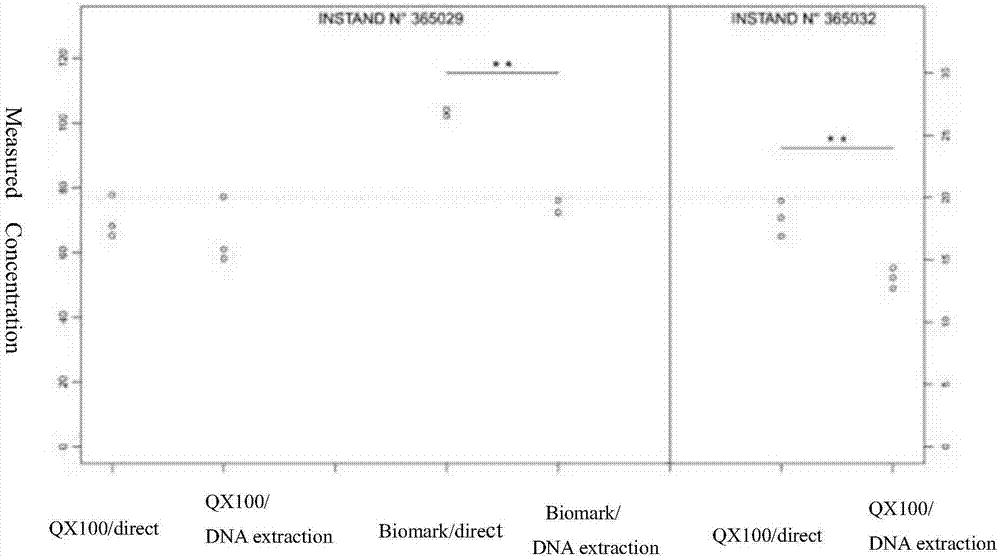
图1为qx100直接定量与对核酸产物定量、biomark直接定量与对核酸产物定量的对比图;
图2为qx100对#365032直接定量与对核酸产物定量、biomark对#365032直接定量与对核酸产物定量的对比图。
具体实施方式
展示一下实例来具体说明本发明的某些实施例,且不应解释为限制本发明的范围。对本发明公开的内容可以同时从材料、方法和反应条件进行改进,所有这些改进,均应落入本发明的的精神和范围之内。
采用两种不同的数字pcr设备对完整的人巨细胞病毒(humancytomegalovirus,hcmv)标准品不经过核酸提取进行直接定量,并与经过核酸纯化的dpcr定量结果进行了比较。
实施例1:待测的完整病毒标准品
1、who的hcmv标准品,浓度为5×106iu/ml。
2、将上述的who的hcmv标准品,分别以acrometrixedtaplasmadilutionmatrix(lifetechnologies,usa)、pbs和双蒸水进行了梯度稀释,最终的浓度分别为1×106iu/ml,1×105iu/ml和1×104iu/ml,前者的稀释模仿了临床样品中的血液背景。
3、instand(societyforpromotingqualityassuranceinmedicallaboratories)的hcmv标准品。#365029的浓度为:77,000cp/ml;#365032的浓度为:20,000cp/ml;#365030为阴性对照。
4病毒核酸纯化试剂盒:roche公司的highpureviralnucleicacidkits,核酸纯化设置三平行重复。
实施例2:病毒分子的dpcr定量
一、核酸纯化时病毒的dpcr定量
1、将实施例1中的浓度分别为1×106iu/ml,1×105iu/ml和1×104iu/ml的标准品进行核酸提取:分别取三种浓度的病毒溶液30ml,加入1.0mlte缓冲液,混匀,8000rpm离心5min,收集底部沉淀;然后向收集到的底部沉淀中加入450μl裂解液和10μl蛋白酶k,在55℃的条件下,水浴1小时,沉淀溶解,得到混合液;采用0.6ml的70%乙醇溶液洗涤2次,晾干后,加入50μlte缓冲液,完成了病毒溶液中hcmvdna的提取,得到了dna模板,在-20℃的条件下保存备用。
2、制备引物反应溶液:
hcmv的pcr扩增正向引物为5’-catgtacgttgctatccaggc-3’
hcmv的pcr扩增反向引物为5’-ctccttaatgtcacgcacgat-3’
引物为室温溶解hcmv的pcr引物,配置20μl引物反应溶液,引物反应溶液包括10μl2×ddpcrmastermix、10μmol/l的正向引物和10μmol/l的反向引物各0.8μl、taqman-mgb探针0.5μl、dna模板2μl、无菌水6μl,阴性对照组中,使用不含dna的te缓冲液作为模板。
3、液滴制备:
配制pcr水相,在超净台中往试管中加入5.22μl,102μm的上游引物和下游引物和pcrmix49.42μl,然后将试管转移到pcr模板加入区加1.66fmol的模板,在超净台中滴加双蒸水足至260μl,充分混匀;
配制pcr油相,一次性往试管中加入1.95ml甘油、0.3ml的tritionx-100、0.3ml的司盘60、0.45ml的辛癸酸甘油酯依次均匀混合,获得的溶液作为反应油相备用;
分别取水相pcr和油相pcr油相按流量比为1:2的比例在线混合,混合的同时在摇床上涡旋搅拌并反应,得到油包水微滴;
4、pcr扩增反应
将上述充分乳化的油水体系分装,手动转移到96孔pcr板上,孔板用锡箱热封后设定pcr反应条件进行pcr扩增;扩增条件为:(1)反转录:温度50℃,10min,1个循环;(2)预变性:温度95℃,10min,1个循环;(3)变性:温度94℃,30s,退火;温度58℃,60s,共40个循环;(4)结束反应:温度98℃,10min,1个循环。
5、检测微滴
pcr反应后,将96孔pcr板置于qx100液滴分析仪中,依次吸取每个样本中的微滴并逐一通过检测器,有荧光信号的微滴为阳性,无荧光信号的微滴为阳性;
二、不进行核酸纯化条件下直接dpcr定量
将实施例1中的浓度分别为1×106iu/ml,1×105iu/ml和1×104iu/ml的病毒溶液直接进行液滴制备、pcr扩增并进行微滴检测、分析。
实施例3:直接定量与经过纯化定量的比较
1、由图1可知,从总体上看,对hcmv的dpcr直接定量结果显著地高于对核酸纯化产物的hcmv定量结果,说明直接定量的方式更接近病毒的真实含量。出现这个结果的原因是由于在核酸纯化的步骤中无法避免会造成病毒核酸的损失。
2、qx100对who的hcmv三个稀释度标准品的定量结果显示:在血浆和pbs稀释的背景下,直接定量的结果分别高出对核酸产物定量结果的18%和35%。类似的,biomark直接定量的结果分别高出对核酸产物定量结果的26%和53%。具体结果见下图1所示。
3、对instand标准品的分析显示:qx100对#365032直接定量的结果高出对核酸纯化产物定量结果的39%,对#365029的分析两者之间无统计学意义上的差异;biomark对#365029直接定量的结果高出对核酸纯化产物定量结果的35%,具体结果见下图2所示。
结果表明,本发明无需在pcr检测之前对核酸进行提取,避免了病毒核酸在提取过程中的损失,更加准确的测定出病毒含量;而且在微滴制备时将配制好的pcr水相和pcr油相同时放料,分别瞬时控制pcr水相和pcr油相的流量,且混合的同时在摇床上涡旋搅拌并反应得到的油包水微滴的粒径为100nm-1μm,平均粒径小,微滴大小均一稳定,每个样品形成的液滴个数显著增加,检测结果的准确度大大提高。
以上所述,仅为本发明较佳的具体实施方式,但本发明的保护范围并不局限于此,任何熟悉本技术领域的技术人员在本发明揭露的技术范围内,根据本发明的技术方案及其发明构思加以等同替换或改变,都应涵盖在本发明的保护范围之内。
- 还没有人留言评论。精彩留言会获得点赞!