用于使烯烃在具有低的布朗斯台德酸浓度的介质中烷氧基羰基化的方法与流程
本发明涉及使烯烃烷氧基羰基化的方法,其中所述烷氧基羰基化在具有低的布朗斯台德酸浓度的介质中进行。
背景技术:
烯烃的烷氧基羰基化是一种日益重要的方法。烷氧基羰基化是指将不饱和的化合物(如烯烃)与一氧化碳和醇在金属或金属配合物和配体的存在下反应得到相应的酯:
示意图1:烯属不饱和化合物的烷氧基羰基化的一般性反应方程式。
在烷氧基羰基化反应中,乙烯-甲氧基羰基化得到3-丙酸甲酯作为制备甲基丙烯酸甲酯的中间步骤是重要的(s.g.khokarale,e.j.garcía-suárez,j.xiong,u.v.mentzel,r.fehrmann,a.riisager,catalysiscommunications2014,44,73-75)。乙烯-甲氧基羰基化在甲醇作为溶剂在温和的条件下使用通过膦配体改性的钯催化剂而进行。非常好的催化体系由lucite–目前是mitsubishirayon–开发和使用基于1,2-双(二-叔丁基膦基甲基)苯(dtbpmb)的配体(w.clegg,g.r.eastham,m.r.j.elsegood,r.p.tooze,x.l.wang,k.whiston,chem.commun.1999,1877-1878)。
所述烷氧基羰基化通常在添加强的布朗斯台德酸,例如对甲苯磺酸、甲磺酸或硫酸的情况下进行。然而,这对于工业使用烷氧基羰基化是不利的,因为这伴随着对反应器和其它设备提高的腐蚀性。
一种已知的无酸方法基于4,5-双(二苯基膦基)-9,9-二甲基呫吨(xantphos)用作二齿的配体(fang,x.,li,h.,jackstell,r.和beller,m.,2014,palladium-catalyzedalkoxycarbonylationofconjugateddienesunderacid-freeconditions:atom-economicsynthesisofβ,γ-unsaturatedesters.angew.chem.int.ed.,53:9030–9034)。然而发现,大量其它的二齿配体不适用于无酸的烷氧基羰基化(fang,x.等,同上)。
技术实现要素:
因此,本发明的目的在于提供一种使烯烃烷氧基羰基化的方法,其中可以添加少量的布朗斯台德酸和可以达到好的产率。
所述目的通过包括下列方法步骤的方法而实现:
a)预先加入烯属不饱和的化合物;
b)添加包含pd和二齿的膦配体的配体-金属-配合物,
或添加二齿的膦配体和包含pd的化合物;
c)添加醇;
d)输入co;
e)加热所述反应混合物,其中烯属不饱和的化合物转化成酯,
其中向所述反应混合物中添加基于烯属不饱和化合物的物质的量少于0.1mol%的布朗斯台德酸,其酸强度pka≤3,
其特征在于,所述膦配体在至少一个磷原子上被至少一种杂芳基取代。
在此,方法步骤a)、b)、c)和d)可以以任意的顺序进行。然而,通常在预先加入步骤a)至c)中的反应成分之后添加co。步骤d)和e)可以同时或相继地进行。此外,也可以在多个步骤中输入co,从而例如首先输入一部分的co,然后加热和接着输入另外一部分的co。
通过根据本发明使用二齿的膦配体(其在至少一个磷原子上被至少一种杂芳基取代),可以在不添加酸强度pka≤3的强的布朗斯台德酸和/或添加基于烯属不饱和化合物的物质的量最多0.1mol%的布朗斯台德酸的情况下进行烯属不饱和化合物的烷氧基羰基化,而没有发生产率降低。由此,特别地避免了腐蚀性问题和/或在大型设备中不必使用昂贵的、耐酸的钢。
优选地,向反应混合物中添加的酸强度pka≤3的布朗斯台德酸的量为少于0.01mol%,优选少于0.001mol%,特别优选少于0.0001mol%,最优选0mol%,基于烯属不饱和化合物的物质的量。在此,布朗斯台德酸的比例基于所有添加的酸强度pka≤3的布朗斯台德酸的总物质的量计算。烯属不饱和化合物的物质的量是指预先加入的烯属不饱和化合物的总物质的量。
在本发明中,术语“布朗斯台德酸”是指可以释放质子的化合物(质子给予体)。因此,该术语不包括不能释放质子的路易斯酸(电子对接收体),例如钯化合物pdcl2。
因此,术语“无酸的”在本发明中是指没有向反应混合物中添加活性布朗斯台德酸的情况。在此不完全排除由于反应进行而形成布朗斯台德酸。
给出的酸强度pka是指在标准条件(25℃,1.01325bar)下测定的pka值。对于多质子酸,酸强度pka在本发明中是指第一质子迁移步骤的pka值。
本发明的方法优选也在不添加pka≤5,优选pka≤6的不那么强的布朗斯台德酸的情况下进行。因此优选地,在反应混合物中的酸强度pka≤5,优选pka≤6的布朗斯台德酸的比例为少于0.1mol%,优选少于0.01mol%,还优选少于0.001mol%,特别优选少于0.0001mol%,最优选0mol%,基于烯属不饱和化合物的物质的量。
在本发明中的二齿膦配体是包含两个膦基团的配体,其中两个膦基团的磷原子可以共同配位在一个钯原子上。已经发现,通过使至少一个磷原子被至少一种杂芳基取代而可以在无酸烷氧基羰基化的情况下实现高的产率。
优选地,所述杂芳基是指-(c3-c20)-杂芳基。
合适的杂芳基例如是呋喃基、噻吩基、吡咯基、噁唑基、异噁唑基、噻唑基、异噻唑基、咪唑基、吡唑基、呋咱基、四唑基、吡啶基、哒嗪基、嘧啶基、吡嗪基、苯并呋喃基、吲哚基、异吲哚基、苯并咪唑基、喹啉基、异喹啉基。
特别优选地,所述杂芳基具有5至10个环原子,优选5或6个环原子。
在此,所述杂芳基可以被选自如下的一种或多种取代基取代:-(c1-c12)-烷基、-(c3-c12)-环烷基、-(c3-c12)-杂环烷基、-o-(c1-c12)-烷基、-o-(c1-c12)-烷基-(c6-c20)-芳基、-o-(c3-c12)-环烷基、-s-(c1-c12)-烷基、-s-(c3-c12)-环烷基、-coo-(c1-c12)-烷基、-coo-(c3-c12)-环烷基、-conh-(c1-c12)-烷基、-conh-(c3-c12)-环烷基、-co-(c1-c12)-烷基、-co-(c3-c12)-环烷基、-n-[(c1-c12)-烷基]2、-(c6-c20)-芳基、-(c6-c20)-芳基-(c1-c12)-烷基、-(c6-c20)-芳基-o-(c1-c12)-烷基、-(c3-c20)-杂芳基、-(c3-c20)-杂芳基-(c1-c12)-烷基、-(c3-c20)-杂芳基-o-(c1-c12)-烷基、-cooh、-oh、-so3h、-nh2、卤素。
优选地,所述取代基选自:-(c1-c12)-烷基、-(c3-c12)-环烷基、-o-(c1-c12)-烷基、-o-(c3-c12)-环烷基、-(c6-c20)-芳基、-(c6-c20)-芳基-(c1-c12)-烷基、-(c6-c20)-芳基-o-(c1-c12)-烷基、-(c3-c20)-杂芳基、-(c3-c20)-杂芳基-(c1-c12)-烷基、-(c3-c20)-杂芳基-o-(c1-c12)-烷基。
特别优选地,两个膦基团的磷原子都被至少一种杂芳基取代。
在一个优选的实施方案中,所述二齿的膦配体选自根据式(i)和(ii)之一的化合物
其中
r1、r2、r3、r4、r1′、r2′、r3′、r4′分别彼此独立地选自-(c1-c12)-烷基、-(c3-c12)-环烷基、-(c3-c12)-杂环烷基、-(c6-c20)-芳基、-(c3-c20)-杂芳基;
基团r1、r2、r3、r4至少之一和/或基团r1′、r2′、r3′、r4′至少之一表示-(c3-c20)-杂芳基;
和
r1、r2、r3、r4、r1′、r2′、r3′、r4′,如果它们表示-(c1-c12)-烷基、-(c3-c12)-环烷基、-(c3-c12)-杂环烷基、-(c6-c20)-芳基或-(c3-c20)-杂芳基,
则可以分别彼此独立地被选自如下的一种或多种取代基取代:
-(c1-c12)-烷基、-(c3-c12)-环烷基、-(c3-c12)-杂环烷基、-o-(c1-c12)-烷基、-o-(c1-c12)-烷基-(c6-c20)-芳基、-o-(c3-c12)-环烷基、-s-(c1-c12)-烷基、-s-(c3-c12)-环烷基、-coo-(c1-c12)-烷基、-coo-(c3-c12)-环烷基、-conh-(c1-c12)-烷基、-conh-(c3-c12)-环烷基、-co-(c1-c12)-烷基、-co-(c3-c12)-环烷基、-n-[(c1-c12)-烷基]2、-(c6-c20)-芳基、-(c6-c20)-芳基-(c1-c12)-烷基、-(c6-c20)-芳基-o-(c1-c12)-烷基、-(c3-c20)-杂芳基、-(c3-c20)-杂芳基-(c1-c12)-烷基、-(c3-c20)-杂芳基-o-(c1-c12)-烷基、-cooh、-oh、-so3h、-nh2、卤素。
术语(c1-c12)-烷基包括直链的和支化的、具有1至12个碳原子的烷基。优选涉及(c1-c8)-烷基,特别优选(c1-c6)-烷基,最优选(c1-c4)-烷基。
合适的(c1-c12)-烷基特别是甲基、乙基、丙基、异丙基、正丁基、异丁基、仲丁基、叔丁基、正戊基、2-戊基、2-甲基丁基、3-甲基丁基、1,2-二甲基丙基、1,1-二甲基丙基、2,2-二甲基丙基、1-乙基丙基、正己基、2-己基、2-甲基戊基、3-甲基戊基、4-甲基戊基、1,1-二甲基丁基、1,2-二甲基丁基、2,2-二甲基丁基、1,3-二甲基丁基、2,3-二甲基丁基、3,3-二甲基丁基、1,1,2-三甲基丙基、1,2,2-三甲基丙基、1-乙基丁基、1-乙基-2-甲基丙基、正庚基、2-庚基、3-庚基、2-乙基戊基、1-丙基丁基、正辛基、2-乙基己基、2-丙基庚基、壬基、癸基。
关于术语(c1-c12)-烷基的说明特别也适用于-o-(c1-c12)-烷基、-s-(c1-c12)-烷基、-coo-(c1-c12)-烷基、-conh-(c1-c12)-烷基、-co-(c1-c12)-烷基和-n-[(c1-c12)-烷基]2中的烷基。
术语(c3-c12)-环烷基包括单-、二-或三环的、具有3至12个碳原子的烃基。优选涉及(c5-c12)-环烷基。
所述(c3-c12)-环烷基优选具有3至8个,特别优选5或6个环原子。
合适的(c3-c12)-环烷基特别是环丙基、环丁基、环戊基、环己基、环庚基、环辛基、环十二烷基、环十五烷基、降冰片基、金刚烷基。
关于术语(c3-c12)-环烷基的说明特别也适用于-o-(c3-c12)-环烷基、-s-(c3-c12)-环烷基、-coo-(c3-c12)-环烷基、-conh-(c3-c12)-环烷基、-co-(c3-c12)-环烷基中的环烷基。
术语(c3-c12)-杂环烷基包括非芳族的、饱和的或部分不饱和的、具有3至12个碳原子的环脂族基团,其中一个或多个环碳原子被杂原子替代。所述(c3-c12)-杂环烷基优选具有3至8个,特别优选5或6个环原子和任选地被脂族侧链取代。不同于环烷基,在杂环烷基中,一个或多个环碳原子被杂原子或含杂原子的基团替代。该杂原子或含杂原子的基团优选选自o、s、n、n(=o)、c(=o)、s(=o)。因此,环氧乙烷在本发明中也是一种(c3-c12)-杂环烷基。
合适的(c3-c12)-杂环烷基特别是四氢噻吩基、四氢呋喃基、四氢吡喃基和二噁烷基。
术语(c6-c20)-芳基包括单环或多环的、具有6至20个碳原子的芳族烃基。优选涉及(c6-c14)-芳基,特别优选(c6-c10)-芳基。
合适的(c6-c20)-芳基特别是苯基、萘基、茚基、芴基、蒽基、菲基、并四苯基、苯并菲基、芘基、蒄基。优选的(c6-c20)-芳基是苯基、萘基和蒽基。
术语(c3-c20)-杂芳基包括单环或多环的、具有3至20个碳原子的芳族烃基,其中所述碳原子的一个或多个被杂原子替代。优选的杂原子是n、o和s。所述(c3-c20)-杂芳基具有3至20个,优选6至14个和特别优选6至10个环原子。因此,在本发明中例如吡啶基是c6-杂芳基,呋喃基是c5-杂芳基。
合适的(c3-c20)-杂芳基特别是呋喃基、噻吩基、吡咯基、噁唑基、异噁唑基、噻唑基、异噻唑基、咪唑基、吡唑基、呋咱基、四唑基、吡啶基、哒嗪基、嘧啶基、吡嗪基、苯并呋喃基、吲哚基、异吲哚基、苯并咪唑基、喹啉基、异喹啉基。
术语卤素特别包括氟、氯、溴和碘。特别优选氟和氯。
在一个实施方案中,基团r1、r2、r3、r4、r1′、r2′、r3′、r4′,如果它们表示-(c1-c12)-烷基、-(c3-c12)-环烷基、-(c3-c12)-杂环烷基、-(c6-c20)-芳基或-(c3-c20)-杂芳基,则可以分别彼此独立地被选自如下的一种或多种取代基取代:-(c1-c12)-烷基、-(c3-c12)-环烷基、-(c3-c12)-杂环烷基、-o-(c1-c12)-烷基、-o-(c1-c12)-烷基-(c6-c20)-芳基、-o-(c3-c12)-环烷基、-s-(c1-c12)-烷基、-s-(c3-c12)-环烷基、-(c6-c20)-芳基、-(c6-c20)-芳基-(c1-c12)-烷基、-(c6-c20)-芳基-o-(c1-c12)-烷基、-(c3-c20)-杂芳基、-(c3-c20)-杂芳基-(c1-c12)-烷基、-(c3-c20)-杂芳基-o-(c1-c12)-烷基、-cooh、-oh、-so3h、-nh2、卤素。
在一个实施方案中,基团r1、r2、r3、r4、r1′、r2′、r3′、r4′,如果它们表示-(c1-c12)-烷基、-(c3-c12)-环烷基、-(c3-c12)-杂环烷基、-(c6-c20)-芳基或-(c3-c20)-杂芳基,则可以分别彼此独立地被选自如下的一种或多种取代基取代:-(c1-c12)-烷基、-(c3-c12)-环烷基、-o-(c1-c12)-烷基、-o-(c1-c12)-烷基-(c6-c20)-芳基、-o-(c3-c12)-环烷基、-(c6-c20)-芳基、-(c6-c20)-芳基-(c1-c12)-烷基、-(c6-c20)-芳基-o-(c1-c12)-烷基、-(c3-c20)-杂芳基、-(c3-c20)-杂芳基-(c1-c12)-烷基、-(c3-c20)-杂芳基-o-(c1-c12)-烷基。
在一个实施方案中,基团r1、r2、r3、r4、r1′、r2′、r3′、r4′,如果它们表示-(c1-c12)-烷基、-(c3-c12)-环烷基、-(c3-c12)-杂环烷基、-(c6-c20)-芳基或-(c3-c20)-杂芳基,则可以分别彼此独立地被选自如下的一种或多种取代基取代:-(c1-c12)-烷基、-o-(c1-c12)-烷基-(c6-c20)-芳基、-(c3-c20)-杂芳基、-(c3-c20)-杂芳基-(c1-c12)-烷基、-(c3-c20)-杂芳基-o-(c1-c12)-烷基。
在一个实施方案中,基团r1、r2、r3、r4、r1′、r2′、r3′、r4′,如果它们表示-(c1-c12)-烷基、-(c3-c12)-环烷基、-(c3-c12)-杂环烷基、-(c6-c20)-芳基或-(c3-c20)-杂芳基,则可以分别彼此独立地被选自如下的一种或多种取代基取代:-(c1-c12)-烷基和-(c3-c20)-杂芳基。
在一个实施方案中,基团r1、r2、r3、r4、r1′、r2′、r3′、r4′,如果它们表示-(c1-c12)-烷基、-(c3-c12)-环烷基或-(c3-c12)-杂环烷基,则是未取代的;如果它们表示-(c6-c20)-芳基或-(c3-c20)-杂芳基,则可以是如上述取代的。
在一个实施方案中,基团r1、r2、r3、r4、r1′、r2′、r3′、r4′,如果它们表示-(c1-c12)-烷基、-(c3-c12)-环烷基、-(c3-c12)-杂环烷基、-(c6-c20)-芳基或-(c3-c20)-杂芳基,则是未取代的。
在一个实施方案中,r1、r2、r3、r4、r1′、r2′、r3′、r4′分别彼此独立地选自-(c1-c12)-烷基、-(c3-c12)-环烷基、-(c3-c12)-杂环烷基、-(c6-c20)-芳基、-(c3-c20)-杂芳基;
其中
基团r1、r2、r3、r4至少之一和/或基团r1′、r2′、r3′、r4′至少之一表示-(c3-c20)-杂芳基;
和
r1、r2、r3、r4、r1′、r2′、r3′、r4′,如果它们表示-(c1-c12)-烷基、-(c3-c12)-环烷基、-(c3-c12)-杂环烷基、-(c6-c20)-芳基或-(c3-c20)-杂芳基,
则可以分别彼此独立地被一种或多种上述的取代基取代。
在一个实施方案中,r1、r2、r3、r4、r1′、r2′、r3′、r4′分别彼此独立地选自-(c1-c12)-烷基、-(c6-c20)-芳基、-(c3-c20)-杂芳基;
其中
基团r1、r2、r3、r4至少之一和/或基团r1′、r2′、r3′、r4′至少之一表示-(c3-c20)-杂芳基;
和
r1、r2、r3、r4、r1′、r2′、r3′、r4′,如果它们表示-(c1-c12)-烷基、-(c6-c20)-芳基或-(c3-c20)-杂芳基,
则可以分别彼此独立地被一种或多种上述的取代基取代。
在一个实施方案中,基团r1、r2、r3、r4至少之二和/或基团r1′、r2′、r3′、r4′至少之二表示-(c3-c20)-杂芳基。
在一个实施方案中,基团r1和r3和/或基团r1′和r3′分别表示-(c3-c20)-杂芳基和可以分别彼此独立地被一种或多种上述的取代基取代。优选地,基团r2和r4和/或基团r2′和r4′不表示-(c3-c20)-杂芳基。特别优选地,基团r2和r4和/或基团r2′和r4′选自-(c1-c12)-烷基、-(c3-c12)-环烷基、-(c3-c12)-杂环烷基、-(c6-c20)-芳基,最优选-(c1-c12)-烷基、-(c3-c12)-环烷基、-(c6-c20)-芳基。
在一个实施方案中,基团r1、r2、r3和/或基团r1′、r2′、r3′分别表示-(c3-c20)-杂芳基和可以分别彼此独立地被一种或多种上述的取代基取代。优选地,r4和/或r4′在此不表示-(c3-c20)-杂芳基。特别优选地,r4和/或r4′在此选自-(c1-c12)-烷基、-(c3-c12)-环烷基、-(c3-c12)-杂环烷基、-(c6-c20)-芳基,最优选选自-(c1-c12)-烷基、-(c3-c12)-环烷基、-(c6-c20)-芳基。
在一个实施方案中,基团r1、r2、r3和r4和/或r1′、r2′、r3′和r4′表示-(c6-c20)-杂芳基和可以分别彼此独立地被一种或多种上述的取代基取代。
在一个实施方案中,基团r1、r2、r3和r4和/或r1′、r2′、r3′和r4′,如果它们表示杂芳基,则分别彼此独立地选自具有5至10个环原子的杂芳基,优选具有5或6个环原子的杂芳基。
在一个实施方案中,基团r1、r2、r3和r4和/或r1′、r2′、r3′和r4′,如果它们表示杂芳基,则是具有6个环原子的杂芳基。
在一个实施方案中,基团r1、r2、r3和r4和/或r1′、r2′、r3′和r4′,如果它们表示杂芳基,则是具有5个环原子的杂芳基。
优选地,基团r1、r2、r3和r4和/或r1′、r2′、r3′和r4′,如果它们表示杂芳基,则分别彼此独立地选自呋喃基、噻吩基、吡咯基、噁唑基、异噁唑基、噻唑基、异噻唑基、咪唑基、吡唑基、呋咱基、四唑基、吡啶基、哒嗪基、嘧啶基、吡嗪基、苯并呋喃基、吲哚基、异吲哚基、苯并咪唑基、喹啉基、异喹啉基,其中所述杂芳基可以是如上述取代的。
在一个实施方案中,基团r1、r2、r3和r4和/或r1′、r2′、r3′和r4′,如果它们表示杂芳基,则分别彼此独立地选自呋喃基、噻吩基、吡咯基、咪唑基、吡啶基、嘧啶基、吲哚基,其中所述杂芳基可以是如上述取代的。
优选地,基团r1、r2、r3和r4和/或r1′、r2′、r3′和r4′,如果它们表示杂芳基,则分别彼此独立地选自2-呋喃基、2-噻吩基、2-吡咯基、2-咪唑基、2-吡啶基、2-嘧啶基、2-吲哚基,其中所述杂芳基可以是如上述取代的。
特别优选地,基团r1、r2、r3和r4和/或r1′、r2′、r3′和r4′,如果它们表示杂芳基,则分别彼此独立地选自2-呋喃基、2-噻吩基、n-甲基-2-吡咯基、n-苯基-2-吡咯基、n-(2-甲氧基苯基)-2-吡咯基、2-吡咯基、n-甲基-2-咪唑基、2-咪唑基、2-吡啶基、2-嘧啶基、n-苯基-2-吲哚基、2-吲哚基,其中所述杂芳基是未进一步取代的。
在一个实施方案中,基团r1和r3和/或r1′和r3′分别表示具有5或6个环原子的-(c3-c20)-杂芳基,
其中基团r2和r4和/或r2′和r4′分别彼此独立地选自-(c1-c12)-烷基、-(c3-c12)-环烷基、-(c3-c12)-杂环烷基、-(c6-c20)-芳基;
和
r1、r3、r1′、r3′以及r2、r2′、r4、r4′,如果它们表示-(c1-c12)-烷基、-(c3-c12)-环烷基、-(c3-c12)-杂环烷基或-(c6-c20)-芳基,
则可以分别彼此独立地被一种或多种上述的取代基取代。
在一个实施方案中,基团r1和r3和/或r1′和r3′分别表示具有5或6个环原子的-(c3-c20)-杂芳基,和基团r2和r4和/或r2′和r4′分别表示-(c1-c12)-烷基;
其中
r1、r3、r1′、r3′以及r2、r2′、r4、r4′可以分别彼此独立地被一种或多种上述的取代基取代。
在一个实施方案中,基团r1和r3和/或r1′和r3′分别表示选自如下的-(c3-c20)-杂芳基:呋喃基、噻吩基、吡咯基、咪唑基、吡啶基、嘧啶基、吲哚基,
其中基团r2和r4分别彼此独立地选自-(c1-c12)-烷基、-(c3-c12)-环烷基、-(c3-c12)-杂环烷基、-(c6-c20)-芳基;
和
r1和r3以及r2和r4,如果它们表示-(c1-c12)-烷基、-(c3-c12)-环烷基、-(c3-c12)-杂环烷基或-(c6-c20)-芳基,
则可以分别彼此独立地被一种或多种上述的取代基取代。
在一个优选的实施方案中,所述二齿的膦配体是式i的化合物,其中r1、r2、r3、r4具有上述的含义。
优选地,所述二齿的膦配体是根据式i的化合物,
其中基团r1和r3分别表示具有5或6个环原子的-(c3-c20)-杂芳基;
基团r2和r4分别彼此独立地选自-(c1-c12)-烷基、-(c3-c12)-环烷基、-(c3-c12)-杂环烷基、-(c6-c20)-芳基;
和
r1、r2、r3和r4则可以分别彼此独立地被一种或多种上述的取代基取代。
特别优选地,所述二齿的膦配体是根据式i的化合物,
其中基团r1和r3分别表示具有6个环原子的-(c3-c20)-杂芳基;
基团r2和r4分别表示-(c1-c12)-烷基。
根据式(8)和(4)之一的下面化合物是用于本发明方法的特别合适的膦配体:
在此,化合物8是特别优选的。
在本发明的方法中用作反应物的烯属不饱和的化合物包含一个或多个碳-碳-双键。这种化合物在下文中也简称为烯烃。双键可以是末端的或内部的。
优选的烯属不饱和的化合物具有2至30个碳原子,优选2至22个碳原子,特别优选2至12个碳原子。
所述烯属不饱和的化合物除了一个或多个双键还可以包含其它的官能团。优选地,所述烯属不饱和的化合物包含选自如下的一种或多种官能团:羧基、硫代羧基、磺基、亚磺酰基、羧酸酐、酰亚胺、羧酸酯、磺酸酯、氨基甲酰基、氨磺酰基、氰基、羰基、硫代羰基、羟基、氢硫基、氨基、醚、硫醚、芳基、杂芳基或甲硅烷基和/或卤素取代基。在此,所述烯属不饱和的化合物优选包含总计2至30个碳原子,优选2至22个碳原子,特别优选2至12个碳原子。
在一个实施方案中,所述烯属不饱和的化合物除了碳-碳-双键之外不包含其它的官能团。
合适的烯属不饱和的化合物是例如:
乙烯;
丙烯;
c4烯烃例如1-丁烯、顺-2-丁烯、反-2-丁烯、顺-和反-2-丁烯的混合物、异丁烯、1,3-丁二烯;萃余液i至iii、裂解-c4;
c5烯烃例如1-戊烯、2-戊烯、2-甲基-1-丁烯、2-甲基-2-丁烯、2-甲基-1,3-丁二烯(异戊二烯)、1,3-戊二烯;
c6烯烃例如四甲基乙烯、1,3-己二烯、1,3-环己二烯;
c7烯烃例如1-甲基环己烯、2,4-庚二烯、降冰片二烯;
c8烯烃例如1-辛烯、2-辛烯、环辛烯、二正丁烯、二异丁烯、1,5-环辛二烯、1,7-辛二烯;
c9烯烃例如三丙烯;
c10烯烃例如二环戊二烯;
十一烯;
十二烯;
内部c14烯烃;
内部c15至c18烯烃;
直链或支化的,环状的、非环状的或部分环状的,内部c15至c30烯烃;
三异丁烯、三正丁烯;
萜例如柠檬烯、香叶醇、金合欢醇、蒎烯、香叶烯、香芹酮、3-蒈烯;
具有18个碳原子的多重不饱和的化合物例如亚油酸或亚麻酸;
不饱和羧酸的酯例如乙酸或丙酸的乙烯基酯,不饱和羧酸的烷基酯,丙烯酸或甲基丙烯酸的甲酯或乙酯,油酸酯例如油酸甲-或乙酯,亚油酸或亚麻酸的酯;
乙烯基化合物例如乙酸乙烯酯、乙烯基环己烯、苯乙烯、α-甲基苯乙烯、2-异丙烯基萘;
2-甲基-2-戊烯醛、3-戊烯酸甲酯、甲基丙烯酸酐。
在所述方法的一个变型方案中,所述烯属不饱和的化合物选自丙烯、1-丁烯、顺-和/或反-2-丁烯或者它们的混合物。
在所述方法的一个变型方案中,所述烯属不饱和的化合物选自1-戊烯、顺-和/或反-2-戊烯、2-甲基-1-丁烯、2-甲基-2-丁烯、3-甲基-1-丁烯或者它们的混合物。
在一个优选的实施方案中,所述烯属不饱和的化合物选自乙烯、丙烯、1-丁烯、顺-和/或反-2-丁烯、异丁烯、1,3-丁二烯、1-戊烯、顺-和/或反-2-戊烯、2-甲基-1-丁烯、3-甲基-1-丁烯、2-甲基-2-丁烯、己烯、四甲基乙烯、庚烯、正辛烯、1-辛烯、2-辛烯或者它们的混合物。
在一个变型方案中,使用烯属不饱和的化合物的混合物。在本发明中的混合物是指包含至少两种不同的烯属不饱和化合物的组合物,其中每一种烯属不饱和化合物的含量为基于所述混合物的总重量计优选至少5重量%。
优选地,使用分别具有2至30个碳原子,优选4至22个碳原子,特别优选6至12个碳原子,最优选8至10个碳原子的烯属不饱和化合物的混合物。
合适的烯属不饱和化合物的混合物是所谓的萃余液i至iii。萃余液i包含40%至50%异丁烯、20%至30%1-丁烯、10%至20%顺-和反-2-丁烯、最多1%1,3-丁二烯和10%至20%正丁烷和异丁烷。萃余液ii是在石脑油裂解中产生的c4馏分的一部分,并且基本上由从萃余液i中分离出异丁烯之后的正丁烯异构体、异丁烷和正丁烷组成。萃余液iii是在石脑油裂解中产生的c4馏分的一部分并基本上由正丁烯异构体和正丁烷组成。
另一种合适的混合物是二正丁烯,也称为二丁烯、dnb或dnb。二正丁烯是c8烯烃的异构体混合物,其由1-丁烯、顺-2-丁烯和反-2-丁烯的混合物的二聚化而产生。工业上,通常对萃余液ii或萃余液iii料流进行催化低聚化,其中包含的丁烷(n/iso)不发生变化,而包含的烯烃则完全或部分地转化。除了二聚的二正丁烯,通常也产生更高级的低聚物(三丁烯c12、四丁烯c16),它们在反应后可以蒸馏分离出。它们同样可以用作反应物。
在一个优选的变型方案中,使用包含异丁烯、1-丁烯、顺-和反-2-丁烯的混合物。优选地,所述混合物包含1-丁烯、顺-和反-2-丁烯。
根据本发明的烷氧基羰基化通过pd配合物催化。该pd配合物可以在此在方法步骤b)中或者作为包含pd和上述的膦配体的预成型配合物添加,或者原位地由包含pd的化合物和游离的膦配体而形成。在此,包含pd的化合物也称为催化剂前体。
在所述催化剂原位地形成的情况下,可以过量地添加配体,从而在反应混合物中也存在未结合的配体。
在一个变型方案中,包含pd的化合物选自氯化钯(pdcl2)、乙酰丙酮钯(ii)[pd(acac)2]、乙酸钯(ii)[pd(oac)2]、二氯(1,5-环辛二烯)钯(ii)[pd(cod)2cl2]、双(二亚芐基丙酮)钯[pd(dba)2]、双(乙腈)二氯化钯(ii)[pd(ch3cn)2cl2]、(肉桂基)二氯化钯[pd(肉桂基)cl2]。
优选地,包含pd的化合物是pdcl2、pd(acac)2或pd(oac)2。特别合适的是pdcl2。
在方法步骤c)中的醇可以是支化的或直链的,环状的、脂环的、部分环状的或脂族的,并且特别是c1-至c30-链烷醇。可以使用一元醇或多元醇。
在方法步骤c)中的醇包含优选1至30个碳原子,特别优选1至22个碳原子,特别优选1至12个碳原子。在此可以是一元醇或多元醇。
除了一个或多个羟基,所述醇还可以包含其它的官能团。优选地,所述醇还可以包含选自如下的一种或多种官能团:羧基、硫代羧基、磺基、亚磺酰基、羧酸酐、酰亚胺、羧酸酯、磺酸酯、氨基甲酰基、氨磺酰基、氰基、羰基、硫代羰基、氢硫基、氨基、醚、硫醚、芳基、杂芳基或甲硅烷基和/或卤素取代基。
在一个实施方案中,所述醇不包含除了羟基之外的其它官能团。
所述醇可以包含不饱和的和芳族的基团。然而优选脂族的醇。
在本发明中的脂族的醇是指不包含芳族基团的醇,即例如链烷醇、链烯醇或链炔醇。
在所述方法的一个变型方案中,在方法步骤c)中的醇选自一元醇类型。
在所述方法的一个变型方案中,在方法步骤c)中的醇选自:甲醇、乙醇、1-丙醇、异丙醇、异丁醇、叔丁醇、1-丁醇、2-丁醇、1-戊醇、2-戊醇、3-戊醇、1-己醇、环己醇、苯酚、2-乙基己醇、异壬醇、2-丙基庚醇。
在一个优选的变型方案中,在方法步骤c)中的醇选自甲醇、乙醇、1-丙醇、1-丁醇、1-戊醇、1-己醇、2-丙醇、叔丁醇、3-戊醇、环己醇、苯酚或其混合物。
在所述方法的一个变型方案中,在方法步骤c)中的醇选自多元醇类型。
在所述方法的一个变型方案中,在方法步骤c)中的醇选自:二元醇、三元醇、四元醇。
在所述方法的一个变型方案中,在方法步骤c)中的醇选自:环己烷-1,2-二醇、1,2-乙二醇、1,3-丙二醇、甘油、1,2,4-丁三醇、2-羟基甲基-1,3-丙二醇、1,2,6-三羟基己烷、季戊四醇、1,1,1-三(羟甲基)乙烷、焦儿茶酚、雷琐酚和羟基氢醌。
在所述方法的一个变型方案中,在方法步骤c)中的醇选自:蔗糖、果糖、甘露糖、山梨糖、半乳糖和葡萄糖。
在所述方法的一个优选变型方案中,在方法步骤c)中的醇选自甲醇、乙醇、1-丙醇、1-丁醇、1-戊醇、1-己醇。
在所述方法的一个特别优选变型方案中,在方法步骤c)中的醇选自甲醇、乙醇。
在所述方法的一个特别优选变型方案中,在方法步骤c)中的醇是甲醇。
在所述方法的一个变型方案中,在方法步骤c)中的醇过量使用。
在所述方法的一个变型方案中,在方法步骤c)中的醇同时用作溶剂。
在所述方法的一个变型方案中,使用选自如下的另一种溶剂:甲苯、二甲苯、四氢呋喃(thf)或二氯甲烷(ch2cl2)。
在步骤d)中,优选在0.1至10mpa(1至100bar),优选1至8mpa(10至80bar),特别优选2至4mpa(20至40bar)的co分压下输入co。
在本发明的方法的步骤e)中,将所述反应混合物优选加热到10℃至180℃,优选20至160℃,特别优选40至120℃的温度,从而使所述烯属不饱和化合物转化成酯。
在步骤a)中预先加入的烯属不饱和化合物与在步骤c)中添加的醇的摩尔比为优选1:1至1:20,优选1:2至1:10,特别优选1:3至1:4。
pd与在步骤a)中预先加入的烯属不饱和化合物的质量比为优选0.001至0.5重量%,优选0.01至0.1重量%,特别优选0.01至0.05重量%。
所述二齿的膦配体与pd的摩尔比为优选0.1:1至400:1,优选0.5:1至400:1,特别优选1:1至100:1,最优选2:1至50:1。
附图说明
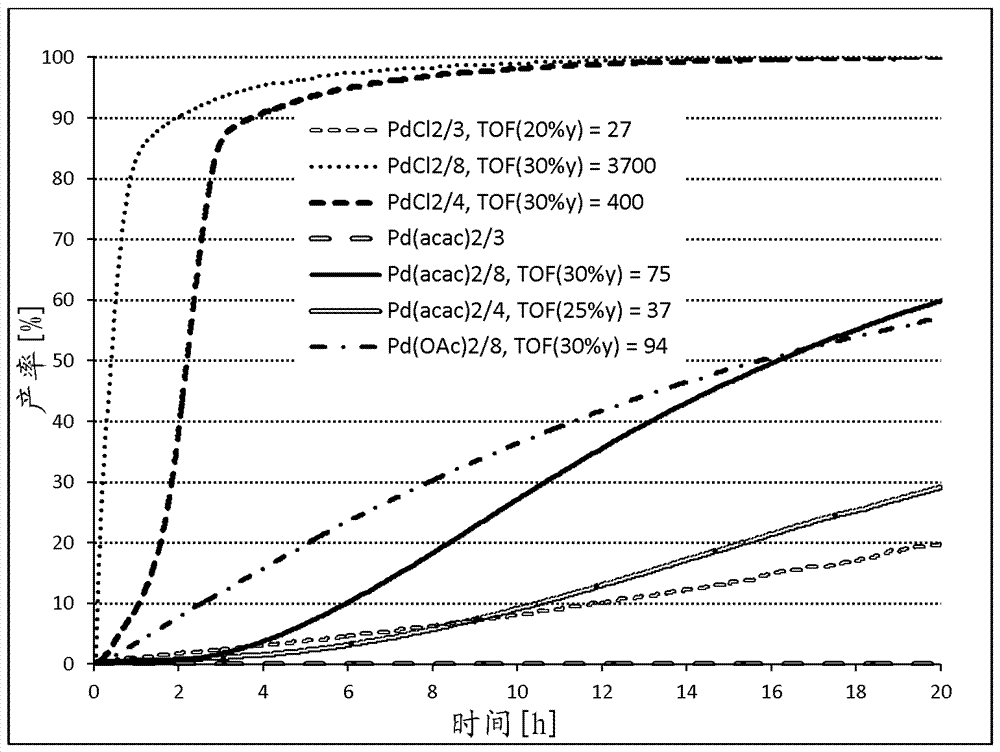
图1:使用配体3、4和8时,钯前体对乙烯的甲氧基羰基化的影响;
图2:使用配体3、4和8时,乙烯的无酸甲氧基羰基化。
具体实施方式
下面借助具体实施例进一步描述本发明。
通用操作说明
所有下面的制备使用标准的schlenk技术在保护气体下进行。溶剂在使用前通过合适的干燥剂干燥(purificationoflaboratorychemicals,w.l.f.armarego(作者),christinachai(作者),butterworthheinemann(elsevier),第6版,oxford2009)。
三氯化磷(aldrich)在使用前在氩气下蒸馏。所有的制备操作在经烘烤的容器中进行。产物用nmr波谱法表征。化学位移(δ)以ppm表示。31p-nmr信号参考如下:sr31p=sr1h*(bf31p/bf1h)=sr1h*0.4048。(robink.harris,edwind.becker,soniam.cabraldemenezes,robingoodfellow和pierregranger,pureappl.chem.,2001,73,1795-1818;robink.harris,edwind.becker,soniam.cabraldemenezes,pierregranger,roye.hoffman和kurtw.zilm,pureappl.chem.,2008,80,59-84)。
核共振谱的记录在brukeravance300或brukeravance400上进行,气相色谱分析在agilentgc7890a上进行,元素分析在lecotruspecchns和varianicp-oes715上进行,和esi-tof质谱在thermoelectronfinniganmat95-xp和agilent6890n/5973设备上进行。
前体e的制备
氯-2-吡啶基-叔丁基膦的制备
用于合成氯-2-吡啶基叔丁基膦的grignard试剂是根据“knochel方法”用异丙基氯化镁制备的(angew.chem.2004,43,2222-2226)。根据budzelaar(organometallics1990,9,1222-1227)的方法进行后处理。
示意图2:前体e的合成。
在具有磁力搅拌器和隔膜的50ml圆底烧瓶中,在氩气下加入8.07ml的1.3m异丙基氯化镁溶液(knochel试剂)并且冷却至-15℃。此后,迅速滴加953.5μl(10mmol)的2-溴吡啶。该溶液立即变黄。将其升温至-10℃。反应的转化率如下测定:取出约100μl的溶液并将其加入到1ml的氯化铵饱和溶液中。如果该溶液“起泡”,则仍未形成大量的grignard试剂。将所述水溶液用一管的乙醚萃取,并且将有机相用na2so4干燥。记录乙醚溶液的gc。当与2-溴吡啶相比形成大量吡啶时,则转化率高。在-10℃下,几乎没有反应。升温至室温并搅拌1-2小时后,反应溶液变成棕黄色。gc测试表明完全反应。这时可以用注射泵将grignard溶液缓慢滴加到预先冷却至-15℃的1.748g(11mmol)二氯叔丁基膦在10mlthf中的溶液中。重要的是将二氯叔丁基膦溶液冷却。在室温下,会生成大量的二吡啶基-叔丁基膦。最初形成澄清的黄色溶液,然后变成浑浊。将该混合物温热至室温并搅拌过夜。在高真空下除去溶剂,得到包含棕色斑点的白色固体。将该固体用20ml庚烷悬浮,并将固体在超声浴中粉碎。让白色固体沉淀后,倾出溶液。每次用10-20ml的庚烷重复操作两次。在高真空下浓缩该庚烷溶液后,对其减压蒸馏。在4.6mbar,油浴120℃和蒸馏温度98℃下可以蒸馏出产物。得到1.08g的无色油状物(50%)。
分析数据:1hnmr(300mhz,c6d6):δ8.36(m,1h,py),7.67(m,1h,py),7.03-6.93(m,1h,py),6.55-6.46(m,1h,py),1.07(d,j=13.3hz,9h,t-bu).
13cnmr(75mhz,c6d6):δ162.9,162.6,148.8,135.5,125.8,125.7,122.8,35.3,34.8,25.9,25.8.
31pnmr(121mhz,c6d6)δ97.9.
ms(ei)m:z(相对强度)201(m+,2),147(32),145(100),109(17),78(8),57.1(17)。
化合物8的制备
1,1'-双(叔丁基-2-吡啶基膦基)二茂铁的制备
示意图3:化合物8的合成。
变型a:
将474.4mg(2.55mmol)升华的二茂铁称取到具有磁力搅拌器和隔膜的50ml圆底烧瓶中,并通过抽真空和填充惰性气体而惰化。加入15ml庚烷后,二茂铁完全溶解。然后一次性加入841μl的四甲基乙二胺(1.1eq,5.61mmol),和滴加2.04mlbuli(2.5m在己烷中,2.0eq,5.1mmol)。2-3小时后,形成橙色沉淀物。将该混合物搅拌过夜,倾出庚烷溶液,橙色固体用庚烷洗涤两次。然后再加入10ml庚烷,将悬浮液冷却至-70℃。将1.08g(2.1eq,5.36mmol)氯-2-吡啶基-叔丁基膦溶于7ml庚烷中。该溶液变浑浊,和必须通过celite过滤。形成稍微不溶的白色固体。将该溶液滴加到二锂二茂铁溶液中。在升温至室温的过程中,橙色悬浮液的颜色变浅。为了完成反应,将反应溶液加热回流约1小时。形成澄清的橙色溶液和白色沉淀物。
向悬浮液中加入7ml的用氩气饱和的水。白色沉淀物溶解。除去水相后,重复该过程两次。在此,庚烷相变得浑浊。在高真空中完全除去有机相后,留下油状橙色残余物。将该残余物溶于10ml乙醚中,并用na2so4干燥(粗产率913mg)。在-28℃下过夜,没有形成沉淀物或晶体。即使乙醚和庚烷的混合物在-28℃下也不会导致结晶。溶液的31p-nmr再次显示目前在7.39ppm的产物峰和在40.4ppm的信号。所述产物可以通过柱色谱法纯化。在氩气下将乙醚溶液施加到用乙醚洗脱的短柱上。橙色的产物级分在最前面流出和可以方便地收集。除去乙醚得到241mg(16%)的粘性橙色油状物,纯度约95%。
变型b:
使用量:650.17mg(3.495mol)二茂铁(升华),2.8ml(2eq,6.99mmol)2.5mbuli(正丁基锂),1.1ml(2.1eq,7.3mmol)四甲基乙二胺和1.48g(2.1eq,7.34mmol)氯-2-吡啶基-叔丁基膦。
再次在15ml庚烷中制备二茂铁的二锂盐。将氯-2-吡啶基叔丁基膦溶解在10mlthf中而不是庚烷中,因为氯膦在thf中更好地溶解。同样优化后处理:回流沸腾后,将反应混合物仅用1mlh2o淬灭,并在高真空下完全除去溶剂(庚烷和thf)。将深黄橙色粘性固体溶于8mlh2o和15ml乙醚中并搅拌1分钟。进行相分离后,通过注射器除去水相,将有机相用h2o洗涤3次。将有机相用na2so4干燥并过滤。分三次各用10ml乙醚将产物从na2so4中洗出,直到溶液几乎无色。将深橙色溶液浓缩至10ml的体积,并在氩气下通过含有硅胶60的柱。使用的洗脱液再次为乙醚。滤液基本上更亮和为橙色的。除去溶剂得到1.16g的粘性橙色固体(64%)。
化合物4(α,α'-双(2-吡啶基(叔丁基)膦基)邻二甲苯)的制备
示意图4:化合物4的合成
(根据grahameastham等,us6335471b1)。
在手套箱中在具有氮气阀和磁力搅拌子的250ml圆底烧瓶中称取675mg(27.8mmol,4eq.)的mg粉末,并用隔膜封闭烧瓶。对圆底烧瓶施加高真空(约5x10-2mbar),并将其加热至90℃45分钟。冷却至室温后,加入2小粒的碘并溶于20ml的thf中。将该悬浮液搅拌约10分钟,直到碘的黄色消失。镁粉沉淀后,倾出浑浊的thf溶液,用1-2ml的thf洗涤活化的镁粉两次。然后再加入20ml的新鲜thf。在室温下,用注射泵缓慢滴加1.21g(6.9mmol)α,α'-二氯-邻二甲苯在70mlthf中的溶液。该thf溶液逐渐变成深色。第二天,过滤thf悬浮液以除去未反应的镁粉,并且如下测定grignard化合物的含量:
将1mlgrignard溶液在饱和的nh4cl水溶液中淬灭,并用乙醚萃取,和通过na2so4干燥。
grignard溶液的含量的定量测定:
将1mlgrignard溶液用2ml的0.1mhcl淬灭,并将过量的酸用0.1mnaoh滴定。合适的指示剂是0.04%的溴甲酚水溶液。颜色变化从黄色变为蓝色。已经消耗了0.74ml的0.1mnaoh。2ml-0.74ml=1.26ml,这对应于0.126mmol的grignard化合物。由于存在二-grignard试剂,grignard溶液为0.063m。这是超过90%的产率。
在配有回流冷凝器和磁力搅拌器的250ml三颈烧瓶中,在氩气下将1.8g(8.66mmol)氯膦(2-py(tbu)pcl)溶解在10ml的thf中并冷却至-60℃。然后用注射泵在该温度下缓慢滴加55ml的上述测定的grignard溶液(0.063m,3.46mmol)。该溶液起初保持澄清,然后剧烈地变成黄色。在1.5小时后,溶液变浑浊。将该混合物温热至室温过夜,得到澄清的黄色溶液。为了完成反应,将该混合物加热回流1小时。冷却后,加入1ml的h2o,溶液失去颜色,变成乳白色浑浊。在高真空下除去thf后,得到粘性的浅黄色固体。加入10ml水和10ml乙醚,得到两个均匀的澄清相,其分离性良好。将水相用乙醚萃取两次。有机相用na2so4干燥后,在高真空下除去乙醚,得到粘性的几乎无色的固体。将其在水浴上加热的情况下溶解在5ml的meoh中,并通过celite过滤。在-28℃下,过夜以白色晶体的形式得到772mg的产物(51%)。浓缩后,可以从母液中分离另外100mg。总产率为57.6%。
1hnmr(300mhz,c6d6):δ8.58(m,2h,py),7.31-7.30(m,2h,苯),7.30-7.22(m,2h,py),6.85-6.77(m,2h,py),6.73(m,2h,苯),6.57-6.50(m,2h,py),4.33(dd,j=13.3和4.3hz,2h,ch2),3.72-3.62(m,2h,ch2),121(d,j=11.8hz,18h,tbu).
13cnmr(75mhz,c6d6):δ161.3,161.1,149.6,137.8,137.7,134.5,133.3,132.7,131.4,131.3,125.7,122.9,30.7,30.5,28.2,28.0,26.5,26.4,26.2,26.1.
31pnmr(121mhz,c6d6)δ8.8.
ea(c26h34n2p2)计算值:c,71.54;h,7.85;n,6.56;p,14.35,测量值:c,71.21;h,7.55;n,6.56;p,14.35。
高压实验
使用原料:
甲醇(meoh)
乙烯(也称为乙烯)
用于实施高压实验的通用说明:
用于分批试验中的反应的通用试验描述:
根据钯前体,在可以气密性封闭的25mlparr反应器(parr高压釜)中在氩气下称量基于乙烯0.04mol%的钯前体和0.16mol%的相应配体。加入5ml甲醇。然后将1g的乙烯(35.7mmol)转移到高压釜中(通过称重高压釜监测)。将高压釜加热至80℃。在80℃下乙烯的自生压力现在为20bar。此时压入30bar的co。在该温度下,将高压釜搅拌20小时,使用parrinstruments的压力传感器和specview软件测量压降。示意图中所示的产物产率与气体消耗量一致。随后将高压釜冷却至室温并释放压力。将高压釜的内容物转移到50ml的schlenk容器中,加入1ml的异辛烷作为内部标准品。丙酸甲酯的产率由gc分析确定。
分析:
乙烯的产物的gc分析:gc分析使用具有30mhp柱的agilent7890a色谱仪(agilentgc)。温度程序:35℃,10min;10℃/min至200℃,16.5min;注射体积为1µl,以50:1的分流。丙酸甲酯的保留时间:6.158min。
甲醇分析
将甲醇在溶剂干燥设备中预处理:puresolvmd-/溶剂纯化系统,innovativetechnologyinc.oneindustrialway,amesburyma01013。
水值:
通过karlfischer滴定测定:titralab580-tim580,radiometeranalyticalsas(karl-fischer滴定),水含量:测量范围,0.1-100%w/w,测量的水含量:0.13889%。
使用:
来自applichem的工业甲醇:no.a2954,5000,批次号:lot:3l005446
水含量最多1%
来自acrosorganics的甲醇(通过分子筛):水含量0.005%,编号:364390010,批次号:lot1370321。
ton:转化数,定义为每摩尔催化剂金属的产物摩尔数
tof:转化频率,定义为每单位时间实现特定转化的ton,例如50%
n/iso-比表示在末端转化成酯的烯烃与在内部转化成酯的烯烃的比例。
以下给出的n-选择性基于末端甲氧基羰基化相对于甲氧基羰基化产物的总产率的比例。
乙烯实施例
示意图5:乙烯的甲氧基羰基化。
pdcl2/3(对比例):在氩气下,在25mlparr高压釜中装入pdcl2(2.53mg,基于乙烯的物质的量为0.04mol%)和3(22.5mg,基于乙烯的物质的量为0.16mol%)和5ml的甲醇。然后将1g(35.7mmol)乙烯转移到高压釜中。通过称重高压釜监测质量。将高压釜加热至80℃。此时,高压釜中的压力在80℃下为20bar。然后压入30bar的co。在80℃下搅拌20小时,并测量高压釜中的压降。然后将高压釜冷却,将剩余压力释放。然后将高压釜的内容物转移到50mlschlenk容器中,并加入1ml的异辛烷作为内部标准品。进行gc分析以确定产率。产率为20%。
pdcl2/8:在氩气下,在25mlparr高压釜中装入pdcl2(2.53mg,基于乙烯的物质的量为0.04mol%)和8(29.5mg,基于乙烯的物质的量为0.16mol%)和5ml的甲醇。然后将1g(35.7mmol)乙烯转移到高压釜中。通过称重高压釜监测质量。将高压釜加热至80℃。此时,高压釜中的压力在80℃下为20bar。然后压入30bar的co。在80℃下搅拌20小时,并测量高压釜中的压降。然后将高压釜冷却,将剩余压力释放。然后将高压釜的内容物转移到50mlschlenk容器中,并加入1ml的异辛烷作为内部标准品。进行gc分析以确定产率。产率为100%。
pdcl2/4:在氩气下,在25mlparr高压釜中装入pdcl2(2.53mg,此处和下面总是基于乙烯的物质的量为0.04mol%)和4(24.9mg,此处和下面总是基于乙烯的物质的量为0.16mol%)和5ml的甲醇。然后将1g(35.7mmol)乙烯转移到高压釜中。通过称重高压釜监测质量。将高压釜加热至80℃。此时,高压釜中的压力在80℃下为20bar。然后压入30bar的co。在80℃下搅拌20小时,并测量高压釜中的压降。然后将高压釜冷却,将剩余压力释放。然后将高压釜的内容物转移到50mlschlenk容器中,并加入1ml的异辛烷作为内部标准品。进行gc分析以确定产率。产率为100%。
pd(acac)2/3(对比例):在氩气下,在25mlparr高压釜中装入pd(acac)2(4.34mg,0.04mol%)和3(22.5mg,0.16mol%)和5ml的甲醇。然后将1g(35.7mmol)乙烯转移到高压釜中。通过称重高压釜监测质量。将高压釜加热至80℃。此时,高压釜中的压力在80℃下为20bar。然后压入30bar的co。在80℃下搅拌20小时,并测量高压釜中的压降。然后将高压釜冷却,将剩余压力释放。然后将高压釜的内容物转移到50mlschlenk容器中,并加入1ml的异辛烷作为内部标准品。进行gc分析以确定产率。产物的产率无法测得。
pd(acac)2/8:在氩气下,在25mlparr高压釜中装入pd(acac)2(4.34mg,0.04mol%)和8(29.5mg,0.16mol%)和5ml的甲醇。然后将1g(35.7mmol)乙烯转移到高压釜中。通过称重高压釜监测质量。将高压釜加热至80℃。此时,高压釜中的压力在80℃下为20bar。然后压入30bar的co。在80℃下搅拌20小时,并测量高压釜中的压降。然后将高压釜冷却,将剩余压力释放。然后将高压釜的内容物转移到50mlschlenk容器中,并加入1ml的异辛烷作为内部标准品。进行gc分析以确定产率。产率为60%。
pd(acac)2/4:在氩气下,在25mlparr高压釜中装入pd(acac)2(4.34mg,0.04mol%)和4(24.9mg,0.16mol%)和5ml的甲醇。然后将1g(35.7mmol)乙烯转移到高压釜中。通过称重高压釜监测质量。将高压釜加热至80℃。此时,高压釜中的压力在80℃下为20bar。然后压入30bar的co。在80℃下搅拌20小时,并测量高压釜中的压降。然后将高压釜冷却,将剩余压力释放。然后将高压釜的内容物转移到50mlschlenk容器中,并加入1ml的异辛烷作为内部标准品。进行gc分析以确定产率。产率为29%。
pd(oac)2/8:在氩气下,在25mlparr高压釜中装入pd(oac)2(3.2mg,0.04mol%)和8(29.5mg,0.16mol%)和5ml的甲醇。然后将1g(35.7mmol)乙烯转移到高压釜中。通过称重高压釜监测质量。将高压釜加热至80℃。此时,高压釜中的压力在80℃下为20bar。然后压入30bar的co。在80℃下搅拌20小时,并测量高压釜中的压降。然后将高压釜冷却,将剩余压力释放。然后将高压釜的内容物转移到50mlschlenk容器中,并加入1ml的异辛烷作为内部标准品。进行gc分析以确定产率。产率为58%。
结果显示在图1中
图1:使用配体3、4和8时,钯前体对乙烯的甲氧基羰基化的影响。
显而易见的是,在没有添加酸的情况下,使用pdcl2/配体8的组合,仅在约2小时后就获得>90%的丙酸甲酯产率,转化频率为3700mol产物/(molpd*h),基于30%的产率。使用配体4可以达到类似好的值。这里在约3小时后的产率为90%,转换频率为400。与此相比,对比配体dtbpmb(3)在20小时后才显示出约20%的产率,转换频率为27。使用乙酰丙酮钯或乙酸钯作为金属前体与本发明待使用的配体的组合在无酸体系中仍然导致可测量的产率,而配体3不再具有催化活性。
图2:使用配体3、4和8时,乙烯的无酸甲氧基羰基化。
图2显示了使用配体3、4和8时,乙烯的无酸甲氧基羰基化的结果。参考点是在80℃下使用配体8和pd化合物乙酸钯pd(oac)2的甲氧基羰基化。通过将温度升高至120℃,可以在20小时内将丙酸甲酯的产率从50%提高到84%。使用配体4,在120℃下在20小时后甚至可以达到87%的产率。对比配体dtbpmb(3)在无酸体系中仅显示3%的产率。所述试验在下面详细描述。
pd(oac)2/8:在氩气下,在25mlparr高压釜中装入pd(oac)2(3.2mg,0.04mol%)和8(29.5mg,0.16mol%)和5ml的甲醇。然后将1g(35.7mmol)乙烯转移到高压釜中。通过称重高压釜监测质量。然后压入30bar的co。将高压釜加热至80℃。在80℃下搅拌20小时,并测量高压釜中的压降。然后将高压釜冷却,将剩余压力释放。然后将高压釜的内容物转移到50mlschlenk容器中,并加入1ml的异辛烷作为内部标准品。进行gc分析以确定产率。产率为50%。
pd(oac)2/8:在氩气下,在25mlparr高压釜中装入pd(oac)2(3.2mg,0.04mol%)和8(29.5mg,0.16mol%)和5ml的甲醇。然后将1g(35.7mmol)乙烯转移到高压釜中。通过称重高压釜监测质量。然后压入30bar的co。将高压釜加热至100℃。在100℃下搅拌20小时,并测量高压釜中的压降。然后将高压釜冷却,将剩余压力释放。然后将高压釜的内容物转移到50mlschlenk容器中,并加入1ml的异辛烷作为内部标准品。进行gc分析以确定产率。产率为64%。
pd(oac)2/8:在氩气下,在25mlparr高压釜中装入pd(oac)2(3.2mg,0.04mol%)和8(29.5mg,0.16mol%)和5ml的甲醇。然后将1g(35.7mmol)乙烯转移到高压釜中。通过称重高压釜监测质量。然后压入30bar的co。将高压釜加热至120℃。在120℃下搅拌20小时,并测量高压釜中的压降。然后将高压釜冷却,将剩余压力释放。然后将高压釜的内容物转移到50mlschlenk容器中,并加入1ml的异辛烷作为内部标准品。进行gc分析以确定产率。产率为84%。
pd(oac)2/3(对比例):在氩气下,在25mlparr高压釜中装入pd(oac)2(3.2mg,0.04mol%)和3(22.5mg,0.16mol%)和5ml的甲醇。然后将1g(35.7mmol)乙烯转移到高压釜中。通过称重高压釜监测质量。然后压入30bar的co。将高压釜加热至120℃。在120℃下搅拌20小时,并测量高压釜中的压降。然后将高压釜冷却,将剩余压力释放。然后将高压釜的内容物转移到50mlschlenk容器中,并加入1ml的异辛烷作为内部标准品。进行gc分析以确定产率。产率为3%。
pd(oac)2/4:在氩气下,在25mlparr高压釜中装入pd(oac)2(3.2mg,0.04mol%)和4(24.9mg,0.16mol%)和5ml的甲醇。然后将1g(35.7mmol)乙烯转移到高压釜中。通过称重高压釜监测质量。然后压入30bar的co。将高压釜加热至120℃。在120℃下搅拌20小时,并测量高压釜中的压降。然后将高压釜冷却,将剩余压力释放。然后将高压釜的内容物转移到50mlschlenk容器中,并加入1ml的异辛烷作为内部标准品。进行gc分析以确定产率。产率为87%。
- 还没有人留言评论。精彩留言会获得点赞!