一种敲除野生型T细胞TCRbeta链的gRNA及方法与流程
本发明涉及基因敲除技术领域,尤其是涉及一种敲除野生型t细胞tcrbeta链的grna及方法。
背景技术:
肿瘤是目前人类健康的最大杀手,现有的治疗手段包括手术,化疗,放疗都无法彻底清除肿瘤,免疫t细胞治疗为肿瘤患者的康复带来了巨大希望。目前免疫t细胞治疗的方法主要有car-t和tcr-t细胞技术,这些t细胞治疗的原理是将肿瘤特异性的chimericantigenreceptor(car)或者tcellreceptor(tcr)基因转染到正常t细胞上面,使之获得肿瘤特异性识别的能力,从而杀死肿瘤细胞。然而,由于正常t细胞含有自身的t细胞受体(野生型alpha和beta链),这些野生型的alpha和beta链可以影响car-t或者tcr-t的表达,导致car-t或者tcr-t的活性降低;或者在受者体内攻击肿瘤外的靶器官和组织,导致供体对受体的移植免疫反应病(gvhd,graftverushostdisease)病;或者野生型的tcralpha和beta链和肿瘤特异性的tcralpha和beta链产生错配,导致t细胞获得新抗原识别能力,损害受体组织。因此,基因敲除野生型tcralpha和beta链是保证car-t或者tcr-t细胞免疫治疗安全性的重要措施。通过敲除野生型tcralpha和beta链,我们可以提高car-t或者tcr-t的功效,减少gvhd的发生,消除tcralpha和beta链的错配现象,大大提高免疫t细胞治疗肿瘤的效果。
目前基因修饰技术有rnai干扰技术,zfn(锌指核酸酶技术),talen(转录激活样酶技术),已有人用这些技术进行tcr野生型的alpha和beta链的敲除工作。敲除后的t细胞不表达野生型的alpha和beta链,不引起gvhd病,发生tcr错配的可能性大大降低。然而,以上技术在实际应用中也存在许多不足,其中,rnai技术仅仅在rna水平上面降低野生型alpha和beta链的表达,而且是不完全的敲除,残余的rna可以继续表达tcr的蛋白分子;zfn技术需要制备多个载体,在体外转录成rna后转入t细胞才可以敲除基因,rna不稳定,制备繁琐;talent技术同样需要制备多个载体后才可用,而且转染的效率比较低,影响tcr野生型alpha和beta链的敲除效率。
成簇的规律间隔短回文重复序列及其相关的cas9蛋白系统(crispr/cas9)是一种在细菌和古细菌中广泛存在,并用于抵御外源病毒感染的天然防御机制。外源的dna入侵细菌和古细菌后,会被细胞中与外源dna特定区域互补的rna引导序列(grna)识别,并引导cas9核酸酶到达识别部位,对目标序列进行酶切,从而降解外源dna。根据这个特性,crispr/cas9技术广泛用于基因编辑,其基本步骤是是将基因特异性的grna和crispr/cas9基因联合,共同转入细胞中。在grna的引导下,crispr/cas9特异性地敲除某个基因。crispr/cas9基因敲除效率高,制备相对简易。已经成为基因修饰的主流技术。
针对野生型tcrbeta链的grna的序列,我们通过联合使用grna和crispr/cas9的技术,敲除t细胞中的野生型tcrbeta链,构建安全可应用的tcrbeta链缺失的t细胞,用于car-t或者tcr-t的免疫t细胞治疗。
技术实现要素:
本发明的第一个目的在于克服现有技术的不足之处而提供一种敲除野生型t细胞tcrbeta链的grna。
本发明的第二个目的在于提供一种敲除野生型t细胞tcrbeta链的方法。
为实现上述目的,本发明采取的技术方案如下:
一种敲除野生型t细胞tcrbeta链的grna,所述grna的序列如seqidno:1所示。
一种所述grna的编码dna,所述grna的编码dna序列如seqidno:2所示。
所述核酸序列如下:
seqidno:1:gggcucaaacacagcgaccuc;
seqidno:2:caccgggctcaaacacagcgacctc。
本发明提供一种所述grna在敲除野生型t细胞tcrbeta链中的应用。
一种敲除野生型t细胞tcrbeta链的方法,所述方法利用crispr/cas9技术,通过所述grna和crispr/cas9共感染t细胞,敲除野生型t细胞tcrbeta链,构建野生型tcrbeta链缺失的t细胞。
作为本发明所述敲除野生型t细胞tcrbeta链的方法的优选实施方式,所述grna的启动子为u6启动子。
作为本发明所述敲除野生型t细胞tcrbeta链的方法的优选实施方式,包括以下步骤:
1)grna靶位点的设计,合成编码grna的dna序列;
2)将步骤1)中合成的dna片段和酶切过的crispr/cas9载体(lenticrisprv2)载体进行连接,构建grna/cprispr/cas9表达载体;
3)将步骤2)构建的grna/cprispr/cas9表达载体和第三代慢病毒的包装载体共感染293t细胞,生成表达grna/cprispr/cas9的慢病毒,使用慢病毒转染正常人t细胞,完成敲除野生型tcrbeta链,获得野生型tcrbeta链缺失的正常人t细胞。
作为本发明所述敲除野生型t细胞tcrbeta链的方法的优选实施方式,所述正常人t细胞为正常人周围血t细胞。
作为本发明所述敲除野生型t细胞tcrbeta链的方法的优选实施方式,其特征在于,所述酶为bbsi酶。
作为本发明所述敲除野生型t细胞tcrbeta链的方法的优选实施方式,所述步骤1)中,合成针对grna的dna序列的方法为:在与grna对应的dna序列的5’末端加上cacc得到正向核苷酸序列,在其互补链的5’末端加上aaac得到反向核苷酸序列,分别合成正向和反向核苷酸序列,然后将合成的序列变性、退火,得到双链dna片段。
与现有技术相比,本发明的有益效果为:本发明针对野生型tcrbeta链,通过联合使用grna和crispr/cas9的技术,我们成功敲除t细胞中的野生型tcrbeta链,被敲除野生型tcrbeta链的t细胞不表达野生型的tcrbeta链,是安全可应用的t细胞。与现有技术相比,本发明通过特异性的grna和crispr/cas9的联合使用,基因敲除效率高,制备方法相对简易,可以快速,高效地为临床提供野生型tcrbeta链缺失的t细胞用于car-t或者tcr-t的免疫t细胞治疗。
附图说明
图1是引物1和引物2的碱基互补配对图。
图2是利用crispr/cas9技术敲除野生型t细胞tcrbeta链的设计图。
图3是检测t细胞表面的tcrbeta链的表达流式抗体染色结果。
具体实施方式
为更好地说明本发明的目的、技术方案和优点,下面将结合附图和具体实施例对本发明作进一步说明。本领域技术人员应当理解,此处所描述的具体实施例仅用以解释本发明,并不用于限定本发明。
实施例
一种敲除野生型tcrbeta链的方法,包括以下步骤:
1)grna靶位点的设计,合成编码grna的dna序列;
通过国际免疫学信息系统(theinternationalimmunogeneticsinformationsyste),获得人类tcr的beta链恒定编码区(trbc)基因的序列信息如seqidno:4所示。
>m12887|trbc1*01|homosapiens|f|ex1+ex2+ex3+ex4|213..599+1041..1058+1211..1317+1640..1657|531nt|1|+1||||531+0=531|||
把人类trbc的序列信息放在网上crispr/cas9设计工具crisprgrnadesigntool(https://www.atum.bio/ecommerce/cas9/input)进行电脑预测得到数个针对trbc的grna的dna编码序列。其中,设计的grna的核酸序列如seqidno:1所示,grna在其对应dna序列的5’末端加上cacc得到正向核苷酸序列,在其互补链的5’末端加上aaac得到反向核苷酸序列,dna序列如seqidno:2所示。
根据电脑预测序列,我们在idtdna公司合成两条dna引物,在体外进行双链互补,具体实验条件如下:1ul引物1(100um,序列如seqidno:2);1ul引物2(100um,序列如seqidno:3所示),图1是引物1和引物2的碱基互补配对图;1ul10×t4ligationbuffer(neb);6.5ulddh2o;0.5ult4pnk(neb)。将反应体系置于pcr仪中,反应条件为:37℃,30min;95℃,5min;然后以5℃/min的降温速率将反应体系温度降至25℃。
2)构建grna/cprispr/cas9表达载体
将crispr/cas9的慢病毒表达载体lenticrisprv2(plasmid#52961,addgene)经bbsi(nebcat#r0539s)酶切30min后,进行dna电泳回收。
将已经互补连接的dna引物和回收切好的lenticrisprv2质粒按照1:1的比例在室温进行dna连接反应,dna连接反应采用快速连接试剂盒(neb,cat#m2200s)。将连接好的dna引物和lenticrisprv2质粒转化入感受态细菌。次日,挑选连接阳性克隆进行测序鉴定,确定grna/cprispr/cas9表达载体构建成功。
3)转染t细胞
将已经鉴定grna/cprispr/cas9表达载体在体外大量扩增后,和第三代慢病毒的包装载体试剂盒(abmgood,cat#lv053)共感染293t细胞,其中,转染效率为99%。培养36,60小时后,收集细胞培养上清,检测病毒浓度,过滤,浓集,置于-80℃保存,生成包含grna/crispr/cas9基因的慢病毒。
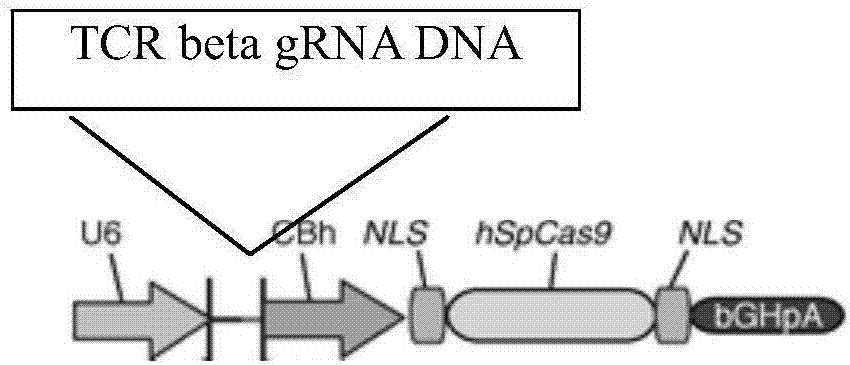
利用crispr/cas9技术敲除野生型t细胞tcrbeta链的设计图如图2所示。由图2可知,特异性识别tcrbeta链的grna的dna编码序列合成后,通过分子生物学的方法装载在表达crispr/cas9的载体上,在u6启动子的作用下,grna可以在细胞中特异性表达,指引crispr/cas9特异性敲除野生型tcrbeta链。
4)敲除野生型tcrbeta链的验证
对数生长期的正常人t细胞在体外和步骤3)中包含grna/crispr/cas9基因的慢病毒于30℃离心,共培养12小时后,换细胞培养液。48-72小时后,用流式抗体(anti-tcrbeta,biolegend,cat#109215)进行染色,检测正常人t细胞中野生型tcrbeta链的表达。
检测正常人t细胞表面的tcrbeta链的表达流式抗体染色结果如图3所示。由图3可知,经过tcrbeta链grna联合crispr/cas9基因敲除的正常人t细胞表面的tcrbeta链,正常人t细胞的tcrbeta链的表达严重降低,甚至无表达,这表明敲除野生型tcrbeta链的正常人t细胞是安全可应用的。
最后所应当说明的是,以上实施例仅用以说明本发明的技术方案而非对本发明保护范围的限制,尽管参照较佳实施例对本发明作了详细说明,本领域的普通技术人员应当理解,可以对本发明的技术方案进行修改或者等同替换,而不脱离本发明技术方案的实质和范围。
sequencelisting
<110>广州医科大学附属第五医院
<120>一种敲除野生型t细胞tcrbeta链的grna及方法
<160>4
<170>patentinversion3.3
<210>1
<211>21
<212>rna
<213>人工序列
<400>1
gggcucaaacacagcgaccuc21
<210>2
<211>25
<212>dna
<213>人工序列
<400>2
caccgggctcaaacacagcgacctc25
<210>3
<211>25
<212>dna
<213>人工序列
<400>3
cccgagtttgtgtcgctggagcaaa25
<210>4
<211>531
<212>dna
<213>人种(humanspecies)
<400>4
gaggacctgaacaaggtgttcccacccgaggtcgctgtgtttgagccatcagaagcagag60
atctcccacacccaaaaggccacactggtgtgcctggccacaggcttcttccccgaccac120
gtggagctgagctggtgggtgaatgggaaggaggtgcacagtggggtcagcacggacccg180
cagcccctcaaggagcagcccgccctcaatgactccagatactgcctgagcagccgcctg240
agggtctcggccaccttctggcagaacccccgcaaccacttccgctgtcaagtccagttc300
tacgggctctcggagaatgacgagtggacccaggatagggccaaacccgtcacccagatc360
gtcagcgccgaggcctggggtagagcagactgtggctttacctcggtgtcctaccagcaa420
ggggtcctgtctgccaccatcctctatgagatcctgctagggaaggccaccctgtatgct480
gtgctggtcagcgcccttgtgttgatggccatggtcaagagaaaggatttc531
- 还没有人留言评论。精彩留言会获得点赞!